参附注射液对肾母细胞瘤细胞增殖、凋亡的影响及机制探讨
仲智勇,时保军,周辉,王文博
(河北医科大学第二医院,石家庄050017)
参附注射液对肾母细胞瘤细胞增殖、凋亡的影响及机制探讨
仲智勇,时保军,周辉,王文博
(河北医科大学第二医院,石家庄050017)
目的观察参附注射液对肾母细胞瘤细胞增殖及凋亡的影响,并探讨其机制。方法取适量对数生长期肾母细胞瘤细胞,分为低、中、高浓度组及对照组。低、中、高浓度组分别加入0.4、0.8、1.2 mg/mL参附注射液2 mL,对照组加入等量无菌DMSO培养液。干预24 h时采用MTT法检测各组细胞增殖抑制率,采用流式细胞仪测算各组细胞凋亡率,采用Western blot法检测各组细胞p53、B细胞淋巴瘤因子l-2(bcl-2)蛋白。结果干预24 h时低浓度组、中浓度组、高浓度组、对照组的细胞增殖抑制率分别为22.83%±5.18%、35.76%±6.01%、54.51%±9.07%、6.39%±2.81%,组间比较,P均<0.05。干预24 h时低浓度组、终浓度组、高浓度组、对照组的细胞凋亡率分别为14.59%±1.24%、18.27%±1.73%、21.85%±1.62%、3.92%±1.36%,组间比较,P均<0.05。各组细胞p53的相对表达量为高浓度组<中浓度组<低浓度组<对照组,P均<0.05;bcl-2 的相对表达量为高浓度组>中浓度组>低浓度组>对照组,P均<0.05。结论参附注射液可抑制肾母细胞瘤细胞增殖,促进细胞凋亡;其机制可能与降低p53表达、升高bcl-2表达有关。
参附注射液;肾母细胞瘤;细胞增殖;细胞凋亡;p53;B细胞淋巴瘤因子-2
肾母细胞瘤是小儿常见的肾脏恶性肿瘤,占儿童肾脏肿瘤的95%[1]。目前,临床常用的治疗方式有手术、放化疗等,但并发症较多。寻找敏感且不良反应较少的抗肾母细胞瘤药物是目前的研究热点。参附注射液源自古文“参附汤”,由红参、黑附片两味药经现代提取工艺提取制成,主要含人参皂苷、人参三醇和乌头碱等生物活性成分,具有回阳救逆、益气固脱作用,可增强心肌收缩力、清除氧自由基,另具有调节机体及抗肿瘤等作用[2,3],已广泛应用于心血管、呼吸系统疾病的治疗。p53和B细胞淋巴瘤因子-2(bcl-2)是临床常用的细胞凋亡指标。近年研究显示,参附注射液对肺癌、食管癌、胃癌、肠癌、肝癌、乳腺癌和卵巢癌等肿瘤均有一定的临床效果[4],但对于肾母细胞瘤的相关报道较少。2014年3~12月,我们观察了参附注射液对肾母细胞瘤细胞增殖、凋亡的影响,并探讨其可能的作用机制。现报告如下。
1 材料与方法
1.1材料肾母细胞瘤细胞由中国科学院细胞度提供;参附注射液购自雅安三九药业有限公司;bcl-2羊抗人多克隆抗体、鼠抗人p53单克隆抗体匀购自美国Santa Cruz公司,免疫组化ABC试剂盒、DAB显色试剂盒购自广州华美生物工程公司;荧光标记兔抗羊IgG购自上海微蒙生物技术有限公司,PVDF膜购自Sigma公司,基因组DNA抽提试剂盒购自艾美捷科技有限公司;Annexin V-FITC流式试剂盒购自上海前尘生物科技有限公司,ECL发光试剂盒购自上海通善生物科技有限公司,核酸电泳仪、转膜电泳仪购自美国Bio-Rad公司。
1.2细胞分组及干预取适量对数生长期肾母细胞瘤细胞接种于96孔板,1.0×104/孔。将细胞分为低、中、高浓度组及对照组4组,每组6个复孔,低、中、高浓度组分别加入0.4、0.8、1.2 mg/mL参附注射液2 mL,对照组加入等量无菌DMSO培养液,置于37 ℃、5 %CO2恒温培养箱中培养24 h。
1.3细胞增殖抑制率检测采用MTT法。取干预24 h各组对数生长期细胞, 1.0×104/孔接种于96孔板中,每组5个复孔。培养24 h时加入5 mg/mLMTT 20 μL, 4 h后弃上清液,加入200 mL DMSO振荡。用酶标仪检测各组细胞吸光度OD值,计算各组细胞增殖抑制率。细胞增殖抑制率=1-(观察组OD值/ 空白组OD值)×100%。实验共重复3次。
1.4细胞凋亡率测算采用流式细胞仪。收集干预24 h对数生长期各组细胞,调整细胞密度为1×104/mL,接种于6孔板,每组6个复孔。PBS洗2次,1 000 r/min离心10 min,加入结合缓冲液 200 mL 、Annexin V-FITC 10 μL,室温下避光放置15 min,加入结合缓冲液300 mL、PI 5 μL,混匀后在流式细胞仪上检测细胞的凋亡率。细胞凋亡率=凋亡细胞数/(凋亡细胞数+正常细胞数)×100%。实验共重复3次。
1.5细胞p53、bcl-2 蛋白检测采用Western blot法。取干预24 h时各组对数生长期细胞, 1.0×105/孔接种于6孔板中,每组6个复孔。PBS冲洗3遍,裂解、13 000 r/min、4 ℃离心5 min,精密移取上清液。用琼脂糖凝胶电泳,取下凝胶,PVDF膜300 mA 转膜110 min,加入适量的封闭液封闭60 min,再分别用封闭液稀释抗p53、bcl-2多克隆抗体浓度至0.1 μg/mL,加到PVDF膜的正面,4 ℃冷藏过夜,PBS冲洗5 min,连续冲洗5次。将兔抗羊IgG用5%脱脂奶粉封闭液稀释2 000倍,置于PVDF膜中,25 ℃下放置60 min, PBS冲洗5 min,连续冲洗5次。以β-actin为内参,采用凝胶图像分析仪分析各组p53、bcl-2 蛋白表达条带的光密度,以目的蛋白与内参灰度比值来表示目的蛋白的相对表达量。实验重复3次。
2 结果
2.1各组细胞增殖抑制率比较干预24 h时低浓度组、中浓度组、高浓度组、对照组的细胞增殖抑制率分别为22.83%±5.18%、35.76%±6.01%、54.51%±9.07%、6.39%±2.81%,组间比较,P均<0.05。
2.2各组细胞凋亡率比较干预24 h时低浓度组、终浓度组、高浓度组、对照组的细胞凋亡率分别为14.59%±1.24%、18.27%±1.73%、21.85%±1.62%、3.92%±1.36%,组间比较,P均<0.05。
2.3各组细胞p53、bcl-2 蛋白表达量比较各组细胞p53的相对表达量为高浓度组<中浓度组<低浓度组<对照组,P均<0.05;bcl-2 的相对表达量为高浓度组>中浓度组>低浓度组>对照组,P均<0.05。见表1。
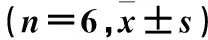
表1 干预24 h各组细胞p53、bcl-2 蛋白相对表达量比较
注:与对照组比较,*P<0.05;与低浓度组比较,#P<0.05;与中浓度组比较,ΔP<0.05。
3 讨论
肾母细胞瘤的发病因素涉及多个基因[5],与肿瘤的发生、发展有密切的联系。p53基因是肿瘤领域众多相关的抑制基因中研究得最为广泛、最为系统的抑癌基因。p53基因是最早发现的肿瘤抑制基因之一,能调节细胞周期,避免细胞癌变发生。在所有恶性肿瘤中,50%以上会出现该基因的突变。由p53编码的蛋白质是一种转录因子,其控制着细胞周期的启动。p53基因突变是肿瘤中最常见的分子遗传学改变[6~8]。辐射诱导的DNA损伤可通过ATM激活p53,阻断细胞周期,并提高Fas的表达,诱导细胞凋亡。p53基因不仅可促进肿瘤细胞的凋亡,还与细胞对药物的敏感性有关[9]。p53基因是重要的肾母细胞瘤抑癌基因,研究显示对化疗药物敏感的肿瘤细胞含有野生型p53基因,而含有突变型p53型基因的肿瘤细胞对化疗药物具有一定的抵抗性。这时,只有加大化疗药物的用量才可激活p53依赖的凋亡作用[10,11]。bcl-2是一种原癌基因,是细胞凋亡的关键调节因子[12,13]。细胞接受凋亡信号后,促凋亡因子Bax发生寡聚化,从细胞质中转移到线粒体外膜上,并与膜上的电压依赖阴离子通道相互作用,使通道开放到足以使线粒体内的凋亡因子如细胞色素C等释放到细胞质基质中,引起细胞死亡。研究发现,bcl-2高表达与肿瘤的发生、发展密切相关。bcl-2的过量表达常导致肿瘤细胞对化疗药物的耐药而阻止细胞凋亡,影响治疗效果。bcl-2基因直接或间接使细胞寿命延长,增加遗传物质突变率及细胞数增多,从而促进肿瘤的发生、发展[14]。国内外研究发现,bcl-2在多种肿瘤中均有表达,如肾癌、胰腺癌、食管癌、淋巴造血组织、胃癌等[15~17]。
参附注射液可诱导多种肿瘤细胞的凋亡,抑制肿瘤细胞的增殖,其机制可能与其阻断多能干细胞的增殖,抑制肿瘤细胞内I-κB免疫抑制因子的表达,抑制TNF-α的表达有关。药理研究显示,参附注射液可抑制大鼠缺血性脑损伤神经元凋亡,可能是与参附注射液上调bcl-2蛋白表达及下调p53蛋白表达有关[18]。临床研究显示,参附注射液在一定程度上对恶病质细胞因子具有下调作用,而且可改善患者的厌食等症状[19]。参附注射液的主要生物活性成分为人参皂苷、人参三醇和乌头碱,均可降低Caspase3、7酶活性,显著下调羟化酶CYP4A1基因表达水平,同时上调bcl-2基因表达,最终下调Bax基因表达[20]。
本研究结果显示,干预24 h时细胞增殖抑制率和细胞凋亡率均为对照组<低浓度组<中浓度组<高浓度组,p53的相对表达量为高浓度组<中浓度组<低浓度组<对照组,bcl-2 的相对表达量为高浓度组>中浓度组>低浓度组>对照组。因此,参附注射液可抑制肾母细胞瘤细胞增殖,促进细胞凋亡;其具体作用机制可能与其抑制p53表达、促进bcl-2表达有关。
[1] 郑成中.肾母细胞瘤的诊断与治疗[J].实用儿科临床杂志,2005,20(1):3-4.
[2] 廖工铁.参附注射液制备工艺的研究[J].中成药,1989,11(2):2.
[3] 黄金活,嵇玉峰,梁洪江,等.参附注射液治疗恶性肿瘤化疗毒副反应的临床观察[J].现代肿瘤医学,2004,12(3):185-187.
[4] 毛敏,陈超,朱立平,等.参附注射液辅助治疗肿瘤的研究进展[J].中国药房,2010,21 (44):4220-4222.
[5] 光炜,杜传书.Wilms瘤的分子遗传学研究[J].国外医学:遗传学分册,1996(19):23.
[6] Vogelatein B,Kinger KW.p53 function and dysfunction[J].Cell,1992,2170(4):523-526.
[7] Soussl T, Legros Y, Lubin K, et al. Multifactoral analysis of p53 alteration in human cancer:a review[J]. Int J Cancer, 1994,57(1):1-9.
[8] 季旭明,欧阳兵,吴智春,等.温下方含药血清诱导A549/DDP细胞凋亡及Bcl-2,Bax,p53蛋白表达的影响[J].中国实验方剂学,2011,17(12):123-125.
[9] Lowe SW, Jacks T, Housman D, et al. Abrogation of oncogene associated apoptosis allows transformation of P53 deficient cells[J]. Proc Natl Acad Sci USA, 1994, 91(6):2026-2030.
[10] 步星耀,金百祥,沈兆忠,等.肾母细胞瘤p53基因突变与其组织类型的关系[J].中华小儿外科杂志,1997,18(4):197-199.
[11] Loew SW, Ruley HE, Jacks T, et al. P53-dependent apoptosis modulates the cytotoxicity of anticancer agents[J]. Cell, 1993(74):957.
[12] Magnaldo T,Sarasin A. Xeroderma pigmentosum:from symptoms and genetice to gene-based skin therapy[J].Cells Tossues Organs, 2004,5(177):189-198.
[13] 汤小军,黄建春,黄仁彬,等.六月青表多糖对S180荷瘤小鼠免疫功能及p53,Bcl-2,Bax表达的影响[J].中国实验方剂学杂志,2013,19(4):250-251.
[14] Moon DO,Kim MO,Choi YH, et al. Bcl-2 overexpression attenuates SP-600125induced apoptosis in human leukemia U937 cells[J]. Cancer Lett, 2008,264(2):316-325.
[15] Emi M,Kim R,Tanabe K,et al.Targeted therapyagainst Bcl-2-related proteins in breast cancer cells[J].Breast Cancer Res,2005,7(6):940-952.
[16] Vlachos K,Siafakas N,Karameris A,et al. Esophageal squamous cell carcinomas and expression of p53,Bcl-2,and Bcl-X(L)[J].Int Surg,2008,93(2):63-71.
[17] Tas F,Duranyildiz D,Oguz H,et al.Serum vascular endothelialgrowth factor(VEGF)and bcl-2 levels in advanced stage non-small cell lung cancer[J].Cancer Invest,2006,24(6):576-580.
[18] 胡金玲,孟凡荣,董中国,等.参附注射液对脑缺血再灌注大鼠bcl-2、p53表达的影响[J].中国老年学杂志,2011,31(9):1621-1622.
[19] 崔慧娟,李园,万冬桂,等.参附注射液抗癌症恶病质的临床研究[J].中国肿瘤临床与康复,2005,12(5):478-480.
[20] 肖勇.参附注射液及其有效成分人参皂苷Re的减毒作用机制研究[D].长沙:中南大学, 2014:35-39.
Effects of Shenfu injection on proliferation and apoptosis of Wilm's tumor cells
ZHONGZhiyong,SHIBaojun,ZHOUHui,WANGWenbo
(TheSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050017,China)
ObjectiveTo investigate the effects and related mechanism of Shenfu injection on the proliferation and apoptosis of Wilm's tumor cells in vitro. MethodsWilm's tumor cells were divided into the control group, low-dose, medium-dose and high-dose groups. The low-dose, medium-dose and high-dose groups were treated with 2 mL of 0.4 mg/mL, 0.8 mg/mL and 1.2 mg/mL Shenfu injection, and the control group was added with DMSO. After 24-hour intervention, the proliferation inhibition rate was detected by MTT, the rate of apoptosis and the expression of p53 and Bcl-2 protein was detected by flow cytometry and Western blotting, respectively.ResultsAfter 24-hour intervention, the proliferation inhibition rates of the low-dose group, medium-dose group, high-dose group and the control group were respectively 22.83%±5.18%, 35.76%±6.01%, 54.51%±9.07% and 6.39%±2.81%, allP<0.05. After 24-hour intervention, the apoptosis rates of the low-dose group, medium-dose group, high-dose group and the control group were 14.59%±1.24%, 18.27%±1.73%, 21.85%±1.62% and 3.92%±1.36%, respectively, allP<0.05. The relative expression of p53 was high-dose group
Shenfu injection; Wilm's tumor; cell proliferation; apoptosis; p53; B lymphocyte-2
河北省医学科学研究课题计划项目(20130151)。
仲智勇(1970-),男,硕士,副主任医师,主要研究方向为小儿肿瘤。E-mail: zhongzy2005@163.com
10.3969/j.issn.1002-266X.2016.18.006
R737.1
A
1002-266X(2016)18-0018-03
2016-01-16)

