蓝莓花青素对氧化应激诱导肝星状细胞活化、增殖和凋亡的影响及机制探讨
王丽,何萍,孙建超,王豫萍,程明亮
(贵州医科大学临床检验学院,贵阳 550004)
蓝莓花青素对氧化应激诱导肝星状细胞活化、增殖和凋亡的影响及机制探讨
王丽,何萍,孙建超,王豫萍,程明亮
(贵州医科大学临床检验学院,贵阳 550004)
目的观察蓝莓提取物花青素对氧化应激诱导肝星状细胞HSC-T6活化、增殖的影响,并探讨其作用机制。方法取对数生长期HSC-T6细胞分为观察组、对照组、空白组,观察组先加入600 μg/mL蓝莓花青素干预24 h后,加葡萄糖氧化酶(GO)100 U/L孵育3 h,对照组加入GO 100 U/L孵育3 h,空白组不做任何处理。干预24 h时采用细胞免疫化学法检测各组α-平滑肌肌动蛋白(α-SMA),ELISA法检测胞质Ⅰ型胶原(Col Ⅰ);采用MTT法观察各组细胞增殖情况,采用流式细胞仪观察各组细胞凋亡情况;采用硫代巴比妥酸法检测各组胞质丙二醛(MDA),黄嘌呤氧化酶法检测各组胞质SOD,微量酶标法测定各组胞质谷胱甘肽(GSH)。结果干预24 h时,各组α-SMA相对表达量为空白组<观察组<对照组,P均<0.05。干预24 h时,观察组细胞增殖率低于对照组,P<0.05。干预24 h时,观察组细胞凋亡率高于其余两组,P均<0.05。干预24 h时,观察组胞质MDA低于对照组(P<0.05),SOD、GSH均高于空白组(P均<0.05)。结论蓝莓花青素可抑制氧化应激诱导的肝星状细胞的活化与增殖,并促进细胞凋亡;其机制可能与抑制胞质内MDA表达,促进SOD、GSH表达有关。
肝星状细胞;蓝莓;花青素;氧化应激;α-平滑肌肌动蛋白;Ⅰ型胶原;细胞增殖;细胞凋亡
肝纤维化是指肝脏内弥漫性细胞外基质(特别是胶原物质)过度沉积,是机体对各种病因引起的慢性肝损伤后一种损伤性修复反应[1]。氧化应激是导致肝损害的重要机制之一[2, 3]。肝星状细胞(HSC)活化和增殖可促进肝纤维化[4],α-平滑肌肌动蛋白(α-SMA)和Ⅰ型胶原(ColⅠ)是临床常用的细胞活化指标。蓝莓富含花青素、超氧化物歧化酶(SOD)等抗氧化成分。其中花青素具有抗氧化、促进肿瘤细胞凋亡、保护肝脏、降低DNA氧化损伤的功能[5, 6],是现今发现的最有效的天然水溶性自由基清除剂。本课题组前期研究发现,蓝莓可预防CCl4所致的大鼠急、慢性肝损伤[7~9],但其具体有效成分目前尚不明确。2015年4~12月,我们观察了蓝莓花青素对氧化应激诱导肝星状细胞HSC-T6活化、增殖的影响,并探讨其可能的机制。现报告如下。
1 材料与方法
1.1材料HSC-T6购自中国科学院上海分院(货号:BRL3A);蓝莓由贵州省麻江县蓝莓生产基地提供,由中国科学院天然产物重点化学研究实验室提取蓝莓花青素[10]。胎牛血清(杭州四季青公司),低糖DMEM(Hyclone公司),葡萄糖氧化酶(GO,美国Sigma公司),MTT(美国Sigma公司),α-SMA单克隆抗体(美国Abcam公司),DAB显色试剂盒(中杉金桥公司),辣根过氧化酶标记的二抗(中杉金桥公司);二甲基亚砜(美国Sigma公司),蛋白提取试剂盒(碧云天生物技术公司),BCA蛋白浓度测定试剂盒(北京索莱宝公司),ColⅠ试剂盒(武汉基因美生物公司),丙二醛(MDA)、SOD、胱甘肽(GSH)试剂盒(南京建成生物公司),Annexin V、 FITC凋亡试剂盒(日本同仁化学研究所)。二氧化碳培养箱(WJ-3,上海跃进医疗器械厂),倒置显微镜(CKX41+DP25,日本Olympas公司),荧光显微镜(日本Olympas公司),超纯水仪(英国ELGA公司),-80 ℃低温冰箱(日本Sanyo公司),酶标仪(美国BioTek公司),超净工作台(SW-CJ-1FD,苏州净化设备有限公司),YHF7F-1LCantoTMⅡ流式细胞分析仪(美国BD公司)。
1.2HSC-T6分组及处理取对数生长期的适量HSC-T6常规复苏,用含10%胎牛血清的低糖DMEM培养液培养,置于37 ℃、5% CO2培养箱中隔天换液。待细胞长满80%~90%时,0.25%胰酶消化传代。以7.5×103/孔接种于96孔板中,将细胞分为观察组、对照组、空白组,观察组先加入600 μg/mL蓝莓花青素干预24 h后,加GO 100 U/L孵育3 h,对照组加入GO 100 U/L孵育3 h,空白组不做任何处理,三组均置于含10%胎牛血清的DMEM培养基中培养备用。
1.3HSC-T6活化情况观察干预24 h时,采用细胞免疫化学法检测HSC-T6中α-SMA表达。取对数生长期各组细胞,4×104/mL接种于96孔板中,每组6个复孔。PBS轻洗,4%多聚甲醛固定,0.1%Triton X-100破膜,羊血清封闭;加入α-SMA一抗(1∶100)4 ℃过夜,Envision二步法显色。胞质染成棕黄色者为阳性细胞,采用Image-pro-plus分析积分光密度(IOD),以IOD值代表α-SMA的相对表达量。干预24 h时,采用ELISA法检测HSC-T6胞质 ColⅠ含量。另取各组细胞12×104/mL接种于25 cm2培养瓶中,PBS冲洗,利用蛋白提取试剂盒提取胞质蛋白,-80 ℃保存备用。采用ELISA法检测HSC-T6胞质ColⅠ的相对表达量,所有操作严格按照使用说明书进行。
1.4HSC-T6增殖情况观察采用MTT法。干预24 h时,取对数生长期各组细胞接种于96孔板,7.5×103/孔,每组6个复孔。用PBS轻洗,加入低糖DMEM 180 μL和5 mg/mL MTT 20 μL继续孵育4 h。弃培养液,加入150 μL DMSO,震荡10 min,使结晶物充分溶解。采用酶标仪测量各组在490 nm处的光密度(OD)值,重复3次,取平均值计算各组细胞增殖率。细胞增殖率=(观察组OD值-阴性对照OD值)/阴性对照OD值×100%。
1.5HSC-T6凋亡情况观察采用流式细胞仪。干预24 h时,取对数生长期的各组细胞,调整细胞密度为1×106/mL。各取100 μL加入 Annexin V FITC结合物和PI Solution各5 μL,涡旋混匀后避光温孵育15 min。48 h后采用流式细胞仪检测各组细胞凋亡情况,采用BD FACSDIVA软件对结果进行分析,计算细胞凋亡率。
1.6HSC-T6胞质MDA、SOD、GSH蛋白检测干预24 h时,取对数生长期各组细胞,采用硫代巴比妥酸法检测各组胞质MDA含量;黄嘌呤氧化酶法检测各组胞质SOD活性;微量酶标法测定各组胞质GSH含量,所有操作严格按照使用说明书进行。各组均随机选取30个视野采集图像,用以上MDA、SOD、GSH的阳性与所占整个图像的百分比来表示MDA、SOD、GSH的表达量。
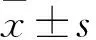
2 结果
2.1 各组α-SMA及胞质ColⅠ表达比较干预24 h时,观察组、对照组、空白组α-SMA相对表达量分别为0.032±0.007、0.053±0.002、0.013±0.005;组间比较,P均<0.05。干预24 h时,观察组、对照组、空白组胞质ColⅠ相对表达量分别为808.47±10.14、1 037.04±106.47、687.47±11.4;对照组高于空白组(P<0.05),观察组低于对照组(P<0.05)。
2.2各组细胞增殖率比较干预24 h时,观察组、对照组、空白组的细胞增殖率分别为0.830%±0.061%、1.050%±0.06%、0.800%±0.015%,观察组细胞增殖率明显低于对照组(P<0.05),观察组细胞增殖率与空白组差异无统计学意义(P=0.517)。
2.3各组细胞凋亡率比较干预24 h时,观察组、对照组、空白组细胞凋亡率分别为64.03%±1.50%、39.03%±1.57%、36.5%±0.70%,观察组细胞凋亡率高于其余两组(P均<0.05),对照组与空白组间差异无统计学意义。
2.4各组胞质MDA、SOD、GSH表达比较见表1。
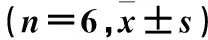
表1 干预24 h时各组胞质MDA、SOD、GSH表达量比较
注:与空白组比较,#P<0.05;与对照组比较,△P<0.05。
3 讨论
研究发现,氧化应激反应是肝纤维化发生、发展中造成HSC激活的一个重要因素。受损肝细胞损伤部位聚集的炎性细胞和激活的Kuffer细胞均释放活性氧簇(ROS),ROS可通过旁分泌方式激活HSC,并导致HSC进一步释放ROS,致使HSC细胞增殖、产生大量胶原蛋白、基质降解失衡、增强血管收缩性、增加肝内血流压力等,从而加快肝纤维化形成进程。以往研究认为,肝纤维化逆转主要与激活状态HSC转为静止状态有关;但Iredale等[11]研究认为,活化HSC数量减少与凋亡有关。HSC凋亡可使活化HSC数量减少,胶原蛋白合成减少,使肝纤维化得以逆转。大量研究发现,姜黄素、草苁蓉等生物碱和黄酮类化合物可通过减轻细胞过氧化损伤、抑制肝细胞凋亡从而抑制HSC活化或者促进活化型HSC凋亡[12,13]。α-SMA是HSC活化的标志[14],常作为HSC激活标志物。氧化应激可导致HSC合成以ColⅠ及Col Ⅲ为主的多种细胞外基质[15],是肝纤维化发生的中心环节。氧化应激主要表现为氧化与抗氧化反应失衡,其中MDA作为脂质过氧化产物之一,是连接氧化应激损伤与肝纤维化之间的桥梁,MDA含量高低间接反映细胞氧化损伤程度[16]。初级抗氧化防御系统主要分为酶类和非酶类抗氧化系统,其代表物质分别为SOD、GSH。SOD具有特殊的生理活性,是生物体内清除自由基的首要物质。GSH是一种由3个氨基酸组成的小分子肽,是体内重要的抗氧化剂和ROS清除剂,可与ROS、重金属等结合,把机体内有害的毒物转化为无害的物质排泄出体外。
野生蓝莓富含花青素,花青素是一种特殊分子结构的生物类黄酮,是种天然抗氧化剂。研究发现,花青素能够抑制环磷酰胺诱导的心肌损伤[13]。陈琦等[17]研究发现,花青素对正常细胞也具有抑制增殖和促进凋亡作用。王琴等[18]研究发现,600 μg/mL紫甘薯花色苷对DPPH自由基清除率达到90.69%。本课题组前期研究表明,蓝莓可通过下调Bcl-2、降低Bcl-2/Bax值诱导HSC凋亡[19]。本研究发现,干预24 h时各组α-SMA相对表达量为空白组<观察组<对照组,说明氧化应激模型制作成功;干预24 h时,观察组细胞增殖率明显低于对照组,干预24 h时观察组细胞凋亡率明显高于其余两组,干预24 h时,观察组SOD、GSH均高于空白组,说明花青素可降低MDA,减轻肝细胞线粒体的氧化应激水平,促进SOD与GSH表达,提高细胞抗氧化能力。
综上所述,蓝莓花青素可抑制氧化应激诱导的HSC活化、增殖,促进细胞凋亡;其机制可能与抑制胞质MDA表达且促进SOD、GSH表达有关。
[1] Friedman SL. Molecular regulation of hepatic fibrosis, an integrated cellular response to tissue injury [J]. J Biol Chem, 2000,275(4):2247-2250.
[2] Poli G. Pathogenesis of liver fibrosis: role of oxidative stress [J]. Mol Aspects Med, 2000,21 (3):79-98.
[3] Nieto N, Friedman SL, Cederbaum AI. Stimulation and proliferation of primary rat hepatic stellate cells by cytochrome P450 2E1-derived reactive oxygen species [J]. Hepatology, 2002,35(1):62-73.
[4] Gebhardt R. Oxidative stress, plant-derived antioxidants and liver fibrosis [J]. Planta Med, 2002,68(4):289-296.
[5] Del BC, Riso P, Campolo J, et al. A single portion of blueberry (Vaccinium corymbosum L) improves protection against DNA damage but not vascular function in healthy male volunteers [J]. Nutr Res, 2013,33(3):220-227.
[6] Adams LS, Phung S, Yee N, et al. Blueberry phytochemicals inhibit growth and metastatic potential of MDA-MB-231 breast cancer cells through modulation of the phosphatidylinositol 3-kinase pathway [J]. Cancer Res, 2010,70(9):3594-3605.
[7] Wang Y, Cheng M, Zhang B, et al. Dietary supplementation of blueberry juice enhances hepatic expression of metallothionein and attenuates liver fibrosis in rats [J]. PLoS One, 2013,8(3):58659.
[8] Wang YP, Cheng ML, Zhang BF, et al. Effect of blueberry on hepatic and immunological functions in mice [J]. Hepatobiliary Pancreat Dis Int, 2010,9(2):164-168.
[9] Wang YP, Cheng ML, Zhang BF, et al. Effects of blueberry on hepatic fibrosis and transcription factor Nrf2 in rats [J]. World J Gastroenterol, 2010, 16(21):2657-2663.
[10] 刘仁道,张猛. 蓝莓果实花青素提取及定量方法的比较[J].园艺学报,2008,35(5):655-660.
[11] Iredale JP, Benyon RC, Pickering J, et al. Mechanisms of spontaneous resolution of rat liver fibrosis. Hepatic stellate cell apoptosis and reduced hepatic expression of metalloproteinase inhibitors [J]. J Clin Invest, 1998,102(3):538-549.
[12] Wang Y, Wang R, Wang Y, et al. Ginkgo biloba extract mitigates liver fibrosis and apoptosis by regulating p38 MAPK, NF-kappaB/IkappaBalpha, and Bcl-2/Bax signaling [J]. Drug Des Devel Ther, 2015(9):6303-6317.
[13] He YJ, Kuchta K, Lv X, et al. Curcumin, the main active constituent of turmeric (Curcuma longa L.), induces apoptosis in hepatic stellate cells by modulating the abundance of apoptosis -related growth factors [J]. Z Naturforsch C, 2015,70(11-12):281-285.
[14] Sato M, Suzuki S, Senoo H. Hepatic stellate cells: unique characteristics in cell biology and phenotype[J]. Cell Struct Funct, 2003,28(2):105-112.
[15] Brown B, Lindberg K, Reing J, et al. The basement membrane component of biologic scaffolds derived from extracellular matrix [J]. Tissue Eng, 2006,12(3):519-526.
[16] Cassiman D, Libbrecht L, Desmet V, et al. Hepatic stellate cell/myofibroblast subpopulations in fibrotic human and rat livers [J]. J Hepatol, 2002, 36(2):200-209.
[17] 陈琦,王利,李少伟,等. 蓝莓花青素对肾小球系膜细胞增殖与凋亡作用[J].生物技术,2013,23(5):38-42.
[18] 王琴,温其标.紫甘薯花色苷光谱特性及抗氧化性的研究[J].现代食品科技,2009,25(11):67-72.
[19] 陆爽,程明亮,杨德猛,等.蓝莓对大鼠肝星状细胞T6凋亡及Bcl-2、Bax表达的影响[J].中华医学杂志,2015,95(31):35-38.
Effects of blueberry anthocyanins on activation and proliferation of oxidative stress-induced rat hepatic stellate cells
WANGLi,HEPing,SUNJiangchao,WANGYuping,CHENGMingliang
(GuizhouMedicalUniversity,Guiyang550004,China)
ObjectiveTo investigate the effects of blueberry anthocyanins on the activation, proliferation and apoptosis of oxidative stress-induced rat hepatic stellate cells (HSC-T6) and the correlated mechanisms. MethodsHSC-T6 cells in the logarithmic phase were divided into the observation group, control group and the blank group, respectively. The observation group was incubated with 100 μg/mL U/L GO for 3 hours after blueberry anthocyanin intervention of 24 hours, the control group was incubated with 100 U/L GO for 3 hours, and the blank group without any treatment. After 24-hour intervention, the expression of α-smooth muscle actin (α-SMA) in HSC-T6 cells was measured by immunohistochemistry, the cytosolic collagen I (Col I) level was detected by ELISA, the cell proliferation was detected by MTT, the apoptosis of HSC-T6 was detected by flow cytometry, the level of MDA was measured by thiobarbituric acid method, and the activity of superoxide dismutase (SOD) and the level of GSH were detected by xanthine oxidase and enzyme linked immunosorbent assay, respectively. ResultsAfter intervention of 24 h, the expression level of α-SMA in each group was blank group hepatic stellate cells; blueberry; anthocyanins; oxidative stress; α-smooth muscle actin; collagen I; cell proliferation; apoptosis 国家自然科学基金资助项目(81460125);贵州省留学人员科技活动项目(20151010);贵州省科技厅中药现代项目(黔科合ZY字-2012-3017);贵州省省长基金项目(黔省专合字2012-44)。 王丽(1987-),女,硕士研究生,研究方向为肝纤维化的治疗。E-mail: 81393551@qq.com 简介:程明亮(1957-),男,博士,博士生导师,教授,研究方向为肝纤维化及病毒性肝炎的治疗。E-mail: chengml@21cn.com 10.3969/j.issn.1002-266X.2016.18.003 R575.2 A 1002-266X(2016)18-0008-03 2016-01-06)

