β-榄香烯对人肝癌细胞HepG2增殖的影响及机制探讨
张义敏,田明涛,李萍,唐承
(1 山东中医药大学,济南250355;2 威海市胸科医院)
·基础研究·
β-榄香烯对人肝癌细胞HepG2增殖的影响及机制探讨
张义敏1,2,田明涛2,李萍2,唐承2
(1 山东中医药大学,济南250355;2 威海市胸科医院)
目的观察β-榄香烯对人肝癌细胞株HepG2增殖的影响,并探讨其作用机制。方法取对数生长期HepG2细胞分为A、B、C、D组,分别置于含10%胎牛血清RPMI 1640培养基、5 μg/mL β-榄香烯+10%胎牛血清RPMI 1640培养基、10 μg/mL β-榄香烯+10%胎牛血清RPMI 1640培养基、20 μg/mL β-榄香烯+10%胎牛血清RPMI 1640培养基中培养。采用MTT法检测培养0、24、48、72 h时细胞增殖抑制率,采用RT-PCR法检测各组培养24 h时细胞轴蛋白(Axin)、结肠腺瘤息肉易感基因(APC)蛋白和β-连环蛋白(β-catenin) mRNA 。结果培养0、24、48、72 h各组细胞增殖抑制率均B组 肝癌;β-榄香烯;Wnt/β-catenin信号通路;轴蛋白;结肠腺瘤息肉易感基因;β-连环蛋白 原发性肝癌是我国常见的恶性肿瘤,病死率居恶性肿瘤的第3位[1]。肝癌的发生与病毒感染、肝硬化、摄入黄曲霉素、环境污染等有关,目前尚无有效治疗方法[2]。近年研究发现,多种信号转导通路与原发性肝癌的发生密切相关。Wnt/β-连环蛋白(β-catenin)信号转导通路(经典Wnt通路)在生物发育、细胞转运、凋亡等过程中发挥重要作用[3],其异常活化与肿瘤的发生、发展关系密切[4]。轴蛋白(Axin)、结肠腺瘤息肉易感基因(APC)蛋白和β-catenin是Wnt信号通路中的重要组成因子。莪术是我国姜科植物蓬莪术或温郁金、广西莪术的根茎,具有行气破血、消积止痛的功效,以往常用于治疗癥瘕痞块、瘀血经闭、胸痹心痛、食积胀痛[5]。现代药理研究发现,莪术具有抗肿瘤作用[6]。莪术根茎提取物β-榄香烯是莪术抗肿瘤的3种有效成分之一,可抑制肿瘤细胞的增殖,但其具体作用机制目前尚不明确。2014年8月~2015年11月,我们观察了β-榄香烯对体外培养的人肝癌细胞HepG2增殖的影响,并探讨其可能机制。现报告如下。 1.1材料HepG2购自中国科学院上海生化所细胞库,RPMI 1640培养基与胎牛血清均购自Gibco公司,β-榄香烯购自中国药品生物制品检定所(NICPBP),兔抗β-catenin、Axin、APC多克隆抗体购自Santa Cruz Biotech公司;鼠抗β-catenin、Axin、APC购自Beyotime公司。Tris、DTT、SDS、Nuclease Mix等购自美国Sigma公司,Immobiline Drystrip Cover Fluid、Immobiline Drystrip PH3-10NL等购自美国GE公司,Temed、CHAPS、 Electrophoresis Regent(T9281)购自美国Simga公司,CCK-8试剂盒购自江苏碧云天公司。 1.2细胞分组及干预取对数生长期HepG2细胞,置于含10%胎牛血清的RPMI 1640体外培养基,37 ℃、5%CO2、饱和湿度无菌培养箱中培养。将细胞分为A、B、C、D组,分别置于含10%胎牛血清RPMI 1640培养基、5 μg/mL β-榄香烯+10%胎牛血清RPMI 1640培养基、10 μg/mL β-榄香烯+10%胎牛血清RPMI 1640培养基、20 μg/mL β-榄香烯+10%胎牛血清RPMI 1640培养基中培养。 1.3HepG2细胞增殖观察采用MTT 法。取各组对数生长期细胞接种于96孔板,3×103/孔,每组6个复孔。分别于培养0、24、48、72 h后加入10 μL CCK-8,2 h后用酶标仪检测波长450 nm处光密度(OD)值。以A组为对照,计算各组细胞增殖抑制率。细胞增殖抑制率=(OD对照-OD观察)/OD对照×100%。实验共重复3次。 1.4HepG2细胞β-catenin、Axin、APC mRNA检测采用RT-PCR法。取各组培养24 h时对数生长期细胞,TRIzol法提取总RNA,反转录合成cDNA,采用sybr染色相对定量目标基因的表达,具体实验步骤与条件参考文献进行[7],引物购自克劳宁生物科技有限公司,以β-actin为内参。β-catenin上游引物5′-ATGACTCGAGCTCAGAGGGT-3′,下游引物5′- ATTGCACGTGTGGCAAGTTC -3′;Axin上游引物5′-ACCGAAAGTACATTCTTGATAAC-3′,下游引物5′-TCCATACCTGAACTCTCTGC-3′;APC上游引物5′-GGATGGAGAAGGCGAAAGTGAG-3′,下游引物5′-TTGCCAAAGGGTAGGGAAATG-3′。以反转录获得的cDNA为模板,分别扩增Axin、APC和β-catenin,复性温度分别为52 ℃、52 ℃、55 ℃,循环数均为30次。扩增产物经1.5%琼脂糖凝胶电泳(100 V、30 min)后,用BioImaging system观察成像。用NIH image software分析产物带灰度,以产物带与β-actin条带的灰度比值表示该基因的相对表达量,实验重复3次。 2.1各组细胞增殖抑制率比较见表1。 表1 各组细胞增殖抑制率比较 注:与B组比较,*P<0.05;与C组比较,#P<0.05;与同组前一时点比较,☆P<0.05。 2.2各组细胞β-catenin、Axin、APC mRNA表达比较见表2。 表2 培养24 h时各组细胞β-catenin、Axin、APC mRNA相对表达量比较 注:与A组比较,*P<0.05;与B组比较,#P<0.05;与C组比较,△P<0.05。 中药单体或复方抗肿瘤的确切疗效已得到国际公认,是近年来研究热点。中药可作用于肿瘤发生、发展的多个环节,具有多靶点、多环节、多效应的特点。其在抑制、杀伤肿瘤细胞、改善症状与体征,以及减轻放化疗不良反应、延长患者生存期等方面发挥重要作用;同时,具有不良反应少,能提高机体免疫力,不易产生耐药性等特点。β-榄香烯是莪术主要成分之一,是临床用于治疗恶性浆膜腔积液、肺癌、消化道肿瘤、脑瘤以及其他浅表性肿瘤的潜在新药,具有很强杀灭肿瘤细胞及抑制肿瘤生长作用[8]。研究发现,榄香烯联合TACE治疗肝癌可增加肿瘤反应率,延长肿瘤进展时间,并能够有效改善肝癌患者的生存质量[9,10],但其具体机制尚有待探讨。 Wnt/β-catenin信号通路在肿瘤的发生、发展及预后中起着重要的作用,针对Wnt/β-catenin信号通路中的关键分子靶向治疗肝癌,已成为肝癌治疗的新方向[11]。β-catenin/T细胞可调节Wnt靶基因的表达,其中β-catenin是正向调节因子,APC、Axin在Wnt信号转导通路中起负向调节作用[12,13]。研究认为,β-catenin基因是一种原癌基因,其表达产物β-catenin主要位于细胞膜,是Wnt信号通路的关键调节因子,决定着Wnt信号的开放或关闭。正常情况下,β-catenin介导Wnt信号从细胞膜到细胞质及细胞核的传递,从而使Wnt信号转导通路得以启动激活并顺利进行[14]。在异常Wnt信号通路中,β-catenin降解障碍致使细胞质内游离的β-catenin积聚并进入细胞核,并最终导致癌变的发生[15]。APC蛋白是一个多功能蛋白,可作为一个多种蛋白质复合物相互连接的骨架,在细胞周期、运动、黏附以及信号传导过程中发挥着重要作用,是Wnt信号转导通路的重要组成分子[16]。APC蛋白可控制β-catenin在细胞内的含量,在正常细胞内通过与Axin、GSK-3β蛋白结合,促进β-catenin在细胞内的降解[17]。APC基因突变或蛋白异常可使Wnt信号转导通路异常激活,引起多种原癌基因持续转录而最终导致肿瘤的发生[18]。Axin与APC一样,是一种重要的骨架蛋白,是支架蛋白复合体的构建基础,同时通过Wnt信号转导途径参与一系列生物学效应的调控,如体轴发育、细胞死亡、神经元的分化等,是一个新发现的肿瘤抑制因子[19]。Axin在各种肿瘤组织中存在不同情况的突变,其无法发挥在Wnt信号传导通路的调节作用,使细胞正常凋亡无法继续进行,引起肿瘤细胞异常增殖。 本研究发现,培养0、24、48、72 h,各组细胞增殖抑制率均为B组 [1] 张洋洋,曹海英,王志敏,等.淮安地区2009~2011年肝癌发病率与死亡率分析[J].中华肿瘤防治杂志,2014,21(7):490-497. [2] Ette AI, Ndububa DA, Adekanle O, et al. Utility of serum des-gamma- carboxyprothrombin in the diagnosis of hepatocellular carcinomaamong Nigerians, a case-control study[J]. BMC Gas, 2015, 15(1):113. [3] Koziński K, Dobrzyń A. Wnt signaling pathway-its role in regulation of cell metabolism [J]. Postepy Hig Med Dosw, 2013,67(213):1098-1108. [4] Brandl L, Horst D, de Toni E, et al. ITF-2B protein levels are correlated with favorable prognosis in patients with colorectal carcinomas [J]. Am J Cancer Res, 2015,5(7):2241-2248. [5] 国家药典委员会.中国药典(一部)[M].北京:中国医药科技出版社,2015:274-275. [6] 曾建红,黄凤香,廖迎.莪术油的含量测定和抗肿瘤作用的新进展[J].肿瘤药学,2012,2(1):19-22. [7] 赖满香,杨丽,张荣华.梓醇对OB-Oc共育体系中OB、OC活性及OBERα、β mRNA表达的影响[J].中国病理生理杂志,2015,31(7):1242-1246. [8] Zhang J, Zhang HD, Yao YF, et al. β-elemene reverses chemoresistance of breast cancer cells by reducing resistance transmission via exosomes [J]. Cell Physiol Biochem, 2015,36(6):2274-2286. [9] 陈德连,江会红.榄香烯联合介入治疗中晚期肝癌患者的近期疗效[J].广州中医药大学学报,2016,33(1):27-30. [10] 谭兵,吴府容.不同中药注射剂辅助治疗肝癌的有效性与经济学评价[J].中国医院用药评价与分析,2013,13(6):494-496. [11] Vasileiou G, Ekici AB, Uebe S, et al. Chromatin-remodeling-factor ARID1B represses wnt/β-catenin signaling[J]. Am J Hum Genet, 2015,97(3):445-456. [12] Moon RT, Bowerman B, Boutros M, et al. The promise and perils of Wnt signaling through beta-catenin[J]. Science, 2002,296(5573):1644-1646. [13] Akiyama T. Wnt/β-catenin signaling[J]. Cytokine Growth Factor Rev, 2000,11(4):273-282. [14] Luo W, Zou HY, Jin LH, et al. Axin contains three separabledomains that confer intramolecular, homodimeric and heterodime-ric interactions involved in distinct functions[J]. J Biol Chem, 2008,280(6):5054-5060. [15] Shou J, Ali-Osman F, Multani AS, et al. Human Dkk-1, agene encoding a Wnt antagonist, responds to DNA damage andits overexpression sensitizes brain tumor cells to apoptosis fol-lowing alkylation damage of DNA[J]. Oncogene, 2002,21(6):878. [16] Van E, JH, Giles JH. The many faces of the tumor suppressor gene APC[J]. Exp Cell Res, 2001,264(1):126-134. [17] Kikuchi A, Kishida S, Yamamoto H. Regulation of Wnt signaling by protein-protein interaction and post-translational modifications [J]. Exp Mol Med, 2006,38(1):1-10. [18] Yoo W, Coughlin SS, Lillard JW. Trends in cancer incidence rates in Georgia[J]. J Ga Public Health Associate, 2015,5(1):96-100. [19] Hida T, Nakamura F, Usui H, et al. Semaphorin3A-induced axonal transport mediated through phosphorylation of Axin-1 by GSK3β [J]. Brain Res, 2015,19(2):46-56. 唐承(E-mail: tangcheng968@126.com) 10.3969/j.issn.1002-266X.2016.18.009 R735.7 A 1002-266X(2016)18-0029-03 2016-03-18)1 材料与方法
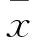
2 结果
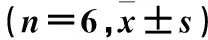
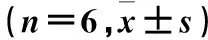
3 讨论

