抗氧化降脂治疗对非酒精性脂肪肝大鼠的影响
卢彩平,赵晓建,曹俊娟,苏白玉,吴 琳,任巧华
(1.河北省石家庄市第一医院内分泌科,河北 石家庄 050011;2.河北省石家庄市第一医院胸外科,河北 石家庄 050011;3.河北省石家庄市第一医院检验科,河北 石家庄 050011;4.河北省石家庄市第一医院心内科,河北 石家庄 050011)
·论著·
抗氧化降脂治疗对非酒精性脂肪肝大鼠的影响
卢彩平1,赵晓建2,曹俊娟3,苏白玉1,吴琳4,任巧华1
(1.河北省石家庄市第一医院内分泌科,河北 石家庄 050011;2.河北省石家庄市第一医院胸外科,河北 石家庄 050011;3.河北省石家庄市第一医院检验科,河北 石家庄 050011;4.河北省石家庄市第一医院心内科,河北 石家庄 050011)
目的观察阿托伐他汀钙、普罗布考对非酒精性脂肪肝(non-alcoholic fatty liver disease,NAFLD)大鼠的影响,探讨其作用机制。方法雄性成年SD大鼠32只随机分4组:正常对照组,普通饲料喂养,并予生理盐水灌胃;模型组,高脂饲料喂养,并予生理盐水灌胃;普罗布考干预组,高脂饲料喂养,并予普罗布考灌胃;普罗布考联合阿托伐他汀干预组(联合干预组),高脂饲料喂养,并予普罗布考灌胃和阿托伐他汀溶于生理盐水灌胃。饲养至18周末,处死大鼠,观察血脂、胰岛素、血糖等指标的变化,测定各组血清肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)、白细胞介素8(interleukin-6,IL-8)的水平。结果模型组、普罗布考干预组、联合干预组体质量和肝指数均高于正常对照组;普罗布考干预组、联合干预组体质量低于模型组(P<0.05)。模型组大鼠三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、丙氨酸转氨酶(alanine transaminase,ALT)明显高于正常对照组;普罗布考干预组TG、TC、LDL-C明显高于正常对照组,TG、TC、LDL-C、ALT低于模型组;联合干预组TG、TC、LDL-C、低于模型组和普罗布考干预组,ALT低于模型组;模型组、普罗布考干预组、联合干预组高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)低于正常对照组(P<0.05)。模型组、普罗布考干预组、联合干预组大鼠的血清胰岛素明显高于正常对照组(P<0.05)。模型组、普罗布考干预组、联合干预组大鼠内脏脂肪和内脏脂肪系数均高于正常对照组(P<0.05),普罗布考干预组、联合干预组内脏脂肪高于模型组(P<0.05)。模型组、普罗布考干预组、联合干预组糖化血红蛋白高于正常对照组(P<0.05)。模型组、普罗布考干预组大鼠外周血清IL-8、IL-6、TNF-α水平高于正常对照组,普罗布考干预组、联合干预组血清IL-8、IL-6、TNF-α水平低于模型组,联合干预组血清IL-8、IL-6、TNF-α水平低于普罗布考干预组(P<0.05)。结论普罗布考可能通过减轻肝细胞炎症反应来发挥保肝作用;普罗布考与阿托伐他汀在降脂方面可能存在协同作用。
脂肪肝;普罗布考;阿托伐他汀钙;大鼠
10.3969/j.issn.1007-3205.2016.08.004
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)已成为最常见的慢性肝脏疾病之一,其危害不仅可以进展为肝硬化、肝癌,而且作为代谢综合征的重要组分,与心脑血管疾病密切相关[1]。研究表明脂肪组织的作用不仅是能量储备,同时具有内分泌作用[2]。在NAFLD的发病过程中,脂肪细胞分泌多种炎症因子,通过影响胰岛素抵抗,参与糖类和脂类代谢;通过炎症反应、氧化应激等过程,在NAFLD疾病发展中起重要作用[3]。NAFLD的治疗包括生活方式干预及药物治疗,生活方式干预是治疗基础,目前治疗药物包括降脂药、胰岛素增敏剂、抗氧化剂及中成药等[4-6]。本研究通过高脂饮食复制NAFLD模型,观察普罗布考联合阿托伐他汀钙对NAFLD的内脏脂肪、胰岛素、白细胞介素6(interleukin,IL-6)、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)等的影响。报告如下。
1 材料与方法
1.1动物分组及标本采集雄性成年SD大鼠32只,随机分为4组。对照组8只,普通饲料喂养,并予1 mL/100 g体质量的生理盐水灌胃;模型组8只,高脂饲料(81%普通饲料、3%胆固醇、5%玉米油、1%蔗糖和10%猪油) 喂养,并予1 mL/100 g体质量的生理盐水灌胃;普罗布考干预组8只,高脂饲料喂养,并予普罗布考500 mg·d-1·kg-1灌胃;阿托伐他汀联合普罗布考干预组(联合干预组)8只,高脂饲料喂养,并予普罗布考500 mg·d-1·kg-1灌胃和阿托伐他汀10 mg·d-1·kg-1溶于生理盐水灌胃(每周根据大鼠的体质量情况调整药物剂量)。饲养至18周末,处死大鼠,采血进行指标测定。
1.2主要试剂普罗布考由北京诺美医药科技有限公司提供;三酰甘油(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)测定试剂盒,丙氨酸转氨酶(alanine transaminase,ALT)、天冬氨酸转氨酶(aspartateamino-transferase,AST)测定试剂盒购于中生北控生物科技股份有限公司;胰岛素、血糖、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)、白细胞介素8(interleukin-6,IL-8)放射免疫试剂盒购于上海依柯赛生物制品有限公司。
1.3方法①每周观察大鼠毛发、行为、体质量情况。18周末处死所有大鼠。处死前均禁食不禁水12 h,称质量后用1%水合氯醛腹腔麻醉,完整取出肝脏,观察肝脏外形,称肝脏湿质量来计算肝指数(肝湿质量/体质量×100%)。将肠系膜脂肪组织、肾周脂肪垫尽可能全的取出,为内脏脂肪组织(visceral fat,VF),称质量并计算内脏脂肪系数(内脏脂肪/体质量×100%)。②血清IL-8、IL-6、TNF-α测定,在末次给药后,当晚20:00禁食不禁水,次日上午8:00下腔静脉取血,分离血清,置于20 ℃冰箱保存备用,放射免疫法测定血清IL-8、IL-6、TNF-α水平。③血脂、AST、ALT、糖化血红蛋白(hemoglobin A1c,HbA1c)的测定,严格按照试剂盒说明书操作;④按照试剂盒说明书检测血清胰岛素,并计算胰岛素抵抗指数(HOMA-insulin resistance,HOMA-IR)=空腹胰岛素×空腹血糖÷22.5。
1.4统计学方法应用 SPSS 16.0统计学软件分析数据,计量资料比较分别采用F检验和q检验。P<0.05为差异有统计学意义。
2 结 果
2.1一般情况比较实验期间各组大鼠均无死亡。正常对照组大鼠皮毛整洁,饮食正常,灵活性好。模型组大鼠毛色偏黄,体型较大,懒动。普罗布考干预组及联合干预组大鼠体形稍大,灵活性差。第18周末模型组、普罗布考干预组、联合干预组体质量和肝指数均高于正常对照组(P<0.05);普罗布考干预组、联合干预组体质量低于模型组(P<0.05),肝指数与模型组差异无统计学意义(P>0.05);普罗布考干预组与联合干预组体质量、肝指数差异无统计学意义(P>0.05)。见表1。
表1各组大鼠体质量和肝指数比较
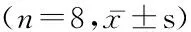

组别 体质量(g)肝指数(%)正常对照组350.4±10.32.6±0.4模型组403.3±16.3*3.4±0.3*普罗布考干预组389.2±12.5*#3.2±0.4*联合干预组380.5±10.4*#3.1±0.2* F25.1678.237 P0.0000.000
*P<0.05与对照组比较#P<0.05与模型组比较(q检验)
2.2各组血脂、转氨酶比较模型组大鼠TG、TC、LDL-C、ALT明显高于正常对照组(P<0.05);普罗布考干预组TG、TC、LDL-C明显高于正常对照组,TG、TC、LDL-C、ALT低于模型组(P<0.05);联合干预组TG、TC、LDL-C低于模型组和普罗布考干预组,ALT低于模型组(P<0.05);模型组、普罗布考干预组、联合干预组HDL-C低于正常对照组(P<0.05)。4组AST差异无统计学意义(P>0.05)。见表2。
表2各组大鼠血清学指标变化
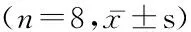

组别 TG(mmol/L)TC(mmol/L)HDL-C(mmol/L)LDL-C(mmol/L)ALT(U)AST(U)正常对照组0.3±0.11.8±0.11.3±0.10.4±0.261.6±16.3163.8±22.5模型组0.8±0.1*4.5±0.5*0.8±0.1*2.6±0.7*110.2±36.3*207.8±28.4普罗布考干预组0.6±0.2*#2.9±0.6*#0.8±0.1*1.9±0.4*#78.3±18.5#169.7±47.4联合干预组0.4±0.1#△2.2±0.5#△0.8±0.2*1.3±0.6*#△80.5±15.4#168.5±35.5 F22.47652.10728.57126.5146.0452.761 P0.0000.0000.0000.0000.0030.061
*P<0.05与正常对照组比较#P<0.05与模型组比较△P<0.05与普罗布考干预组比较(q检验)
2.3各组胰岛素水平和HOMA-IR比较模型组、普罗布考干预组、联合干预组大鼠血清胰岛素明显高于正常对照组(P<0.05),模型组、普罗布考干预组、联合干预组血清胰岛素差异无统计学意义(P>0.05)。4组HOMA-IR差异无统计学意义(P>0.05)。见表3。
表3各组大鼠胰岛素和HOMA-IR变化
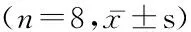
组别 胰岛素(mU/L)HOMA-IR正常对照组86.13±2.801.51±0.22模型组93.63±4.53*1.85±0.28普罗布考干预组92.75±5.18*1.73±0.29联合干预组93.35±4.68*1.71±0.25 F5.3062.325 P0.0050.096
*P<0.05与正常对照组比较(q检验)
2.4各组大鼠内脏脂肪、内脏脂肪系数比较模型组、普罗布考干预组、联合干预组大鼠内脏脂肪和内脏脂肪系数均高于正常对照组(P<0.05);普罗布考干预组、联合干预组内脏脂肪高于模型组(P<0.05),内脏脂肪系数与模型组差异无统计学意义(P>0.05);普罗布考干预组、联合干预组内脏脂肪和内脏脂肪系数差异无统计学意义(P>0.05)。见表4。
表4各组大鼠内脏脂肪和内脏脂肪系数变化

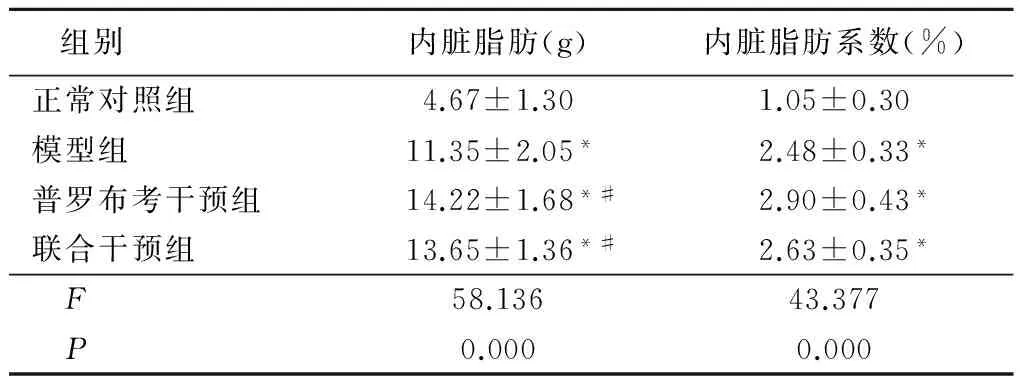
组别 内脏脂肪(g)内脏脂肪系数(%)正常对照组4.67±1.301.05±0.30模型组11.35±2.05*2.48±0.33*普罗布考干预组14.22±1.68*#2.90±0.43*联合干预组13.65±1.36*#2.63±0.35* F58.13643.377 P0.0000.000
*P<0.05与正常对照组比较#P<0.05与模型组比较(q检验)
2.5各组大鼠血糖和HbA1c比较模型组、普罗布考干预组、联合干预组HbA1c高于正常对照组(P<0.05),模型组、普罗布考干预组、联合干预组HbA1c差异无统计学意义(P>0.05);4组血糖水平差异无统计学意义(P>0.05)。见表5。
2.6各组大鼠血清IL-8、IL-6、TNF-α水平比较模型组、普罗布考干预组大鼠外周血清IL-8、IL-6、TNF-α水平高于正常对照组(P<0.05),普罗布考干预组、联合干预组血清IL-8、IL-6、TNF-α水平低于模型组(P<0.05);联合干预组血清IL-8、IL-6、TNF-α水平低于普罗布考干预组(P<0.05)。见表6。
表5各组大鼠血糖和HbA1c比较


组别 HbA1c(%)血糖(mmol/L)正常对照组86.13±2.804.47±0.59模型组93.63±4.53*4.92±0.46普罗布考干预组92.75±5.18*4.88±0.42联合干预组92.06±5.03*4.85±0.55 F4.7641.341 P0.0080.281
*P<0.05与正常对照组比较#P<0.05与模型组比较(q检验)
表6各组大鼠血清IL-8、IL-6、TNF-α水平比较


组别 IL-8(μg/L)IL-6(ng/L)TNF-α(μg/L)正常对照组0.7±0.159.5±13.70.5±0.4模型组1.3±0.4*108.4±25.9*1.3±0.3*普罗布考干预组1.0±0.2*#85.3±13.4*#1.0±0.2*#联合干预组0.6±0.1#△65.8±15.9#△0.7±0.1#△ F14.54512.2854.772 P0.0000.0000.008
*P<0.05与正常对照组比较#P<0.05与模型组比较△P<0.05与普罗布考干预组比较(q检验)
3 讨 论
NAFLD是一种进展性疾病。近年来,随着人们生活方式的改变,与肥胖、代谢综合征和糖尿病相关的NAFLD发病率明显上升,且患病人群呈年轻化趋势[7-8]。但其具体发病机制目前尚未完全明确。
NAFLD的发病原因较多,根据病因可分为原发性和继发性,与胰岛素抵抗和遗传易感性有关的超体质量/肥胖、2型糖尿病、高脂血症及特发因素引起的脂肪肝称为原发性NAFLD,而由营养不良、胃肠道手术后、全胃肠道外营养、体质量严重减少、药物、工业中毒及环境因素引的脂肪肝称为继发性NAFLD。一般所述NAFLD常指原发性NAFLD。
有报道认为肥胖是NAFLD的独立危险因素,且与其进展密切相关,61%~94%的肥胖患者患有脂肪肝[9],男性脂肪肝的患病率较绝经前女性高,绝经后的女性脂肪肝检出率与男性相当。可能与绝经前女性雌激素分泌较多有关,雌激素可增加皮下脂肪抑制内脏脂肪的生成,在相同饮食情况下,男性摄入的脂肪更多的储存在内脏[1]。人体相关研究发现,皮下、内脏脂肪等不同部位的脂肪组织功能存在根本性差异,皮下脂肪参与维持机体能量的稳态,而大网膜、肾周、附睾旁等部位的内脏脂肪与胰岛素抵抗、糖尿病等代谢性疾病的相关性较高。本研究结果显示,模型组大鼠内脏脂肪质量以及内脏脂肪系数都显著高正常对照组,普罗布考干预组及联合干预组的内脏脂肪以及内脏脂肪系数显著低于模型组;联合干预组内脏脂肪质量、内脏脂肪系数与普罗布考干预组差异无统计学意义。可能与药物干预时间短有关,需在今后的研究中进一步完善。
有研究表明NAFLD是代谢综合征在肝脏的表现,胰岛素抵抗不仅是NAFLD的始动因素,而且参与NAFLD发展的整个过程。胰岛素抵抗造成大量脂质在肝脏的堆积,引起肝细胞的脂肪变,形成了肝细胞的初次打击。本研究结果显示,模型组、普罗布考干预组及联合干预组大鼠血清胰岛素水平明显高于正常对照组,表明在NAFLD大鼠中存在胰岛素抵抗。模型组、联合干预组和普罗布考干预组胰岛素水平差异无统计学意义。此外,胰岛素抵抗还能引起脂肪组织分泌包括IL-8、IL-6、TNF-α等细胞炎性因子,造成对肝细胞的二次打击[10]。
近年来,炎症因子在肝脏疾病发病过程中的作用受到学者们越来越多的关注。从肝细胞脂肪变性到脂肪性肝炎、肝纤维化、肝硬化的进展过程中,细胞因子都发挥了重要作用。细胞因子分为致炎因子和抗炎因子,参与肝脏疾病的致炎因子很多,TNF-α为其中重要的一种,TNF-α在动脉粥样硬化、胰岛素抵抗、肥胖、2型糖尿病的发病过程中均起重要作用。乙醇及其代谢产物、内毒素、免疫复合物、病毒等物质诱导单核巨噬细胞产生的TNF-α,作用在其靶器官肝脏上,介导了肝损伤与肝修复的病理生理过程。研究表明TNF-α诱导细胞因子的生成,后者导致炎性细胞的聚集;高浓度TNF-α可减少外周组织的脂肪分解,还可以强力抑制脂蛋白脂酶的活性,促进肝细胞合成和聚集TG[11-12]。另外,IL-6也是致炎因子,可由巨噬细胞和单核细胞等多种细胞产生,它对脂肪分解具有一定的抑制作用,并促进肝脏产生局部炎症反应,从而促进脂肪肝的形成。同时它也是具有广泛免疫调节作用的脂肪因子,IL-6可诱导肝脏合成C反应蛋白,还可刺激肝脏分泌极低密度脂蛋白胆固醇,导致高三酰甘油血症。在骨骼肌中,IL-6对胰岛素敏感性的调节具有双重作用。短期IL-6可增强胰岛素敏感性,IL-6通过激活氨基末端激酶2、蛋白酪氨酸磷酸酶1B和细胞信号转导抑制因子3信号通路的表达,导致胰岛素抵抗[13-14]。IL-8可促使活化的中性粒细胞聚集至肝脏而引起炎症反应,还可使脂类物质在肝细胞内聚集,而内毒素水平的升高也可刺激库普弗细胞释放TNF-α,TNF-α再进一步促进IL-8的产生,参与肝细胞的炎症反应,最终导致肝细胞的损伤[15-16]。
本研究结果显示,模型组大鼠血清TNF-α、IL-8、IL-6水平较正常对照组明显升高,证实了TNF-α、IL-6、IL-8参与了NAFLD的发病过程;而应用普罗布考和阿托伐他汀治疗后,大鼠血清TNF-α、IL-6、IL-8水平明显下降,证实普罗布考及阿托伐他汀干预能显著改善NAFLD的生化指标。其中的可能机制是其通过调节大鼠体内脂质代谢,间接改善了胰岛素抵抗,减少了TNF-α等炎性因子的水平,减轻了炎症反应及脂质过氧化,进一步减少了炎性细胞的浸润,从而延缓了NAFLD的病情进展。
综上所述,普罗布考可能通过减轻炎症反应来发挥保肝、降脂作用;普罗布考与阿托伐他汀在降脂方面可能存在协同作用。治疗NAFLD的药物正在不断研发中,目前尚无特效药物。NAFLD是一种不良生活方式导致的代谢性疾病,其防治不能单靠药物,还需要生活方式干预,纠正不良饮食习惯,增加有氧运动,合理控制体质量,在此基础上配合药物治疗才能取得最好的效果,从而延缓动脉粥样硬化、2型糖尿病及急性心脑血管事件的发生,提高NAFLD患者的生活质量。
[1]Team R,LaBrecque DR,Abbas Z,et al. World gastroenterology organisation global guidelines:nonalcoholic fatty liver disease and nonalcoholic steatohepatitis[J]. J Clin Gastroenterol,2014,48(6):467-473.
[2]Abu-Serie MM,EL-Gamal BA,EI-Kersh MA,et al. Investigation into the antioxidant role of arginine in the treatment and the protection for intralipid-induced non-alcoholic steatohepatitis[J]. Lipids Health Dis,2015,14:128.
[3]Chalasani N,Younossi Z,Lavine JE,et al. The diagnosis and management of non-alcoholic fatty liver disease:practice guideline by the American Association for the Study of Liver Diseases,American College of Gastroenterology,and the American Gastroenterological Association[J]. Hepatology,2012,55(6):2005-2023.
[4]Hoofnagle JH,van Natta ML,Kleiner DE,et al. Vitamin E and changes in serum alanine aminotransferase levels in patients with non-alcoholic steatohepatitis[J]. Aliment Pharmacol Ther,2013,38(2):134-143.
[5]Musso G,Cassader M,Gambino R. Cholesterol-lowering therepy for the treatment of nonalcoholic fatty liver disease:an update[J]. Curr Opin Lipidol,2011,22(6):489-496.
[6]Samson SL,Bajaj M. Potential of incretin-based therapies for non-alcoholic fatty liver disease[J]. J Diabetes Complications,2013,27(4):401-406.
[7]Lonardo A,Ballestri S,Marchesini G,et al. Nonalcoholic fatty liver disease:a precursor of the metabolic syndrome[J]. Dig Liver Dis,2015,47(3):181-190.
[8]Bambha K,Belt P,Abraham M,et al.Ethnicity and nonalcoholic fatty liver disease[J]. Hepatology,2012, 55(3):769-780.
[9]李钰,李姣,陈红,等.脂肪肝与糖尿病、高血压及体质量指数的相关性分析[J].现代中西医结合杂志,2015,24(5):1640-1641,1646.
[10]Parnell JA,Kaman M,Rioux KP,et al. The potential role of prebiotic fibre for treatment and management of non-alcoholic fatty liver disease and associated obesity and insulin resistance[J]. Liver Int,2012,32(5):701-711.
[11]Gao H,Xu L,Li D,et al. Effects of glucagon-like peptide-1 on liver oxidative stress,TNF-α and TGF-β1 in rats with non-alcoholic fatty liver disease[J] . Nan Fang Yi Ke Da Xue Xue Bao,2013,33(11):1661-1664.
[12]Cheng Q,Li N,Chen M,et al. Cyclooxygenase-2 promotes hepatocellular apoptosis by interacting with TNF-α and IL-6 in the pathogenesis of nonalcoholic steatohepatitis in rats[J]. Dig Dis Sci,2013,58(10):2895-2902.
[13]Mas E,Danjoux M,Garcia V,et al. The pro-inflammatory action of tumour necrosis factor-α in non-alcoholic steatohepatitis is independent of the NSMAF gene product[J]. Dig Liver Dis,2013,45(2):147-154.
[14]Giannitrapani L,Soresi M,Balasus D,et al. Genetic association of interleukin-6 polymorphism(-174 G/C) with chronic liver diseases and hepatocellular carcinoma[J]. World J Gastroenterol,2013,19(16):2449-2455.
[15]Bakar MH,Sarmidi MR,Kai CK,et al. Amelioration of mitochondrial dysfunction-induced insulin resistance in differentiatief 3T3-L1 adipocyte via inhibition of NF-κB pathways[J]. Int J Mol Sci,2014,15(12):22227-22257.
[16]Zhao J,Zheng H,Liu Y,et al. Anti-inflammatory effects of total alkaloids from Rbus alceifolius Poir [corrected].On non-alcoholic fatty liver disease through regulation of the NF-κB pathway[J]. Int J Mol Med,2013,31(4):931-937.
(本文编辑:赵丽洁)
Effects of antioxidant lipid-lowering therapy on nonalcoholic fatty liver disease in rats
LU Cai-ping1, ZHAO Xiao-jian2, CAO Jun-juan3, SU Bai-yu1, WU Lin4, REN Qiao-hua1
(1.Department of Endocrinology, the First Hospital of Shijiazhuang City,Hebei Province, Shijiazhuang 050011,China; 2.Department of Thoracic Surgery , the First Hospital of Shijiazhuang City,Hebei Province, Shijiazhuang 050011,China; 3.Department of Clinical Laboratory, the First Hospital of Shijiazhuang City,Hebei Province, Shijiazhuang 050011,China;4.Department of Cardiovascular, the First Hospital of Shijiazhuang City,Hebei Province, Shijiazhuang 050011,China)
ObjectiveTo investigate the effects of atorvastatin and probucol therapy on nonaloholic fatty liver disease (NAFLD) in rats,and to explore the related mechanism. MethodsThirty-two male SD rats were randomly divided into four group: normal group with normal diet and gastric perfusion of saline, NAFLD control group with high fat diet and gastric perfusion of saline, and probucol prevention group with high fat diet and gastric perfusion of probucol, atorvastatin and probucol prevention group with high fat diet and gastric perfusion of probucol and atorvastatin. At the end of 18th week, rats were sacrificed to observe the changes of blood lipid, insulin and blood glucose in rats, and to determine the levels of serum TNF-α, IL-6 and IL-8. ResultsRats weight and hepatic index in the model group, probucol prevention group, atorvastatin and probucol prevention group were higher than those in the control group. Rats weight in probucol prevention group, atorvastatin and probucol prevention group was lower than that in the model group(P<0.05).The TG, TC, LDL-C, ALT in the model group were significantly higher than that in the control group. The TG, TC and LDL-C in the probucol prevention group were significantly higer than that in the normal group. TG, TC, LDL-C and ALT in the probucol prevention group were significantly lower than those in the control group. TG, TC and LDL-C in atorvastatin and probucol prevention group were lower than those in the model group and probucol prevention group. ALT in atorvastatin and probucol prevention group was lower than that in the model group. The HDL in model group, probucol prevention group, atorvastatin and probucol prevention group were lower than that in the normal group(P<0.05) . The serum insulin in model group, the probucol prevention group and the atorvastatin and probucol prevention group was significantly higher than that in the control group(P<0.05). Visceral fat and visceral fat coefficient in the model group, the probucol prevention group and the atorvastatin and probucol prevention group were higher than those in the normal control group(P<0.05). Visceral fat in probucol group, atorvastatin and probucol prevention group were higher than that in the model group(P<0.05). HbA1c in the model group, the probucol prevention group and the atorvastatin and probucol prevention group were higher than those in the normal control group(P<0.05). The serum IL-8, IL-6, TNF-α in the model group, the probucol prevention group were higher than those in the normal group. The serum IL-8, IL-6, TNF-α in the probucol prevention group and atorvastatin and probucol prevention group were higher than those in the model group. The serum IL-8, IL-6, TNF-α in atorvastatin and probucol prevention group were lower than those in the probucol prevention group(P<0.05). ConclusionProbucol could protect live functiong, which might be related to alleviate inflammation.There might be synergistic effect of atorvastatin and atorvastatin on lipid lowering.
fatty liver; probucol; atorvastatin; rats
2016-01-22;
2016-03-11
河北省科学技术研究与发展指导计划(132777200)
卢彩平(1981-),女,山西临汾人,河北省石家庄市
R575.5
A
1007-3205(2016)08-0883-06
第一医院主治医师,医学硕士,从事内分泌疾病诊治研究。

