菊芋花盘酚类物质提取和体外抗氧化活性研究
王海涛,于 涛
(东北林业大学盐碱地生物资源环境研究中心,东北油田盐碱植被恢复与重建教育部重点实验室,黑龙江哈尔滨 150040)
菊芋花盘酚类物质提取和体外抗氧化活性研究
王海涛,于涛*
(东北林业大学盐碱地生物资源环境研究中心,东北油田盐碱植被恢复与重建教育部重点实验室,黑龙江哈尔滨 150040)
目的:明确不同的提取剂对菊芋(Helianthustuberosus)花盘中次生代谢物质含量和体外抗氧化活性的影响,并探究花盘中的主要的酚类物质。方法:以菊芋花盘干粉为实验材料,使用了不同体积分数的乙醇、甲醇、丙酮等有机溶剂对材料进行提取,测定了总酚、总黄酮含量,并使用FRAP、DPPH、ABTS三种抗氧化方法测定样品的抗氧化活性。通过超效液相色谱的方法测定菊芋花盘中主要的酚类物质。结果:60%乙醇提取的情况下总酚含量最高,70%丙酮提取的情况下总黄酮含量最高,菊芋花盘的抗氧化活性较强并且液相分析结果表明槲皮素是其最主要酚类物质。结论:不同的提取液对菊芋花盘的次生代谢物提取含量影响显著,不同的抗氧化方法均表明菊芋花盘有较强的抗氧化活性,槲皮素作为菊芋花盘的主要酚类物质可以进一步开发利用。
菊芋,花,总酚,总黄酮,抗氧化活性,槲皮素
菊芋(Helianthustuberosus)原产于北美洲,当地的土著居民很早之前就对其进行了栽培,然后在世界范围内广泛传播种植[1]。菊芋是一种菊科向日葵属的多年生草本被子植物,茎高1~3 m,开黄色花,叶子为椭圆形,具有叶毛,地下根茎系统发达,能结出很多块茎[2-3]。与传统的农作物相比,菊芋拥有一系列的优点:较高的生长率,比较强的抗寒、抗旱能力,可以在比较贫瘠的土壤中生长,并且对害虫和一些植物类疾病有很强的抵御能力[4]。传统上,菊芋被当作食物或者动物饲料,而在过去的两个世纪里,人们开始开发利用菊芋中的菊粉、低聚果糖和果糖等作为功能性食品的添加剂[5-6]。
生物体氧化过程中可以产生以超氧阴离子为代表的活性氧自由基,许多人类疾病包括早衰、癌症、心血管疾病、神经衰弱等都与体内过量的自由基有关,使用抗氧化剂来治疗这些疾病是有效的应对方法。由于使用合成的药物有一定的风险[7-8],人们把越来越多的注意力转向了自然界中天然存在的抗氧化物质,这些物质可以清除各种各样的自由基,例如DPPH、ABTS、FRAP和一些有氧细胞产生的活性氧[9-10]。许多研究发现菊芋叶片中总酚、总黄酮的含量很高,并具有良好的抗氧化活性,说明菊芋叶片可以作为一种潜在的天然抗氧化物质[11-12]。菊芋的花盘一般在侧枝和主干的末端独立或者成群分布,被许多小的黄色管状圆形花围在中心。目前对菊芋花盘的研究还是空白的,本研究旨在对菊芋花盘的抗氧化物质的提取和测定进行探索,并通过超效液相色谱的方法对花盘中的主要酚类物质种类和含量进行研究和鉴定。
1 材料与方法
1.1材料与仪器
菊芋来自课题组东北林业大学种植园,在2014年9月中旬花期旺盛时采摘,去除花瓣,65 ℃烘干,粉碎,备用。Folin-Ciocalteus试剂、没食子酸、芦丁、ABTS、甲醇Sigma;Trolox、DPPH、TPTZ日本;过硫酸钾、冰乙酸、FeCl3、NaOAC·3H2O、浓HCl等均为国产分析纯。
超效液相色谱系统UPLC-PAD,Waters,USA,ACQUITY UPLC H-Class;液质联用仪系统LC-MS,Waters-AB,USA,AB SCIEX QTRAP 5500;色谱柱Waters ACQUITY UPLC® HSS T3 Column(2.1×50 mm,1.8 μm);旋转蒸发仪Eppendorf Concentrator Plus;高速万能粉碎仪泰斯特;恒温水浴锅SY21-KP4;电热鼓风干燥箱赛多利斯101-2AB等。
1.2提取
称取0.l g菊芋花盘的干粉作为一个样品,进行不同浓度的甲醇、乙醇、丙酮等提取试剂的比较,每个样品加入提取试剂2 mL。混合后的样品在频率100 kHz、功率120 W、温度45 ℃的条件下超声1 h,过夜静置。离心10 min,取上清转移至新的离心管中,使用旋转蒸发仪45 ℃旋转蒸发至干燥,然后向管中加入1 mL甲醇∶水(1∶1)溶液进行溶解,离心30 min,上清转移至新管备用,每种提取试剂重复3次。
1.3总酚含量的测定
总酚含量的测定使用福林酚试剂法,选取没食子酸作为标品[13]。吸取50 μL的样品加入5 mL离心管中,加入450 μL甲醇∶水(1∶1)溶液补齐到0.5 mL,然后加入0.5 mL福林酚试剂,混匀后加入1.5 mL 10%碳酸钠溶液,把混合液放在75 ℃水浴中反应10 min,760 nm测定吸光光度值。总酚含量以mg GAE/g DW表示。
1.4总黄酮含量的测定
标曲的测定,选取芦丁作为标品[14]。吸取125 μL的样品加入到5 mL离心管中,然后加入5%亚硝酸钠溶液摇匀,放置6 min;加入10%硝酸铝溶液125 μL,放置6 min;加入4%氢氧化钠溶液1.0 mL,再加入1.125 mL乙醇定容到2.5 mL。总黄酮含量以mg QE/g DW表示。
1.5FRAP抗氧化实验
FRAP抗氧化实验根据以前的方法报道,选取Trolox作为标品[15]。30 μL的样品加入到3 mL配制好的FRAP溶液,混合后在黑暗下反应5 min,595 nm测定吸光光度值,每个样品重复3次。FRAP总还原力以mg TE/g DW表示。
1.6DPPH抗氧化实验
DPPH抗氧化实验根据以前的方法报道,选取Trolox作为标品[16]。30 μL的样品加入到3 mL配制好的DPPH溶液,混合后在黑暗下反应30 min,517 nm测定吸光光度值,每个样品重复3次。自由基清除能力以X%来表示,清除率按以下公式计算。
X(%)=[1-(Ai-Aj)/Ac]×100
式中:Ai为30 μL样品溶液+3 mL DPPH试剂混合液的吸光度;Aj为30 μL样品溶液+3 mL空白溶剂(无水甲醇)混合液的吸光度;Ac为3 mL DPPH溶液+30 μL空白溶剂混合液的吸光度。
1.7ABTS抗氧化实验
ABTS抗氧化实验根据以前的方法报道,选取Trolox作为标品[17]。30 μL的样品加入到3 mL配制好的ABTS溶液,混合后在黑暗下反应6 min,734 nm测定吸光光度值,每个样品重复3次。自由基清除能力以X%来表示,清除率按以下公式计算。
X(%)=[(Ai-Aj)/Ai]×100
试中:Ai为30 μL空白溶剂(无水甲醇)+3 mL混合液的吸光度;Aj为30 μL样品溶液+3 mL DPPH试剂混合液的吸光度。
1.8使用UPLC和LC-MS技术进行酚的定量分析
选择60%的乙醇花盘提取物,进行酚类物质的定量分析。选取了14种酚类物质标品,进行LC-MS分析,质谱检测方式为正离子检测,扫描方式为多反应检测。通过样品与标准品酚类物质的离子对、CE及保留时间等信息的比对来鉴定和测定菊芋花盘的酚类物质种类和含量。
1.9数据分析
采用spss13.0统计软件对不同浓度有机溶剂提取得到的总酚、总黄酮和不同的抗氧化结果分别进行单因素方差分析,结果用平均数±标准差表示,显著水平为p<0.05。
2 结果与分析
2.1不同浓度种类有机溶剂提取得到的总酚结果

表1 不同浓度有机溶剂提取得到的总酚含量(mg GAE/g DW)Table 1 The total phenolic content of different concentration solvents extract(mg GAE/g DW)
注:不同大写字母表示同一有机溶剂不同浓度间差异显著(p<0.05)。ND代表没有对相应浓度进行测定,表2~表5同。
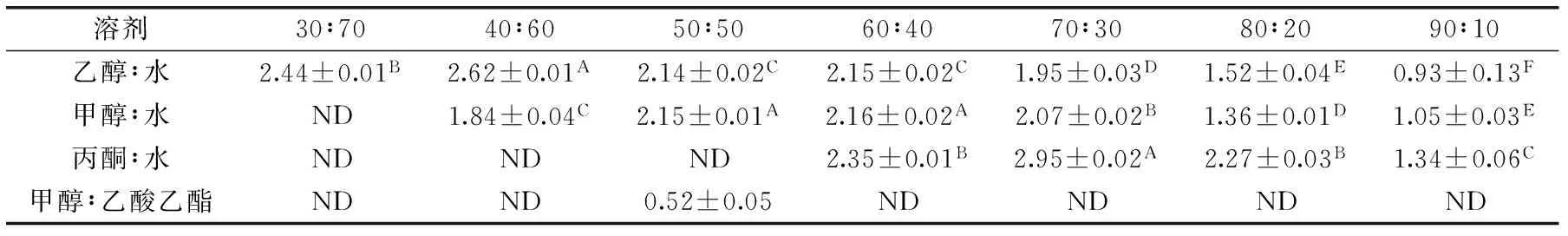
表2 不同浓度有机溶剂提取得到的总黄酮含量(mg QE/g DW)Table 2 The total flavonoids content of different concentration solvents extract(mg QE/g DW)
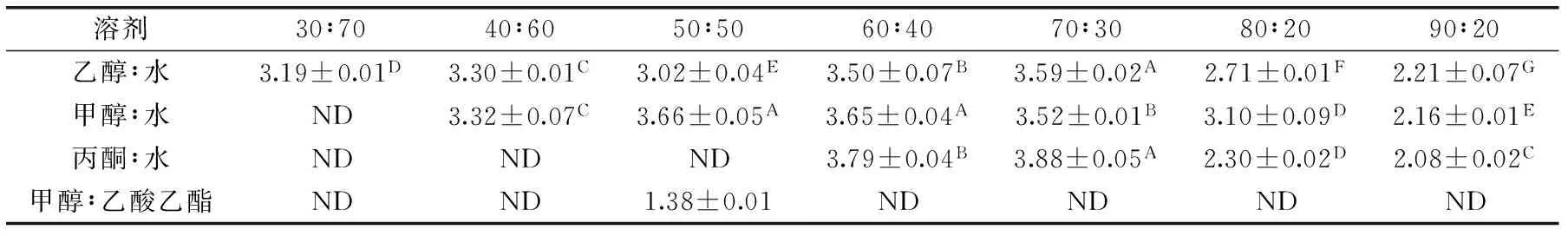
表3 不同浓度有机溶剂提取物的FRAP抗氧化活性(mg TE/g DW)Table 3 The FRAP antioxidant performance of different concentration solvents extract(mg TE/g DW)

表4 不同浓度有机溶剂提取物的DPPH抗氧化活性(%)Table 4 The DPPH antioxidant performance of different concentration solvents extract(%)
乙醇、甲醇和丙酮是次生代谢物质提取过程中常用的有机溶剂,选取了这几种有机溶剂对样品进行提取,并探索相应的最佳提取浓度,并且有研究发现在菊芋叶片总酚提取的过程中发现在乙酸乙酯提取部位的酚含量最高[18],因此也选择了乙酸乙酯∶水(1∶1)溶剂进行了提取。由表1可知,当选择60%的乙醇进行提取时,提取得到的酚类物质含量最高,为5.54 mg GAE/g DW,60%的甲醇、丙酮的提取效果也较好,提取剂浓度较高时提取量显著降低,可能是因为植物多酚既有水溶性的又有脂溶性的,因此中等浓度的有机溶剂更适合选取。使用甲醇∶乙酸乙酯(1∶1)进行提取时,得到总酚含量较低,为1.71 mg GAE/g DW,说明不适合直接使用乙酸乙酯对菊芋花盘进行提取,而选取别的有机溶剂粗提取后用乙酸乙酯进行萃取的效果有待进一步探索。
2.2不同浓度种类有机溶剂提取得到的总黄酮结果
由表2可知,当选择70%的丙酮进行提取时,提取得到的黄酮类物质含量最高,为2.95 mg QE/g DW,而乙醇和甲醇的最佳提取浓度分别是40%和60%,分别为2.62 mg QE/g DW和2.16 mg QE/g DW,不过考虑到丙酮的毒性,实际应用中应选择40%的乙醇。与总酚的提取类似,选取中等浓度的有机溶剂对总黄酮提取效果更好,也与黄酮类物质的溶解性有关,并且有研究发现使用不同浓度甲醇对菊芋叶片黄酮提取时最佳浓度是70%[12],也进一步证实了这个结论。使用甲醇∶乙酸乙酯(1∶1)进行提取时,提取得到的黄酮类物质含量最低,为0.52 mg QE/g DW。
2.3体外抗氧化实验结果
为了探究菊芋花盘提取物的体外抗氧化能力,选择了FRAP、DPPH、ABTS三种方法对提取到的样品的抗氧化活性进行测定。由表3可知,当选择70%的丙酮进行提取时,提取物的FRAP抗氧化活性最强,达到3.88 mg TE/g DW,并且这个浓度的丙酮提取得到的黄酮含量也最高,而甲醇和乙醇的最适提取浓度分别是50%和70%,含量分别为3.66 mg TE/g DW和3.59 mg TE/g DW。由表4可知,当选择60%乙醇进行提取时,提取物的DPPH自由基清除能力最强,清除率达到42.65%,此时总酚类物质含量也最高,相同浓度(40%、60%、80%)的乙醇和甲醇提取物比较,乙醇提取物的DPPH自由基清除能力显著高于甲醇。由表5可知,当选择60%丙酮进行提取时,提取物的ABTS自由基清除能力最强,达到91.26%,而甲醇和乙醇最佳的提取浓度分别是50%和60%,分别达到85.79%和81.77%,并且与另外两种方法相比,同种溶剂不同浓度间的测定结果变化幅度较大,可能此方法更灵敏。3种方法中的乙酸乙酯提取物的抗氧化活性都比较弱,可能与其提取得到的次生代谢物质较少有关。综合来看中等浓度的甲醇、乙醇和丙酮提取物的体外抗氧化活性比较强,可能与其提取到的总酚和总黄酮含量比较高有关,并且前人已经做了许多研究证实植物的体外抗氧化能力主要是由植物中的次生代谢物决定的[19-21]。随着人们越来越重视从天然植物中获取抗氧化物质,改善人类的生活质量,菊芋花盘可以作为这样的植物材料被开发利用。

表5 不同浓度有机溶剂提取物的ABTS抗氧化活性(%)Table 5 The ABTS antioxidant performance of different concentration solvents extract(%)
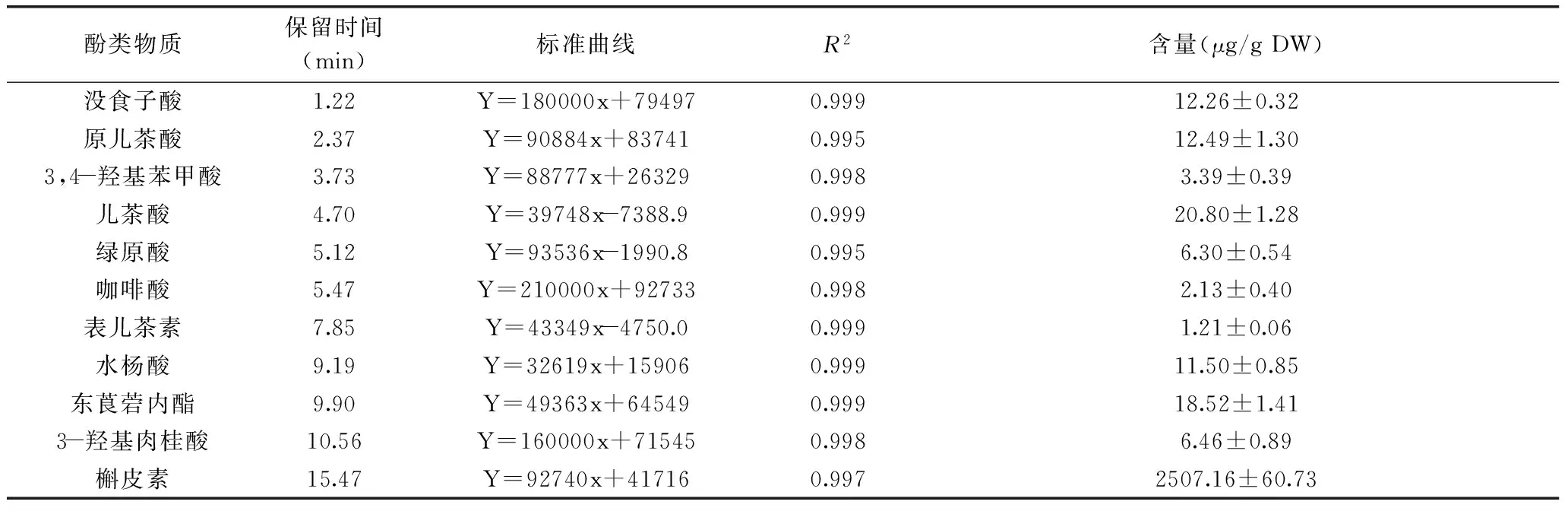
表6 花盘中酚类物质含量Table 6 The phenolic compound content in the Jerusalem artichoke disk
2.4UPLC法测定酚类物质种类和含量

图1 14种标准酚类物质和菊芋花盘UPLC分离图谱Fig.1 UPLC chromatogram of the 14 responding standards and Jerusalem artichoke disk 标注:峰1~14分别为没食子酸、原儿茶酸、 4-羟基苯甲酸、儿茶素、绿原酸、咖啡酸、 表儿茶素、水杨酸、东莨菪内酯、3-羟基肉桂酸、 阿魏酸、芥子酸、4-羟基香豆素、槲皮素。
选取了60%乙醇提取条件下的花盘溶液进行超效液相色谱液相分析(图1)。分别以14种标品不同梯度浓度混合进样,建立了酚类物质的标准曲线,测得11种酚类物质的含量如表6,阿魏酸、芥子酸和4-羟基香豆素在样品中未被测出。从图1B中可以看出菊芋花盘中主要的酚类物质是槲皮素,峰面积远远高于其他种类的酚类物质,如表6槲皮素含量为2507.16 μg/g,而鉴定出来的另外10种酚类物质含量都很低,说明槲皮素在菊芋花盘中可能是富集的。
3 结论
选取了甲醇、乙醇和丙酮3种常见的有机溶剂对菊芋花盘中的总酚和总黄酮进行提取并对提取效果进行分析,结果表明:60%乙醇提取到的总酚含量最高,达到5.54 mg GAE/g DW;使用70%的丙酮提取得到的总黄酮含量最高,达到2.95 mg QE/g DW,不过考虑到丙酮的毒性,最好选择40%的乙醇提取总黄酮。为了探究菊芋花盘提取物的体外抗氧化活性,选择了FRAP、DPPH、ABTS三种方法进行抗氧化活性研究,结果表明:使用70%丙酮提取时,FRAP抗氧化活性最强,达到3.88 mg TE/g DW;使用60%乙醇,此时DPPH自由基清除能力最强,清除率达到42.65%;使用60%的丙酮得到的提取物ABTS抗氧化活性最强,达到91.26%。使用超效液相色谱技术测定出槲皮素是菊芋花盘的主要酚类物质,含量为2507.16 μg/g,几乎占到总酚含量的一半。整体来看,菊芋花盘中酚和黄酮含量比较高,抗氧化活性较强,可以作为天然的抗氧化物质,而槲皮素作为花盘中最主要的酚类物质可以进一步开发利用。
[1]Yang L X,He Q S,Corscadden K,et al.The prospects of Jerusalem artichoke in functional food ingredients and bioenergy production[J].Biotechnology Reports,2015,5:77-88.
[2]Monti A,Amaducci M T,Venturi G.Growth response,leaf gas exchange and fructans accumulation of Jerusalem artichoke(Helianthus tuberosusL.)as affected by different water regimes[J].European Journal of Agronomy,2005,23(2):136-145.
[3]Tassoni A,Bagni N,Ferri M,et al.Helianthus tuberosus and polyamine research:past and recent applications of a classical growth model[J].Plant Physiolgy and Biochemistry,2010,48(7):496-505.
[4]Slimestad R,Seljaasen R,Meijer K,et al.Norwegian-grown Jerusalem artichoke(HelianthustuberosusL.):morphology and content of sugars and fructo-oligosaccharides in stems and tubers[J].Journal of the Science of Food and Agriculture,2010,90(6):956-964.
[5]Kosaric N,Cosentino G P,Wieczorec A,et al.The Jerusalem artichoke as an agricultural crop[J].Biomass,1984,5(1):1-36.
[6]周东,隋丹,于涛,等.盐碱土壤对菊芋菊糖含量的影响[J].中国调味品,2014,39(3):5-9.
[7]Viuda-Martos M,López-Marcos M C,Fernández-López J,et al.Role of fibre in cardiovascular diseases:A review[J]. Comprehensive Reviews in Food Science and Food Safety,2010,9(2):240-258.
[8]Zhang W,Li C,You L J,et al.Structural identification of compounds from Toona sinensis leaves with antioxidant and anticancer activities[J].Journal of Functional Foods,2014,10:427-435.
[9]Benavente-García O,Castillo J,Lorente J,et al.Antioxidant activity of phenolics extracted from Olea europaeaL.leaves[J].Food Chemistry,2000,68(4):457-462.
[10]Matés J M,Sánchez-Jiménez F M.Role of reactive oxygen species in apoptosis:Implications for cancer therapy[J].
International Journal of Biochemistry and Cell Biology,2000,32(2):157-170.
[11]刘海伟,刘兆普,刘玲,等.菊芋叶片提取物抑菌活性与化学成分的研究[J].天然产物研究与开发.2007,3:405-409.
[12]郑晓涛,隆小华,刘玲,等.菊芋叶总黄酮提取工艺优化及含量动态变化[J].天然产物研究与开发,2012,11:1642-1645.
[13]Slinkard K,Singleton V L.Total phenol analysis:automation and comparison with manual methods[J].American Journal Enology and Viticulture,1977,28(1):49-55.
[14]杨明俊,王亮,吴婧,等.菊芋叶黄酮类化合物的体外抗氧化活性研究[J].贵州农业科学,2011,39(4):52-54.
[15]Benzie I F F,Strain J J.The ferric reducing ability of plasma as a measure of“antioxidant power”the FRAP assay[J]. Analytical Biochemistry,1996,239(1):70-76.
[16]Brand-Williams W,Cuvelier M E,Berset C.Use of a free radical method to evaluate antioxidant activity[J].LWT-Food Science and Technology,1995,28(1):25-30.
[17]Roberta R,Nicoletta P,Anna P,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Radical Biology and Medicine,1999,26(9):1231-1237.
[18]Du Y G,Yuan X Y,Gao M Z,et al.Free radical scavenging activities and bioactive substances of Jerusalem
artichoke(Helianthus tuberosusL.)leaves[J].Food chemistry,2012,133(1):10-14.
[19]Amarowicz R,Karamac′ M,Weidner S,et al.Antioxidant activity of wheat caryopses and embryos extracts[J].Journal of Food Lipids,2002,9(3):201-210.
[20]Rathee J S,Hassarajani S A,Chattopadhyay S.Antioxidant activity of Nyctanthes arbor-tristis leaf extract[J].Food Chemistry,2007,103(4):1350-1357.
[21]Wettasinghe M,Shahidi F.Antioxidant and free radical-scavenging properties of ethanolic extracts of defatted borage(BoragoofficinalisL.)seeds[J].Food Chemistry,1999,67(4):399-414.
Study on the phenolic extraction andinvitroantioxidant activity of Jerusalem artichoke disk
WANG Hai-tao,YU Tao*
(Alkali Soil Natural Environmental Science Center,Northeast Forestry University;Key Laboratory of Saline-alkali Vegetation Ecology Restoration in Oil Field,Ministry of Education,Harbin 150040,China)
Objective:To study the effect of different extraction agents of Jerusalem artichoke(Helianthustuberosus)disk in secondary metabolism substance content andinvitroantioxidant activity.Methods:Using the disk powder of Jerusalem artichoke as raw material,the different volume fraction of ethanol,methanol,acetone and other organic solvents were used to extract the samples,the total phenolic and flavonoids content was determined,and three different types of radical scavenging capacities including the FRAP,DPPH and ABTS were chosen to determine theinvitroantioxidant activity of the samples.By ultra performance liquid chromatography(UPLC)method,the main phenolics of disk were studied.Results:The highest phenolic content was measured in 60% ethanol extraction.The highest content of total flavonoids was measured in 70% acetone extraction.The Jerusalem artichoke disk showed a stronginvitroantioxidant activity by all three methods and liquid phase analysis results,which showed that the quercerin was the main phenolic in Jerusalem artichoke disk.Conclusion:The different extract had great effect on the secondary metabolics content of Jerusalem artichoke disk and the antioxidant activity of disk was strong.
Jerusalem artichoke;disk;total phenolics;total flavonoids;antioxidant activity;quercetin
2015-11-02
王海涛(1990-),男,硕士,研究方向:植物次生代谢和生物活性物质利用,E-mail:949977257@qq.com。
于涛(1969-),男,学士,工程师,研究方向:植物次生代谢和生物活性物质利用,E-mail:aisingioro@dlou.edu.cn。
国家自然科学基金项目(31470647)。
TS201.2
A
1002-0306(2016)09-0101-05
10.13386/j.issn1002-0306.2016.09.012

