灯盏乙素对LPS诱导的RAW264.7细胞炎症介质分泌的影响*
魏 静,陈景瑞,苗 琳,王亚东,樊官伟
(天津中医药大学,天津市现代中药重点实验室,天津 300193)
·中药研究·
灯盏乙素对LPS诱导的RAW264.7细胞炎症介质分泌的影响*
魏静,陈景瑞,苗琳,王亚东,樊官伟
(天津中医药大学,天津市现代中药重点实验室,天津300193)
[目的]研究灯盏乙素对脂多糖(LPS)诱导的RAW264.7细胞炎症的影响,初步探讨其抗炎作用机制。[方法]用噻唑蓝(MTT)法检测灯盏乙素对RAW264.7细胞活力的影响;用Griess法检测灯盏乙素对LPS诱导的RAW264.7细胞中一氧化氮(NO)生成的影响;用荧光素酶报告质粒法检测灯盏乙素对LPS诱导的核转录因子(NF-κB)转录活性的影响;用实时定量聚合酶链反应(PCR)法检测灯盏乙素对LPS诱导的RAW264.7细胞中NF-κB靶基因肿瘤坏死因子-α(TNF-α)、白介素-1β(IL-1β)、白介素-6(IL-6)mRNA表达的影响。[结果]0.01~10 μmol/L的灯盏乙素处理24 h后对RAW264.7活力无显著影响;1、10 μmol/L的灯盏乙素可以显著抑制LPS诱导的NO的生成及NF-κB转录活性;灯盏乙素可以不同程度的抑制LPS诱导的RAW264.7细胞NF-κB靶基因TNF-α、IL-1β、IL-6 mRNA的上调作用。[结论]灯盏乙素可能通过抑制NF-κB的活化及炎症因子的表达发挥一定的抗炎作用。
灯盏乙素;炎症;RAW264.7细胞;作用机制
炎症是人体为了确保去除有害刺激并修复受损组织的一种防御反应,据流行病学和临床资料显示,多数疾病的发生发展过程中都伴有炎症的发生,此外炎症反应还可引起一些自身免疫疾病或癌症,并加速疾病的发展[1],因此,研究开发具有抗炎作用的药物意义重大。临床证实,中国传统中药中具有抗炎作用的药物众多[2-3],明确抗炎有效成分及探索抗炎作用机制成为学者们关注的焦点。桑白皮是桑科桑属植物干燥的根皮,具有平喘利尿、降糖降压、镇痛抗炎等功效,临床用于肺热咳喘,小便不利等症的治疗[4]。近年来关于桑白皮抗炎的报道日益增加,但其抗炎有效成分及机制还尚不明确。笔者以抑制脂多糖(LPS)诱导的RAW264.7细胞的核转录因子(NF-κB)转录活性为指标,筛选桑白皮中有效单体成分时发现灯盏乙素显示出较强的抗炎作用,并进一步对其发挥抗炎作用可能的机制进行了探讨。
1 材料与方法
1.1材料RAW264.7细胞(小鼠腹腔单核巨噬细胞)购自北京协和细胞资源中心;pGL4.32及pTk-Renila质粒均由南开大学药学院馈赠;LPS;热灭活胎牛血清(HI-FBS)美国BI公司;NO(Nitric Oxide)检测试剂盒及噻唑蓝(MTT)试剂为上海碧云天生物技术有限公司产品;Lipofectamine®2000转染试剂及 Trizol为美国 Invitrogen公司产品;Dual-Luciferase报告基因检测系美国 Promega公司;cDNA合成试剂盒(TaqMan Reverse Transcription Rengents)及聚合酶链反应(PCR)扩增试剂盒(SYBR GREEN PCR Master Mix)为Roche公司产品;无内毒素质粒大量快速提取试剂盒为北京天根生物技术服务有限责任公司产品;胎牛血清、DMEM培养液、胰酶为Hyclone公司产品。
1.2细胞培养RAW264.7细胞培养于含10%热灭活胎牛血清的DMEM培养液中。待细胞处于对数生长期或接近铺满整个培养瓶底面后用细胞刮轻轻将细胞刮下,反复吹吸,形成单细胞悬液。细胞计数后,接种于新的培养瓶内,5%二氧化碳(CO2)、37℃的条件下培养,依细胞状态以1∶3或1∶6进行传代。
1.3MTT实验将RAW264.7细胞以1×104个每孔接种于96孔板,24 h后加入不同浓度的灯盏乙素(0.01、0.1、1、10 μmol/L)。待加药处理72 h后,取出培养板,小心吸弃培养液,每孔加入100 μL 5 mg/mL MTT试剂,37℃孵育4 h,小心吸弃上清液,每孔加入100 μL DMSO。振荡器上振荡15 min,于490 nm处检测OD值。
1.4一氧化氮(NO)生成量检测将RAW264.7细胞以2×105个每孔接种于24孔板,24 h后加入不同浓度的灯盏乙素(0.1、1、10 μmol/L)孵育2 h后加入1 mg/L的LPS孵育24 h,收集上清液离心后取上清液,按照试剂盒说明分别加入Griess ReagentⅠ和Ⅱ,于540 nm测定吸光度值。用标准品溶液的吸光度值与溶度做标准曲线,得到回归方程,计算得到各待测样品中NO的浓度。
1.5 细胞总RNA的提取和实时定量PCRRAW264.7细胞以2×106个每孔接种于6孔板。使用Trizol裂解法提取细胞总RNA,采用反转录试剂盒将2 μg RNA反转为cDNA第Ⅰ链,采用SYBR-Green染料掺入法进行实时定量PCR,GAPDH为管家基因。引物序列见表1。
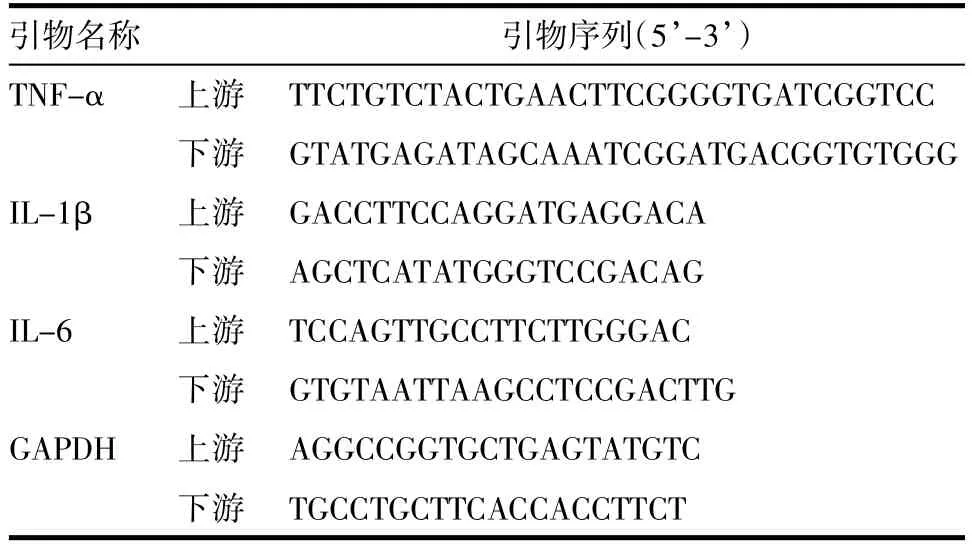
表1 基因引物序列Tab.1 Gene primer sequences
反应条件为:95℃10 min,95℃15 s,60℃1 min,40 cycles。
1.6转染及荧光素酶活性检测RAW264.7细胞以含10%热灭活胎牛血清的DMEM培养液接种于96孔板,使得转染前细胞密度为75%~90%按照Lipofectamine®2000转染试剂说明转染pGL4.32及pTk-Renila质粒。8 h后吸去上清液,加入含有不同浓度受试药物孵育2 h,加入1 mg/L的LPS,同时设置空白对照组,刺激24 h后进行荧光素酶活性检测。
1.7统计学方法实验数据用SPSS 17.0软件包进行统计学处理。实验结果以均值±标准差(±s)进行表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较若为方差不齐采用LSD法,若方差不齐采用Dunnett's T3法。P<0.05为差异有统计学意义。
2 结果
2.1细胞活性检测本实验采用MTT法检测了灯盏乙素对RAW264.7细胞活力的影响。结果显示0.01~10 μmol/L的灯盏乙素对RAW264.7细胞处理24 h后活力无显著影响(见表2),后续研究选取0.1~10 μmol/L的灯盏乙素进行实验。
表2 灯盏乙素对RAW264.7细胞活力的影响(±s)Tab.2 Effects of scutellarin on viability of RAW264.7 cells (±s)

表2 灯盏乙素对RAW264.7细胞活力的影响(±s)Tab.2 Effects of scutellarin on viability of RAW264.7 cells (±s)
组别 细胞活力(%)对照组 100.00±5.17灯盏乙素组 97.51±4.58 97.81±3.83 103.25±7.16 100.76±6.37 n6 6浓度(μmol/L)-0.01 0.1 1 10
2.2灯盏乙素抑制LPS诱导的RAW264.7细胞NO的生成NO是近年来发现的一个重要的调节物质,具有重要的生物学意义,NO可参与多种炎症信号传导,与多种炎症因子相互作用,在炎症反应的发生和信号传导方面起着重要的作用。结果显示,1、10 μmol/L的灯盏乙素可以显著抑制由LPS诱导的RAW264.7细胞NO生成(见表3),提示灯盏乙素具有较强的抗炎作用。
表3 灯盏乙素对LPS诱导的RAW264.7细胞NO生成的影响(±s)Tab.3 Effects of scutellarin on LPS-induced NO production in RAW264.7 cells(±s)

表3 灯盏乙素对LPS诱导的RAW264.7细胞NO生成的影响(±s)Tab.3 Effects of scutellarin on LPS-induced NO production in RAW264.7 cells(±s)
注:与对照组比较,*P<0.01;与LPS组比,#P<0.01。
组别对照组LPS组灯盏乙素组n6 6 6浓度 NO生成量(μmol/L)-4.92±0.27 1 μg/mL 22.37±0.81* 0.1 μmol/L 22.24±0.62 1 μmol/L 20.92±0.66#10 μmol/L 15.19±0.39#
2.3灯盏乙素抑制由LPS诱导的RAW264.7细胞的NF-κB靶基因mRNA的表达采用1 mg/L的LPS刺激 RAW264.7,24 h后肿瘤坏死因子-α (TNF-α)、白介素-1β(IL-1β)、白介素-6(IL-6)的mRNA表达显著上调(P<0.01)。给予不同浓度灯盏乙素处理细胞24 h后,可不同程度抑制炎症因子mRNA表达上调作用。其中,0.1~10 μmol/L的灯盏乙素均可显著抑制TNF-α及IL-6 mRNA的表达上调作用,仅10 μmol/L的灯盏乙素可显著抑制IL-1β mRNA的表达(见表4)。
2.4灯盏乙素抑制LPS诱导的RAW264.7细胞的NF-κB的转录活性将载有NF-κB的重组报告基因质粒与内参质粒pTk-Renila共转染RAW264.7细胞8 h后,不同受试药预处理2 h后给予1 mg/L 的LPS刺激24 h。只经LPS处理组的NF-κB转录活性显著上调(P<0.01)。而1、10 μmol/L的灯盏乙素可显著抑制由LPS诱导的NF-κB转录活性的上调作用(见表5)。
表4 灯盏乙素LPS诱导的RAW264.7细胞TNF-α,IL-1β,IL-6 mRNA表达的影响(±s)Tab.4 Effects of scutellarin on LPS-induced TNF-α,IL-1β,IL-6 mRNA expression in RAW264.7 cells (±s)
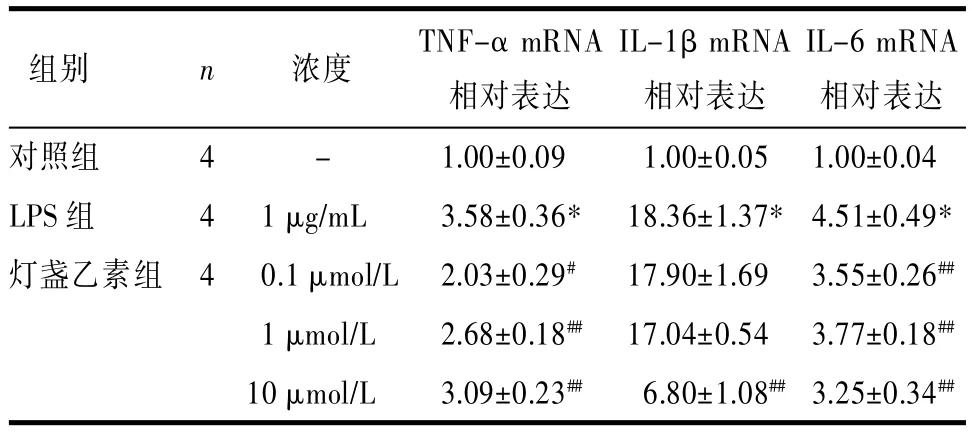
表4 灯盏乙素LPS诱导的RAW264.7细胞TNF-α,IL-1β,IL-6 mRNA表达的影响(±s)Tab.4 Effects of scutellarin on LPS-induced TNF-α,IL-1β,IL-6 mRNA expression in RAW264.7 cells (±s)
注:与对照组比较,*P<0.01;与LPS组比,#P<0.05,##P<0.01。
组别IL-1β mRNA相对表达对照组LPS组灯盏乙素组n 4 4 4 IL-6 mRNA相对表达- 1.00±0.09 1.00±0.05 1.00±0.04 1 μg/mL 3.58±0.36* 18.36±1.37* 4.51±0.49* 0.1 μmol/L 2.03±0.29# 17.90±1.69 3.55±0.26##1 μmol/L 2.68±0.18## 17.04±0.54 3.77±0.18##10 μmol/L 3.09±0.23## 6.80±1.08##3.25±0.34##浓度 TNF-α mRNA相对表达
表5 灯盏乙素对LPS诱导的RAW264.7细胞NF-κB转录活性的影响(±s)Tab.5 Effects of scutellarin on LPS-induced NF-κB activity in RAW264.7 cells(±s)
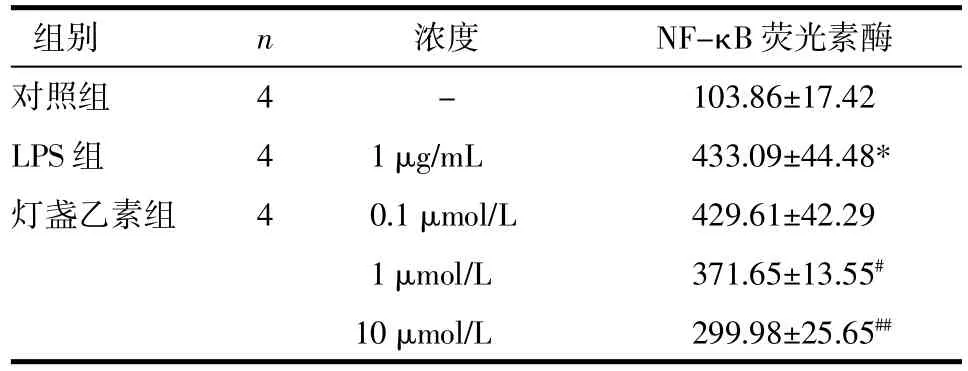
表5 灯盏乙素对LPS诱导的RAW264.7细胞NF-κB转录活性的影响(±s)Tab.5 Effects of scutellarin on LPS-induced NF-κB activity in RAW264.7 cells(±s)
注:与对照组比较,*P<0.01;与LPS组比,#P<0.05,##P<0.01。
组别对照组LPS组灯盏乙素组n4 4 4浓度 NF-κB荧光素酶-103.86±17.42 1 μg/mL 433.09±44.48* 0.1 μmol/L 429.61±42.29 1 μmol/L 371.65±13.55#10 μmol/L 299.98±25.65##
3 讨论
桑白皮含有多种化学成分,因而具有多种药效作用。本实验所采用的灯盏乙素由桑白皮中提取分离而得。先前的研究显示灯盏乙素具有增加脑血流量、改善脑部血液循环、提高机体耐氧能力、促进纤溶活性及良好的溶栓功效,抗肝脏及肺的纤维化等多种药理作用。临床上多用于急性脑梗死,缺血性脑卒中和冠心病等心脑血管疾病的治疗[5-6]。近年来的研究显示灯盏乙素可通过抑制脑内炎症反应发挥脑保护作用。该保护作用可能是灯盏乙素通过抑制小胶质细胞中TLR4(TLR4)、p65、TNF-α、IL-1β、IL-18、Bax的表达而实现的[7]。炎症是机体抵御外界伤害和组织损伤的一种非常复杂的病理过程,大量的研究均表明炎症与许多疾病的发生发展都密切相关,对急性炎症和慢性炎症加以抑制,将有效减缓疾病的发展。巨噬细胞具有强大的吞噬清除凋亡细胞的能力。LPS为革兰阴性细菌细胞壁的主要成分,因与机体一系列病、生理过程如促进炎症因子转录和表达等相关,被认为是造成全身性炎症的重要原因[8-9]。RAW264.7可在LPS的刺激下分泌TNF-α,IL-1β,IL-6,NO,前列腺素E2(PGE2)等不同的促炎症因子对炎症进行调节[1],它是目前有关炎症介质研究中应用最广,最为高效的模型[10]。
在炎症反应中NO被认为是一种重要的介质和调节因子[11-12],在活化的炎症细胞中NO可由一氧化氮合酶催化L-精氨酸产生。NO在体内易被氧化成亚硝酸盐,酸性条件下与重氮盐磺胺发生化学反应。本实验应用Griess法检测细胞上清液中亚硝酸盐含量从而表征NO的生成量。NO可通过抑制黏附因子表达,抑制中性粒细胞和内皮细胞的黏附及抑制肥大细胞脱颗粒等发挥抗炎作用。本实验发现灯盏乙素体外毒性小,1、10 μmol/L的灯盏乙素可显著抑制LPS诱导的NO生成。
现代研究发现,TNF-α、IL-6、IL-1β作为炎症敏感指标,可有效反应炎症的严重程度。TNF-α作为重要的促炎因子,可激活炎症细胞,上调黏附因子,氧自由基和NO,还可作用于内皮细胞增加毛细血管通透性。IL-6可有激活的巨噬细胞产生,可直接激活炎症细胞,诱导急性期蛋白的合成[13]。IL-6可促进丝裂原活化蛋白激酶(MAPK)活化,激活信号转导子和转录激活子从而加重炎症反应[14]。然而,当上述促炎症因子分泌过多时,可在LPS诱导的炎症反应中激发一系列的级联反应,诱导其他多种炎症因子的表达[15]。因此,抑制促炎因子的生成,可有效降低炎症反应。在本研究中发现,灯盏乙素可有效降低由LPS诱导的RAW264.7 TNF-α,IL-1β,IL-6 mRNA的表达。大量研究表明NF-κB信号转导通路是炎症反应信号通路中最重要的下游通路,LPS作用于TLR4后导致其活化,激活一系列的激酶引起NF-κB的磷酸化,活化后的NF-κB进入细胞核,启动下游靶基因的转录[16]。TNF-α,IL-1β,IL-6作为NF-κB的下游靶基因,灯盏乙素对其抑制作用可能是通过抑制NF-κB活化而实现的。本实验采用双荧光素酶报告基因法证实LPS可增加RAW264.7的NF-κB转录活性,而灯盏乙素可显著抑制该种上调作用。提示灯盏乙素可能通过抑制NF-κB的活化入核发挥抗炎作用。灯盏乙素是否会通过其他途径发挥抗炎作用还有待于进一步实验研究。
[1]Lin WW,Karin M.A cytokine-mediated link between innate immunity,inflammation,and cancer[J].J Clin Invest,2007,117(5):1175-1183.
[2]郑璐璐,张贵君,王晶娟,等.野菊花药效组分抗炎的生物效应研究[J].天津中医药,2011,8(3):251-253.
[3]张智圆,张贵君,王晶娟,等.响应面法优化零陵香水溶性多糖组分提取工艺及其抗炎作用的研究[J].天津中医药,2013,30(4):235-238.
[4]景王慧,吴文进,燕茹,等.归肺经中药桑白皮的化学药理与药代动力学研究进展[J].世界中医药,2014,9(1):109-116.
[5]Yun Yuan,Hao Zha,Parakalan Rangarajan,et al.Anti-inflammatory effects of Edaravone and Scutellarin in activated microglia in experimentally induced ischemia injury in rats and in BV-2 microglia[J]. BMC Neuroscience,2014,15:125.
[6]赵杰,杨仁华,罗文羲,等.灯盏乙素体外抗氧化活性的实验研究[J].昆明医科大学学报,2015,36(5):1-4.
[7]Xingyong Chen,Xiaogeng Shi,Xu Zhang,et al.Scutellarin attenuates hypertension-induced expression of brain toll-like receptor 4/nuclear factor kappa B[J].Mediators Inflamm,2013,432,623.
[8]王璇,杜蕊,韩悦,等.脂多糖的研究进展[J].黑龙江医药,2011,24(5):775-776.
[9]Liu DZ,Liang HJ,Chen CH,et al.Comparative anti-inflammatory characterization of wild fruiting body,liquid-state fermentation,and solid-stateculture of Taiwanofungus camphoratus in microglia and the mechanism of its action[J].J Ethnopharmacol,2007,15,113(1):45-53.
[10]Mano R,Maurya,Shakti Gupta,et al.Analysis of inflammatory and lipid metabolic networks across RAW264.7 and thioglycolateelicited macrophages[J].J Lipid Res,2013,54(9):2525-2542.
[11]范精华,刘康,刘保林.NO在炎症及免疫应答中的调节作用[J].中外医疗,2009,25:163-166.
[12]Korhonen R,Lahti A,Kankaanranta H,et al.Nitric oxide production and signaling in inflammation[J].Curr Drug Targets Inflamm Allergy,2005,4(4):471-479.
[13]乐海浪,罗国强.创伤后早期炎症因子TNF-α、IL-1、IL-6的研究进展[J].现代诊断与治疗,2014,25(4):763-765.
[14]Hodge D R,Hurt E M,Farrar WL.The role of IL-6 and STAT3 in inflammation and cancer[J].Eur J Cancer,2005,41(16):2502-2512.
[15]Lawrence T,Willoughby DA,Gilroy DW.Anti-inflammatory lipid mediatorsandinsightsintotheresolutionofinflammation[J].Nat.Rev. Immunol,2002,2(10):787-95.
[16]Zhang H,Sun SC.NF-κB in inflammation and renal diseases[J]. Cell Biosci,2015,16(5):63.
(本文编辑:高杉,马英)
Effect of scutellarin on the secretion of inflammatory mediators of RAW264.7 cell induced by LPS
WEI Jing,CHEN Jing-rui,MIAO Lin,WANG Ya-dong,FAN Guan-wei
(Tianjin Modern Chinese Medicine Key Laboratory,Tianjin University of Traditional Chinese Medicine,Tianjin 300193,China)
[Objective]To study the effect of scutellarin on RAW264.7 cell inflammation induced by LPS,and to explore the mechanism of its anti-inflammatory effect.[Methods]To detect effect of scutellarin on RAW264.7 cell viability by MTT,detect effect of scutellarin on NF-κB transcription activity induced by LPS,detect scutellarin on TNF-α,IL-1β,IL-6 mRNA expression of NF-κB target gene in RAW264.7 cell induced by LPS.[Results]It had no obvious significance on RAW264.7 by 0.01~10 μmol/L scutellarin treatment for 24 h;1,10 μmol/L scutellarin could significantly inhibit NO generation and NF-κB transcription activity induced by LPS;scutellarin could inhibit up-regulation of TNF-α,IL-1β,IL-6 mRNA of NF-κB target gene in RAW264.7 cell induced by LPS.[Conclusion]Scutellarin has certain anti-inflammatory effect by inhibition NF-κB activation and inflammatory factor expression.
scutellarin;inflammation;RAW264.7 cell;mechanism
R285.5
A
1672-1519(2016)08-0487-04
10.11656/j.issn.1672-1519.2016.08.11
2016-04-26)
国家科技支撑计划课题(2014BAI05B01)。
魏静(1989-),女,硕士研究生,从事中药药理研究。
樊官伟,E-mail:fgw1005@hotmail.com。

