电针对特应性皮炎瘙痒模型小鼠的止痒作用及对强啡肽、P物质的影响
蒋 丽 谢长才 黄键澎 符文彬
(广州中医药大学第二临床医学院,广东 广州 510120)
电针对特应性皮炎瘙痒模型小鼠的止痒作用及对强啡肽、P物质的影响
蒋丽谢长才黄键澎符文彬
(广州中医药大学第二临床医学院,广东广州510120)
目的观察电针不同穴位对特应性皮炎(AD)瘙痒模型小鼠搔抓行为、脊髓强啡肽(DYN)及血清P物质(SP)的影响。方法将32只雌性BALB/c小鼠分为空白组、模型组、内关组和曲池组,每组8只。除空白组外,其余各组均以2,4-二硝基氯苯(DNCB)诱导建立AD动物模型,共刺激7次。内关组和曲池组在实验第5天开始分别给予电针内关、曲池穴治疗。空白组和模型组不给予任何治疗。观察小鼠搔抓次数、腹部皮损改变,运用Western印迹法检测脊髓DYN含量,ELISA法检测血清中SP水平变化。结果与空白组比较,模型组小鼠搔抓次数显著升高,腹部皮肤产生AD样湿疹皮损改变,脊髓内DYN及血清SP水平明显升高(P<0.05,P<0.01)。与模型组比较,内关组和曲池组小鼠的搔抓次数显著降低,腹部皮损炎症略有减轻,脊髓DYN含量明显升高(均P<0.05)、血清SP水平显著降低(P<0.05);内关组和曲池组间比较,各指标均未见统计学差异(P>0.05)。结论电针对DNCB诱发的AD样瘙痒模型小鼠的止痒作用可能是通过提高脊髓中DYN的含量、抑制SP水平而介导的。
电针;特应性皮炎;强啡肽;P物质
瘙痒是多种皮肤病和系统性疾病最常见的自觉症状〔1,2〕。特应性皮炎(AD)即是一种以持续性瘙痒为主要症状的遗传性慢性炎症性皮肤病〔3,4〕。由于持续剧烈的瘙痒,多数患者因不能忍受而剧烈的抓挠皮肤病患处,从而使瘙痒症和抓挠形成反复恶性的转归模式,造成该病迁延难愈,对患者身心健康及生活质量造成很大影响〔5〕。然而,引起AD皮肤瘙痒的发病机制至今尚不完全清楚,导致临床治疗过程中缺少理想的止痒药物〔5~7〕。近年来,针灸止痒具有显著疗效已得到众多临床研究的证实,穴位是针灸取效的关键〔8~12〕。但是研究多倾向于临床,有关针灸抗瘙痒作用机制的研究相对缺乏。本研究初步探讨电针对2,4-二硝基氯苯(DNCB)诱发的AD样瘙痒的止痒疗效及其可能的神经生物学机制。
1 材料与方法
1.1实验动物及分组方法6~8周龄的健康SPF级BALB/c小鼠32只,雌性,体重20~25 g,广东省医学实验动物中心提供,合格证号SCXK(粤)2013-0002,给予3 d适应性喂养。实验室温度(24±2)℃,相对湿度55%~65%。昼夜时间控制在各12 h。将32只小鼠按体重随机分为空白组、模型组、电针内关穴组(内关组)和电针曲池穴组(曲池组),每组8只。
1.2药物与试剂DNCB(Sigma 公司)、P物质(SP)试剂盒(USCNK公司)、BCA蛋白定量试剂盒(北京康为世纪生物科技有限公司)、磷酸甘油醛脱氨酶(GAPDH,广州速聚生物有限公司)。将DNCB 溶解于丙酮/橄榄油(1∶4)基质溶液中,分别配制成浓度1%和2%的DNCB致敏溶液。
1.3主要仪器低速离心机(中佳SC3614),低温冷冻离心机(黑马Min1612r),匀浆机(Bertin Precellys 24),台式高速离心机(湖南湘仪实验室仪器开发,TG16-W),电泳仪(上海天能科技有限公司,EPS-300),X射线摄影暗匣(广东粤华医疗器械有限公司,AX-Ⅱ),紫外线分光光度仪(Thermo Nanodrop 2000C),酶标仪(thermo multiskanMK3)、显微镜(Leica DMI6000B)。华佗牌电子针疗仪(型号:SDZ-Ⅴ型,苏州医疗用品厂出产)、华佗牌一次性针灸针(0.25 mm×13 mm,苏州医疗用品厂出产)。
1.4AD模型的建立除空白组外,其余3组均需造模。AD小鼠模型的建立参考文献〔13~15〕方法并略有改进:实验前2 d剃去小鼠腹部体毛,面积约2.5 cm×2.5 cm。实验第1天用2% DNCB丙酮溶液100 μl涂于腹部剃毛处和耳部,实验第2~4天不作处理,第5天改用1%DNCB 丙酮溶液100 μl涂搽小鼠的腹部剃毛处和耳部,以后每隔2 d刺激1次,持续21 d,共进行7次刺激。空白组小鼠腹部脱毛区及耳部仅涂搽丙酮/橄榄油基质溶液,涂搽时间及涂搽剂量与模型组一致。
1.5治疗方法内关组和曲池组在造模期第5天开始接受电针治疗。若治疗当日有造模刺激,则电针治疗应在DNCB刺激前不少于2 h进行。内关组取内关穴(双侧),曲池组取曲池穴(双侧)。穴位定位参照《实验针灸学》常用实验动物针灸穴位定位方法〔16〕,并根据大鼠形态、解剖、生理特点而定。内关位于前肢内侧尺桡骨缝间,离腕关节约3 mm;曲池位于小鼠桡骨近端关节外侧前方凹陷处。针刺时,在内关穴区刺入两根针灸针,刺入深度1~2 mm,两针间隔约2~3 mm,防止两针相触,以免短路;胶布固定后与电针治疗仪相连接,同一对正负极连接同穴区两针柄;针刺曲池穴方法同内关穴。电针采用输出电流强度1~2 mA(先1 mA,然后逐渐加大到2 mA,以引起大鼠肢体轻微抖动为度),疏密波,频率2/100 Hz,交替,留针20 min。隔天治疗1次,共治疗9次。空白组及模型组以同样方法抓取大鼠,但不做电针处理。
1.6检测指标
1.6.1小鼠搔抓次数记录将各组小鼠单笼放置,采用视频摄像机记录并计数10 min内小鼠的搔抓次数。以后肢连续搔抓耳部及腹部视为1次搔抓活动,当后爪落地或被舔舐时代表本次搔抓结束。前肢的活动以及后爪对面、背部等处的搔抓则不作统计。分别于实验第1天(DNCB第1次刺激后1 h内)、实验第5天(第1次电针治疗前)以及实验第21天(末次电针针治疗后)各观察1次,共观察3次。
1.6.2观察小鼠皮损改变及体重变化肉眼观察各组小鼠皮损表现情况并拍照记录。于实验开始前及实验结束时分别检测各组小鼠体重。
1.6.3血清SP水平末次电针后24 h内,各组小鼠(n=5)均眼球取血,室温放置2 h后1 000 r/min离心20 min。取血清于-80℃保存,血清各指标检测均按照ELISA试剂盒说明书操作。用酶标仪测定OD450 nm值,根据标准曲线计算出相应的样本浓度值,单位为pg/ml。
1.6.4脊髓强啡肽(DYN)Western印迹检测各组小鼠经麻醉取血后,经心脏灌流PBS冲净血液,快速暴露脊髓,小心取出脊髓组织置于含有蛋白酶抑制剂的RIPA裂解液中。匀浆后冰上裂解20 min,4℃离心,13 000 r/min,5 min。取上清,用二喹啉甲酸(BCA)法进行蛋白浓度定量检测。取20 μg 蛋白样品加入上样缓冲液,浓度为1 mg/ml,进行聚丙烯酰胺凝胶(SDS-PAGE)电泳,转膜后将偏聚二氟乙烯(PVDF)膜置于封闭液中室温封闭60 min,然后孵育于一抗(Rabbit Anti-Big dynorphin,博奥森生物技术有限公司,北京),4℃ 过夜。在室温孵育30 min后,PVDF 膜在洗膜缓冲液(TBST)中漂洗3次,每次10 min。孵育于辣根过氧化物酶(HRP)标记的二抗(康为世纪生物科技有限公司,北京),室温孵育1 h。PVDF 膜在TBST 中漂洗5次,每次3 min,然后采用化学发光法观察目的条带,以GAPDH作为对照进行图像灰度分析。
2 结 果
2.1不同组别小鼠搔抓次数比较见表1。各组小鼠搔抓次数组间重复性测量方差分析显示有显著性差异(F=42.403,P<0.01);进一步组间两两比较,实验第5天,与空白组比较,所有参与刺激造模的小鼠搔抓次数均显著升高(均P<0.01);模型组与内关组、曲池组三组之间比较均无统计学差异(P>0.05)。实验第21天,各组小鼠搔抓次数仍均显著高于空白组,但内关穴组和曲池穴组小鼠搔抓次数均明显低于模型组(P<0.05,P<0.01);内关组与曲池组间比较无统计学差异(P>0.05)。
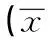
表1 四组小鼠各观察时点搔抓次数和体重的比较±s,n=8)
与空白组比较:1)P<0.01;与模型组比较:2)P<0.05,3)P<0.01
2.2不同组别小鼠体重比较在实验第1天与实验结束时,各组小鼠的体重均无统计学差异(P>0.05);各组小鼠体重增长的差值组间比较也无统计学差异(P>0.05)。见表1。
2.3各组小鼠腹部皮损表现实验第21天时,空白组小鼠腹部皮肤基本无变化,仅有轻微潮红和水肿,未见皮疹、渗出及结痂。模型组小鼠腹部皮肤出现明显红斑、水肿、渗出,部分糜烂面逐渐结痂,可见黄色厚薄不一的痂皮,同时可见局部干燥、脱屑及表皮增厚等AD样皮损改变。内关组和曲池组小鼠腹部皮损表现与模型组相似,均有红斑、水肿、皮疹等表现,但渗出、糜烂结痂及表皮增厚等症状均略轻于模型组。
2.4血清SP水平比较SP水平各组间比较差异有统计学意义(F=16.28,P<0.01)。组间两两比较,与空白组〔(627.83±37.29)pg/ml〕相比,其余3组〔模型组(929.83±80.80)pg/ml;内关组(827.62±93.81)pg/ml;曲池组(802.27±50.60)pg/ml〕小鼠血清SP含量均显著增高(均P<0.01)。与模型组比较,内关组与曲池组SP水平显著降低(均P<0.05);内关组与曲池组比较差异无统计学意义(P>0.05)。
2.5脊髓DYN的Western印迹检测结果小鼠脊髓DYN含量各组间比较差异有统计学意义(F=12.367,P<0.01)。组间两两比较显示,与空白组(11.33±17.039)相比,其余三组(模型组:33.33±3.215,内关组:58.67±10.017,曲池组61.00±11.533)小鼠脊髓DYN浓度均明显升高(均P<0.01)。内关组与曲池组脊髓DYN浓度也均高于模型组(均P<0.05);但是内关组与曲池组间比较无统计学差异(P>0.05)。见图1。

图1 Western印迹检测DYN表达
3 讨 论
瘙痒是许多AD患者中常见而棘手的问题,也是影响疾病转归预后的重要因素。目前西医临床中主要是系统或局部应用皮质类固醇、抗组胺药和免疫抑制剂等抑制瘙痒,止痒效果有限,且常因不良反应无法长期应用,治疗间断后瘙痒迅速复发〔2,5,6,17〕。近年来,众多临床报道证实,无论是对于由组胺皮内注射引起的实验性瘙痒,还是对由致敏源刺激诱发的瘙痒(如AD的慢性瘙痒),针灸治疗均显示良好的止痒效果,且更安全无毒副作用〔8~12〕。
有报道指出〔3,13~18〕,运用DNCB反复外搽刺激小鼠皮肤可以诱发出类似AD患者的瘙痒及皮损表现,故该法常被用于建立AD模型或是变态反应性接触性皮炎模型,以考察瘙痒机制或药物的抗炎止痒机制。搔抓次数是反映动物瘙痒程度的主要评价指标。本实验提示电针可以有效抑制DNCB刺激诱发的瘙痒。经电针处理的小鼠皮损症状略轻于模型组,其原因可能与电针抑制了搔抓行为从而减少对皮损的进一步刺激有关。此外,各组小鼠体重增加未显示出明显差异,提示DNCB的反复慢性刺激并不会对小鼠的进食及生长造成很大影响。
DYN是一种内源性阿片肽,为κ-受体激动剂,主要在脊髓内发挥显著的镇痛作用,是针灸发挥镇痛作用的重要阿片肽物质〔19,20〕。疼痛与瘙痒在病理生理学方面有相似之处〔21〕,大量研究发现〔7,22,23〕,阿片肽类物质及其受体不仅参与了痛觉的形成,也参与了痒觉的发生和调控机制。μ-阿片肽受体和κ-阿片肽受体是神经系统内最主要的阿片类物质受体。神经生理学研究证实,μ-受体激活参与痒觉的形成,而κ-受体激活则参与痒觉的抑制〔23〕。在神经系统内,这两个受体及其相应内源性阿片肽物质形成相互制约的平衡关系,若打破这一平衡关系,则会出现痒觉异常。临床上观察到,吗啡是U-受体激动剂,外周或中枢给予吗啡止痛可以引起瘙痒,给予选择性κ-受体激动剂却显示出对抗吗啡相关性瘙痒的作用〔23~26〕。电针镇痛的机制研究显示〔19,20,27〕,电针(2/100 Hz或100~120 Hz)使脊髓DYN大量释放,起到了强有力的镇痛效果,却不会产生类似吗啡镇痛后带来的瘙痒这一不良反应。而应用κ-阿片肽受体阻断剂显著抑制120 Hz电针的止痒效应,说明120 Hz电针的止痒效应是通过激活κ-受体而产生的〔28〕。由此我们推测,脊髓DYN在电针止痒中也扮演了重要的角色。本研究结果显示,除空白组外,经DNCB处理的各组小鼠的脊髓内DYN含量均明显提高,提示内源性止痒活动的开始,外周致痒物质的持续刺激可以促使体内合成和释放更多的DYN来对抗瘙痒,但由于含量少因此对痒觉的抑制效果有限;经电针治疗后小鼠的DYN含量又显著高于模型组,是由于电针的刺激使DYN在脊髓水平的释放进一步增强,加强了脊髓水平痒觉信号初级整合中枢的作用。
SP是广泛分布于中枢、外周神经系统中的一种神经多肽,通过与游离感觉神经末梢神经激肽(NK)受体结合启动痒觉传导过程,参与许多瘙痒性皮肤病的发生〔7〕。SP本身也是一种重要的瘙痒介质。AD患者血清中SP水平明显高于健康对照组,其含量与疾病的严重程度正相关。精神紧张可通过周围神经元导致神经肽逆向释放从而加重AD患者的瘙痒。在高压力状态下AD患者血清中SP水平可显著提高〔29,30〕。在皮肤组织中,研究发现AD 患者的SP 阳性神经纤维数目较正常对照组显著增多〔2〕。这些结果提示,SP与AD 发病有密切的关系。本研究显示经DNCB处理的小鼠血清SP水平显著升高,而电针可以逆转模型小鼠血清中SP升高趋势,降低SP水平,由此推测电针可能是通过促进脊髓内DYN释放,使κ-受体大量激活,一方面减弱了中枢内瘙痒的信号传递,另一方面通过抑制炎性介质SP的释放,减轻对外周痒觉神经的刺激。
穴位是针灸取效的关键因素之一。曲池穴有祛邪透表和驱逐周身风邪的特殊作用,是针灸临床中用于治疗皮肤病的常用穴位。而《素问·至真要大论》云:“诸痛痒疮,皆属于心”,明确提出“痒”与“心”的关系,止痒治疗当从“心”论治。中医理论认为心主神明,内关穴属手厥阴心包经,心包与心在功能上联系密切,常代心受邪。临床上,内关穴主要治疗失眠、心悸、焦虑等神志和心脑疾病。类似于临床上运用抗抑郁焦虑药缓解瘙痒〔2〕,对于皮肤湿疹瘙痒的治疗,内关穴则有安神止痒的功效。然而本实验结果未显示出电针内关穴或曲池穴在止痒疗效上的统计学差异,这一结果的产生是否与两穴属于相邻脊髓神经节段产生相似的抗瘙痒效应有关,还是因样本量不足以显示出两者间的疗效差异还不能明确。此外,两穴在脊髓上中枢的效应有无差异等问题尚需要进一步的深入研究。
1Charlesworth EN,Beltrani VS.Pruritic dermatoses:overview of etiology and therapy〔J〕.Am J Med,2002;113(Suppl 9A):25S-33S.
2丁媛,普雄明.瘙痒的发生机制、相关疾病和治疗〔J〕.中国麻风皮肤病杂志,2006;22(6):492-5.
3王燕,赵京霞,刘欣,等.特应性皮炎动物模型研究进展〔J〕.中国皮肤性病学杂志,2013;27(6):626-8.
4Thomas B.Atopic dermatitis〔J〕.Ann Dermatol,2010;22(2):125-37.
5Judith H,Joerg B,Timothy GB,etal.Management of itch in atopic dermatitis〔J〕.Semin Cutan Med Surg,2011;30(2):71-86.
6刘苏俊,许爱娥.皮肤源性瘙痒的发病机制和治疗〔J〕.国外医学·皮肤性病学分册,2005;31(1):21-3.
7黄林雪,李利.皮肤源性慢性瘙痒神经生理机制研究进展〔J〕.中国中西医结合皮肤性病学杂志,2015;14(4):265-9.
8Pfab F,Huss-Marp J,Gatti A,etal.Influence of acupuncture on type hypersensitivity itch and the wheal and flare response in adults with atopic eczema-a blinded,randomized,placebo controlled,crossover trial〔J〕.Allergy,2010;65(7):903-10.
9Pfab F,Kirchner MT,Huss-Marp J,etal.Acupuncture compared with oral antihistamine for type hypersensitivity itch and skin response in adults with atopic dermatitis—a patient- and examiner-blinded,randomized,placebo-controlled,crossover trial〔J〕.Allergy,2012;67(4):566-73.
10Pfab F,Hammes M,Backer M,etal.Preventive effect of acupuncture onhistamine-induced itch:a blinded,randomized,placebo-controlled,crossover trial〔J〕.J Allergy Clin Immunol,2005;116(6):1386-8.
11 Lundeberg T,Bondesson L,Thomas M.Effect of acupuncture on experimentally induced itch〔J〕.Br J Dermatol,1987;117(6):771-7.
12Kachiu CL,Ashley K,Jennifer RH,etal.Effectiveness of acupressure on pruritus and lichenification associated with atopic dermatitis:a pilot trial〔J〕.Acupunct Med,2012;30:8-11.
13莫俊銮,周继昌,刘小立,等.DNCB致敏诱导BALB/c小鼠特应性皮炎模型的建立〔J〕.中国热带医学,2013;13(12):1439-42.
14 李絮茹,岑醒洪,毕田田,等.维生素D受体激动剂对模型小鼠特应性皮炎的治疗作用〔J〕.中国皮肤性病学杂志,2015;29(2):133-54.
15王翼腾,李覃,张璐,等.应用Balb/c小鼠建立特应性皮炎的方法与评价〔J〕.免疫学杂志,2015;31(4):349-52.
16张露芬.实验针灸学〔M〕.北京:化学工业出版社,2010:9-221.
17 聂红,付凯,林娟,等.瘙痒的神经机制及其动物模型〔J〕.协和医学杂志,2011;2(4):370-4.
18Wu G,Li L,Sung GH,etal.Inhibition of 2,4-dinitrofluorobenzene induced atopic dermatitis by topical application of the butanol extract of Cordyceps bassiana in NC/Nga mice〔J〕.J Ethnopharmacol,2011;134:504-9.
19韩济生.强啡肽在脊髓中有强烈镇痛作用并参与电针镇痛〔J〕.医学研究通讯,1987;16(7):194-5.
20何承敏.中枢阿片肤介导不同频率电针镇痛作用的研究〔J〕.华中医学杂志,1997;21(6):285-6.
21Yosipovitch G,Carstens E,McGlone F.Chronic itch and chronic pain:analogous mechanisms〔J〕.Pain,2007;131:4-7.
22 Mitsutoshi T,Iideoki O,Kenji T.Possible roles of epidermal opioid systems in pruritus of atopic dermatitis〔J〕.J Invest Dermatol,2007;127:2228-35.
23Yosipovitch G,Fleischer A.Itch associated with skin disease:advances in pathophysiology and emerging therapies〔J〕.Am J Clin Dermatol,2003;4:617-22.
24 Ko MC,Song MS,Edwards T,etal.The role of central μ opioid receptors in opioid-induced itch in primates〔J〕.J Pharmacol Exp Ther,2004,310:169-76.
25 Ko MC,Husbands SM.Effects of atypical κ-opioid receptor agonists on intrathecal morphine-induced itch and analgesia in primates〔J〕.J Pharmacol Exp Ther,2009;328(1):193-200.
26 Umeuchi H,Togashi Y,Honda T,etal.Involvement of central muopioid system in the scratching behavior in mice,and the suppression of it by the activation of kappa-opioid system〔J〕.Eur J Pharmacol,2003;477(1):29-35.
27 陈小红,果淑凤,韩济生.疏密波电针镇痛最佳刺激条件的选择〔J〕.北京医科大学学报,1993;25(5):338.
28Han JB,Kim CW,Sun B,etal.The antipruritic effect of acupuncture on serotonin-evoked itch in rats〔J〕.Acupunct Electrother Res,2008;33(3-4):145-56.
29Kang H,Byun DG,Kim JW.Effect s of substance P and vasoactive intestinal peptide on interferon-gamma and interleukin-4 production in severe atopic dermatitis〔J〕.Ann Allergy Asthma Immunol,2000;85(3):227-32.
30付瑶,高明阳,谷玲.特应性皮炎患者血浆中P物质的测定及其临床意义〔J〕.中华皮肤科杂志,2007;40(7):422-3.
〔2016-07-22修回〕
(编辑曲莉)
国家自然科学基金青年基金项目(81403461)
符文彬(1963-),男,教授,博士生导师,主要从事针灸治疗痛症及抑郁相关病症的研究。
蒋丽(1983-),女,博士,主要从事针灸治疗皮肤病及抑郁相关病症的研究。
R749
A
1005-9202(2016)16-3874-04;doi:10.3969/j.issn.1005-9202.2016.16.003

