葛根素对RAW264.7源性泡沫细胞胆固醇摄取及外排功能的影响*
温柱华, 付大伟, 王 静, 徐如芹, 吴功雄, 刘世明
(广州医科大学附属第二医院,广州市心血管疾病研究所,广东 广州 510260)
葛根素对RAW264.7源性泡沫细胞胆固醇摄取及外排功能的影响*
温柱华, 付大伟, 王 静, 徐如芹, 吴功雄△, 刘世明△
(广州医科大学附属第二医院,广州市心血管疾病研究所,广东 广州 510260)
目的: 探讨葛根素(puerarin, Pur)对RAW264.7源性泡沫细胞胆固醇摄取及外排功能的影响。方法: 以氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)诱导RAW264.7源性泡沫细胞。细胞经处理后,利用荧光探针DiI-ox-LDL检测泡沫细胞摄取ox-LDL的能力,NBD标记胆固醇外排实验检测泡沫细胞的胆固醇外排功能,Western blot 法检测LC3II、P62、CD36、ATP结合盒转运蛋白 A1(ATP-binding cassette transporter A1,ABCA1)、溶酶体酸性脂肪酶(lysosomal acid lipase,LAL)以及p-AMPK的蛋白水平。结果: RAW264.7源性泡沫细胞经Pur处理后胆固醇摄取减少、胞内胆固醇外排增加并且自噬相关蛋白LC3II表达增加,P62表达减少,脂质吸收相关蛋白CD36表达减少,胆固醇外排相关蛋白ABCA1和LAL表达增加,其变化与自噬激动剂雷帕霉素处理后改变类似。Pur与自噬抑制剂3-甲基腺嘌呤共处理后,胆固醇摄取增加、胆固醇外排功能减弱,并且ABCA1、LAL和p-AMPK的蛋白水平减少,但CD36表达未有明显改变。结论: Pur可使得泡沫细胞LAL和ABCA1介导的胆固醇外排能力有所增强,其机制可能是通过AMPK通路增强自噬对胆固醇外排的调控;又可通过对CD36负向调节而使得泡沫细胞对脂质的摄取减少。
葛根素; 泡沫细胞; 胆固醇代谢; 自噬
动脉粥样硬化(atherosclerosis,AS)是众多心血管疾病的病理基础,AS病变过程中泡沫细胞的形成与发展始终贯穿于其中[1]。当体内的氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)被巨噬细胞吞噬后,将导致巨噬细胞内的脂质蓄积而形成巨噬细胞源性的泡沫细胞,而泡沫细胞对胞内脂质的代谢紊乱又将导致胞体的涨大、破裂并最终导致动脉粥样硬化斑块的破裂、出血而引发一系列心血管急症的发生[2-3]。此外,大量证据表明,在动脉粥样硬化斑块中血管内皮细胞、平滑肌细胞以及巨噬细胞等血管组织主要的细胞类型均有着自噬现象的改变[4-5]。
葛根素(puerarin,Pur)具有扩张冠状动脉、保护缺血心肌和抗心肌缺血再损伤、减少急性心肌梗死面积等多种作用[6-7],临床上主要用于冠心病心绞痛、心肌梗死等心血管疾病的治疗。另有研究表明,Pur对AS有着治疗作用[8],但其机制仍未十分明确。本研究观察Pur对泡沫细胞自噬现象、胞内胆固醇蓄积以及泡沫细胞胆固醇外排能力的影响,进而探讨其抗AS作用的机制。
材 料 和 方 法
1 材料
无酚红DMEM培养基和荧光NBD胆固醇均购自Invitrogen;葛根素、兔抗人LC3B多克隆抗体、人高密度脂蛋白(high-density lipoprotein,HDL)和人载脂蛋白A-I(apolipoprotein A-I,ApoA-I)均购自Sigma;兔抗人P62多克隆抗体购自CST;鼠抗人ATP结合盒转运蛋白A1(ATP-binding cassette transporter A1, ABCA1)和兔抗人CD36多克隆抗体均购自Abcam;兔抗人溶酶体酸性脂肪酶(lysosomal acid lipase,LAL)多克隆抗体购自Proteintech;辣根过氧化物酶标记的羊抗兔 IgG 购自武汉博士德生物工程有限公司;辣根过氧化物酶标记的羊抗小鼠 IgG 购自Jackson;ECL试剂购自 Santa Cruz;DiI-ox-LDL和ox-LDL购自广州奕源生物公司;其它试剂为国产分析纯品。
2 主要方法
2.1 细胞培养与细胞模型的建立 小鼠巨噬细胞系RAW264.7购自上海细胞库,培养于DMEM培养基[含1%青链霉素混合液、1.5 g/L NaHCO3(Invitrogen)和10%胎牛血清(Bioind)];培养条件为37 ℃、5 % CO2。以100 mg/L ox-LDL处理细胞48 h建立泡沫细胞模型。
2.2 荧光探针DiI-ox-LDL检测巨噬细胞摄取ox-LDL的能力 细胞处理结束后,与 10 mg/L的 Dil-ox-LDL,4 ℃下孵育细胞4 h。 DPBS 洗 3 次,用荧光显微镜(×400)随机拍照,激发波波长520 nm和发射波波长580 nm,红色荧光表示摄取DiI-ox-LDL的细胞。
2.3 胆固醇外排功能检测[9]以 5 μmol/L NBD-胆固醇孵育液干预ox-LDL负载的细胞。NBD-胆固醇孵育细胞6 h后,以PBS缓冲液洗涤细胞3次,分别以含有ApoA-I 或HDL的诱导外流液干预细胞,处理18~24 h后分别收集含荧光的诱导外流液(即细胞上清)和细胞裂解液(收集上清后将细胞裂解而得),分别测定荧光强度,荧光NBD胆固醇浓度与其荧光信号强度成正比。
2.4 Western blot 法检测LC3、P62、CD36、LAL、ABCA1和p-AMPK的蛋白水平 细胞处理结束后,收集蛋白样品,以Lowry法进行定量后,在8%、12% SDS-PAGE中分离,然后电转至PVDF膜上,5%脱脂牛奶或BSA室温封闭1 h,加入1∶2 000稀释的兔抗人LC3抗体、1∶1 000稀释的兔抗人P62抗体、1∶1 000稀释的兔抗人CD36抗体、1∶500稀释的鼠抗人ABCA1抗体、1∶500稀释的兔抗人LAL抗体以及1∶1 000稀释的兔抗人p-AMPK抗体,4 ℃孵育过夜,TBST洗膜7 min 2次,1∶4 000稀释的羊抗兔辣根过氧化物酶标记的羊抗兔 IgG,室温孵育1 h,TBST洗膜7 min 3次。目的蛋白特异条带化学发光法显影,经内参照 GAPDH标准化,并通过 Image-Pro Plus 软件半定量分析。
3 统计学处理
数据由 SPSS 13.0统计软件进行统计, 计量资料以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析(one-way ANOVA),并采用Bonferroni校正的t检验进行两两比较,以P<0.05为差异有统计学意义。
结 果
1 Pur对RAW264.7源性泡沫细胞胆固醇摄取能力的影响
经不同浓度的Pur处理后,泡沫细胞的胆固醇摄取能力均有所下降。采用荧光标记的ox-LDL方法观察葛根素对RAW264.7巨噬细胞摄取 ox-LDL能力的影响,结果显示80、160、320和640 μmol/L葛根素预孵育后,巨噬细胞对ox-LDL的摄取能力均降低(P<0.05)。鉴于CD36对胆固醇摄取有着重要的作用,因此,我们利用Western blot 法检测经Pur处理后细胞CD36蛋白的表达情况。结果表明,与ox-LDL模型组相比,各浓度Pur处理后CD36蛋白的表达水平降低,见图1。
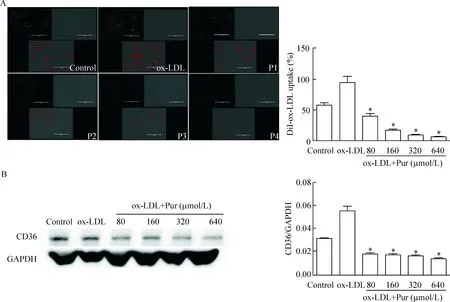
Figure 1.The effects of puerarin (Pur) on cholesterol influx in the RAW264.7 macrophage-derived foam cells. P1: 80 μmol/L Pur + ox-LDL; P2: 160 μmol/L Pur + ox-LDL; P3: 320 μmol/L Pur + ox-LDL; P4: 640 μmol/L Pur + ox-LDL. A: the cholesterol uptake was evaluated by a DiI-ox-LDL binding assay (scale bar=10 μm); B: the protein level of CD36 was detected by Western blot. Mean±SD.n=3.*P<0.05vsox-LDL group.
图1 Pur对RAW264.7源性泡沫细胞胆固醇摄取能力的影响
2 Pur对RAW264.7源性泡沫细胞胆固醇外排能力的影响
经不同浓度Pur处理后,泡沫细胞的胆固醇外排能力有所增加。采用荧光标记NBD胆固醇外流方法观察Pur对RAW264.7巨噬细胞源性泡沫细胞胆固醇外排功能的影响,结果显示泡沫细胞在由ApoA-I介导的胆固醇外流功能检测中,各浓度Pur处理后均对外流率产生影响(P<0.05)。由HDL介导的胆固醇外流功能检测中可见,细胞经160、320以及640 μmol/L浓度的Pur处理后,其胆固醇外流率均有所增加(P<0.05)。Western blot 实验的检测结果表明,Pur处理泡沫细胞可上调ABCA1和LAL蛋白的表达水平,见图2。
3 Pur可通过AMPK通路激活细胞自噬
如图3所示,不同浓度的Pur处理泡沫细胞后均可使得自噬相关蛋白LC3II水平上调及P62水平下调。经Pur处理后,泡沫细胞的AMPK磷酸化水平升高,见图3。
4 促进或抑制自噬后泡沫细胞的胆固醇摄取、外排外功能以及相关蛋白的改变
如图4所示,经雷帕霉素或与3-MA共孵育后, Pur组和RAPA组,与ox-LDL模型组相比均能明显减弱对DiI-ox-LDL的摄取,Pur与3-MA共孵育后胆固醇摄取较Pur组有所增加。Pur组和RAPA组与ox-LDL模型组相比细胞内脂质向HDL和ApoA-I的胆固醇外流率均明显增加,并且给予3-MA后,Pur处理的细胞胆固醇外流均较Pur组有所减少(P<0.05)。Pur组的LC3II表达以及AMPK磷酸化水平均增加明显,而Pur+3-MA组的LC3II表达以及AMPK磷酸化水平均下调。胆固醇摄取相关蛋白CD36的表达在Pur组和RAPA组均下调,但Pur与3-MA共孵育组未见CD36表达明显上调;而Pur组与RAPA组LAL的蛋白表达均有所上调,但RAPA组ABCA1的蛋白表达上调不甚明显。
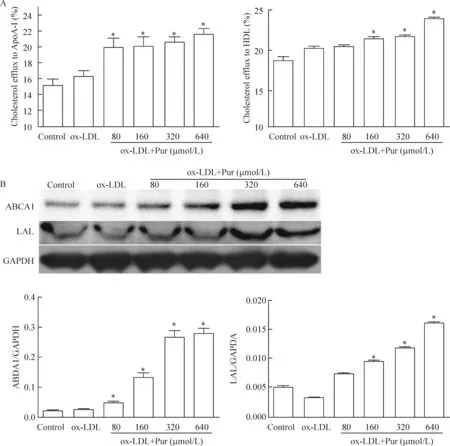
Figure 2.The effects of Pur on cholesterol efflux in the RAW264.7 macrophage-derived foam cells (A) and the expression of ABCA1 and LAL detected by Western blot (B). Mean±SD.n=3.*P<0.05vsox-LDL group.
图2 Pur对RAW264.7源性泡沫细胞胆固醇外排能力的影响
讨 论
泡沫细胞的形成与发展过程中,胆固醇的摄取与排出占据着重要地位[10]。因此,本研究中利用DiI-ox-LDL对泡沫细胞的胆固醇摄取功能进行检测并利用荧光NBD胆固醇外排实验对泡沫细胞胆固醇外排功能进行检测。结果表明,Pur处理后泡沫细胞胆固醇摄取能力减弱并且外排能力增强。既往研究表明,巨噬细胞接受ox-LDL刺激后,CD36蛋白表达增加,并且呈现出浓度依赖性,提示CD36在胆固醇吸收的过程中起着重要作用[11]。动物与细胞实验中,沉默CD36基因后动脉粥样硬化病变程度会有所减轻,进一步证实CD36在巨噬细胞胆固醇摄取过程中的促进作用[12]。本研究中,RAW264.7予以Pur处理后,细胞对DiI-ox-LDL摄取减少,同时伴有CD36蛋白表达减少,说明Pur可通过调控CD36的蛋白表达而影响巨噬细胞对胆固醇的吸收。
在胆固醇外排的过程中,ABCA1是较明确的介导胆固醇外排的蛋白之一,是细胞内多余胆固醇外排机制中的关键分子[13]。临床研究和动物实验结果表明,ABCA1基因突变或缺失会导致血浆HDL水平下降,巨噬细胞内大量胆固醇堆积和冠心病发病率增加。在易患AS的LDLR基因敲除小鼠中特异性敲除巨噬细胞内的ABCA1基因后,血清HDL水平无明显影响,却同样可加快AS的病程。由此可见,巨噬细胞上正常功能的 ABCA1 对于抑制 AS 病变的发展具有十分重要的意义。本研究中,Pur干预后能够有效增加胞内胆固醇外排并促进ABCA1的表达,说明胆固醇外排能力的增强是通过促进ABCA1的表达。
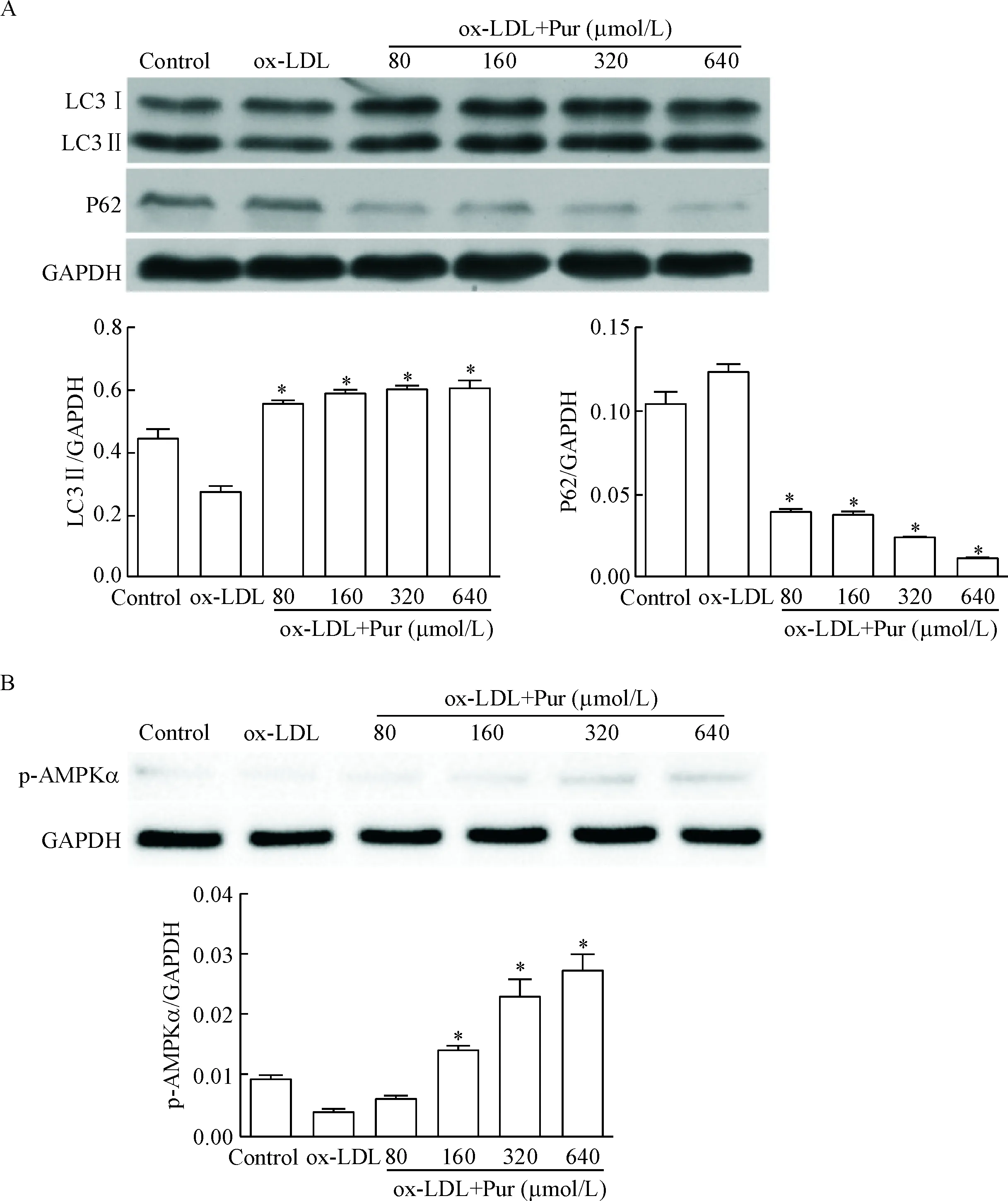
Figure 3.The protein levels of LC3, P62 (A) and p-AMPK (B) determined by Western blot. Mean±SD.n=3.*P<0.05vsox-LDL group.
图3 Western blot 检测LC3、P62以及p-AMPK表达
研究表明,在巨噬细胞源性泡沫细胞的胆固醇外排过程中,LAL对胆固醇进行降解并且介导胆固醇向ABCA1的外排[14]。该酶活性在ox-LDL的作用下的减弱,又可导致胆固醇的蓄积增多而促进AS的病变发展。我们的研究结果显示,Pur处理后的泡沫细胞LAL蛋白表达增加,表明Pur通过调控LAL的表达而增强胆固醇外排的能力。
LC3II 的相对量反映了自噬体的含量,是目前最广泛用来检测自噬体的分子标记;自噬底物蛋白P62也被称为SQSTM1,可通过LPS/LIRA途径与 LC3结合并形成复合物,由LC3介导形成自噬小体,最后自噬小体与溶酶体融合完成蛋白的降解。本研究中,Pur处理后的泡沫细胞LC3II的相对量有所增加而P62的表达则减少,表明Pur有效促进泡沫细胞的自噬发生。既往研究也提示,ox-LDL能够通过AMPK通路抑制巨噬细胞的自噬水平,并且Pur可通过AMPK通路上调H4IIE细胞自噬水平[15]。本研究中,Pur处理可上调泡沫细胞内AMPK蛋白磷酸化水平,表明在Pur 促进自噬的过程中,AMPK相关通路占有重要位置。
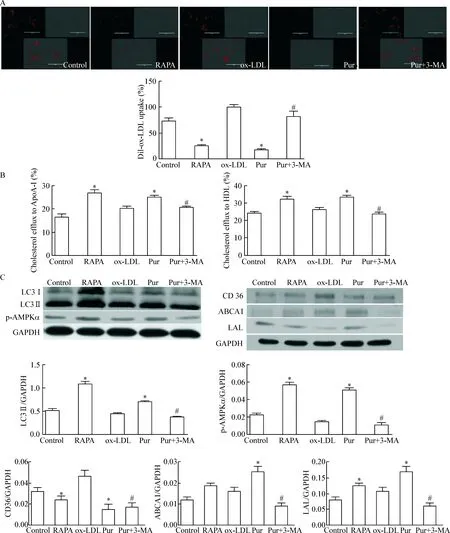
Figure 4. The effects of the agonist and inhibitor of autophagy on the functions of cholesterol influx and efflux and the changes of the related protein levels. A: the capacity of combining to ox-LDL was evaluated by a DiI-ox-LDL binding assay (scale bar=10 μm); B: cholesterol efflux to ApoA-I or HDL was tested in RAW264.7 macrophage-derived foam cells; C: the protein levels of LC3 II, p-AMPK, CD36, ABCA1 and LAL were determined by Western blot. Mean±SD.n=3.*P<0.05vsox-LDL group;#P<0.05vsPur group.
图4 自噬促进剂雷帕霉素以及自噬抑制剂3-MA处理后泡沫细胞胆固醇摄取、胆固醇外流率的变化以及相关蛋白的改变
Ouimet等[16]研究表明,在泡沫细胞胆固醇排出过程中,自噬可介导泡沫细胞内胆固醇外排,并且脂滴可通过自噬途径输送至溶酶体,并由LAL对脂滴进行降解后再经过ABCA1排出胞外,进而实现胆固醇的逆转运。故我们推测Pur对CD36的下调以及LAL、ABCA1的上调是通过自噬相关通路AMPK信号通路而实现的。为此,我们使用了自噬激动剂RAPA作为阳性对照,并将广谱自噬抑制剂3-MA与Pur共孵育以进一步证实猜想。本研究中,Pur与自噬促进剂RAPA有着类似的促进自噬以及AMPK磷酸化水平升高的作用,并且两者都能够促进胆固醇外流以及LAL的表达;予以3-MA与Pur共同作用后,p-AMPK、ABCA1和LAL的蛋白水平均减少,表明Pur对ABCA1以及LAL介导的胆固醇外排的促进作用可通过AMPK相关通路而产生。本研究中,RAPA处理后ABCA1表达未有明显增加而胆固醇外排效率有所增加,与既往文献报道一致[17]。我们认为其可能与RAPA对ABCA1的调控并非仅仅通过调节其表达,可能主要调控ABCA1的定位,但目前未有相关研究。此外,CD36的表达并没有因自噬的抑制而增加,可能是由于3-MA抑制自噬后使得Pur对于其它通路的作用增加而致CD36表达减少,有研究表明CD36的变化与PPARγ相关通路的改变有关,但Pur对CD36的调节机制仍有待进一步探讨。
综上所述,我们推测Pur可使得泡沫细胞LAL和ABCA1介导的胆固醇外排能力有所增强,其机制可能是通过AMPK通路增强自噬对胆固醇外排的调控;又可通过对CD36负向调节而使得巨噬细胞对脂质的摄取减少,但具体机制有待探讨。
[1] Chistiakov DA, Bobryshev YV, Orekhov AN. Macrophage-mediated cholesterol handling in atherosclerosis[J]. J Cell Mol Med, 2016, 20(1):17-28.
[2] Tsimikas S, Miller YI. Oxidative modification of lipoproteins: mechanisms, role in inflammation and potential clinical applications in cardiovascular disease[J]. Curr Pharm Des, 2011,17(1):27-37.
[3] Orsó E, Grandl M, Schmitz G. Oxidized LDL-induced endolysosomal phospholipidosis and enzymatically modified LDL-induced foam cell formation determine specific lipid species modulation in human macrophages[J]. Chem Phys Lipids, 2011, 164(6):479-487.
[4] Lavandero S, Chiong M, Rothermel BA, et al. Autophagy in cardiovascular biology[J]. J Clin Invest, 2015, 125(1):55-64.
[5] Vural A, Kehrl JH. Autophagy in macrophages: impacting inflammation and bacterial infection[J]. Scientifica (Cairo), 2014, 2014:825463.
[6] Bebrevska L, Foubert K, Hermans N, et al.Invivoantioxidative activity of a quantifiedPuerarialobataroot extract[J]. J Ethnopharmacol, 2010, 127(1):112-117.
[7] Yang X, Hu W, Zhang Q, et al. Puerarin inhibits C-reactive protein expression via suppression of nuclear factor κB activation in lipopolysaccharide induced peripheral blood mononuclear cells of patients with stable angina pectoris[J]. Basic Clin Pharmacol Toxicol, 2010, 107(2):637-642.
[8] Bao L, Zhang Y, Wei G, et al. The anti-atherosclerotic effects of puerarin on induced-atherosclerosis in rabbits[J]. Biomed Pap Med Fac Univ Palacky Olomouc Czech Repub, 2015, 159(1):53-59.
[9] 宋 玮, 王 伟, 王 雨, 等. 荧光标记胆固醇用于测定人单核巨噬细胞脂质外流[J]. 中国动脉硬化杂志, 2012, 20(8):749-754.
[10]Pennings M, Meurs I, Ye D, et al. Regulation of cholesterol homeostasis in macrophages and consequences for atherosclerotic lesion development[J]. FEBS Lett, 2006, 580(23):5588-5596..
[11]Collot-Teixeira S, Martin J, McDermott-Roe C, et al. CD36 and macrophages in atherosclerosis[J]. Cardiovasc Res, 2007, 75(3):468-477.
[12]Wang X, Wei J, Pan L, et al. The role of CD36 in the effect of arginine in atherosclerotic rats[J]. Med Sci Monit, 2015, 21:1494-1499.
[13]万晶晶,成 蓓,王彦富,等. Ghrelin对THP-1源性泡沫细胞ATP结合盒转运子A1和G1表达的调控作用[J]. 中国病理生理杂志, 2009, 25(8):1554-1558.
[14]Ouimet M, Franklin V, Mak E,et al. Autophagy regulates cholesterol efflux from macrophage foam cells via lysosomal acid lipase[J]. Cell Metab, 2011, 13(6):655-667.
[15]Noh BK, Lee JK, Jun HJ, et al. Restoration of autophagy by puerarin in ethanol-treated hepatocytes via the activation of AMP-activated protein kinase[J]. Biochem Biophys Res Commun, 2011, 414(2):361-366.
[16]Ouimet M, Marcel YL. Regulation of lipid droplet cholesterol efflux from macrophage foam cells[J]. Arterioscler Thromb Vasc Biol, 2012, 32(3):575-581.
[17]Dong F, Mo Z, Eid W, et al. Akt inhibition promotes ABCA1-mediated cholesterol efflux to ApoA-I through suppressing mTORC1[J]. PLoS One, 2014,9(11):e113789.
(责任编辑: 陈妙玲, 罗 森)
Effect of puerarin on cholesterol influx and efflux in RAW264.7-treated foam cells
WEN Zhu-hua, FU Da-wei, WANG Jing, XU Ru-qing, WU Gong-xiong, LIU Shi-ming
(TheSecondAffiliatedHospitalofGuangzhouMedicalUniversity,GuangzhouInstituteofCardiovascularDisease,Guangzhou510260,China.E-mail:gzliushiming@126.com)
AIM: To study the protective effect of puerarin on the atherosclerosis of RAW264.7-derived foam cells. METHODS: The model of foam cells was established by incubating the RAW264.7 cells with ox-LDL. The cholesterol uptake was evaluated by a DiI-ox-LDL binding assay. The ability of cholesterol efflux of the RAW264.7-derived foam cells was detected by cholesterol efflux assay. The protein levels of LC3II, P62, CD36, ABCA1, LAL and p-AMPK were determined by Western blot. RESULTS: Puerarin treatment reduced the cholesterol uptake capacity and enhanced the cholesterol efflux rate. The protein levels of LC3II, ABCA1 and LAL in puerarin group were higher than that in ox-LDL group, while the protein levels of P62 and CD36 were obviously decreased, and those in rapamycin treatment group had the same change as puerarin group. The protein levels of LC3II, ABCA1 and LAL were obviously decreased and the protein level of p-AMPK was increased after co-treated with 3-MA. CONCLUSION: Puerarin promotes LAL and ABCA1-mediated cholesterol efflux in ox-LDL-treated RAW264.7 macrophages, which might enhance autophagy through AMPK-dependent pathway for cholesterol efflux regulation, and reduce the uptake of lipids by CD36 negative regulation.
Puerarin; Foam cells; Cholesterol metabolism; Autophagy
杂志网址: http://www.cjpp.net
1000- 4718(2016)09- 1614- 07
2016- 03- 18
2016- 06- 01
广东省自然科学基金资助项目(No. S2013020012479);广州市属高校科研计划项目(No. 2013C213)
△ 通讯作者 刘世明 Tel: 020-34153522; E-mail: gzliushiming@126.com;吴功雄 Tel: 020-34153522; E-mail: wugongxiong@hotmail.com
R363
A
10.3969/j.issn.1000- 4718.2016.09.014

