HIF-1α介导人参皂甙Rb1对缺氧心肌细胞葡萄糖代谢的调节*
孔宏亮, 侯爱洁, 陈晓明, 石蕴琦, 赵红岩
(辽宁省人民医院心脏中心,辽宁 沈阳 110016)
HIF-1α介导人参皂甙Rb1对缺氧心肌细胞葡萄糖代谢的调节*
孔宏亮△, 侯爱洁, 陈晓明, 石蕴琦, 赵红岩
(辽宁省人民医院心脏中心,辽宁 沈阳 110016)
目的: 探讨人参皂甙Rb1(Gs-Rb1)是否通过缺氧诱导因子1α(HIF-1α)和(或)AMP激活的蛋白激酶α(AMPKα)调节缺氧心肌细胞的葡萄糖代谢而改善其生存能力。方法: 将乳鼠心肌细胞随机分为对照组、缺氧组(1% O2、94% N2和5% CO2)和缺氧干预组(即Gs-Rb1组、Ara-A组、Gs-Rb1+Ara-A组、YC-1组、Gs-Rb1+YC-1组、Ara-A+YC-1组和Gs-Rb1+YC-1+Ara-A组),Gs-Rb1、Ara-A和YC-1浓度分别为200 μmol/L、500 μmol/L和5 μmol/L,均干预8 h。MTT法检测细胞存活率;Western blot法半定量检测AMPKα、p-AMPKα、HIF-1α和葡萄糖转运体4(GLUT-4)的蛋白水平;ELISA检测己糖激酶(HK)、磷酸果糖激酶(PFK)和乳酸脱氢酶(LDH)的活性。结果: Gs-Rb1显著改善缺氧心肌细胞的生存能力,该作用可被Ara-A和YC-1抑制,且YC-1和Ara-A具有协同效应。Gs-Rb1增加缺氧心肌细胞AMPK活性的效应可被Ara-A或YC-1抑制。Ara-A和YC-1能不同程度抑制Gs-Rb1上调缺氧心肌细胞HIF-1α表达的效应。Gs-Rb1显著上调缺氧心肌细胞膜GLUT-4的表达,但该作用可被Ara-A或YC-1抑制,Ara-A和YC-1联用时尤为显著。Gs-Rb1显著增加缺氧心肌细胞HK、PFK和LDH等的活性,但该作用可被Ara-A和YC-1抑制,且YC-1和Ara-A具有协同抑制效应。结论: 人参皂甙Rb1改善缺氧心肌细胞生存能力与其促进葡萄糖摄取和增强葡萄糖糖酵解有关,这些效应可被HIF-1α和(或)AMPK调节,且HIF-1α和AMPK对此的调节具有协同作用。
心肌细胞; 人参皂甙Rb1; 缺氧; 缺氧诱导因子1α; 糖酵解
心肌缺氧时,细胞能量检测器AMP激活的蛋白激酶(AMP-activated kinase,AMPK)一方面通过磷酸化靶蛋白启动分解代谢途径增加ATP的产生,另一方面通过抑制/关闭合成代谢途径减少ATP消耗,从而调节细胞能量平衡[1]。同时,细胞通过缺氧感知系统感知氧分压变化后通过调节各种缺氧相关基因改善缺氧对细胞的影响,其中缺氧诱导因子1α(hypoxia-inducible factor 1α,HIF-1α)是重要的偶联调控因子[2],可通过调控葡萄糖转运体4(glucose transporter-4,GLUT-4)和其受体以及与糖酵解相关的酶等促使心肌细胞对缺氧作出代偿性反应[3]。不过,在缺氧心肌细胞中,AMPK和HIF-1α的相互作用尚不清楚。
人参是我国中药治疗心血管疾病的重要传统药物,其有效活性成分人参皂甙Rb1(ginsenoside Rb1,Gs-Rb1)具有改善慢性心力衰竭[4-8]和减轻缺血缺氧相关的心肌损伤[9-10]等生物学效应。其中,Gs-Rb1改善心肌细胞耐缺氧能力可能与其提高缺氧心肌细胞的葡萄糖摄取能力有关,其通过AMPK介导的GLUT-4实现[10]。Gs-Rb1亦可通过调控GLUT-4、诱导HIF-1α系统等改善心力衰竭[11-13]。不过,Gs-Rb1如何调控缺氧心肌细胞的葡萄糖代谢并不清楚,而在其调控作用中,AMPK和HIF-1α的相互作用如何亦不清楚。
因此,本研究通过对缺氧心肌细胞的综合干预,探讨AMPK和HIF-1α二者如何调节缺氧心肌细胞的葡萄糖代谢以及Gs-Rb1是否通过AMPK和HIF-1α的作用调节心肌细胞的糖代谢。
材 料 和 方 法
1 动物
Wistar乳鼠(鼠龄3 d)购自中国医科大学动物试验中心[SCXK(辽)2003-0009]。
2 试剂和仪器
人参皂甙Rb1 (纯度96%,中科院昆明植物研究所);AMPK抑制剂adenine 9-β-D-arabinofuranoside (Ara-A)、HIF-1抑制剂3-(5’-hydroxymethyl-2’-fu-ryl)-1-benzylindazole (YC-1)、胰蛋白酶和L-DMEM(Gibco);标准胎牛血清(fetal bovine serum,FBS;HyClone);即用型兔抗大鼠磷酸化AMPKα(Thr172,p-AMPKα)、AMPKα、HIF-1α、GLUT-4、GAPDH单克隆抗体和羊抗兔Ig G(Sigma);RIPA细胞裂解液、己糖激酶(hexokinase,HK)、磷酸果糖激酶(phosphofructokinase,PFK)和乳酸脱氢酶(lactate dehydrogenase,LDH)测试试剂盒(Sigma)。低温离心机(Hitachi);低温超速离心机(Sigma);超净工作台(Ibemotol);细胞培养箱(Heal Force Development Co.Ltd);缺氧孵育箱(Olympus);微量加样器和分光光度仪(PYE-Vnicam/Apectronic);紫外可见光光度计(Beckman);Multiscan酶标测试仪(Labsystems)和湿式转膜仪(Bio-Rad)。
3 方法
3.1 心肌细胞分离、培养和干预、分组 根据文献[8-10, 12]获取乳鼠心肌细胞,培养、同步化后随机分为对照组、缺氧组(缺氧箱中培养:94% N2、1% O2和5% CO2)和缺氧干预组(Gs-Rb1组、Ara-A组、Gs-Rb1+Ara-A组、YC-1组、Gs-Rb1+ YC-1组、Ara-A+YC-1组和Gs-Rb1+YC-1+Ara-A组),Gs-Rb1、Ara-A和YC-1的浓度分别为200 μmol/L、500 μmol/L和5 μmol/L,其它干预条件均相同。各组干预前24 h均换为含15% FBS的L-DMEM,干预时培养液中不含FBS以避免FBS的影响,干预时间均为8 h。
3.2 MTT法检测细胞存活率 按每孔1×104个接种心肌细胞于96孔板中并随机分组孵育8 h,继而每孔快速加入20 μL MTT(5 g/L)溶液并仍于原先条件下孵育,4 h后移除培养液并每孔各加100 μL DMSO,于微孔板振荡器上振荡以充分溶解结晶,应用酶标仪测560 nm处吸光度值(A值)。本底值为同等无细胞培养基。细胞存活率=(干预A值-本底值)/(对照A值-本底值)×100%。
3.3 Western blot法检测蛋白水平 提取各组(各组每样本细胞接种时均为1×106)心肌总蛋白并将其调至同一浓度后行聚丙烯酰胺凝胶电泳(每孔加样20 μL)、转膜、封闭,之后分别加入 抗p-AMPKα、AMPKα、HIF-1α和GAPDH的I 抗(均1∶200稀释)于4 ℃孵育过夜,洗膜后加入 II 抗(1∶400)孵育1 h,自动凝胶成像分析系统计算条带积分吸光度(integral absorbance,IA),其IA与内参照IA比值为相应蛋白的半定量指标。
3.4 心肌细胞膜GLUT-4的检测 根据文献[8, 13]提取细胞膜蛋白,即溶细胞(各组每样本细胞均为1×106)于蔗糖-Tris溶液中匀浆,200×g、 4 ℃离心5 min,取上清液高速离心(15 000×g,15 min,4 ℃), 得沉淀物后溶于蔗糖-Tris溶液中再35 000×g、4 ℃离心20 min,获取细胞膜蛋白。然后按上述Western blot实验方法加入抗GLUT-4和GAPDH的I 抗(均1∶200稀释)以及 II 抗(1∶400)。
3.5 糖酵解关键酶活性检测 按各自条件消化各组心肌细胞并调整其密度为3×109/L后加入预冷细胞裂解液于冰浴(4 ℃)15 min,13 200×g离心30 min后取上清液。按试剂盒说明应用比色法测HK(U/g)、PFK(U/g)及应用酶标仪测定LDH(U/L)的活性。
4 统计学处理
各组均为5个样本,且每样本均检测3次并取其均值。数据用均值±标准差(mean±SD)表示,采用SPSS 19.0软件包行统计学分析,计量资料采用单因素方差分析(one-way ANOVN)中的Dunnett T3法,以P<0.05为差异有统计学意义。
结 果
1 Gs-Rb1改善缺氧心肌细胞的生存能力
缺氧显著降低心肌细胞生存能力(P<0.01);Ara-A或YC-1更进一步降低缺氧心肌细胞生存能力,联合干预时降低更为显著(P<0.01);比较Ara-A组和YC-1组的生存能力两组间差异没有统计学显著性。Gs-Rb1显著改善缺氧心肌细胞的生存能力(P<0.01),但可被Ara-A和YC-1抑制;Gs-Rb1+YC-1+Ara-A组的心肌细胞生存能力显著低于Gs-Rb1+Ara-A组和Gs-Rb1+YC-1组(P<0.01),但显著高于Ara-A+YC-1组(P<0.01),见图1。

Figure 1.The results of MTT assay showed that Gs-Rb1 improved the viability of hypoxic cardiomyocytes. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vshypoxia group;△P<0.05vsGs-Rb1 group.
图1 Gs-Rb1改善缺氧心肌细胞的生存能力
2 Gs-Rb1改善缺氧心肌细胞AMPK活性
缺氧时心肌细胞的AMPK活性显著提高(P<0.01),Ara-A干预完全消除了AMPK的活性,而YC-1干预弱化AMPK的活性(P<0.01);Gs-Rb1显著增加缺氧心肌细胞AMPK的活性(P<0.01),该效应可被Ara-A完全抑制或被YC-1部分抑制(P<0.01),见图2。

Figure 2.The results of Western blot showed that Gs-Rb1 improved the AMPK activity in hypoxic cardiomyocytes. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vshypoxia group;△P<0.05vsGs-Rb1 group.
图2 Gs-Rb1改善缺氧心肌细胞的AMPK活性
3 Gs-Rb1对缺氧心肌细胞HIF-1α的影响
缺氧时,心肌细胞的HIF-1α显著上调,YC-1干预完全抑制HIF-1α表达,而Ara-A则部分抑制HIF-1α的表达(P<0.01);Gs-Rb1显著上调缺氧心肌细胞HIF-1α的表达(P<0.01),但该效应可被Ara-A部分抑制和被YC-1完全抑制,见图3。
4 Gs-Rb1对缺氧心肌细胞膜GLUT-4表达的影响
缺氧时,心肌细胞膜GLUT-4表达上调,但Ara-A和YC-1均可抑制其表达;Gs-Rb1可上调缺氧心肌细胞膜GLUT-4的表达,但此效应可被Ara-A或YC-1以及Ara-A和YC-1联合作用所抑制(P<0.01),见图4。
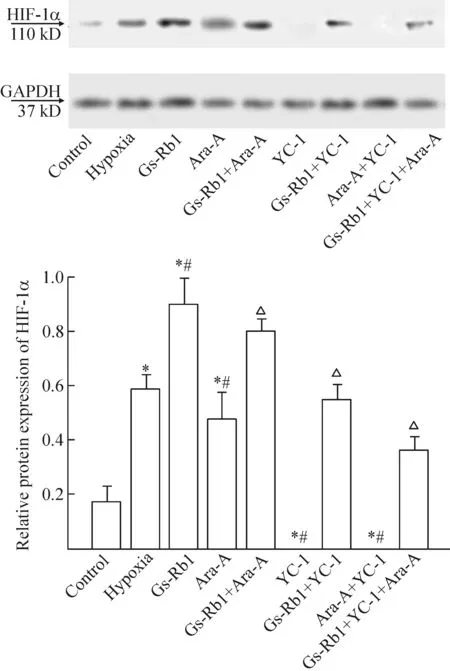
Figure 3.The results of Western blot showed that the effects of Gs-Rb1 on the expression of HIF-1α in hypoxic cardiomyocytes. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vshypoxia group;△P<0.05vsGs-Rb1 group.
图3 Gs-Rb1对缺氧心肌细胞HIF-1α表达的影响

Figure 4.The results of Western blot showed that the effects of Gs-Rb1 on the expression of GLUT-4 in hypoxic cardiomyocytes. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vshypoxia group;△P<0.05vsGs-Rb1 group.
图4 Gs-Rb1对缺氧心肌细胞GLUT-4表达的影响
5 Gs-Rb1改善缺氧心肌细胞的糖酵解
与缺氧前相比,缺氧心肌细胞内HK活性、PFK活性和LDH活性均显著升高(P<0.01);但Ara-A和YC-1可显著抑制这些效应。Gs-Rb1可进一步显著增加缺氧心肌细胞的HK、PFK和LDH的活性,单独和联合应用Ara-A和(或)YC-1均可显著抑制上述变化,见图5。
讨 论
初生乳鼠虽然可以通过氧化磷酸化供能,但更多地依赖于糖酵解[14],故而选用乳鼠心肌细胞作为干预对象,以便更准确评价Gs-Rb1对缺氧心肌细胞糖代谢的影响。同时,为了明确AMPK和HIF-1α在其中的作用,选用其各自对应的抑制剂即Ara-A和YC-1;作为Ara-ATP前体,Ara-A竞争性抑制AMPK激活,具有极高的特异性[15];YC-1虽非HIF-1特异性抑制剂,但其可通过转录后水平完全抑制HIF-1的表达及活性[16],故而并不能排除“HIF-1逃逸”效应,其仍可在某种意义上反映HIF-1介导的效应。
缺血、缺氧状态下,心肌细胞脂肪酸β-氧化磷酸化功能受损,其时葡萄糖代谢即葡萄糖的易化摄取和糖酵解至关重要。葡萄糖易化摄取取决于细胞膜内GLUT-4的表达及转位[15-17],故而细胞膜GLUT-4水平反映了细胞的葡萄糖摄取能力。HK和PFK是糖酵解的重要限速酶,LDH是糖酵解的重要产物,三者共同反映糖酵解水平。葡萄糖易化摄取是足够葡萄糖底物的保障,而糖酵解水平是能量之源,二者相铺相成方能尽可能保障缺氧心肌细胞的生存。与其它研究一样,本研究证实Gs-Rb1可以改善缺氧心肌细胞生存能力[8-11],这种能力与其改善葡萄糖代谢有关,即促进GLUT-4移位[8]和改善糖酵解。
缺氧状态下,心肌细胞可通过能量感知途径调节细胞能量代谢,即通过细胞能量检测器AMPK的激活途径维持细胞能量平衡[18]。本研究进一步证实AMPK介导Gs-Rb1通过促进GLUT-4表达改善缺氧心肌细胞的生存能力[8],同时显示Gs-Rb1可在AMPK介导下通过改善缺氧心肌细胞糖酵解改善心肌细胞的生存能力。缺氧可通过促进HIF-1α的表达改善心肌细胞的耐缺氧能力[3, 9, 19, 23],本研究在论证这些结论的基础上显示HIF-1α介导Gs-Rb1通过促进缺氧心肌细胞GLUT-4表达和糖酵解等改善心肌细胞的生存能力。

Figure 5.Gs-Rb1 regulated the rate-limiting enzymes of glycosis in the hypoxic cardiomyocyte. Mean±SD.n=5.*P<0.05vscontrol group;#P<0.05vshypoxia group;△P<0.05vsGs-Rb1 group.
图5 Gs-Rb1调节缺氧心肌细胞糖酵解限速酶
癌细胞中的AMPK可调控HIF-1的表达和移位[20-21],软骨细胞的自噬通过HIF-1调控AMPK实现[22],心肌AMPK活性下降[8,10]和HIF-1α稳定性下降[23-24]均可致心肌受损于缺血再灌注损伤,但在缺血心肌细胞中,AMPK和HIF-1如何相互作用并不清楚。本研究发现YC-1干预弱化AMPKα活性和Ara-A弱化HIF-1α表达,此提示AMPKα受HIF-1α调节,而HIF-1α亦受AMPKα调节,即二者相互调节,但其调节的机制并不清楚。在明确Gs-Rb1改善AMPKα活性和HIF-1α表达的同时,本研究亦证实HIF-1α和AMPKα协同作用以实现Gs-Rb1对HIF-1α和/或AMPKα的调节效应,但其确切机制亟待进一步证实。
本研究显示HIF-1α和AMPKα相互协同保障缺氧心肌细胞的生存能力,这种能力与改善葡萄糖代谢相关,包括促进葡萄糖摄取和改善糖酵解水平,也就是说,能量代谢状态的能量检测器AMPK和缺氧感知信号系统HIF-1相互勾连共同调节心肌细胞应对缺氧状态。在证实Gs-Rb1改善心肌细胞耐缺氧能力基础上,证实该效应可能与其促进葡萄糖代谢有关,并且该效应至少部分受AMPKα和(或)HIF-1α调节,尤为重要的是AMPKα和(或)HIF-1α相互影响且协同作用调节Gs-Rb1的生物学效应。另外,Gs-Rb1改善缺氧心肌细胞糖代谢等提示Gs-Rb1可能在“有限氧供”下充分利用氧又尽可能维护缺氧心肌细胞的能量供应以保障缺氧心肌细胞的生存。不过,YC-1的非特异性效应提示可能存在HIF-1α外的通路介导人参皂甙Rb1对缺氧心肌细胞葡萄糖代谢的调节,此尚需进一步研究。
[1] Yaoita H, Maruyama Y. AMPK signalling and the control of substrate use in the heart[J]. Mol Cell Endocrinol, 2013, 366(2):180-193.
[2] Wang X, Ma S, Qi G. Effect of hypoxia-inducible factor 1-alpha on hypoxia/reoxygenation-induced apoptosis in primary neonatal rat cardiomyocytes[J]. Biochem Biophys Res Commun, 2012, 417(4):1227-1234.
[3] Date T, Mochizuki S, Belanger AJ, et al. Expression of constitutively stable hybrid hypoxia-inducible factor-1alpha protects cultured rat cardiomyocytes against simulated ischemia-reperfusion injury[J]. Am J Physiol Cell Physiol, 2005, 288(2):C314-C320.
[4] 孔宏亮, 苗志林, 郭翠艳, 等. 人参皂甙Rb1对阿霉素心力衰竭大鼠心肌细胞核因子-кB的影响[J]. 中国药理学通报, 2013, 29(4):573-576.
[5] 孔宏亮, 侯爱洁, 郭翠艳, 等. 人参皂甙Rb1对心力衰竭大鼠蛋白激酶R样内质网激酶途径的影响[J]. 中国组织化学与细胞化学杂志, 2013, 22(4): 290-295.
[6] Zhao H, Lv D, Zhang W, et al. Ginsenoside-Rb1 attenuates dilated cardiomyopathy in cTnT (R141W) transgenic mouse[J]. J Pharmacol Sci, 2010, 112(2):214-222.
[7] 孔宏亮, 宋丽杰, 李占全, 等.人参皂甙Rb1对阿霉素心力衰竭大鼠致心脏纤维化因子表达的影响[J]. 南京医科大学学报, 2012, 32(1):26-29.
[8] Kong HL, Wang JP, Li ZQ, et al. Anti-hypoxic effect of ginsenoside Rb1 on neonatal rat cardiomyocytes is mediated through the specific activation of glucose transporter-4 ex vivo[J]. Acta Pharmacol Sin, 2009, 30(4):396-403.
[9] Kong HL, Li ZQ, Zhao SM, et al. Apelin-APJ effects of ginsenoside-Rb1 depending on hypoxia-induced factor 1α in hypoxia neonatal cardiomyocytes[J]. Chin J Integr Med, 2015, 21(2):139-146.
[10]Kong HL, Li ZQ, Zhao YJ, et al. Ginsenoside Rb1 protects cardiomyocytes against CoCl2-induced apoptosis in neonatal rats by inhibiting mitochondria permeability transition pore opening[J]. Acta Pharmacol Sin, 2010, 31(6):687-695.
[11]赵颖军, 孔宏亮, 吴 昊, 等. 人参皂苷 Rb1对缺氧乳鼠心肌细胞缺氧诱导因子-1α的影响[J]. 山西医药杂志, 2010, 39(9):801-820.
[12]孔宏亮, 李占全, 辛爽清, 等. 人参皂苷Rb1对心力衰竭大鼠心肌细胞葡萄糖转运载体-4的影响[J]. 广东医学, 2013, 34(8):1157-1159.
[13]孔宏亮, 赵颖军, 陈 敏, 等. 高糖对乳鼠心肌细胞葡萄糖转运载体-4的影响[J]. 广东医学, 2010, 31(11):1387-1389.
[14]Lopaschuk GD, Wambolt RB, Barr RL. An imbalance between glycolysis and glucose oxidation is a possible explanation for the detrimental effects of high levels of fatty acids during aerobic reperfusion of ischemic hearts[J]. J Pharmacol Exp Ther, 1993, 264(1):135-144.
[15]Henin N, Vincent MF, Van den Berghe G. Stimulation of rat liver AMP-activated protein kinase by AMP analogues[J]. Biochim Biophys Acta, 1996, 1290(2):197-203.
[16]Chun YS, Yeo EJ, Choi E, et al. Inhibitory effect of YC-1 on the hypoxic induction of erythropoietin and vascular endothelial growth factor in Hep3B cells[J]. Biochem Pharmacol, 2001, 61(8):947-954.
[17]Razeghi P, Young ME, Ying J, et al. Downregulation of metabolic gene expression in failing human heart before and after mechanical unloading[J]. Cardiology, 2002, 97(4):203-209.
[18]Czech MP, Corvera S. Signaling mechanisms that regulate glucose transport[J]. J Biol Chem, 1999, 274(4):1865-1868.
[19]郑耀富, 殷 然, 王梦洪, 等. 肝X受体通过调控GLUT-4减轻心肌缺血/再灌注损伤[J]. 中国病理生理杂志, 2014, 30(1):18-24.
[20]黄金贤, 罗佳妮, 刘培庆, 等. AMPK/PPARα/SCAD信号途径对心肌肥大的调控研究[J]. 中国病理生理杂志, 2014, 30(5):769-778.
[21]Zhang J, Liu A, Hou R, et al. Salidroside protects cardiomyocyte against hypoxia-induced death: a HIF-1α-activated and VEGF-mediated pathway[J]. Eur J Pharmacol, 2009, 607(1-3):6-14.
[22]Russell RR 3rd, Li J, Coven DL, et al. AMP-activated protein kinase mediates ischemic glucose uptake and prevents postischemic cardiac dysfunction, apoptosis, and injury[J]. J Clin Invest, 2004, 114(4):495-503.
[23]Lim JY, Oh MA, Kim WH, et al. AMP-activated protein kinase inhibits TGF-β-induced fibrogenic responses of hepatic stellate cells by targeting transcriptional coactivator p300[J]. J Cell Physiol, 2012, 227(3):1081-1089.
[24]Chen S, Yin C, Lao T, et al. AMPK-HDAC5 pathway facilitates nuclear accumulation of HIF-1α and functional activation of HIF-1 by deacetylating Hsp70 in the cytosol[J]. Cell Cycle, 2015,14(15):2520-2536.
[25]Bohensky J, Leshinsky S, Srinivas V, et al. Chondrocyte autophagy is stimulated by HIF-1 dependent AMPK activation and mTOR suppression[J]. Pediatr Nephrol, 2010, 25(4):633-642.
[26]Cai Z, Zhong H, Bosch-Marce M, et al. Complete loss of ischaemic preconditioning-induced cardioprotection in mice with partial deficiency of HIF-1 alpha[J]. Cardiovasc Res, 2008, 77(3):463-470.
(责任编辑: 卢 萍, 罗 森)
Improving effects of ginsenoside Rb1 on glucose metabolism in cardiomyocytes under hypoxia by hypoxia-inducible factor 1α
KONG Hong-liang, HOU Ai-jie, CHEN Xiao-ming, SHI Yun-qi, ZHAO Hong-yan
(CardiologyCenter,ThePeople’sHospitalofLiaoningProvince,Shenyang110016,China.E-mail:khl339@163.com)
AIM: To elucidate the effect of ginsenoside Rb1 (Gs-Rb1) on the glucose metabolism to improve the viability of the cardiomyocytes under hypoxia, and whether hypoxia-inducible factor 1α (HIF-1α) and/or AMPKα are involved in the process.METHODS: The neonatal rat cardiomyocytes were cultured, and randomly divided into control group, hypoxia (1% O2, 94% N2and 5% CO2) group, Gs-Rb1 (200 μmol/L) group, Ara-A (500 μmol/L) group, Gs-Rb1+Ara-A group, YC-1 (5 μmol/L) group, Gs-Rb1+YC-1 group, Ara-A+YC-1 group and Gs-Rb1+YC-1+Ara-A group. After the intervention for 8 h, the cell viability was analyzed by MTT assay. The protein levels of AMPK, HIF-1α and glucose transporter-4 (GLUT-4) were determined by Western blot. The activities of heterophosphatase (HK), phosphofructokinase (PFK) and lactic dehydrogenase (LDH) were measured by ELISA.RESULTS: Gs-Rb1 significantly improved the viability of hypoxic cardiomyocytes, which was significantly inhibited by YC-1 and Ara-A. In addition, YC-1 and Ara-A had a synergistic effect. Gs-Rb1 increased the protein levels of AMPK and HIF-1α in the hypoxic cardiomyocytes, which was significantly inhibited by Ara-A and YC-1. Gs-Rb1 significantly increased the expression of GLUT-4 on the cytomembrane of hypoxic cardiomyocytes, which was significantly inhibited by YC-1 or Ara-A, especially Ara-A+YC-1. Gs-Rb1 significantly increased the activities of HK, PFK and LDH, all those were significantly inhibited by YC-1 or Ara-A. Besides, YC-1 and Ara-A had a synergistic effect.CONCLUSION: Gs-Rb1 improves the viability of hypoxic cardiomyocytes, which may be related to the regulation of glucose uptake and enhancement of glycolysis by synergy of both HIF-1α and AMPK.
Cardiomyocytes; Ginsenoside Rb1; Hypoxia; Hypoxia-inducible factor 1α; Glycolysis
杂志网址: http://www.cjpp.net
1000- 4718(2016)09- 1621- 06
2016- 03- 21
2016- 08- 05
沈阳市科技创新专项资金-人口与健康科技攻关专项(No. F15-199-1-06);辽宁省自然科学基金资助项目(No. 2015020282)
△通讯作者 Tel: 17702487789; E-mail: khl339@163.com
R363
A
10.3969/j.issn.1000- 4718.2016.09.015

