小檗碱抑制脓毒症诱导的肠上皮细胞凋亡*
李红梅, 邢 云, 唐翔诩, 杨多猛, 王华东, 吕秀秀, 戚仁斌, 陆大祥
(暨南大学医学院病理生理学系, 国家中医药管理局病理生理学实验室, 广东 广州 510632)
小檗碱抑制脓毒症诱导的肠上皮细胞凋亡*
李红梅, 邢 云, 唐翔诩, 杨多猛, 王华东△, 吕秀秀, 戚仁斌, 陆大祥
(暨南大学医学院病理生理学系, 国家中医药管理局病理生理学实验室, 广东 广州 510632)
目的: 观察小檗碱对脓毒症小鼠肠上皮细胞凋亡的影响及其作用机制。方法: 8~10周雄性C57BL/6小鼠,随机分为假手术组(sham组)、脓毒症模型组(CLP组)、小檗碱治疗组(CLP+Ber组)、小檗碱对照组(sham+Ber组)。CLP组行盲肠结扎穿孔术复制小鼠脓毒症模型,其余组除不结扎盲肠外,其它操作同CLP组。各组小鼠术后2 h内分别予双蒸水、小檗碱(50 mg/kg)灌胃。术后20 h,小鼠腹腔注射过量的戊巴比妥钠处以安乐死后开腹取回肠组织,HE染色观察各组小鼠肠组织形态学改变;Western blot法观察各组肠组织凋亡相关蛋白caspase-3降解片段、胞浆组织细胞色素C(Cyt C)、线粒体蛋白Bax及细胞总蛋白Bcl-2、Fas、FasL、Fas相关死亡域结构蛋白(FADD)的含量变化;real-time PCR法检测各组肠组织酪氨酸羟化酶(TH)和多巴胺β-羟化酶(DBH)的mRNA表达水平。结果:小鼠CLP术后20 h,可见脓毒症模型组小鼠肠绒毛坏死并伴有大量炎症细胞浸润;模型组肠组织caspase-3降解片段显著增多,线粒体Bax、胞浆Cyt C及总蛋白Fas、FasL含量显著增高,而总蛋白Bcl-2含量明显降低,FADD未见明显改变;脓毒症模型组肠组织TH、DBH的mRNA表达明显增高。术后给予小檗碱治疗后可显著减轻肠组织炎症,逆转caspase-3降解片段、Bax、Cyt C、Fas、FasL、Bcl-2蛋白和TH、DBH mRNA的表达。结论:小檗碱可显著抑制脓毒症小鼠肠上皮细胞凋亡,其机制可能与抑制内、外源性凋亡途径有关。
小檗碱; 脓毒症; 肠; 细胞凋亡; 去甲肾上腺素
2015年的国际脓毒症会议将脓毒症定义为机体对感染的失控性反应进而导致危及生命的器官功能障碍[1],由脓毒症引起的多器官功能障碍是ICU患者死亡的重要原因[2-3]。肠道被认为是脓毒症所致多器官功能障碍的始发器官,是“肠-肝-肺”轴的第一步[4]。脓毒症时,外周神经系统兴奋性增强,血液中去甲肾上腺素(norepinephrine,NE)含量升高[5-6]。在肠黏膜和黏膜下神经丛分布有很多去甲肾上腺素能神经元,它们产生的NE 被称为“肠源性去甲肾上腺素”。肠道产生的NE大部分进入血液循环后又扩散到肠系膜组织,这种高浓度的NE可进一步渗透到肠腔从而造成肠组织损伤[7-8]。肠源性NE在脓毒症性肝损伤中也发挥重要作用[9],NE还可促进放射线诱导的肠上皮细胞凋亡[10]。
我们前期的研究发现,小檗碱(berberine,Ber)可减轻脂多糖性肝损伤[11]。我们进一步研究又发现,小檗碱还能减轻内毒素诱导的小鼠肠损伤、脓毒症性肠损伤,并抑制肠上皮细胞凋亡,但其作用机制尚不清楚[12-13]。另外,脓毒症时小檗碱对肠源性NE产生和释放的影响亦未见报道。本实验中,我们将对小檗碱抑制脓毒症性肠上皮细胞凋亡的机制进行研究,并初步探讨小檗碱对肠源性NE产生和释放的影响。
材 料 和 方 法
1 实验动物
8~10周雄性C57BL/6鼠,体重为21~23 g,购自广州中医药大学动物中心,合格证号为SCXK(粤)2013-0034。实验小鼠分笼饲养,自由饮水进食,在实验前放在实验环境中隔离检测10 d,相对湿度控制在60%~80%,温度控制在(24±2)℃。动物处理符合暨南大学实验动物管理的相关规定。
2 主要试剂、器材与仪器
中性硫酸小檗碱、戊巴比妥钠均购自Sigma,实验前用蒸馏水或生理盐水配制成实验所需浓度;线粒体蛋白提取试剂盒购自Thermo Scientific;抗Fas、FasL、Fas相关死亡结构域蛋白(Fas associated protein with death domain,FADD)抗体购自Abcam;抗 GAPDH、VDAC(线粒体内参照)、Bax、Bcl-2、细胞色素C(cytochrome C,Cyt C)、cleaved caspase-3和caspase-3抗体购自CST;辣根过氧化物酶标记的山羊抗兔 II 抗购自北京鼎国生物科技有限公司;BCA 法蛋白定量试剂盒购自上海申能博彩生物科技有限公司;ECL发光液试剂盒购自Pierce。
固定板、无菌洞巾、持针器、缝针、缝线、有(无)齿镊、直(弯)剪、眼科剪、眼科镊、注射器、手术刀、刀片等均由暨南大学附属第一医院提供。此处,还应用到Western blot实验装置(Bio-Rad)、BI2000 图像分析系统(成都泰盟电子有限公司)、real-time PCR仪(Roche)及BX40 型光学显微镜 (Olympus)。
3 方法
3.1 实验分组及模型建立 将C57BL/6小鼠随机分为4组:假手术组(sham组);脓毒症模型组,即盲肠结扎穿孔(cecal ligation puncture,CLP)组;小檗碱治疗组(CLP+Ber组);小檗碱对照组(sham+Ber组)。脓毒症模型组小鼠腹腔注射0.67%戊巴比妥钠(0.01 mL/g)全身麻醉,仰卧位固定,备皮、消毒,无菌操作行盲肠结扎穿孔术。假手术组除不结扎盲肠和穿孔外,其余操作均与CLP组相同。术后2 h内,假手术组和模型组予以双蒸水灌胃(0.01 mL/g)、小檗碱治疗组和小檗碱对照组予以小檗碱(50 mg/kg,0.01 mL/g)灌胃。
3.2 肠组织病理学检查 术后20 h处死小鼠,在距离盲肠末端1 cm处取回肠组织标本,弃去肠内容物后迅速置于4%甲醛溶液中固定,常规方法制备石蜡切片,HE染色,在光学显微镜下观察各组小鼠回肠组织结构改变。
3.3 Western blot法检测肠组织线粒体蛋白Bax、胞浆蛋白Cyt C的含量 各组小鼠术后20 h处死,取200 mg回肠组织,加入3 mL PBS清洗2次后剪碎组织,按照线粒体提取试剂盒说明书加入相应试剂,提取线粒体蛋白和胞浆蛋白,分别用于Bax和Cyt C的含量测定。
3.4 Western blot法检测肠组织总蛋白cleaved caspase-3、caspase-3、Bcl-2、Fas、FasL、FADD的含量 各组小鼠术后20 h处死,取50 mg回肠组织,用生理盐水(4 ℃) 冲洗,滤纸吸干,加入1 mL 的 RIPA 裂解液(含终浓度为1 mmoL/L的PMSF),充分匀浆,冰面静置 30 min,4 ℃、15 000×g离心15 min。BCA蛋白定量试剂盒检测肠组织匀浆液中总蛋白含量。按每个泳道孔加入5~10 μg蛋白样品进行SDS-PAGE。Bio-Rad 半干转印仪12 V~18 V 恒压转印10 min至PVDF膜上。封闭1 h后分别加入1∶1 000稀释的兔抗小鼠cleaved caspase-3、caspase-3、Bcl-2、Fas、FasL、FADD抗体,以 GAPDH为内参照,4 ℃过夜孵育。加入辣根过氧化物酶标记的山羊抗兔Ⅱ抗孵育液,室温孵育 1 h。化学发光法检测抗原抗体复合物含量,BI2000 软件分析蛋白条带的积分光密度值,以目的蛋白与GAPDH 积分光密度比值来分析结果。
3.5 Real-time PCR法检测小鼠肠组织酪氨酸羟化酶(tyrosine hydroxylase, TH)、多巴胺β-羟化酶(dopamine beta hydroxylase, DBH)的mRNA表达 各组小鼠术后20 h处死,取出50 mg回肠组织加入1 mL的TRIzol液充分匀浆后采用TRIzol法提取RNA,使用 NanoDrop-1000 测定 RNA 浓度和纯度,所获得的RNA 溶液A260/A280比值范围在1.8~2.1 之间,取总 RNA 1 000 ng 反转录合成 cDNA;按照 SYBR® PrimeScriptTM反转录试剂盒II体系说明加入相应的cDNA、H2O、引物、Taq酶和荧光染料充分混合后置于LightCycler®480 实时荧光定量PCR仪进行反应。设置程序如下:95 ℃ 30 s;95 ℃10 s、60 ℃10 s、72 ℃10 s,40个循环;在72 ℃采集荧光信号并绘制熔解曲线,根据熔解曲线来衡量产物特异性。PCR反应引物如下:TH 上游引物为5′-GGTTCAGCAGTGAGGAGGTC-3′,下游引物为5′-GGGGCGTAGTCATACAGAGC-3′;DBH 上游引物为5′-TTCTTGAAGGAACGGACTGG-3′,下游引物为5′-GGCATGACGGATGTACTGTG-3′; GAPDH 上游引物为5′-TCACCACCATGGAGAAGGC-3′,下游引物为5′-GCTAAGCAGTTGGTGGTGCA-3′。每个PCR反应设置3个复孔,用10倍稀释后的样品分别制作TH、DBH和GAPDH的标准曲线来计算该基因的扩增效率,并将实际的扩增效率带入系统软件中计算。
4 统计学处理
用SPSS 13.0软件进行数据处理。计量资料以均数±标准误(mean±SEM)表示,多组间比较用单因素方差分析:各组方差齐时,采用SNK法进行两两比较;各组方差不齐时,用Tamhane’s T2法进行两两比较。以P<0.05为差异有统计学意义。
结 果
1 小肠组织病理学改变
光学显微镜下可见,CLP术后20 h,小鼠肠绒毛坏死、大量炎症细胞浸润; 肠腔可见大量炎症细胞、红细胞及脱落坏死组织;小檗碱治疗组肠绒毛及肠腔内炎症细胞浸润、出血明显轻于CLP组;各对照组肠道组织结构正常,肠绒毛结构清晰,见图1。
2 小檗碱可显著抑制脓毒症小鼠肠道组织caspase-3的降解
如图2所示,小鼠CLP术后 20 h,与假手术组相比,CLP组肠组织 caspase-3降解片段明显增多(P<0.05);脓毒症小鼠术后给予小檗碱灌胃能显著抑制肠组织caspase-3的切割(P<0.05)。Ber对照组与假手术组相比,肠组织cleaved caspase-3的含量差异无统计学显著性。
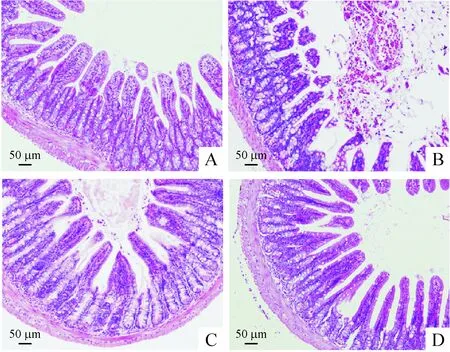
Figure 1.Photomicrograph of intestine from the mice in sham group (A), CLP group (B), CLP+Ber group (C) and sham+Ber group (D). The intestine histological sections were stained with hematoxylin-eosin. Ber: berberine.
图1 各组小鼠肠组织形态学改变
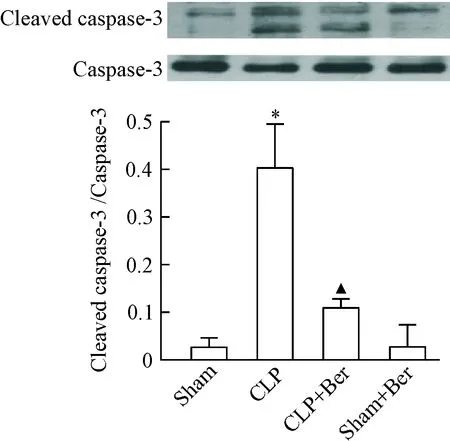
Figure 2.The effect of berberine on the protein levels of cleaved caspase-3 in the intestinal tissues 20 h after CLP operation. Mean±SEM.n=6.*P<0.05vssham group;▲P<0.05vsCLP group.
图2 小檗碱对脓毒症小鼠肠组织cleaved caspase-3含量的影响
3 小檗碱对脓毒症小鼠肠组织凋亡相关蛋白表达的影响
与假手术组相比,脓毒症小鼠肠组织线粒体的Bax、胞浆Cyt C,肠组织总提取蛋白中的Fas、FasL含量显著增高,Bcl-2含量明显降低,而FADD的含量未见明显改变。小檗碱治疗组可明显逆转上述蛋白的改变。假手术组和小檗碱对照组上述指标的差异无统计学显著性,见图3。
4 小檗碱对脓毒症小鼠肠组织TH和DBH mRNA表达的影响
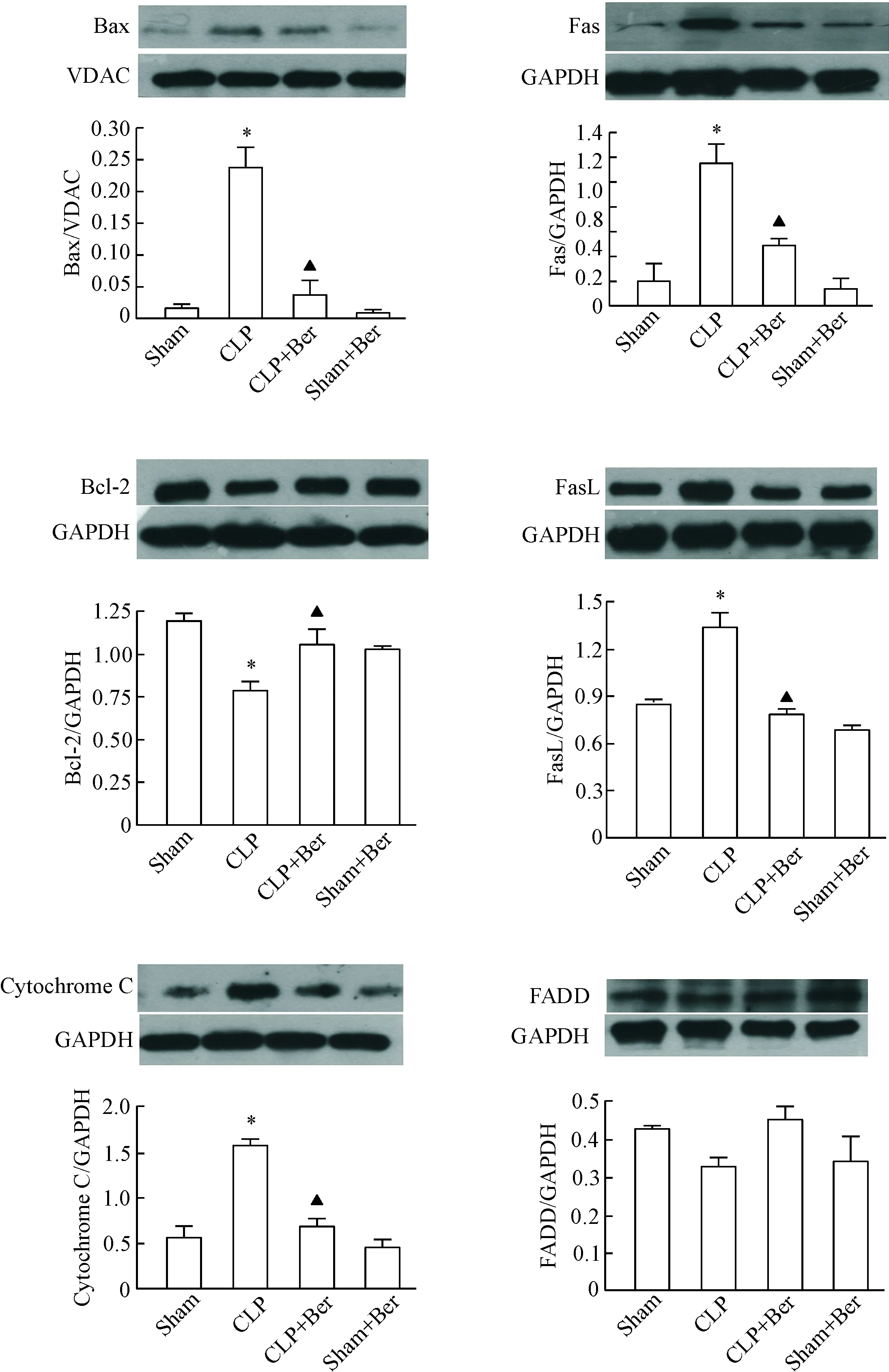
Figure 3.The protein levels of mitochondrial Bax, cytoplasmic cytochrome C, and Bcl-2, Fas, FasL, FADD in ileum total protein were determined by Western blot at 20 h after the operation. Mean±SEM.n=6.*P<0.05vssham group;▲P<0.05vsCLP group.
图3 小檗碱对脓毒症小鼠肠组织凋亡相关蛋白表达的影响
TH、DBH和GAPDH均呈现单一的熔解曲线峰,TM值分别为88.5 ℃、87.5 ℃和88.0 ℃,说明PCR引物设计特异性强,扩增产物单一。在小鼠复制脓毒症模型20 h后,TH 和DBH的mRNA表达均较假手术组显著增高(P<0.05),给予小檗碱治疗后,TH和DBH的mRNA表达较CLP组明显降低,差异有统计学显著性(P<0.05),见图4。
讨 论
本研究中, 我们首先观察小鼠行盲肠结扎穿孔术后20 h肠组织形态学改变。光学显微镜下可见,CLP组小鼠肠绒毛充血水肿、坏死,大量炎症细胞浸润;肠腔可见大量炎症细胞、红细胞及脱落坏死组织。术后2 h内给予小檗碱灌胃治疗后,小鼠肠腔内仅有少量炎症细胞和坏死脱落组织。这些结果说明,小檗碱可明显减轻脓毒症小鼠肠道的炎症反应,进一步证实了我们先前报道的结果[13]。
Gao等[14]发现,大鼠腹腔注射LPS 24 h后,TUNEL染色显示小肠上皮细胞凋亡增多,caspase-3降解片段明显增高。Khailova等[15]研究也发现,运
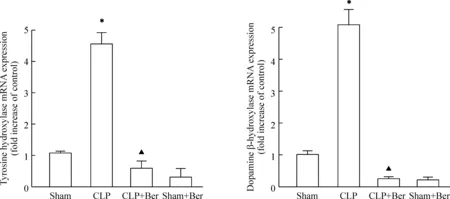
Figure 4.The mRNA expression of tyrosine hydroxylase and dopamine β-hydroxylase in the ileum detected by real-time PCR analysis 20 h after CLP operation. Sham group was recognized as a control and data was expressed as the ratio to sham group. Mean±SEM.n=6.*P<0.05vssham group;▲P<0.05vsCLP group.
图4 小檗碱对脓毒症小鼠肠组织TH和DBH mRNA表达的影响
用盲肠结扎穿孔术复制小鼠脓毒症模型24 h后,肠上皮细胞caspase-3激活的阳性细胞数显著增多,服用益生菌可通过激活蛋白激酶B来下调TLR4的表达,显著抑制脓毒症小鼠肠上皮细胞凋亡情况,保护肠屏障。这说明,脓毒症可导致肠上皮细胞凋亡,进而破坏肠屏障功能,这是脓毒症肠损伤的一个重要机制。本研究发现,脓毒症小鼠术后20 h,回肠组织凋亡蛋白酶caspase-3降解片段显著增多,而术后给予小檗碱灌胃治疗可显著抑制caspase-3蛋白酶的降解,这表明,抑制肠上皮细胞凋亡可能是小檗碱防治脓毒症性肠损伤的一个重要机制。
为了进一步验证小檗碱防治脓毒症性肠损伤的上述机制,我们采用Western blot检测小鼠回肠组织中Fas、FasL、FADD的含量,结果发现脓毒症小鼠肠组织Fas和FasL含量显著增高,而FADD未见明显改变,运用小檗碱治疗均可明显降低Fas和FasL的含量。Fas是细胞外源性凋亡途径中重要受体蛋白,Fas蛋白识别其配体FasL后,Fas三聚化与接头蛋白FADD结合形成死亡诱导信号复合物,激活caspase-8、10及其下游的caspase-3,最终导致细胞凋亡。促凋亡蛋白Bid是联系外源性凋亡途径和内源性凋亡途径的中间介质[16]。在Bid作用下,内源性凋亡途径激活,线粒体外膜通透性增加,细胞色素C通过线粒体PT孔释放到胞浆,进一步激活caspase-9而导致细胞凋亡。于是我们进一步检测小鼠回肠组织中线粒体蛋白Bax、胞浆蛋白Cyt C及总蛋白中Bcl-2的含量改变。结果显示,小鼠CLP术后20 h,脓毒症模型组肠组织线粒体Bax、胞浆Cyt C含量显著增高,总蛋白中Bcl-2含量明显降低。运用小檗碱灌胃治疗可明显逆转线粒体Bax、胞浆Cyt C及总蛋白Bcl-2的上述改变。这些结果进一步证明,抑制肠上皮细胞凋亡是小檗碱抑制脓毒症性肠损伤的重要机制。Perrone等[17]研究也发现,脓毒症小鼠24 h肠组织蛋白Bax、Fas、FasL显著增高,Bcl-2被显著抑制,而FADD有增高的趋势但差异无统计学显著性,这与我们的结果一致。以上结果可见,小檗碱可通过抑制内、外源性凋亡通路来抑制脓毒症所致的肠上皮细胞凋亡。
有报道称[18],在脓毒症早期(2 h)大鼠肝门静脉和循环中NE含量增高,且门静脉中NE含量较循环中NE含量显著增多;相反,当CLP造模之前切除大鼠肠道可以阻止NE的升高。肠源性NE通过α2-AR受体途径可促进肝脏枯否氏细胞释放TNF-α,导致肝功能障碍[5, 9]。脓毒症时肠源性NE的产生对肠自身亦可造成不良影响[8]。研究发现,NE可促进放射线诱导的肠上皮细胞凋亡[10],还可通过下调Bcl-2的表达而诱导乳鼠内皮细胞凋亡[19]。我们前面的研究结果已经证实,小檗碱可以抑制脓毒症诱导的肠上皮细胞凋亡,而脓毒症时,小檗碱对肠源性NE的生成和释放的影响尚不清楚。TH和DBH在组织中常被认为是去甲肾上腺素能递质神经支配的特异性标记物,是NE合成的主要限速酶[20]。于是我们提取小鼠肠组织RNA检测其TH和DBH的mRNA表达。研究发现,在小鼠复制脓毒症模型20 h后,TH和DBH的mRNA表达均较假手术明显增高,给予小檗碱治疗后,TH和DBH的mRNA表达明显降低。而Zhou等[21]的研究表明,脓毒症后2 h和20 h,肠组织TH的mRNA水平及蛋白含量显著增高,这与我们的研究结果一致。
综上所述,小檗碱可减轻脓毒症性肠损伤,抑制内源性和外源性的细胞凋亡途径减轻脓毒症所致的肠上皮细胞凋亡。然而,小檗碱是否通过抑制肠源性NE的产生和释放来减轻脓毒症诱导的肠上皮细胞凋亡,还有待进一步深入验证。
[1] Singer M, Deutschman CS, Seymour CW, et al. The third international consensus definitions for sepsis and septic shock (sepsis-3)[J]. JAMA, 2016, 315(8):801-810.
[2] Vincent JL, Marshall JC, Namendys-Silva SA, et al. Assessment of the worldwide burden of critical illness: the intensive care over nations (ICON) audit[J]. Lancet Respir Med, 2014, 2(5):380-386.
[3] Fleischmann C, Scherag A, Adhikari NK, et al. Assessment of global incidence and mortality of hospital-treated sepsis. Current estimates and limitations[J]. Am J Respir Crit Care Med, 2016, 193(3):259-272.
[4] Klingensmith NJ,Coopersmith CM. The gut as the motor of multiple organ dysfunction in critical illness[J]. Crit Care Clin, 2016, 32(2):203-212.
[5] Zhou M, Das P, Simms HH, et al. Gut-derived norepinephrine plays an important role in up-regulating IL-1beta and IL-10[J]. Biochim Biophys Acta, 2005, 1740(3):446-452.
[6] Miksa M, Das P, Zhou M, et al. Pivotal role of the alpha(2A)-adrenoceptor in producing inflammation and organ injury in a rat model of sepsis[J]. PLoS One, 2009, 4(5): e5504.
[7] Cogan TA, Thomas AO, Rees LE, et al. Norepinephrine increases the pathogenic potential of campylobacter jejuni[J]. Gut, 2007, 56(8):1060-1065.
[8] Jorgensen VL, Reiter N,Perner A. Luminal concentrations of L- and D-lactate in the rectum may relate to severity of disease and outcome in septic patients[J]. Crit Care, 2006, 10(6):R163.
[9] Zhang F, Wu R, Qiang X, et al. Antagonism of alpha2A-adrenoceptor: a novel approach to inhibit inflammatory responses in sepsis[J]. J Mol Med (Berl), 2010, 88(3):289-296.
[10]Matsuu-Matsuyama M, Okaichi K, Shichijo K, et al. Norepinephrine enhances radiosensitivity in rat ileal epithelial cells[J]. J Radiat Res, 2011, 52(3): 369-373.
[11]李梅爱, 王华东, 陆大祥, 等. 小檗碱预防脂多糖性肝损伤的机制研究[J]. 中国病理生理杂志, 2006, 25(5):987-991.
[12]Lv XX, Yu XH, Wang HD, et al. Berberine inhibits norepinephrine-induced apoptosis in neonatal rat cardiomyocytes via inhibiting ROS-TNF-alpha-caspase signaling pathway[J]. Chin J Integr Med, 2013, 19(6): 424-431.
[13]Li HM, Wang YY, Wang HD, et al. Berberine protects against lipopolysaccharide-induced intestinal injury in mice via alpha 2 adrenoceptor-independent mechanisms[J]. Acta Pharmacol Sin, 2011, 32(11): 1364-1372.
[14]Gao X, Hao S, Yan H, et al. Neutrophil extracellular traps contribute to the intestine damage in endotoxemic rats[J]. J Surg Res, 2015, 195(1):211-218.
[15]Khailova L, Frank DN, Dominguez JA, et al. Probiotic administration reduces mortality and improves intestinal epithelial homeostasis in experimental sepsis[J]. Anesthesiology, 2013, 119(1): 166-177.
[16]Tafani M, Karpinich NO, Hurster KA, et al. Cytochrome c release upon Fas receptor activation depends on translocation of full-length bid and the induction of the mitochondrial permeability transition[J]. J Biol Chem, 2002, 277(12): 10073-10082.
[17]Perrone EE, Jung E, Breed E, et al. Mechanisms of methicillin-resistant Staphylococcus aureus pneumonia-induced intestinal epithelial apoptosis[J]. Shock, 2012, 38(1):68-75.
[18]Yang S, Koo DJ, Zhou M, et al. Gut-derived norepinephrine plays a critical role in producing hepatocellular dysfunction during early sepsis[J]. Am J Physiol Gastrointest Liver Physiol, 2000, 279(6):G1274-G1281.
[19]Fu YC, Yin SC, Chi CS, et al. Norepinephrine induces apoptosis in neonatal rat endothelial cells via a ROS-dependent JNK activation pathway[J]. Apoptosis, 2006, 11(11): 2053-2063.
[20]Elenkov IJ, Wilder RL, Chrousos GP, et al. The sympathetic nerve—an integrative interface between two supersystems: the brain and the immune system[J]. Pharmacol Rev, 2000, 52(4):595-638.
[21]Zhou M, Hank Simms H,Wang P. Increased gut-derived norepinephrine release in sepsis: up-regulation of intestinal tyrosine hydroxylase[J]. Biochim Biophys Acta, 2004, 1689(3): 212-218.
(责任编辑: 陈妙玲, 余小慧)
Berberine inhibits enterocyte apoptosis in septic mice
LI Hong-mei, XING Yun, TANG Xiang-xu, YANG Duo-meng, WANG Hua-dong, LÜ Xiu-xiu, QI Ren-bin, LU Da-xiang
(DepartmentofPathophysiology,SchoolofMedicine,JinanUniversity,KeyLaboratoryofPathophysiology,StateAdministrationofTraditionalChineseMedicineofThePeople’sRepublicofChina,Guangzhou510632,China.E-mail:twhd@jnu.edu.cn)
AIM: To observe the effects of berberine (Ber) on enterocyte apoptosis in septic mice and its possible mechanism. METHODS: Male C57BL/6 mice (8~10 weeks old) were randomly divided into sham group, cecal ligation and puncture (CLP) group, CLP+Ber group and sham+Ber group. The mice in CLP group underwent CLP ope-ration, and the mice in sham groups suffered a similar operation except the ligation and puncture. After the sham or CLP operation, the mice were administered intragastrically with distilled water or berberine (50 mg/kg) within 2 h. After 20 h, the mice were killed with excess pentobarbital sodium and the ileum tissues were removed. The histological changes of the intestine were observed and the enterocyte apoptosis was examined by determining the protein level of cleaved caspase-3. Furthermore, mitochondrial Bax, cytoplasm cytochrome C (Cyt C) and the total proteins of Bcl-2, Fas, FasL and Fas-associated protein with death domain (FADD) were examined by Western blot. The mRNA expression of tyrosine hydroxylase (TH) and dopamine beta-hydroxylase (DBH) was measured by real-time PCR. RESULTS: The extensive ileum injuries, including remarkably increased leukocytes and necrosis of intestinal villus were observed 20 h after CLP. In CLP group, the protein levels of cleaved caspase-3, cytoplasm Cyt C, as well as Fas, FasL were significantly increased, but the Bcl-2 level was decreased. Bax translocation into mitochondria was promoted. However, FADD was not changed significantly. The mRNA expression of TH and DBH was also increased sharply in CLP group. On the contrary, treatment with berberine made a considerable alleviating alteration in the ileum of the septic mice.CONCLUSION: Treatment with berberine provides protective effects on intestinal injury in septic mice by reducing enterocyte apoptosis, and its possible mechanism may be involved in the inhibition of the endogenous and exogenous apoptosis pathways.
Berberine; Sepsis; Intestine; Apoptosis; Norepinephrine
杂志网址: http://www.cjpp.net
1000- 4718(2016)09- 1660- 06
2016- 06- 14
2016- 07- 18
广东省医学科研基金(No.B2013204)
△ 通讯作者 Tel: 020-85220241;E - mail: twhd@jnu.edu.cn
R363; R515.3
A
10.3969/j.issn.1000- 4718.2016.09.021

