重组人内皮抑素通过激活Dll4/Notch通路抑制大鼠动脉粥样硬化斑块内血管新生*
蔡宏文, 朱 敏, 周鑫斌, 缪 静, 邱原刚, 毛 威
(浙江中医药大学附属第一医院心内科,浙江 杭州 310006)
重组人内皮抑素通过激活Dll4/Notch通路抑制大鼠动脉粥样硬化斑块内血管新生*
蔡宏文, 朱 敏, 周鑫斌, 缪 静, 邱原刚, 毛 威△
(浙江中医药大学附属第一医院心内科,浙江 杭州 310006)
目的: 观察重组人内皮抑素(rhES)对大鼠动脉粥样硬化(AS)斑块内新生血管的抑制作用,探讨Dll4/Notch信号通路在其中的调控机制。方法:雄性Wistar大鼠随机分为正常对照组(N组)、AS组和AS+rhES组,每组10只。N组始终喂基础饲料,其余2组采用高脂喂养、维生素D3负荷及球囊损伤动脉内膜建立大鼠AS模型。AS+rhES组以10 mg·kg-1·d-1的rhES腹腔注射4周,另2组注射等量生理盐水。采血检测各组的总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、C反应蛋白(CRP)、白细胞介素-1(IL-1)和肌钙蛋白I(TnI)等;免疫组化CD31染色观察新生血管密度;Western blot法检测主动脉内Dll4、Notch1蛋白表达。结果:与N组比较,AS组和AS+rhES组的TC、TG、LDL-C、CRP和L-1水平均显著升高(P<0.05),但上述指标在AS组和AS+rhES组之间差异无统计学显著性。CD31染色结果显示,AS组的新生血管表达最丰富;与AS组比较,AS+rhES组的新生血管密度显著下降(P<0.05)。AS组的Dll4和Notch1蛋白水平显著低于N组(P<0.05);相比AS组,AS+rhES组的Dll4和Notch1蛋白水平显著升高(P<0.05)。结论: rhES能够抑制大鼠AS斑块内血管新生,Dll4/Notch通路的激活可能是rhES抑制斑块内的血管新生的信号机制。
重组人内皮抑素; 动脉粥样硬化; Dll4/Notch通路; 新生血管
动脉粥样硬化(atherosclerosis,AS)是冠心病病理基础,结构不同的AS斑块有着不同的稳定性,稳定性低的斑块易发生破裂继发急性血栓形成,这是导致冠心病死亡的主要原因。因此,如何稳定AS斑块,预防斑块破裂是近年来冠心病防治研究关注的重点。近年发现,斑块内新生血管是不稳定斑块形成的关键,抑制斑块内血管新生已成为防治AS的一个新方向[1-2]。重组人内皮抑素(recombinant human endostatin,rhES)是特异性的病理性新生血管抑制剂,前期工作中,我们发现rhES可有效抑制AS斑块内新生微血管形成,能稳定并消退AS斑块,但rhES上述作用的具体信号机制尚不清楚[3-4]。已知Dll4/Notch信号通路是调控体内多种病理性血管新生的重要通路[5]。但Dll4/Notch通路是否参与调控AS斑块内血管新生这一过程尚无研究报道,对其进一步研究有望揭示AS新的治疗靶点。因此,本实验将探讨Dll4/Notch通路在rhES抑制AS斑块内血管新生过程中的调控机制。
材 料 和 方 法
1 动物
清洁级雄性Wistar大鼠30只,8周龄,体重150~180 g,由浙江中医药大学动物实验中心统一代购,并饲养于该中心。动物合格证为SYXK(浙)2013-0184。
2 药物、试剂和仪器
rhES由山东先声麦得津制药有限公司提供。高脂饲料配方:3%胆固醇、0.5%胆酸钠、5%干络素、10%蛋黄粉、8%全脂奶粉、10%猪油、63.5%基础饲料,由浙江中医药大学动物实验中心提供。维生素D3注射液购自上海通用药业股份有限公司。大鼠C反应蛋白(C-reactive protein,CRP)、白细胞介素-1(interleukin-1,IL-1)、肌钙蛋白I(troponin I,TnI)ELISA试剂盒购自上海源叶生物科技有限公司。Anti-Dll4 antibody、anti-Notch1 antibody、anti-β-actin antibody均购自杭州诚维生物科技有限公司。酶联免疫检测仪(Bio-Tek);垂直电泳仪及转膜装置(Bio-Rad)。
3 方法
3.1 分组、造模和给药方法 Wistar大鼠30只,随机分为3组,每组10只,分别为正常对照(normal control,N)组、AS组和AS+rhES组。N组始终喂基础饲料,其余2组始终喂高脂饲料。AS和AS+rhES组于喂养开始时1次性腹腔注射维生素D310 mg/kg,N组注射等量生理盐水。AS和AS+rhES组于喂养后第7天行主动脉球囊拉伤术,0.3%戊巴比妥钠10 mL/kg腹腔麻醉,无菌条件下做颈正中切口,分离左颈外动脉,结扎远心端,向心脏方向插入1.5 F球囊,约进入8 cm后充盈球囊,感到阻力后缓慢回拉约5 cm,放空球囊,再进入5 cm,充盈、回拉,重复3次,退出球囊,结扎近心端,逐层缝合,术后肌注青霉素钠3 d。造模成功后4周,AS+rhES组以10 mg·kg-1·d-1rhES连续腹腔注射注射4周,另2组注射等量生理盐水。
3.2 血脂、TnI及炎症指标检测 采用全自动生化分析仪测定血清总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)等项目。用ELISA法检测血清CRP、IL-1和TnI含量。
3.3 CD31免疫组化染色检测主动脉新生微血管密度 采用内皮细胞特异性标记物CD31行免疫组化染色,CD31标记的新生血管内皮细胞阳性染色呈棕黄色或棕褐色,采用Carl Zeiss Imaging Systems测量的阳性细胞的积分吸光度(integral absorbamce,IA)反映新生血管密度。
3.4 Western blot法检测主动脉Dll4和Notch1蛋白水平变化 提取同等水平球囊损伤处腹主动脉组织总蛋白后采用BCA法测定各组Dll4和Notch1蛋白的表达。凝胶图像处理系统分析各组目的条带与相应β-actin蛋白条带的吸光度比值。
4 统计学处理
采用SPSS 17.0软件进行统计分析。所有数据以均数±标准差(mean±SD)表示,组间比较采用单因素方差分析(one-way ANOVA),组间均数两两比较采用Bonferroni法。以P<0.05为差异有统计学意义。
结 果
1 各组血清TC、TG和LDL-C水平的变化
造模后的AS组和AS+rhES组的血清TC、TG和LDL-C水平与N组比较,均显著升高(P<0.05),但AS组和AS+rhES组之间比较差异无统计学显著性,见表1。
表1 各组血清TC、TG和LDL-C水平的比较
Table 1.The levels of blood TC, TG and LDL-C in 3 groups (mmol/L.Mean±SD.n=10)
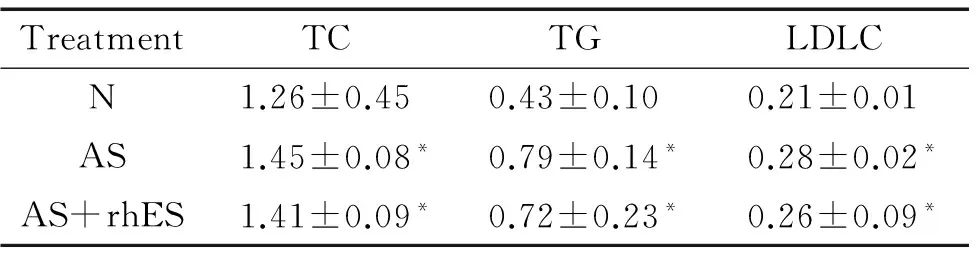
TreatmentTCTGLDLCN1.26±0.450.43±0.100.21±0.01AS1.45±0.08*0.79±0.14*0.28±0.02*AS+rhES1.41±0.09*0.72±0.23*0.26±0.09*
*P<0.05vsN group.
2 各组大鼠血清CRP和IL-1和TnI水平的变化
与N组比较,AS组和AS+rhES组的血清CRP和IL-1水平均显著升高(P<0.05),但上述指标在AS组和AS+rhES组之间比较差异无统计学显著性;各组间TnI水平两两比较差异均无统计学显著性,见表2。
3 免疫组化染色检测各组主动脉新生血管
采用CD31标记的新生血管内皮细胞阳性染色呈棕黄色或棕褐色,结果显示AS组新生血管表达最丰富;与N组相比,AS组和AS+rhES组的CD31表
表2 各组血清CRP、IL-1和TnI水平的比较
Table 2.The levels of blood CRP, IL-1 and TnI in 3 groups (Mean±SD.n=10)
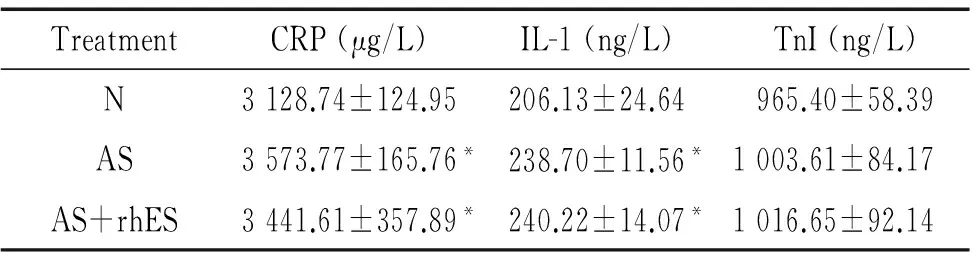
TreatmentCRP(μg/L)IL-1(ng/L)TnI(ng/L)N3128.74±124.95206.13±24.64965.40±58.39AS3573.77±165.76*238.70±11.56*1003.61±84.17AS+rhES3441.61±357.89*240.22±14.07*1016.65±92.14
*P<0.05vsN group.
达均明显增多(P<0.05);与AS相比,AS+rhES组的CD31表达显著减少(P<0.05),见图1。
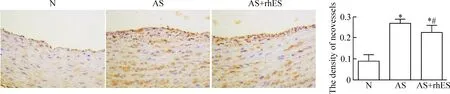
Figure 1.The representative images of aorta with CD31 immunohistochemical staining (×400). Mean±SD.n=10.*P< 0.05vsN;#P<0.05vsAS.
图1 各组主动脉CD31免疫组化染色
4 Western blot法检测各组主动脉Dll4和Notch1蛋白水平变化
与N组比较,AS组的Dll4和Notch1蛋白表达水平均显著降低(P<0.05);而与AS组相比,AS+rhES组的Dll4和Notch1蛋白表达水平均显著升高(P<0.05),见图2。
讨 论
近年研究发现,AS斑块内常出现病理性新生血管,它可以促进AS进展,诱发斑块内出血、破裂及并发症的发生,AS斑块内的新生血管作为不稳定斑块的病理特征已经得到充分认识,抑制斑块内新生血管已成为防治AS的新策略[1-2]。前期工作中,我们发现rhES可有效抑制兔和小型猪模型中AS斑块内新生血管形成,减小斑块面积,延缓AS进展,但rhES抑制斑块内新生血管的具体信号机制尚不清楚[3-4]。
Dll4/Notch通路是近年来颇受关注的对新生血管的形态和功能发育有着重要影响的信号通路[6]。Notch通路由Notch受体及5种配体(Jagged1、Jagged2、Dll1、Dll3和Dll4)组成,其中Dll4是血管特异性Notch配体,它在血管构建和稳态维持中扮演着关键角色,Dll4能在生理及病理性血管生成中特异性表达[7]。Dll4/Notch通路参与调控肿瘤的病理性血管新生已经在乳腺癌、肾癌、Ksposi肉瘤等体内外实验中得到证实[8]。研究发现,Dll4/Notch通路通过抑制内皮细胞增生、血管分支形成和促进血管功能完善来抑制病理性血管的过度发生[9]。在使用Dll4抑制剂阻断Dll4/Notch通路后,可促进血管内皮细胞的新生血管出芽和血管分支形成,从而导致肿瘤组织中病理性新生血管密度增加[10]。而过表达Dll4激活Dll4/Notch通路可以减少肿瘤内新生血管密度,抑制肿瘤生长[11]。同样在眼底疾病的研究中,阻断Dll4/Notch通路将加重脉络膜病理性新生血管的生成,而外源性激活该通路则抑制眼底血管的生长[12]。由此可见,Dll4/Notch通路是体内调控病理性血管新生的重要通路,基于该通路的各种治疗手段将为抗血管新生的治疗带来新方向。
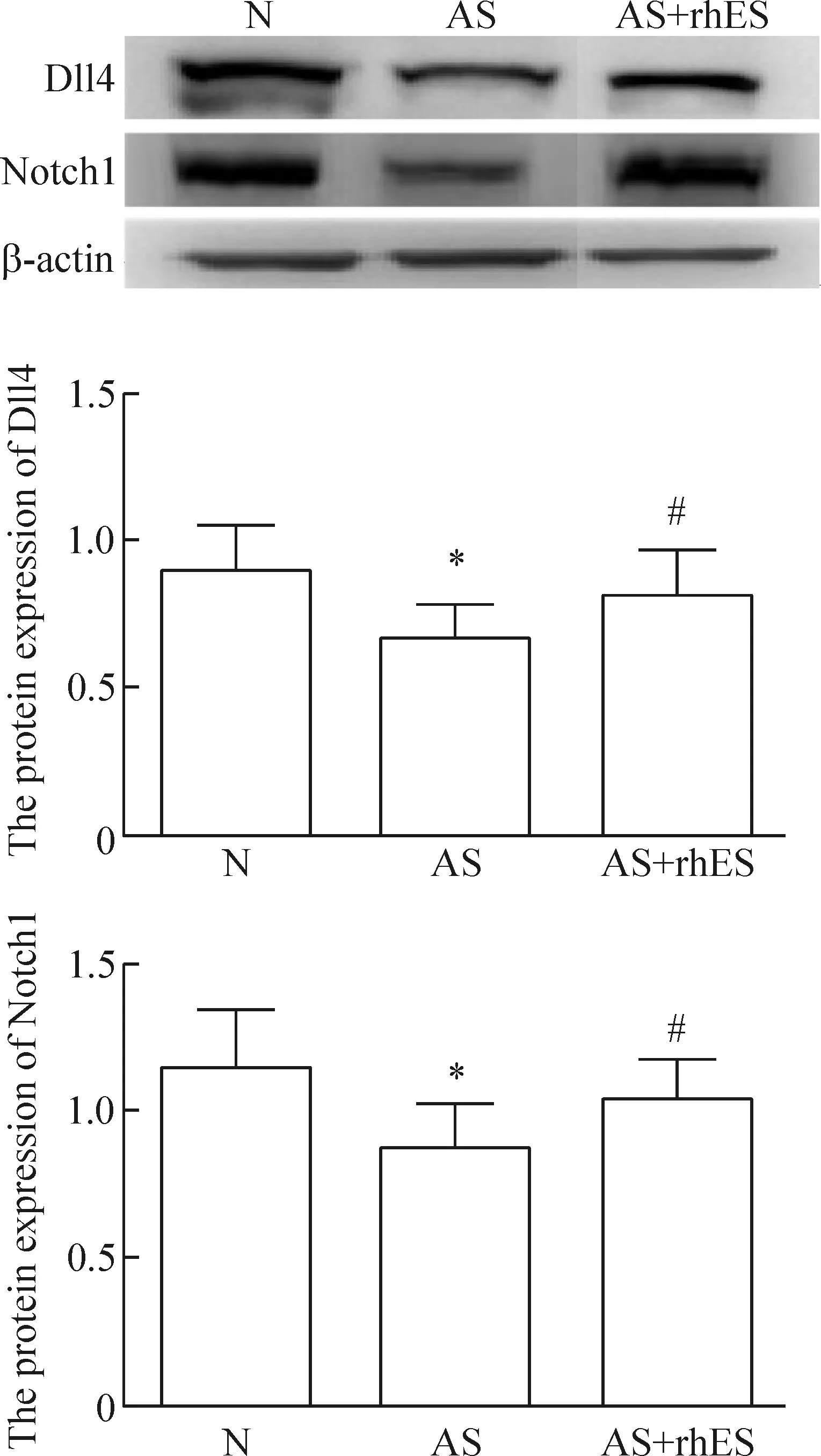
Figure 2.The protein expression of Dll4 and Notch1 in 3 groups. Mean±SD.n=10.*P<0.05vsN;#P<0.05vsAS.
图2 各组主动脉Dll4和Notch1的蛋白表达
鉴于Dll4/Notch通路调控病理性血管新生的重要意义,我们首次将其纳入AS斑块内新生血管的研究当中。我们首先发现,rhES能有效抑制AS大鼠模型主动脉斑块内血管新生,该作用与血脂、炎症因子的变化无关。我们还发现,较之对照组,AS模型组的Dll4和Notch1蛋白表达水平显著降低,提示两者表达的异常可能是加速AS斑块内血管新生的原因;而在rhES干预后,相比模型组,Dll4和Notch1蛋白表达均显著升高,提示rhES可能通过激活Dll4/Notch通路抑制大鼠AS斑块内新生血管形成。本研究在国内外首次发现Dll4/Notch通路参与了rhES抑制AS斑块内血管新生这一过程,这一发现为AS的抗血管新生治疗提供了更多的理论和实验依据,也为AS的防治研究提供了新的思路。但Dll4/Notch通路在斑块内血管新生这一病理过程中究竟发挥了怎样的作用,Dl14/Notch通路是否是调控rhES抗血管新生的具体信号机制,还需要进一步研究。
[1] Staub D, Schinkel AF, Coll B, et al. Contrast-enhanced ultrasound imaging of the vasa vasorum: from early atherosclerosis to the identification of unstable plaques[J]. JACC Cardiovasc Imaging, 2010, 3(7):761-771.
[2] Finn AV, Jain RK. Coronary plaque neovascularization and hemorrhage: a potential target for plaque stabilization?[J]. JACC Cardiovasc Imaging, 2010, 3(1):41-44.
[3] Mao W, Kong J, Dai J, et al.Evaluation of recombinant endostatin in the treatment of atherosclerotic plaques and neovascularization in rabbits[J]. J Zhejiang Univ Sci B, 2010, 11(8):599-607.
[4] Xu X, Mao W, Chai Y, et al. Angiogenesis inhibitor, endostar, prevents vasa vasorum neovascularization in a swine atherosclerosis model[J]. J Atheroscler Thromb, 2015, 22(10):1100-1112.
[5] Ahmad I, Balasubramanian S, Del Debbio CB, et al. Regulation of ocular angiogenesis by Notch signaling: implications in neovascular age-related macular degeneration[J]. Invest Ophthalmol Vis Sci, 2011, 52(6):2868-2878.
[6] Yan M, Plowman GD. Delta-like 4/Notch signaling and its therapeutic implications[J]. Clin Cancer Res, 2007, 13(24):7243-7246.
[7] Kume T. Novel insights into the differential functions of Notch ligands in vascular formation[J]. J Angiogenes Res, 2009, 1:8.
[8] Hu XB, Feng F, Wang YC, et al. Blockade of Notch signaling in tumor-bearing mice may lead to tumor regression, progression, or metastasis, depending on tumor cell types[J]. Neoplasia, 2009, 11(1):32-38.
[9] Suchting S, Freitas C, le Noble F, et al. The Notch ligand Delta-like 4 negatively regulates endothelial tip cell formation and vessel branching[J]. Proc Natl Acad Sci U S A, 2007, 104(9): 3225-3230.
[10]Hellstrom M, Phng LK, Hofmann JJ, et al. Dll4 signaling through Notch1 regulates formation of tip cells during angiogenesis[J]. Nature, 2007, 445(7129): 776-780.
[11]Noguera-Troise I, Daly C, Papadopoulos NJ, et al. Blockade of Dll4 inhibits tumour growth by promoting non-productive angiogenesis[J]. Nature, 2006, 444(7122):1032-1037.
[12]Ahmad I, Balasubramanian S, Del Debbio CB, et al. Regulation of ocular angiogenesis by Notch signaling: implications in neovascular age-related macular degeneration[J]. Invest Ophthalmol Vis Sci, 2011, 52(6):2868-2878.
(责任编辑: 陈妙玲, 罗 森)
Inhibitory effect of recombinant human endostatin on angiogenesis in atherosclerotic plaque of rats by regulating Dll4/Notch pathway
CAI Hong-wen, ZHU Min, ZHOU Xin-bin, MIAO Jing, QIU Yuan-gang, MAO Wei
(DepartmentofCardiology,TheFirstAffiliatedHospitalofZhejiangChineseMedicalUniversity,Hangzhou310006,China.E-mail:chwzju2002@163.com)
AIM: To observe the inhibitory effect of recombinant human endostatin (rhES) on plaque angiogenesis, and to explore the regulatory mechanism of Dll4/Notch pathway in the anti-angiogenic effect of rhES. METHODS: Male Wistar rats were randomized into 3 groups: normal control group (N group), atherosclerotic model group (AS group), and rhES treated group (AS+rhES group). The rats in N group were fed a normal diet, while the remaining 2 groups were established to atherosclerotic rat model via high-cholesterol diet, intraperitoneal injection of vitamin D3and aortic balloon injury. The rats in AS+rhES group received intraperitoneal injection of rhES. The blood total cholesterol (TC), triglyceride (TG), low-density lipoprotein cholesterol (LDL-C), C-reactive protein (CRP), interleukin-1 (IL-1) and troponin I (TnI) were measured. The atherosclerotic abdominal aortas were taken for pathological observation. Immunohistochemical staining was used to measure the density of neovessels in the plaques, which were marked by CD31. The protein levels of Dll4 and Notch1 in the aortas were analyzed by Western blot. RESULTS: The levels of blood TC, TG, LDL-C, CRP and IL-1 in AS group and AS+rhES group were much higher than those in N group (P<0.05), and no statistical difference between AS group and AS+rhES group was observed. The expression of CD31 in AS group was the highest among all groups. Compared with AS group, the density of neovessels in the plaques of AS+rhES group decreased significantly (P<0.05). The protein expression of Dll4 and Notch1 in AS group was lower than that in N group (P<0.05). Compared with AS group, the protein expression of Dll4 and Notch1 increased significantly (P<0.05). CONCLUSION: rhES has the ability to inhibit plaque angiogenesis in rats. The activation of Dll4/Notch pathway may be the mechanism of rhES in inhibiting plaque angiogenesis.
Recombinant human endostatin; Atherosclerosis; Dll4/Notch pathway; Angiogenesis
杂志网址: http://www.cjpp.net
1000- 4718(2016)09- 1700- 04
2016- 01- 11
2016- 07- 03
浙江省中医药科研基金项目(No. 2013ZA054);浙江省医药卫生研究计划(No. 2013KYB186)
△通讯作者 Tel: 0517-86620295; E-mail: chwzju2002@163.com
R363.2
A
10.3969/j.issn.1000- 4718.2016.09.028

