新生大鼠海马神经干细胞的分离培养及分化研究
苗宗宁,吴卫江,钱寒光,赵基栋
(江苏无锡市第三人民医院,江苏 无锡214041)
1 引 言
神经干细胞(neural stem cells,NSCs)是一类起源于神经外胚层,具有自我更新能力并在一定条件下分化为神经元和胶质细胞的多潜能干细胞[1-3]。胚胎期和成人中枢神经系统均发现有神经干细胞,其存在于特殊的niches中,通过自分泌或旁分泌的方式可以产生多种神经细胞因子,神经递质等特异性的功能蛋白[4-5]。研究表明移植NSCs可有效地修复损伤的脊髓组织,重建神经间的连接,治疗脊髓损伤(spinal cord injury,SCI)[6-9]。NSCs主要存在于哺乳动物侧脑室的室管膜下区和海马的齿状回颗粒下层以及脊髓中央管室管膜区等[10]。本实验采用无血清培养法进行新生大鼠海马NSCs体外分离培养,观察其在体外增殖、分化等一系列细胞形态学变化,为细胞移植治疗SCI提供有效的细胞来源。
2 材料与方法
2.1 实验动物
新生SD大鼠,由江苏省血吸虫病防治研究所提供,许可证号SCXK(苏)2007-0021。
实验试剂及材料:DMEM/F12培养基,胎牛血清,Penicillin-Streptomycin,StemPro Accutase(Gibco);B-27(Invitrogen);表皮生长因子,碱性成纤维细胞生长因子(Pepro Tech);兔抗大鼠nestin单克隆抗体,兔抗大鼠GFAP单克隆抗体,兔抗大鼠NSE多克隆抗体,FITC标记的山羊抗兔Ig G(abcam);DAPI,多聚赖氨酸(Sigma);IX-71荧光显微镜(O-lympus);CKX41倒置显微镜(Olympus);培养瓶,离心管,移液管(Corning);sABC试剂盒(BOSTER);CO2细胞培养箱(Thermo)。
2.2 方法
2.2.1 新生大鼠海马神经干细胞分离培养及鉴定 取新生SD大鼠(出生24 h以内),颈椎脱臼法处死,碘酒浸泡1 min后75%乙醇漂洗3次×2 min/次。剪开头皮及颅骨,在解剖显微镜下,分离出海马区脑组织。用显微镊剥除脑膜及血块并用预冷的D-Hank’s液漂洗2次,用眼科剪剪碎,Accutase蛋白酶37℃消化3 min,用弯头滴管轻柔吹打,制成单细胞悬液,1 000 r/min离心3 min,弃去上清液收集沉淀细胞,加入3 ml完全培养基(DMEM/F-12+2%B-27+1%Penicillin-Streptomycin+20 ng/ml EGF+20 ng/ml bFGF),混匀后接种于12.5 cm2培养瓶,37℃、5%CO2、饱和湿度条件下静置培养,第三天开始每3天更换培养液1次,2周左右传代1次。
换液时将培养瓶中培养液轻轻混匀后移至离心管,800 r/min离心3 min,吸出一半上清液,加入一半37℃预温的完全培养基,混匀后接种至培养瓶。
传代时将培养瓶中培养液轻轻混匀后移至离心管,1 000 r/min离心3 min,吸出上清液,加入 Accutase蛋白酶37℃消化3 min,加入5 ml完全培养基,用弯头滴管轻柔吹打,800 r/min离心3 min,弃去上清液收集沉淀细胞,加入完全培养基,按照1∶3的比例传代培养。
鉴定时无菌条件下取多聚赖氨酸包被的盖玻片,置于6孔板内,收集第三代NSCs,接种到盖玻片上,培养3天后,取出盖玻片,D-Hank’s液漂洗2次,4%多聚甲醛固定30 min,PBS漂洗3次后山羊血清封闭20 min,弃血清加入兔抗大鼠nestin单克隆抗体(1∶1000),37℃孵育 2 h,PBS漂洗 3次后加入FITC标记的山羊抗兔 Ig G(1∶1 000),37℃避光反应30 min,PBS漂洗后荧光显微镜下观察。
2.2.2 新生大鼠海马神经干细胞诱导分化及鉴定 无菌条件下取多聚赖氨酸包被的盖玻片,置于6孔板内,收集第三代 NSCs,应用诱导培养基(DMEM/F-12+10%FBS+2%B-27+1%Penicillin-Streptomycin+20 ng/ml EGF+20 ng/ml bFGF)接种到盖玻片上,每天在倒置显微镜下观察细胞形态。培养7天后,取出盖玻片,D-Hank’s液漂洗2次,4%多聚甲醛固定30 min,PBS漂洗3次后山羊血清封闭20 min,弃血清,分别加入兔抗大鼠GFAP单克隆抗体(1∶500)和兔抗大鼠NSE多克隆抗体(1∶500),37℃孵育 2 h,PBS漂洗 3次后加入FITC标记的山羊抗兔 Ig G(1∶1 000),37℃避光反应30 min,PBS漂洗后加入终浓度为100 ng/ml DAPI溶液避光状态下行细胞核染色5 min,PBS漂洗后荧光显微镜下观察。
3 结果
3.1 新生大鼠海马神经干细胞分离培养及鉴定
从海马组织分离的细胞原代接种后,在显微镜下观察可见细小组织团块以及单个细胞,细胞悬浮生长,多呈圆形,大小不一,折光性强。接种2~3天后,可见细胞碎片增多,部分细胞贴壁,随着时间的推移,悬浮细胞集聚成小细胞团,逐渐长成由细胞组成的桑葚状细胞球,部分细胞球因体积过大出现细胞球中心颜色暗淡、透光性较差。体外传代培养后,死亡细胞以及组织碎片减少,可见典型神经球形成,免疫荧光染色结果显示神经球中有大量nestin阳性细胞存在,见图1。

图1 新生大鼠海马神经干细胞分离培养及鉴定。A.原代培养3天 ×40;B.原代培养10天 ×100;C.传代培养7天 ×200;D.E NSCs免疫荧光染色显示nestin阳性细胞 ×100。Fig 1 Isolation culture and identification of the newborn rat hippocampal neural stem cells.A.The morphology of primary generation cells at 3 days×40;B.The morphology of primary generation cells at 10 days×100;C.The morphology of subculture cells at 7 days×200;D-E.NSCs immunofluorescence staining show nestin positive cells×100.
3.2 新生大鼠海马神经干细胞诱导分化及鉴定
用含血清培养基培养NSCs后,显微镜下可见NSCs球很快贴壁,24 h后大量贴壁生长细胞从NSCs球周围长出。开始阶段由于细胞密度大,以NSCs球为中心向四周放射状成片生长,随着培养时间的延长,边缘部位细胞突起逐渐变长、增多,与相邻的细胞构成网状结构,细胞中既有具有多个长突起的神经胶质样细胞,也有具有短突起的神经元样细胞,见图2。免疫荧光染色结果可见大量GFAP阳性细胞及NSE阳性细胞,见图3。

图2 NSCs诱导分化后细胞形态变化A.分化3天 ×40;B.分化7天 ×40;C.分化10天 ×100;D.分化14天 ×100。Fig 2 The cell morphological changes after NSCs differentiation at day 3,7,10 and 14
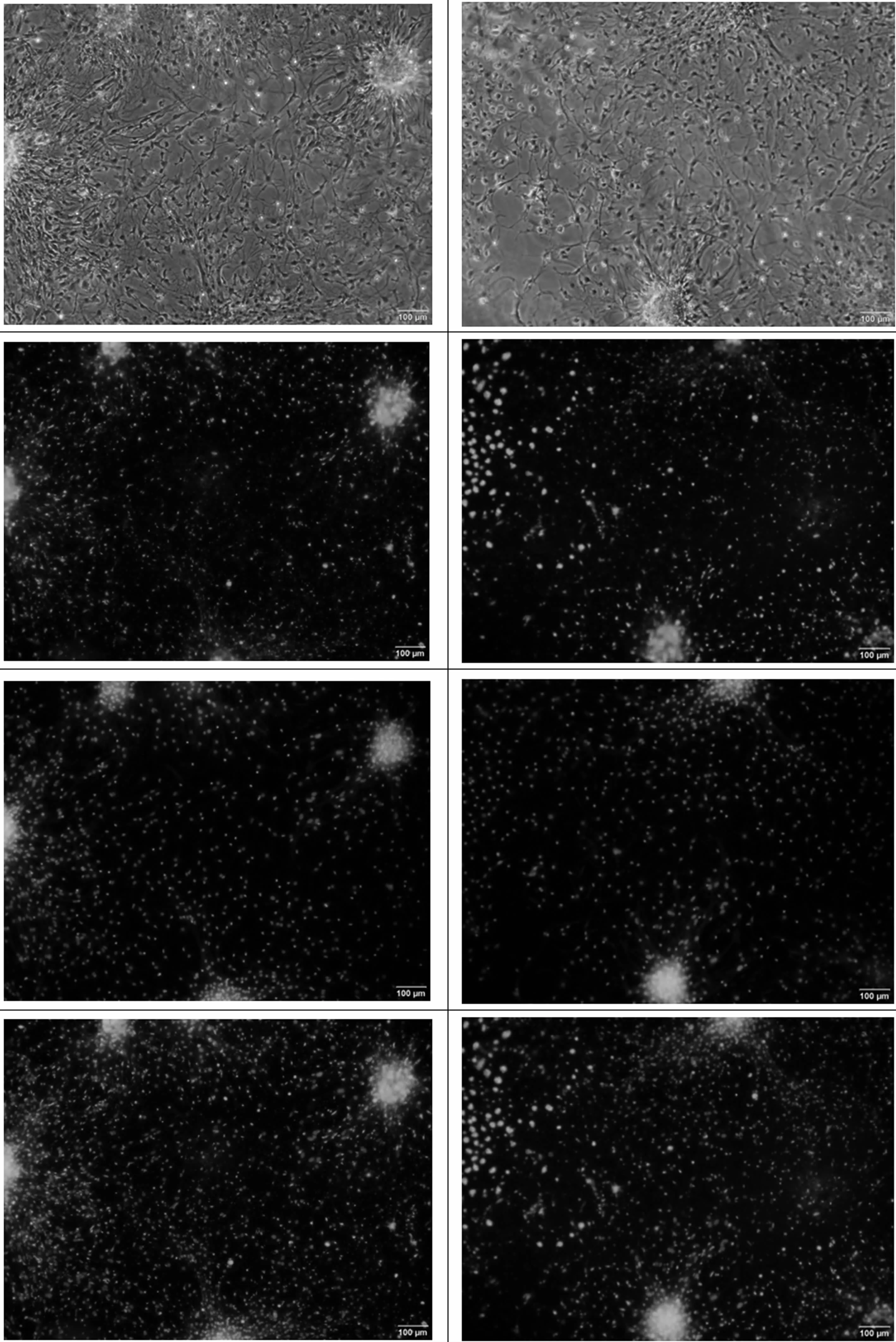
图3 NSCs诱导分化后免疫荧光染色GFAP和NSE表达。Bar=100μmFig 3 The expression of NSE and GFAP identify by immunofluorescence staining after NSCs differentiation.Bar=100μm
4 讨论
神经干细胞是一类原始的未分化的多潜能干细胞,具有自我更新能力,主要向神经系统方向分化,如神经元、星形胶质细胞、少突胶质细胞等,存在于海马齿状回和室管膜下区等区域[11-12],在SCI治疗的相关研究中,NSCs移植受到广泛关注,此类方法多是通过促进移植到SCI部位的外源性NSCs有效地向神经元分化,促进脊髓重建及神经修复的作用[13-14]。因此,获取大量NSCs并建立稳定的分离培养方法尤为重要。本实验从新生大鼠海马组织分离并培养了NSCs,体外可以增殖,通过条件培养基可以诱导分化为神经元和神经胶质细胞,为进一步研究NSCs体内移植后的分化和NSCs治疗SCI提供了前期的技术支持。
研究表明不同部位来源的中脑神经干细胞具有不同的生物学特性,即具有“区域特异性”[14]。本实验对新生小鼠海马神经干细胞进行了分离培养,由于新生小鼠海马组织体积非常小,因此,建立适合的分离培养方法就很重要。神经干细胞原代分离主要采用酶消化法和机械吹打法,研究表明酶消化过程和机械打散都对细胞的活性造成不利影响,常见的胰蛋白酶通过水解细胞间的蛋白质使细胞分离,但其消化能力较强,容易造成细胞膜上的蛋白质也被消化,进而释放其核内的DNA,而这些DNA具有很强的黏性,会将分离消化的单细胞黏附在一起,从而引起细胞的损伤和死亡。机械吹打可以避免细胞膜被消化,但不易掌握吹打的次数和力度,可造成细胞膜的机械损伤,导致细胞活性下降及死亡[15]。这说明需要改进消化过程,例如换用消化能力更加温和的酶,并且减少吸管吹打。研究发现accutase消化酶通过化学解离的方法来分散组织,在细胞培养中的损伤作用具有非特异性[16]。本实验中采用accutase来分散海马组织和神经球进行原代和传代分离培养,并辅以轻微的机械吹打,尽可能减少对细胞的损伤。由于海马组织体积很小,分离后不通过滤网过滤而直接培养,死亡细胞以及组织碎片通过更换培养液以及液化作用可以缓慢去除,这样可以尽可能保留存活细胞。
目前主要通过悬浮培养法体外培养NSCs,这是保持NSCs干性的重要条件[17-18]。EGF主要是维持干细胞的长期存活生长,可以促进NSCs进行对称性分裂,产生的子代细胞均可继续分裂。B-27、bFGF则起到维持细胞悬浮、抑制神经干细胞分化的作用,bFGF还可促进NSCs进行非对称性分裂,所产生的子代细胞中只有一个细胞能够继续分裂。bFGF与EGF同时应用,bFGF可以显著加强EGF的作用[19-21]。本实验以 DMEM/F12为基础培养基,辅以B27添加剂,同时加入bFGF及EGF构成完全培养基,成功培养出NSCs,并进行了有效地增殖和分化。
Nestin是一种中间丝蛋白成分,属于第Ⅵ类中间丝蛋白,仅在胚胎早期神经上皮表达,当神经前体细胞向终末方向分化为神经元和胶质细胞时,Nestin便停止表达,故最常用来鉴定 NSCs[22]。NSE和GFAP均为一种胞浆蛋白,NSE主要表达于神经元。GFAP属Ⅲ型中间丝蛋白家族成员,在活化的星型胶质细胞中大量特异性表达[23]。实验中培养的神经球经免疫荧光染色可见大量Nestin阳性细胞存在,表明成功培养出未分化的NSCs。神经球用体积分数为10%胎牛血清的培养基培养后,可见神经球贴壁后向四周延伸出多个突起,逐步形成相互连接,交错成网,NSE和GFAP染色显示阳性,说明神经干细胞在一定条件下可以分化为神经元和星形胶质细胞。实验选取新生大鼠海马组织进行体外分离培养,尽管优化了取材方法,仍无法避免杂细胞,因此取材与培养方法需要进一步改进,从而快速、精确的获取NSCs。

