四种聚酰胺-胺树状大分子制剂逆转人乳腺癌MCF-7/ADR细胞对阿霉素耐药性的研究
孙冬妮,牛垒
鞍山卫生学校药理教研室,辽宁鞍山114001
四种聚酰胺-胺树状大分子制剂逆转人乳腺癌MCF-7/ADR细胞对阿霉素耐药性的研究
孙冬妮,牛垒
鞍山卫生学校药理教研室,辽宁鞍山114001
目的探讨带有不同电荷及配体的树状大分子(PAMAM)对逆转人乳腺癌MCF-7/ADR细胞多药耐药(MDR)的影响。方法以阿霉素为模型药,比较了四种载药大分子(G 3.5/DOX,G 4.0/DOX,PEG-G 4.0/DOX,FA-G 4.0/DOX)对MCF-7/ADR细胞的细胞毒作用。结果四种大分子制剂的细胞毒均高于DOX溶液,FA-G 4.0(6.74 μg/mL)最强,其逆转倍数达到5.07。与大分子制剂孵育2h后,MCF-7/ADR细胞中阿霉素浓度大小为FA-G 4.0/DOX>G 4.0/DOX≈G 3.5/DOX>PEG-G 4.0/DOX>DOX溶液。结论四种大分子制剂均可一定程度地克服MCF/ADR细胞的耐药性,G 3.5/DOX、G 4.0/DOX、PEG-G 4.0/DOX对MDR的影响没有显著区别,FA-G 4.0/DOX克服MDR的效果最好。
树状大分子;人乳腺癌耐阿霉素细胞;多药耐药;P-gp;叶酸靶向
多药耐药(multidrug resistance,MDR)是肿瘤细胞对一种化疗药物产生抗药性的同时,对其他结构和作用机制不同的抗肿瘤药产生交叉耐药性,是最重要、最常见的肿瘤耐药现象[1]。其中P-gp的过度表达是多药耐药形成的主要机制[2]。目前普遍解决的方法是使用P-gp抑制剂,如维拉帕米、环孢菌素A、等,P-gp抑剂能加强底物药物的生物利用度,但是一般P-gp抑制剂本身具有生物活性,同时具有一定的不良反应。近年来,众多研究表明纳米载体可以克服MDR,如脂质体[3]、聚合物纳米粒[4]、胶束载体[5]等。聚酰胺胺(PAMAM)树状大分子[6]作为新型的一种纳米胶束给药系统,具有无遗传毒性,无免疫原性等特点,作者使用的PAMAM是以乙二胺为核,3.5代树状大分子G 3.5以酯基封端,G 4.0以氨基封端,利用G 4.0分别制备具有长循环作用和叶酸靶向的树状大分子,初步探讨了电荷和配体对MDR逆转的影响。
1 仪器与材料
细胞株:人乳腺癌细胞MCF-7(实验室培养),人乳腺癌耐阿霉素细胞MCF-7/ADR(上海佛雷堡生物科技有限公司)。酶标仪(TECAN SPECTRA)(德国Wetzlar公司),ARX-300型核磁共振波谱仪(瑞士Bruker公司),Bruker vector 22型红外光谱测定仪(瑞士Bruker公司),G 3.5/DOX,G 4.0/DOX,PEG-G 4.0/DOX,FA-G 4.0/DOX(自制)等。
2 方法与结果
2.1载阿霉素树状大分子对MCF-7/ADR细胞耐药性逆转的比较
2.1.1空白树状大分子对MCF-7/ADR细胞的细胞毒作用取对数生长期MCF-7/ADR细胞,以10 000 cells/100 μL的密度分别接种于96孔培养板,37℃,5%CO2条件下培养24h,分别给予四种空白大分子100 μL/孔,使四种空白大分子在培养液中的终浓度为:1 μg/mL、5 μg/mL、15 μg/mL、25 μg/mL。每一浓度平行3孔,培养48h后,每孔加5 mg/mL MTT溶液20 μL,孵箱中培养4h后,去培养液,加DMSO 150 μL/孔,震荡10 min,在波长492 nm处测OD值,计算细胞抑制率,结果见Fig.1。

Fig.1 The cytotoxicity of blank G 3.5,G 4.0,PEG-G 4.0,FA-G 4.0 in MCF-7/ADR
2.1.2载药大分子对耐药细胞的细胞毒作用取对数生长期MCF-7/ADR细胞,以10 000 cells/100 μL的密度分别接种于96孔培养板,37℃,5%CO2条件下培养24h,分别给予四种载药大分子和DOX溶液100 μL/孔,使药物在培养液中的终浓度为:3、9、18、24 μg/mL。每一浓度平行3孔,培养48h后,每孔加5 mg/mL MTT溶液20 μL,孵箱中培养4h后,去培养液,加DMSO 200 μL/孔,震荡10 min,波长490 nm处测OD值,计算细胞抑制率,结果见Fig.2。
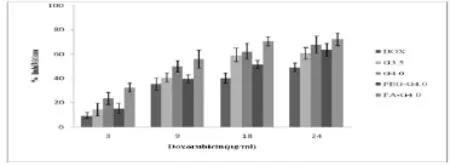
Fig.2 The cytotoxicity of DOX-loaded G 3.5,G 4.0,PEG-G 4.0,FA-G 4.0 in MCF-7/ADR
图2可以看出载药大分子对MCF-7/ADR细胞抑制率的大小为:FA-G 4.0>G 4.0>PEG-G 4.0≈G 3.5>DOX。根据公式:逆转倍数(Resistance Reversion Index RRI)=DOX组IC50/制剂组IC50。计算:FA-G 4.0对MCF-7/DOX的IC50为6.74 μg/mL,逆转倍数为5.07。
2.1.3MCF-7/ADR细胞对载药树状大分子的摄取细胞以1×106cells/mL种于12孔板,每孔2 mL细胞悬液。将DOX溶液和载药大分子加入细胞悬液中,使药物终浓度分别为6、12、18 μg/mL,每一浓度平行3孔,细胞孵育2小时后,去培养液,冷PBS洗3遍,200 μL胰酶消化细胞,1 mL的纯水悬浮细胞。探头超声(400 w超声8 min),10 000 rpm离心5 min,取上清液,在激发波长为497 nm,发射波长为555 nm条件下,利用荧光分光亮度计测定DOX的浓度。结果见Fig.3。

Fig.3 The intracellular DOX amount in MCF-7/ADR after incubation with different concentrations of DOX formulations for 2h
3 讨论
①载药大分子对MCF-7/ADR细胞抑制率的大小为:FA-G 4.0>G 4.0>PEG-G 4.0≈G 3.5>DOX。根据公式:逆转倍数(Resistance Reversion Index RRI)=DOX组IC50/制剂组IC50。计算:FA-G 4.0对MCF-7/DOX的IC50为6.74 μg/mL,逆转倍数为5.07。研究表明阳离子会扰乱细胞膜,进而导致细胞凋亡,这种阳离子结构所引起细胞毒性可能是带负电的细胞膜和带正电的载体间静电相互作用的结果。表面带正电的大分子对Caco-2细胞的毒性比带负电的大分子低的多,表面带负电的大分子浓度达到2 mg/mL时也没有溶血和细胞毒性。因此G4.0相对于G3.5、PEG-G 4.0,对MCF-7/ADR细胞的细胞毒作用更强。
②目前研究认为PAMAM类高分子复合物的细胞摄取通过以下四种途径发生:一是通过胞饮作用形成被膜包围的囊泡;二是吸附性的细胞内吞作用;三是受体介导的细胞内吞作用;四是吞噬作用。所以大分子制剂进入细胞,是通过非P-gp依赖的途径,避过了P-gp的外排作用,增加了细胞内药物的含量,一定程度上克服了MDR。用FA修饰PAMAM分子,形成FA-G 4.0,其进入细胞的方式也发生了改变,是透过受体介导的细胞内吞作用,主动被细胞摄取的,因此将特异性靶向细胞的配体与药物载体结合,载体能特异性的被靶向细胞表面的受体识别并结合,避过P-gp的外排作用,增强细胞对药物的摄取。
综上所述,PAMAM是一种具有良好克服肿瘤多药耐药性应用前景的纳米载药系统。该实验对四种载药大分子(G3.5/DOX,G 4.0/DOX,PEG-G 4.0/DOX,FA-G 4.0/DOX)对逆转人乳腺癌MCF-7/ADR细胞多药耐药(MDR)的影响进行研究,使纳米载体在克服肿瘤多药耐药方面有了更大的突破。带有不同电荷及配体的PAMAM有可能在体内作用时表现出更强的多药耐药作用,其在体内的研究将是我们研究的进一步主题,可望在体内试验中达到较好的抗MDR肿瘤治疗效果。
[1]王海,许立峰,张超.载紫杉醇PLGA/F68纳米粒逆转多药耐药用于乳腺癌的治疗[J].生物医学工程与临床,2013,17(1):17-21.
[2]Ting Chen,Changyuan Wang.Dasatinib reverses the multidrug resistance of breast cancer MCF-7 cells to doxorubicin by downregulaing P-gp expreesion via inhibiting the activation of ERK signaling pathway[J].Biology&Therapy,2015,16(1):106-114.
[3]周文菁,周望,等.阿霉素脂质体对克服肿瘤多药耐药的细胞学体外评价[J].中国医院药学杂志,2012,32(17):1349-1352.
[4]吴俊,严新,等.阿霉素-姜黄素聚氰基丙烯酸正丁酯复方纳米粒的研制及逆转MCF-7/ADR细胞多药耐药的研究[J].中国生物工程杂志2013,33(5):35-43.
[5]谢鑫,余敬谋,等.载阿霉素胶束对乳腺癌多药耐药MCF-7/ADR细胞的逆转作用[J].中国医院药学杂志,2013,33(8):597-600.
[6]李晓琳,胡海梅.聚酰胺-胺形树状大分子表面修饰的研究进展[J].广东药学院学报,2014,30(2):253-257.
Research on the Resistance of Four Polyamidoamine Dendrimers Formulation in Reversing Human Breast Carcinoma MCF-7/ADR Cells to Adriacin
SUN Dong-ni,NIU Lei
Pharmacology Teaching and Research Room,Anshan Health School,Anshan,Liaoning Province,114001 China
Objective To study the effect of dendrimers with different charges and ligands on the multidrug resistance of reversinghuman breast carcinoma MCF-7/ADR cells.Methods The cytotoxic effects of four drug loaded macromoleculars(G 3.5/DOX,G 4.0/DOX,PEG-G 4.0/DOX,FA-G 4.0/DOX)on the MCF-7/ADR cell were compared by taking adriacin as model drugs.Results The cellular poison formulated by four macromoleculars washigher than DOX solution,and FA-G 4.0(6.74 μg/mL)was the strongest,and its reversal index reached 5.07,after 2h incubation of macromolecular formulation,the adriacin concentration in MCF-7/ADR cell was FA-G 4.0/DOX>G 4.0/DOX≈G 3.5/DOX>PEG-G 4.0/DOX>DOX solution.Conclusion Four macromolecular formulations can overcome the resistance of MCF/ADR cells to a certain degree,and there is no obvious difference in the effect of G 3.5/DOX,G 4.0/DOX,PEG-G 4.0/DOX on MDR,and the effect of FAG 4.0/DOX in overcoming MDR is the best.
Dendrimer;Human breast cancer adriacin cell;Multidrug resistance;P-gp;Folate-targeted
R96
A
1672-5654(2016)08(c)-0115-03
10.16659/j.cnki.1672-5654.2016.24.115
孙冬妮(1973-),女,满族,辽宁鞍山人,硕士研究生,讲师,主要从事于药理方面的研究与教育工作。
(2016-05-26)

