金刚烷胺对双侧轻型脑损伤大鼠的神经保护作用研究
王涛 史铁钧 林伟 贾云凤 刘文鹏 王培新 崔绍杰
(1解放军第306医院神经外科,北京 100101; 2第四军医大学西京医院神经外科,陕西 西安 710032)
·论著·
金刚烷胺对双侧轻型脑损伤大鼠的神经保护作用研究
王涛1史铁钧1林伟2贾云凤1刘文鹏1王培新1崔绍杰1*
(1解放军第306医院神经外科,北京 100101;2第四军医大学西京医院神经外科,陕西 西安 710032)
目的探讨金刚烷胺对双侧轻型颅脑损伤后神经细胞的保护作用,并对不同剂量金刚烷胺进行药效学分析。方法建立大鼠液压脑损伤模型,56只大鼠随机分为4组,分别于伤后每8 h一次,连续16 d给予三组剂量(15 mg/kg、45 mg/kg或135 mg/kg)金刚烷胺或等渗盐水,首次给药于伤后1 h完成。脑组织于伤后第48小时或16天提取行Fluoro Jade-B组织荧光染色或甲酚紫染色比较双侧海马CA3区神经细胞存活情况,液相色谱-质谱/质谱(LS-MS/MS)方法测定大鼠体内不同剂量金刚烷胺血药浓度,研究金刚烷胺经腹腔单次给药后在大鼠体内的药代动力学过程。结果45 mg/kg或135 mg/kg两组治疗剂量在大鼠体内血药浓度与临床治疗监测浓度(717 ng/ml)相似。与安慰剂组相比,45或135 mg/kg两组剂量金刚烷胺可明显减少伤后48 h脑组织急性变性神经元数量(Plt;0.05),高剂量组(135 mg/kg)CA3区长期存活神经细胞数量显著增加(P=0.032)。结论治疗剂量金刚烷胺可显著减轻脑损伤后海马结构CA3区神经细胞损伤程度,为临床治疗轻型颅脑损伤提供新的治疗手段。
创伤性颅脑损伤; SD大鼠; 海马; 神经细胞; 药代动力学
近年来,反复性轻型颅脑损伤(repeated mild traumatic brain injurys, rmTBI)已越来越引起研究人员的关注,特别是对于运动员和军人等一些反复轻型脑外伤发生的高比例人群。目前的临床及实验室证据表明,rmTBI可导致不可逆脑损伤。金刚烷胺(amantadine, AMT)临床上主要用于抗病毒及帕金森症治疗,前期研究已证实其可参与多种神经细胞保护机制,有效促进脑损伤后长期意识障碍患者的康复[1,2]。作者选择不同剂量AMT,通过神经组织学染色和药代动力学方法观察不同剂量金刚烷胺对rmTBI大鼠的神经保护作用。
材料与方法
一、实验对象及药物准备
56只成年SD大鼠,体重约(300±15)g,按随机数字法分为四组,A组:损伤+等渗盐水,12只;B组:损伤+金刚烷胺 15 mg/kg,12只;C组:损伤+金刚烷胺 45 mg/kg,13只;D组:损伤+金刚烷胺135 mg/kg,13只。损伤前后详细记录大鼠的生命指标。金刚烷胺(美国Sigma-Aldrich公司, #A1260) 溶解于等渗盐水中,按1 ml/kg换算公式通过腹腔注射给予大鼠体内,首次给药于伤后1 h完成。
二、液压打击损伤动物模型制备
大鼠麻醉后置于手术台,于中线旁3 mm ,前囱后4.5 mm行双侧开颅钻孔术,连接侧方液压打击装置。本实验中打击强度约为1.35 kPa,打击间隔1 min。记录损伤前后体温及脑温变化。同时记录大鼠术后复苏时间,作为推测损伤强度的另一指标。
三、脑组织标本提取、固定及切片制备
大鼠分别于伤后48 h或16 d深度麻醉,经40 g/L多聚甲醛溶液固定脑组织。将选定范围内(前囱后2.4~5.2 mm)脑组织冰冻后连续冠状切片(厚度45 μm)。每隔5张共选取10张贴于已处理的载玻片上,行后续组织学染色。
四、神经组织学染色
组织切片分别用于Fluoro Jade-B组织荧光染色(急性变性神经元)和甲酚紫染色(长期存活神经细胞)。观察区域限定于双侧海马结构CA3区,其一端以上下末端颗粒细胞进入齿状突为界,另一端以锥体细胞层变窄交界区域为界。
1.Fluoro Jade-B组织荧光染色:组织切片经梯度水化和漂洗处理后,浸泡于6 g/L高锰酸钾溶液15 min。至此后所有操作均在昏暗光线下进行, FJ-B染色剂(FJ溶液20 ml,双蒸水180 ml,醋酸18 μl)室温染色30 min,双蒸水漂洗后37℃恒温箱过夜。中性树胶封片处理。荧光显微镜(Nikon B-2A, 日本, 尼康公司)于40倍物镜下计数荧光标记变性神经元。鉴定标准为绿色荧光、形态学清晰可见的胞体及最少可见1个树突。
2.甲酚紫组织染色:经处理后的组织切片浸泡于甲酚紫染色剂内染色6 min,盐酸酒精乙醇处理约40 s,双蒸水冲洗30 s×2次,二甲苯浸泡5 min×2次。中性树胶封片处理。100倍油镜(Nikon E600, 日本, 尼康公司)下观察神经细胞存活状态。通过细胞立体测量计数系统(Stereo InvestigatorTM8.0, 美国, MBF Bioscience公司)记录细胞数量。
五、药代动力学研究
大鼠(共6只)通过腹腔注射给予15 mg/kg AMT,分别于给药后0.25 h, 0.5 h, 1 h, 2 h, 4 h, 8 h自尾静脉缓慢采集血样约3 ml,静置20 min后2 800 r/min离心15 min,取上清液(约0.15 ml)保存于-80℃冰柜。借助液相色谱-质谱/质谱联用技术模拟本实验三组剂量AMT间隔8 h给药后药效学。同时,将不同剂量AMT治疗组大鼠于处死前采集血样,测定血药浓度,根据Win Nolin软件进行曲线拟合并计算代谢动力参数,采血步骤同上所述。
六、统计学分析
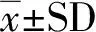
结 果
共52只实验大鼠完成本次实验:A组,9只;B组,12只;C组,13只;D组,12只。多样本均数t检验结果显示,四组大鼠在打击强度、伤后复苏时间及损伤前后温度值方面无差异。4只大鼠(A组,3只;D组,1只)因打击强度过低或伤后出现濒死状态退出实验。
一、体重变化
四组大鼠于伤后前3天体重均显著下降,伤后4~5 d后体重逐渐增加,并于伤后第11~13天内基本恢复至伤前基础体重水平。各组间伤后体重变化差异无统计学意义[F(3,21)= 1.791,P=0.166]。伤后第16天体重分别为:A组(328±24)g;B组(321±20)g;C组(324±18)g;D组(331±22)g。
二、药代动力学
AMT单剂量(15 mg/kg),单次经腹腔注射于大鼠体内,药代动力学参数见表1。通过计算血药浓度峰值(peak concentration, Cmax),血药浓度谷值(minimum concentration, Cmin),稳态浓度(average concentration, Cavg)和浓度-时间曲线下面积(area under concentration-time curve, AUC)等代谢参数模拟三组剂量AMT每8 h给药后大鼠体内药代动力学改变。结果提示15 mg/kg,45 mg/kg和135 mg/kg 三组剂量AMT大鼠体内稳态浓度分别为109 ng/ml,527 ng/ml和981 ng/ml, 45 mg/kg或135 mg/kg AMT治疗组稳态浓度与临床治疗中(100 mg, 1/12 h)人体稳态浓度(717 ng/ml)相似 (图1A)。大鼠于最后一次给药后不同时间点采集血样,结果显示AMT于大鼠体内半衰期为1.2 h,15 mg/kg,45 mg/kg和135 mg/kg三组剂量血药浓度峰值分别为1 032 ng/ml,3 981 ng/ml和11 875 ng/ml,与标准药代动力学参数一致(图1B)。
三、组织学评估
1.急性变性神经元:共20只大鼠(每组5只)于伤后48 h用于急性变性凋亡神经元观察与计数。低倍镜下可见经FJ-B荧光标记的变性神经元主要限定于损伤区域皮层及海马锥体细胞层CA3区。高倍镜下可见双侧损伤皮层及海马区域相对分布稀疏、数量较少的亮绿色荧光染色的变性神经元。细胞计数结果提示AMT治疗组较等渗盐水组表现出减少伤后48 h脑组织变性神经细胞数量的趋势,其中45 mg/kg和135 mg/kg两组剂量神经保护效果最为显著[45 mg/kg,P=0.042 ;135 mg/kg,P=0.038] (图2)。
2.长期存活神经细胞:共26只大鼠(A组, 4只; B组, 7只; C组, 8只; D组, 7只)于伤后16 d行甲酚紫染色用于长期存活神经细胞研究。所有损伤组大鼠脑组织皮层完整,无明显瘢痕组织。光镜下大体病理可见打击区域附近皮层连续性瘢痕组织和棕褐色含铁血黄素沉积软化灶形成,双侧海马锥体细胞层皱缩变窄。100倍油镜下海马CA3区细胞计数结果显示,伤后连续给予高剂量(135 mg/kg)金刚烷胺治疗组较等渗盐水组,长期存活神经细胞数量明显增加[t(9)=3.28,P=0.032] (图3)。

图1 金刚烷胺经腹腔注射入大鼠体内后药代动力学测试结果
Fig 1 Pharmacokinetics analysis for the amantadine after i.p. administration
A: Solid lines represented the simulated plasma concentration profiles at each dose, and the dashed lines represented the average plasma concentrations at steady state (Css). The solid black line represented steady level from the human clinical dose (100 mg twice daily); B: Blood was obtained at different time points post last dose. Terminal blood levels (points) were superimposed on the simulated blood levels (lines) for each dose.
图2 双侧轻型创伤性脑损伤后48 h变性神经元Fluoro-Jade B 组织荧光染色结果
Fig 2 Fluoro-Jade B histofluorescent detection of degenerating neurons at 48 h post TBI in different treatment groups Quantification result revealed administration of MS-275 at both 45 and 135 mg/kg significantly reduced the number of degenerating neurons in the hippocampus CA3 at 48 h after TBI.
aPlt;0.05,vssaline control.
图3 不同治疗组大鼠伤后16 d甲酚紫组织染色结果
Fig 3 Cresyl violet staining neurons in different treatment groups at 16 d post TBI Stereological quantification of cresyl violet stained neurons showed more pyramidal neurons survived in the AMT-135mg/kg group compared to the saline group.
aPlt; 0.05,vssaline control.
讨 论
TBI根据伤后病程发展及生化病理改变可分为原发性和继发性损伤两个阶段。原发性损伤阶段主要指外部因素直接作用引起的神经组织损伤,其病理特征表现为发生在伤后短时间内的急性神经元变性凋亡[3],继发性损伤阶段主要发生在伤后几天至几周时间内,主要表现为进展性神经细胞死亡及神经功能失调。伤后多巴胺能神经元失活,兴奋性神经毒性氨基酸释放,级联神经炎性反应,钙离子超载及细胞膜去极化等多种生化改变均可参与到这一复杂的病理过程中去,可进一步加重颅脑损伤程度,严重者可造成永久性的神经功能缺失[4]。尽管关于颅脑损伤的基础研究已越来越引起人们的广泛关注,然而目前仍缺乏有效的药物干预治疗手段应用于临床颅脑创伤的救治。
最近一项关于184例临床重型颅脑损伤患者的随机双盲对照实验结果显示,参照伤后功能障碍等级量表(disability rating scale)评分标准,脑损伤后4~16 w给予金刚烷胺治疗患者较安慰剂治疗组伤后症状改善及神经功能恢复明显加快(0.24分/w,P=0.007)[5]。Hammond等[6]同样评估了76例脑外伤后6个月患者经金刚烷胺治疗后易怒,暴躁等精神症状改善情况,结果发现金刚烷胺治疗组较安慰剂治疗组神经精神症状量表(neuropsychiatric inventory, NPI)评分明显改善(P=0.0085),81%个体症状发作频率及程度改善至少3分以上。尽管大量临床数据证实了金刚烷胺对于TBI的神经保护潜能,但关于其动物实验的文献报道较少,先前一项垂直打击颅脑损伤模型研究显示,低剂量(10 mg/kg,腹腔注射)金刚烷胺没有明显改善大鼠伤后神经功能[7]。
金刚烷胺神经保护机制主要包括通过增加突触前多巴胺的释放及突触后多巴胺受体数量激活多巴胺能神经元活性[1,8];通过非选择性抑制N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid, NMDA)型谷氨酸受体调节兴奋性氨基酸介导的神经毒性反应[9],抑制上游促炎性因子的释放和刺激产生胶质细胞炎性神经营养因子(glial derived neurotrophic factor, GDNF)[2]等。笔者根据前期研究结果及药代动力学参数,选择了15 mg/kg,45 mg/kg,135 mg/kg三组治疗剂量,每8 h一次,连续16 d通过腹腔注射方式给予大鼠体内。结果显示本次实验金刚烷胺注入大鼠体内后其血药浓度峰值、代谢半衰期及平均稳态血药浓度与药代动力学研究所得标准参数指标一致,同时45 mg/kg和135 mg/kg两组剂量金刚烷胺在大鼠体内代谢周期和平均稳态血药浓度与临床治疗人体内浓度相似。所有损伤组大鼠在伤后致死率,全身营养状态及每日体重变化百分比等方面差异无统计学意义,可认为本研究中金刚烷胺三组给药剂量及治疗时间窗无明显全身毒副作用。
Fluoro-Jade B作为一种阴离子荧光标记物,对于各种原因导致的变性神经细胞,包括胞体、树突及轴突等细胞结构具有特异选择性和高度亲和力,常用以鉴别观察神经系统损伤所致的急性神经元变性[10]。赵学仁等[11]通过观察脑外伤后30 min到7 d不同时间点急性神经细胞变性结果发现,伤后48 h可观察到最大程度的神经元变性死亡,本实验即选择脑损伤后48 h作为观察节点,探讨了金刚烷胺对脑损伤后急性期脑组织海马CA3区急性神经细胞损伤的保护作用。与预期相符,所有损伤组双侧脑组织皮层及海马锥体细胞区均可见亮绿色荧光标记的变性神经细胞分布。定量分析结果提示45 mg/kg和135 mg/kg两组剂量治疗组伤后48 h双侧海马CA3区变性神经细胞数量较安慰剂治疗组明显减少,表现出改善颅脑损伤后脑组织急性病理进程的保护作用。
海马CA3区神经细胞生存状态作为进展期颅脑外伤后的评估标准已被得到广泛认可[12]。本实验中所应用的颅脑打击模型脑组织损伤范围主要集中于大脑边缘系统(如海马组织)及顶叶相关皮层功能区域。因此笔者选择双侧脑组织海马CA3区,通过广泛应用于神经组织的甲酚紫染色方法分别从大体组织学和神经细胞计数两方面探讨了金刚烷胺对于伤后脑组织长期生存神经细胞的保护作用,结果显示所有损伤组脑组织海马锥体细胞层可见皱缩变窄, 135 mg/kg治疗组伤后16 d脑组织海马CA3区存活神经细胞数量较安慰剂治疗组明显增加。结合金刚烷胺对于脑损伤后急性脑组织损伤程度的改善作用,可认为临床治疗剂量的金刚烷胺具有有效的神经保护作用并可参与颅脑损伤后某些病理过程中而发挥其治疗潜能。
本研究主要为金刚烷胺治疗rmTBI的药效性研究。笔者成功构建了与临床相关的rmTBI大鼠模型,并在此基础上通过神经组织学染色方法探讨了颅脑损伤后给予不同剂量金刚烷胺对于减轻伤后急性期及进展期脑组织损伤程度的保护潜能,同时通过记录伤后大鼠全身状况及体重变化等观察指标和药代动力学研究方法,进一步对本实验中金刚烷胺用药剂量及给药周期进行了安全性和有效性评估。研究证实rmTBI可造成损伤脑组织急性期神经元变性和长期存活神经细胞数量的显著下降,伤后给予有效治疗剂量的金刚烷胺可明显减轻双侧海马CA3区神经细胞变性凋亡程度,表现出对轻型颅脑损伤后海马CA3区神经细胞的保护作用。后期实验工作将继续评估金刚烷胺对于脑损伤后大鼠长期神经行为认知功能的改善作用,并深入探讨其潜在神经保护机制,最终为有效治疗临床脑损伤患者提供实验室理论参考。
1Grelak RP, Clark R, Stump JM, et al. Amantadine-dopamine interaction: possible mode of action in Parkinsonism [J]. Science, 1970, 169(3941): 203-204.
2Ossola B, Schendzielorz N, Chen SH, et al. Amantadine protects dopamine neurons by a dual action: reducing activation of microglia and inducing expression of GNDF in astroglia [J]. Neuropharmacology, 2001, 61(4): 574-582.
3Morrison B 3rd, Elkin BS, Dolle JP, et al. In vitro models of traumatic brain injury [J]. Annu Rev Biomed Eng, 2011, 13: 91-126.
4Bales JW, Wagner AK, Kline AE, et al. Persistent cognitive dysfunction after traumatic brain injury: A dopamine hypothesis [J]. Neurosci Biobehav Rev, 2009, 33(7): 981-1003.
5Giacino JT, Whyte J, Bagiella, et al. Placebo-controlled trial of amantadine for severe traumatic brain injury [J]. N Engl J Med, 2012, 366(9): 819-826.
6Hammond F, Bickett AK, Norton JH, et al. Effectiveness of amantadine hydrochloride in the reduction of chronic traumatic brain injury irritability and aggression [J]. J Head Trauma Rehabil, 2014, 29(5): 391-399.
7Dixon CE, Kraus MF, Kline AE, et al. Amantadine improves water maze performance without affecting motor behavior following traumatic brain injury in rats [J]. Restor Neurol Neurosci, 1999, 14(4): 285-294.
8Von Voigtlander PF, Moore KE. Dopamine: release from the brain in vivo by amantadine [J]. Science, 1971, 174(4007): 408-410.
9Parsons CG, Panchenko VA, Pinchenko VO, et al. Comparative patch-clamp studies with freshly dissociated rat hippocampal and striatal neurons on NMDA receptor antagonistic effects of amantadine and memantine [J]. Eur J Neurosci, 1996, 8(3): 446-454.
10Schmued LC, Albertson C, Slikker W Jr. Fluoro-Jade: a novel fluorochrome for the sensitive and reliable histochemical localization of neuronal degeneration [J]. Brain Res, 1997, 751(1): 37-46.
11Zhao X, Ahram A, Berman RF, et al. Early loss of astrocytes after experimental traumatic brain injury [J]. Glia, 2003, 44(2): 140-152.
12Thompson HJ, Lifshitz J, Marklund N, et al. Lateral fluid percussion brain injury: a 15-year review and evaluation [J]. J Neurotrauma, 2005, 22(1): 42-75.
NeuroprotectiveeffectsofamantadineonratmodelsofbilateralmildTBI
WANGTao1,SHITiejun1,LINWei2,JIAYunfeng1,LIUWenpeng1,WANGPeixin1,CUIShaojie1
1DepartmentofNeurosurgery, 306thHospitalofPLA,Beijing100101;2DepartmentofNeurosurgery,XijingHospital,FourthMilitaryMedicalUniversity,Xi'an710032, China
ObjectiveThe potential effects of clinically relevant dose of amantadine on hippocampal cell survival in adult rats following bilateral mild traumatic brain injuries are evaluated.MethodsExperimental TBIs were induced by fluid percussion device. Fifty-six rats were random subjected to four groups. Amantadine (15 mg/kg, 45 mg/kg, and 135 mg/kg) or saline control were administered intraperitoneal at 1 h after TBI followed by dosing three times daily for 16 consecutive days. Brains were removed at 48 h or 16 d after TBI for measurement of acute degenerating neurons and long-term neuronal survival. Amantadine plasma concentrations were determined by liquid chromatograph/mass spectrometer-mass spectrometer (LC/MS-MS) for pharmacokinetic analysis.ResultsStereological quantification revealed that 45 mg/kg or 135 mg/kg dose of amantadine significantly reduced the numbers of degenerating neurons compared to saline treated group (Plt;0.05), with the highest dose (135 mg/kg) producing the largest increase in surviving CA3 pyramidal neurons at 16 d post TBI (P=0.032). Pharmacokinetic analysis confirmed that the employed doses and dosing intervals (every 8 hours) produced plasma exposures of amantadine similar to those in humans (717 ng/ml).ConclusionOur data shows clinically relevant dosing schedules of amantadine would be a potential novel treatment to reduce brain tissue damage after traumatic brain injury.
Traumatic brain injury; Sprague-Dawley rats; Hippocampus; Neuron; Pharmacokinetics
1671-2897(2016)15-037-05
R 651.1+5
A
王涛,主治医师,E-mail: wangtao0111@gmail.com
*通讯作者:崔绍杰,主任医师,E-mail: csjbj@126.com
2014-08-13;
2014-11-22)

