自噬抑制剂3-MA对机械性神经元损伤后神经元凋亡的影响
赵明明 罗鹏 赵永博 尹丰 费舟* (海军总医院神经外科, 北京 00048; 第四军医大学西京医院神经外科,陕西 西安 700; 解放军第医院神经外科,陕西 西安 70054)
·神经损伤研究·
自噬抑制剂3-MA对机械性神经元损伤后神经元凋亡的影响
赵明明1罗鹏2赵永博3尹丰1费舟2*
(1海军总医院神经外科, 北京 100048;2第四军医大学西京医院神经外科,陕西 西安 710032;3解放军第323医院神经外科,陕西 西安 710054)
目的研究自噬抑制剂6-氨基-3-甲基嘌呤(3-MA)对机械性损伤后神经元凋亡的影响。方法小鼠皮层神经元原代培养2 w后,采用机械性神经元损伤模型,通过蛋白印迹法(Western blot)定量分析损伤后不同时间点自噬相关分子微管相关蛋白轻链3(LC3)Ⅰ/Ⅱ的表达情况;通过免疫荧光染色分析机械性损伤后24 h神经元自噬相关分子LC3的表达情况;小鼠皮层神经元原代培养2 w后,用自噬抑制剂3-MA预处理1 h,采用机械性神经元损伤模型,通过乳酸脱氢酶(LDH)活性测定及碘化丙啶(PI)/Hoechst 33342双染测定神经元损伤程度以及3-MA的保护作用,并通过Western blot研究凋亡相关指标caspase-3和自噬相关指标微管相关蛋白轻链3 (LC3)和Beclin-1的表达变化。结果Western blot方法和免疫荧光组化同时证明机械性神经元损伤后24 h LC3Ⅱ表达明显增加;LDH活性测定表明3-MA能抑制机械性损伤造成的LDH活性的增高;PI/Hoechst 33342双染表明3-MA可以明显减少机械性损伤后神经元的凋亡;通过Western blot法证明3-MA抑制LC3Ⅱ,并导致cleaved caspase-3表达明显降低。结论自噬抑制剂3-MA可能通过抑制自噬而减少机械性神经元损伤后神经元凋亡,进而对机械性损伤后神经元起保护性作用。
机械性神经元损伤; 凋亡; 自噬
创伤性脑损伤(traumatic brain injury, TBI)是临床上常见的高致残、致死性疾病,分为原发性脑损伤和继发性脑损伤,根据GCS评分又分为轻度、中度和重度[1,2]。对TBI后继发性脑损伤的合理治疗与其预后密切相关,虽然国内外科学家针对TBI继发性损伤的机制做了大量研究,但仍不够明确,能付诸临床应用的更是少之又少,仍需探索研究,而机械性损伤模型在一定程度上模拟了TBI对神经细胞的损害,为离体条件下研究TBI创造了条件[3]。
自噬是生物进化保守的一种能量合理应用机制,在生物的生理和病理状态下都发挥着重要作用,微管相关蛋白轻链3(microtubule-associated protein light chain 3, LC3)Ⅰ/Ⅱ和Beclin-1是两个重要的自噬相关分子,被广泛地用来研究自噬的发生和发展。在正常生理状况下,哺乳动物通过自噬来清除细胞内错误折叠的蛋白、老化的细胞器并且转化为能量,以维持细胞内环境稳态[4],而在病理状况下(如感染、创伤、神经退行性疾病等)中同样发挥着重要的作用[5],但在不同病理过程中所发挥作用的大小不同,甚至相反。已有文献研究表明,在体创伤性脑损伤、缺血再灌注脑损伤和离体神经细胞化学性损伤、氧糖剥夺损伤中均有明显自噬发生[6~8],然而自噬在TBI后的作用和功能尚不明确,本次实验的目的在于阐明自噬抑制剂3-MA对机械性损伤后神经元凋亡的影响。
材料与方法
一、材料
孕14~16 d 昆明小鼠(第四军医大学实验动物中心),激活caspase-3(Cleaved caspase-3)、Beclin-1抗体和β-actin抗体购于美国CST公司,微管相关蛋白轻链3(microtubule-associated protein light chain 3, LC3)抗体、6-氨基-3-甲基嘌呤(3-methyladenine, 3-MA)、多聚赖氨酸(polylysine, PLL)和二甲基亚砜(dimethyl sulfoxide, DMSO)购于美国sigma公司,神经元基质培养基(neurobasal, NB)、B27、10%胎牛血清(fetal bovine Serum, FBS)和改良Eagle培养基(Dulbecco's modified Eagle medium, DMEM)购于美国Gibco公司,山羊抗兔二抗(北京鼎国)。
二、方法
1.小鼠脑皮层神经元原代培养及分组
神经元培养:孕14~15 d昆明小鼠,颈椎脱臼,腹部皮肤常规消毒,分层剪开皮肤和腹肌,暴露腹腔,无菌状态下快速取出小鼠胚胎,放入盛有D-Hanks并置于冰盒上的培养皿。解剖显微镜下剥离小鼠胚胎大脑皮层,置于预冷至4℃的、新鲜的D-Hanks液中,仔细剥去脑膜及血管组织,将分离之大脑皮层用D-Hanks液漂洗1次。剪碎脑皮层,加入1.25 g/L胰蛋白酶消化液,置于37℃、5% CO2孵箱中消化组织块20 min。吸去消化液,将消化后的脑皮质组织块转移至离心管中,加入含10%胎牛血清的DMEM,室温下终止消化10 min。弃去终止液,将皮层脑组织块用DMEM培养液再漂洗1次,用移液管在含10%胎牛血清的DMEM培养液中将消化后的组织块吹打成细胞悬液。室温静置5 min,取少许细胞悬液滴于血球计数板上,显微镜下计数。以2.5×105个细胞/cm2将细胞接种于35 mm培养皿或者共聚焦小皿(培养皿预先用多聚赖氨酸包被24 h,三蒸水漂洗后晾干备用),培养液中加入青链霉素使其终浓度为100 000 u/lL,谷氨酰胺终浓度为0.5 mmol/l。将细胞置于37℃、5% CO2孵箱中培养24 h后,弃去培养液,用37℃的DMEM小心漂洗细胞,更换含20 ml/L B27添加剂的NB培养液,每天观察细胞生长状况,以后每隔3 d半量更换含20 ml/L B27添加剂的NB培养液。神经元体外培养2 w,备用。
分组情况:对照组(contorl group, 即神经元体外培养2 w未作任何处理);损伤组(trauma group, 即神经元体外培养2 w后,分别在提取蛋白前1 h、3 h、6 h、12 h、24 h给予机械性损伤);T24 h+双蒸水(double distilled H2O, ddH2O)组(由于抑制剂3-MA由 ddH2O溶解配置,设该组为与3-MA组对照,即神经元体外培养2 w,在损伤前1 h加入1 μl/ml的ddH2O 37℃孵育,损伤后24 h提蛋白);抑制剂组(3-MA组,即神经元体外培养2 w,在损伤前1 h加入用ddH2O配置的浓度为5 mmol/l的3-MA ,37℃孵育,损伤后24 h提蛋白),以上实验均重复3次以上。
2.神经元总蛋白提取:弃去培养皿中NB培养基,用磷酸盐缓冲液(phosphate buffered solution, PBS)轻柔洗涤去除杂质,按每皿50 μl加入含2%苯甲基磺酰氟(phenylmethanesulfonyl fluoride, PMSF)的蛋白裂解液,冰上裂解5 min,收集裂解产物超声破碎10 min后4 ℃12 000 rpm离心30 min。收集上清蛋白液,采用二喹啉甲酸(bicinchoninic acid, BCA)法对蛋白含量定量后备用。
3.体外培养神经元机械性损伤:参考Faden的方法[3],以10 μl的微量移液器塑料枪头于35 mm培养皿内划割,造成神经元机械性损伤,划伤道宽度为1 mm,两相邻划伤道间隔4 mm。依据预先在培养皿底面画好的标记线(9×9)划割培养好的神经元,标记线均匀分布在培养皿底面,保证同一组内的神经元损伤程度和范围一致。这种方法制作的损伤模型稳定,能够在体外模拟机械性脑损伤的病理生理过程[9]。
4.乳酸脱氢酶(lactate dehydrogenase, LDH)活性测定:每培养皿收集100 μl培养基用于LDH活性测定,方法按照试剂盒说明书操作,反应结束后在440 nm测定样品吸光度计算LDH活性。标准以每克乳酸脱氢酶蛋白37℃与基质作用15 min,反应体系中产生1 μmol丙酮酸记为1 U LDH活性。
5.碘化丙啶(PI)/Hoechst 33342双染:含PI(终浓度为10 μg/ml)/Hoechst 33342(终浓度为μg/L)的染色液室温下染色15 min,弃去染色液后PBS洗涤3次,每次5 min。4%多聚甲醛固定后封片,荧光显微镜下观察。正常神经元呈胞浆淡红、胞核均质蓝色,损伤神经元呈全细胞亮红、胞浆均质蓝色,其中凋亡神经元呈全细胞亮红、胞核亮蓝色,核固缩明显。
6.免疫荧光组化:将原代皮层神经元种植于共聚焦小皿内,2 w后给予机械性损伤,损伤后24 h用多聚甲醛固定,置入LC3抗体(羊血清和LC3抗体1:30比例配成)于4℃环境中达24 h,然后弃掉抗体PBS洗三遍,加入荧光二抗常温下避光放置4 h,弃掉荧光二抗,PBS洗三遍后加入Hoechst 33342染液,常温避光放置10 min,然后在共聚焦显微镜下随机选取视野观察拍照。此过程对照组和损伤组个各重复三遍,斑点样LC3聚集体少于等于5个的算作正常细胞,大于5个的算作自噬激活细胞,分别统计分析对照组和损伤组中自噬激活细胞所占比例[10]。
7. Western blot检测蛋白表达量变化:定量过的样品按每泳道30 μg蛋白含量进行聚丙烯酰胺凝胶电泳,结束后用湿转法将蛋白转至硝酸纤维素膜上,5%脱脂奶粉室温下封闭1 h,加入一抗(兔抗小鼠LC3,1 ∶1 500;β-actin,1 ∶1 000;兔抗小鼠Beclin-1,1 ∶1 000;兔抗小鼠Cleaved caspase-3,1 ∶500),4 ℃过夜。山羊抗兔二抗(1 ∶20 000)室温下1 h,化学法发光,压片后分析结果。最后用SPSS 13.0图像分析系统测定各条带灰度值,以此反映各分子表达量变化。
8.统计学分析:采用SPSS 13.0统计软件进行数据分析,各组数据以均数±标准差表示,进行方差分析和t检验,以P<0.05认为在统计学上有显著性差异。
结 果
一、机械性神经元损伤后有显著的自噬发生
1.Western blot结果表明: 对照组(contorl group)LC3Ⅱ表达较低,损伤后3 h LC3Ⅱ表达开始增加,且随时间变化逐渐增高,其中损伤后3 h、6 h、12 h、24 h LC3Ⅱ较对照组有显著性差异(P<0.05, 图1)。
2.免疫荧光组化结果表明:对照组神经元胞质中LC3呈均匀的低水平表达,而机械性损伤后24 h的神经元胞质中LC3表达明显增加,并且呈斑点样聚集。对照组中自噬激动神经元所占比例为10%±2.098%,而机械性损伤后24 h的自噬激动神经元所占比例为61%±3.728%,与对照组有显著差异(P<0.05, 图2)。
二、乳酸脱氢酶(lactate dehydrogenase, LDH)活性测定
T24 h组为(613.2±14.6)μ/L,与T24 h+ddH2O组(620.3±11.2)μ/L神经元LDH活性无明显差异,而两者的LDH活性显著高于与对照组(203.5±13.7)μ/L。加入3-MA可以显著抑制机械性损伤造成的LDH活性的增高,与T24 h组和T24 h+ddH2O组相比有显著性差异(P<0.05, 图3)。

图1 Western blot检测机械性神经元损伤后不同时间点LC3Ⅰ/Ⅱ的表达
Fig 1 Detection of LC3Ⅰ/Ⅱ expression at different time points after mechanical neuronal injury by Western blot
aP<0.05,vscontrol group.
Fig 2 激光共聚焦显微镜观察自噬特异性蛋白LC3的表达(×600)
图2 Observation of autophagy protein LC3 expression by laser scanning confocal microscope (×600)
A:Hoechst 33342 staining of control group;B:LC3 staining of control group;C:Merge of A and B;D:Hoechst 33342 staining of trauma group;E:LC3 staining of trauma group;F:Merge of D and E.
aP<0.05,vscontrol group
图3 LDH活性检测
Fig 3 LDH activity in each group
aP<0.05,vsT24 h+ddH2O group;bP<0.05,vscontrol group.
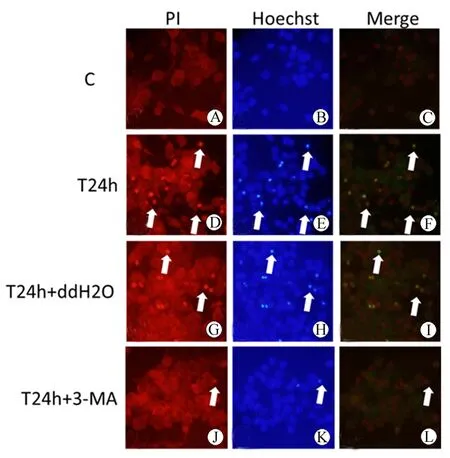
图4 PI/Hoechst 33342双染(×400)
Fig 4 Immunofluorescence double staining of PI and Hoechst 33342 (×400)
Propidium iodide (PI) staining of control group (A), T24 h group (D), T24 h+ddH2O group (G) and T24 h+3-MA (J);Hoechst 33342 staining of control group (B), T24h group (E), T24h+ddH2O group (H) and T24 h+3-MA(K);Double staining of propidium iodide (PI) and Hoechst 33342; C: Merge of A and B; F: Merge of D and ; I: Merge of G and H; L: Merge of J and K.
Arrowhead indicates karyopycnosis.
三、碘化丙啶(PI)/Hoechst 33342双染
对照组可见神经元胞核均质、圆满,对PI不着色,胞浆对PI着淡红色,清晰可见。机械性损伤后24 h,可见大量神经元出现细胞核固缩,对PI着色,胞浆结构消失。机械性神经元损伤的同时使用自噬抑制剂3-MA可以明显减少发生胞膜损害和胞核固缩的神经元数量,正常神经元比例明显增加(图4)。
四、Western blot法检测自噬抑制剂3-MA对凋亡相关因子Cleaved caspase-3及自噬相关分子(LC3、Beclin-1)蛋白表达的影响
Western blot分析表明,与T24 h组和T24 h+ddH2O组相比,抑制剂组(T3 h+3-MA) LC3Ⅱ和Beclin-1显著下调(P<0.05),同时Cleaved caspase-3表达明显降低(P<0.05, 图5)。

图5 Western blot检测自噬抑制剂(3-MA)预处理对自噬相关分子和Cleaved caspase-3表达变化的影响
Fig 5 Detection of Cleaved caspase-3, Beclin-1 and LC3Ⅱ-protein in each group by Western blot
A:LC3Ⅱ/LC3Ⅰratio; B:Beclin-1/β-Actin ratio;C:Cleaved caspase-3/β-Actin ratio;D:Expression of LC3Ⅰ/Ⅱ,Beclin-1 and Cleaved caspase-3 were measured by Western blot.
aP<0.05,vsT24 h+ddH2O group;bP<0.05,vscontrol group.
讨 论
自噬是一种生物进化保守的细胞内溶酶体降解途径,于1963年由比利时科学家Christian de Duve首先命名提出,根据其发生过程的不同分为三类:巨自噬(macroautophagy)、微自噬(microautophagy)和伴侣-介导的自噬(chaperone-mediated autophagy)[11]。Diskin等在2005年首先报道了创伤性脑损伤可以诱导自噬的发生,发现创伤性脑损伤后自噬相关分子Beclin-1在神经元和星形胶质细胞上呈显著高表达,并认为过表达Beclin-1进而激活自噬可能发挥保护性作用[12]。Clark等在TBI患者脑组织中发现大量的自噬相关分子LC3的表达[13]。雷帕霉素是一种通过抑制哺乳动物雷帕霉素靶点(mammalian target of rapamycin, mTOR)来上调自噬的激动剂,Erlich等在研究中发现在小鼠创伤性脑损伤后4 h给予雷帕霉素治疗可以明显改善小鼠的功能恢复,同时发现雷帕霉素的干预显著上调了Beclin-1在脑组织中的表达[14]。与此同时,也有部分研究表明,降低TBI诱导的自噬有保护性作用。Yichen Lai等在研究中发现使用γ-谷氨酰半胱氨酸乙酯(γ-glutamylcysteinyl ethyl ester, GCEE)降低自噬的同时可以改善TBI后小鼠的功能缺失[15]。Luo等通过使用自噬抑制剂3-MA和巴佛洛霉素(bafliomycin A1, BFA)抑制TBI后小鼠的自噬水平,可以降低脑损伤面积和功能缺失[16]。由此可知,目前在自噬与TBI的关系方面的研究中出现较大分歧,需继续探索和研究。
我们的前期研究证实,机械性神经元损伤后有显著的自噬发生,并受PI3K/Akt信号通路的调节。本次实验着重研究了自噬抑制剂3-MA对机械性损伤后神经元凋亡和细胞活性的影响[17]。通过研究发现,自噬抑制剂3-MA抑制自噬可以显著降低神经元的LDH释放,PI/Hoechst 33342双染发现抑制自噬可以降低机械性神经元损伤中神经元的凋亡,同时通过Western blot法证明,抑制自噬可以降低活化的caspase-3的表达。由此可知,抑制机械性神经元损伤中的自噬可以在一定程度上减少神经元的凋亡,进而对损伤后神经元发挥保护作用。Gavin等在小鼠大脑皮层离体神经元H2O2损伤中的研究表明,抑制自噬可以减少神经元凋亡;Grishchuk等也在研究中发现,Beclin-1非依赖的自噬导致皮层神经元的凋亡,3-MA抑制自噬可以减少神经元凋亡,与我们的研究结果基本一致[18]。
迄今为止,国内外科学家已在自噬与脑损伤的关系方面做了大量研究,在取得很大进步的同时也发现了一些问题和矛盾,本研究为进一步探索TBI后自噬的作用和功能提供理论依据。
1Masel BE, DeWitt DS. Traumatic brain injury: a disease process, not an event [J]. J Neurotrauma, 2010, 27(8): 1529-1540.
2DeKosky ST, Ikonomovic MD, Gandy S. Traumatic brain injury-football, warfare, and long-term effects [J]. N Engl J Med, 2010, 363(14): 1293-1296.
3Faden AI, O'Leary DM, Fan L, et al. Selective blockade of the mGluR1 receptor reduces traumatic neuronal injury in vitro and improves outcome after trauma [J]. Exp Neurol, 2001, 167(2): 435-444.
4Mariňo G, Madeo F, Kroemer G. Autophagy for tissue homeostasis and neuroprotection [J]. Curr Opin Cell Biol, 2011, 23(2): 198-206.
5Meijer AJ, Codogno P. Regulation and role of autophagy in mammalian cells [J]. Int J Biochem Cell Biol, 2004, 36(12): 2445-2462.
6Smith CM, Chen Y, Sullivan ML, et al. Autophagy in acute brain injury: feast, famine, or folly ? [J]. Neurobiol Dis, 2011, 43(1): 52-59.
7Higgins GC, Devenish RJ, Beart PM, et al. Autophagic activity in cortical neurons under acute oxidative stress directly contributes to cell death [J]. Cell Mol Life Sci, 2011, 68(22): 3725-3740.
8Qin AP, Liu CF, Qin YY, et al. Autophagy was activated in injured astrocytes and mildly decreased cell survival following glucose and oxygen deprivation and focal cerebral ischemia [J]. Autophagy, 2010, 6(6): 738-753.
9Huang WD, Fei Z, Zhang X. Traumatic injury induced homer-1a gene expression incultured cortical neurons of rat [J]. Neurosci Lett, 2005, 389(1): 46-50.
10Young JE, Martinez RA, La Spada AR. Nutrient deprivation induces neuronal autophagy and implicates reduced insulin signaling in neuroprotective autophagy activation [J]. J Biol Chem, 2009, 284(4): 2363-2373.
11McEwan DG, Dikic I. Not all autophagy membranes are created equal [J]. Cell, 2010, 141(4): 564-566.
12Diskin T, Tal-Or P, Erlich S, et al. Closed head injury induces upregulation of Beclin 1 at the cortical site of injury [J]. J Neurotrauma, 2005, 22(7): 750-762.
13Clark RS, Bayir H, Chu CT, et al. Autophagy is increased in mice after traumatic brain injury and is detectable in human brain after trauma and critical illness [J]. Autophagy, 2008, 4(1): 88-90.
14Erlich S, Alexandrovich A, Shohami E, et al. Rapamycin is a neuroprotective treatment for traumatic brain injury [J]. Neurobiol Dis, 2007, 26(1): 86-93.
15Lai Y, Hickey RW, Chen Y, et al. Autophagy is increased after traumatic brain injury in mice and is partially inhibited by the antioxidant gamma-glutamylcysteinyl ethyl ester [J]. J Cereb Blood Flow Metab, 2008, 28(3): 540-550.
16Luo CL, Li BX, Li QQ, et al. Autophagy is involved in traumatic brain injury-induced cell death and contributes to functional outcome deficits in mice [J]. Neuroscience, 2011, 184: 54-63.
17赵明明, 赵永博,罗鹏, 等. PI3K/Akt信号通路对神经元机械性损伤诱导的自噬调节作用 [J]. 中华神经外科疾病研究杂志, 2012, 11(6): 491-494.
18Grishchuk Y, Ginet V, Truttmann AC, et al. Beclin 1-independent autophagy contributes to apoptosis in cortical neurons [J]. Autophagy, 2011, 7(10): 1115-1131.
Theeffectofautophagyinhibitor3-MAonapoptosisinducedbymechanicalneuronalinjury
ZHAOMingming1,LUOPeng2,ZHAOYongbo3,YINFeng1,FEIZhou2
1DepartmentofNeurosurgery,NavyGeneralHospitalofPLA,Beijing100048;2DepartmentofNeurosurgery,XijingHospital,FourthMilitaryMedicalUniversity,Xi'an710032;3DepartmentofNeurosurgery,The323thHospitalofPLA,Xi'an710054, China
ObjectiveThe effect of autophagy inhibitor 3-methyladenine (3-MA) on apoptosis induced by mechanical neuronal injury is investigated.MethodsMouse cortical neurons were cultured for 2 w in vitro. After establishment of mechanical neuronal injury model, the expression of microtubule-associated protein light chain 3 (LC3)Ⅰ/Ⅱ was measured by Western blot. LC3, as an autophagy related molecular, was detected by immunofluorescence staining in the neurons at 24 h after mechanical neuronal injury. Neurons were pre-treated with autophagy inhibitor 3-MA for 1 h before mechanical neuronal injury model. Then, cell viability was evaluated by lactate dehydrogenase (LDH) activity assay and immunofluorescence double staining of propidium iodide (PI) and Hoechst 33342. The expressions of caspase-3, LC3, and Beclin-1 were measured by Western blot.ResultsWestern blot and immunofluorescence staining indicated that the significant increase of LC3 expression at 24 h after mechanical neuronal injury. LDH assay showed that pre-treatment of 3-MA suppressed mechanical injury-induced elevation of LDH activity. PI/Hoechst double staining suggested that pre-treatment of 3-MA also decreased the neuronal apoptosis after mechanical injury. Furthermore, Western blot indicated that 3-MA inhibited the expression of LC3 II and then resulted in the decrease of cleaved caspase-3.ConclusionAutophagy inhibitor 3-MA might attenuate mechanical neuronal injury-induced neuronal apoptosis via inhibiting autophagy, thereby leading to the neuroprotective effects after mechanical neuronal injury.
Mechanical neuronal injury; Apoptosis; Autophagy
R 322
A
国家自然科学基金资助项目(30930093);全军医学科技青年培育基金资助项目(13QPN026)
赵明明,医师,E-mail: mingming157@163.com
*通讯作者: 费舟,教授、主任医师,博士生导师,E-mail: feizhou@fmmu.edu.cn
2015-03-16;
2015-08-10)

