Nrf2-抗氧化反应元件信号通路对脑损伤大鼠的神经保护作用及机制
薛毅辉 陈富勇 吴赞艺 王灯亮 葛洪良
(福建医科大学附属第一医院神经外科,福建 福州 350005)
Nrf2-抗氧化反应元件信号通路对脑损伤大鼠的神经保护作用及机制
薛毅辉 陈富勇1吴赞艺 王灯亮 葛洪良
(福建医科大学附属第一医院神经外科,福建 福州 350005)
目的 研究Nrf2-抗氧化反应元件(ARE)信号通路对脑损伤大鼠的神经保护作用及机制。方法 将60只SD大鼠随机分为2组,其中假手术组4只,模型组56只。模型组分为A组和B组:A组于手术前24 h腹腔注射特丁基对苯二酚(tBHO)50 mg/kg(5 mg/ml),B组注射等量生理盐水。比较假手术组和模型组术后神经行为评分、脑组织含水量和神经细胞凋亡率。比较A组和B组不同时刻(术后1、3、6、12、24 h,3、7 d)的单核细胞血红素氧合酶(HO)-1、醌氧化还原酶(NQO)1、谷胱甘肽(GSH)和活性氧(ROS)水平。结果 各组神经行为评分,脑组织含水量,凋亡率差异具有统计学意义(P<0.05)。各组术后不同时刻的HO-1、NQO1、 GSH和 ROS水平差异有统计学意义(P<0.05)。结论 Nrf2-ARE通路主要通过上调下游抗氧化酶的表达发挥对脑损伤大鼠神经保护作用。
Nrf2-ARE通路;脑损伤;氧化应激反应;抗氧化酶
颅脑损伤的病理生理过程包括原发性和继发性脑损伤,其特点是脑皮质及白质搓碎、破裂,出血、水肿,血管栓塞,部分神经细胞坏死;后者包括一系列的损伤级联反应,主要包括氧化应激、炎症和神经细胞凋亡等,其中氧化应激是继发性脑损伤的病理生理机制〔1〕。针对颅脑损伤的复杂病理生理机制,临床上尚未出现有效的干预措施,故患者预后较差。目前,Nrf2-抗氧化反应元件(ARE)通路在脑损伤中的作用引起了较为广泛的关注〔2〕,本次研究旨在探讨Nrf2-ARE信号通路对脑损伤大鼠的神经保护作用及机制。
1 资料与方法
1.1 动物、主要仪器及试剂 SD大鼠60只,体重为200~220 g,平均(210.0±6.2)g,由福建医科大学实验动物中心提供,合格证号14-0212。主要仪器及试剂为Elx800光吸收酶标仪〔美国伯腾(北京)仪器有限公司〕、改良液压冲击装置(中国天津医科大学总医院)、BX53电子显微镜(日本奥林巴斯公司)、Image-Pro Insight 图像分析软件(广州市明美光电技术有限公司)、Gallios流式细胞仪(美国贝克曼库尔特有限公司)、特丁基对苯二酚(tBHQ,上海棋成实业有限公司)、细胞凋亡测试盒(UNNEL法,上海博耀生物科技有限公司)、抗Nrf2抗体和抗β-actin抗体〔艾博抗(上海)贸易有限公司〕、大鼠单核细胞血红素氧合酶(HO)-1单克隆抗体(上海钰博生物科技有限公司)、大鼠醌氧化还原酶(NQO)1单克隆抗体(上海古朵生物科技有限公司)、大鼠谷胱甘肽(GSH)ELISA分析检测试剂盒(上海乔羽生物科技有限公司)、活性氧(ROS)检测试剂盒(上海研拓生物科技有限公司)、羊抗鼠多克隆抗体(北京中杉金桥公司)、蛋白定量检测试剂盒(美国Pierce公司)、电化学发光(ECL)底物(瑞典CE life science公司)。
1.2 实验动物分组及模型构建 对大鼠进行分组,其中假手术组4只,模型组56只。均进行适应性培养1 w。大鼠实验前禁食12 h:模型组根据随机数字表法分为A组,术前24 h给予腹腔注射Nrf2激动剂tBHQ,每隔8 h给药1次(5 mg/ml),每次剂量为16.7 mg/kg,共3次,总计50 mg/kg;B组同时给予等量生理盐水。大鼠经2%戊巴比妥钠(40 mg/kg体重)腹腔麻醉后,在无菌条件下沿头部正中矢状位切开皮肤、皮下组织,剥离颅骨外膜,在距离矢状缝、冠状缝5 mm处用磨钻钻取直径0.5 cm的小孔,保持硬脑膜完整,使用改良液压冲击装置造模,压力为0.2 MPa。假手术组常规麻醉、开颅,但不行液压冲击。观察大鼠恢复自主呼吸即放回饲养笼,进行损伤后观察〔3〕。 分别将A组4只大鼠和B组4只大鼠于相应时间点处死,取材对脑挫伤灶及其周围区进行组织学观察。
1.3 大鼠的神经行为学评分 术后24 h进行大鼠脑损伤神经功能评分,采用双盲法〔4〕。
1.4 脑组织含水量测定 术后24 h用滤纸吸除标本表面水分,分析天平称湿重后于110℃恒温干燥箱内干燥24 h至 恒重,称干重后按Elliot公式〔脑含水量=(湿重-干重)/湿重×100%〕计算脑含水量〔5〕。
1.5 组织学观察 ①神经细胞凋亡率:术后24 h取脑组织进行组织染色的标本用4%多聚甲醛固定并进行组织学检查。对组织进行转移酶介导的三磷酸脱氧鸟苷-生物素刻痕末端标记(TUNEL)染色并在显微镜下(×400)观察凋亡细胞(细胞核出现棕黄染颗粒),在镜下分5个视野计数细胞并计算凋亡率。凋亡率=(凋亡细胞/总细胞数)×100.00%。②大鼠Nrf2表达水平检测:手术后1、6、12、24 h,3、7 d采用Western印迹检测大鼠Nrf2表达水平。取新鲜脑组织裂解、匀浆后取上清液,蛋白定量后进行聚丙烯酰胺凝胶电泳、电转移和膜封闭,封闭结束后分别滴加Nrf2大鼠单抗4℃孵育过夜。加入二抗室温下于摇床孵1 h,二抗孵育后显色、曝光、显影。测量并分析上述蛋白的光密度值,并以β-actin为内参计算相对光密度值(ROD)。③大鼠抗氧化与氧化物质水平的检测:别于手术后1、6、12、24 h,3、7 d检测大鼠HO-1,NQO1,GSH和ROS水平。HO-1和NQO1采用Western印迹法,方法同②。 GSH采用酶联免疫吸附法(ELISA),ROS检测采用流式细胞法,操作严格按照说明书进行。
1.6 统计学方法 采用SPSS16.0统计软件进行单因素方差分析,t检验。
2 结 果
2.1 大鼠神经行为学评分及脑组织含水量 各组神经行为学评分和脑组织含水量差异显著(P<0.05)。见表1。
2.2 大鼠神经细胞凋亡率比较 假手术组神经细胞凋亡率(1.17±0.23)%,A组(23.98±4.17)%,B组(47.65±8.96)%,差异具有统计学意义(F=7.984,P<0.05)。
2.3 大鼠不同时点的Nrf2表达水平比较 A组和B组术后不同时点的Nrf2的ROD高于假手术组,A组和B组不同时刻的Nrf2ROD不同(P<0.05)。见表2。
2.4 大鼠不同时点HO-1、NQO1、 GSH和 ROS水平 各组术后不同时点HO-1、NQO1、 GSH和 ROS水平差异显著(P<0.05)。见表3、表4。
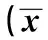
表1 各组神经行为学评分及脑组织含水量比较±s,n=4)
与假手术组相比:1)P<0.05

表2 各组术后不同时点Nrf2 ROD水平比较
与A组比较:1)P<0.05

表3 各组术后不同时点HO-1和NQO1水平比较

表4 各组术后不同时点GSH和ROS水平比较
3 讨 论
颅脑损伤的病理生理过程包括机械性冲击造成的原发性损伤和损伤后启动的一系列生化过程引起的继发性、进行性神经细胞损伤即继发性脑损伤〔6〕。后者则一般持续数小时至数天,是在首次损伤后启动的包括一系列生化降解过程的损伤级联反应,主要包括兴奋性氨基酸毒性、氧化应激、炎症和凋亡,由自由基造成的氧化损伤成为继发性脑损伤的重要原因之一〔7,8〕。为改善颅脑损伤者的预后,临床上除避免或减轻原发性脑损伤外,还应该对继发性脑损伤进行干预。
颅脑损伤大鼠存在氧化应激、钙紊乱、线粒体毒性、炎症和凋亡等一系列病理生理变化:同时,大鼠体内存在抗氧化应激系统〔9〕。Nrf2反应性表达增加,引起下游ARE元件及包含的HO-1和NQO1等抗氧化酶的表达水平增高,从而发挥抗氧化作用。大鼠术后的GSH水平明显降低,而ROS水平增加,说明抗氧化能力减弱。Nrf2是具有基本亮氨酸拉链结构的一种核转录因子,正常情况下存在于胞质内,一种Keap1蛋白可以特异结合在Nrf2的氨基端,使Nrf2的活性受到抑制。当诱导剂存在的情况下,Nrf2磷酸化,向细胞核内转移。磷酸化的Nrf2进入核内后,通过P38/ERK/JNK途径与Maf蛋白形成异二聚体,并与ARE结合〔10〕。ARE是顺式作用元件的一段增强子序列,NQO1、HO-1等基因序列中都存在ARE序列。因此,ARE介导细胞内参与氧化应激的基因转录水平的激活,Nrf2-ARE信号的激活能够上调多种抗氧化酶、解毒酶的表达,抑制炎性反应,强力升高细胞保护功能〔11〕。本研究说明Nrf2-ARE通路对脑损伤大鼠的神经系统具有保护作用,而tBHQ的可以通过上调Nrf2表达减轻大鼠的脑水肿和神经细胞凋亡〔12〕。
1 钱 伟,钱志远,沈合春,等.大鼠原发脑挫伤灶和邻近脑组织在继发性脑损伤发生发展中的作用〔J〕.中华实验外科杂志,2013;30(2):299-300.
2 Andriessen TM,Jacobs B,Vos PE.Clinical characteristics and pathophysiological mechanisms of focal and diffuse traumatic brain injury〔J〕.J Cell Mol Med,2010;14(10):2381-92.
3 陈梅花,陈贵珍,贾万钧,等.改良大鼠弥漫性脑损伤实验模型〔J〕.中国比较医学杂志,2013;23(7):29-31.
4 孙国柱,杨连琦,陈盼虎,等.不同冲击压力脑损伤大鼠神经功能评分差异性与病理学特征的关系〔J〕.中华行为医学与脑科学杂志,2012;21(8):687-9.
5 何 娅,陈松盛,王 辉,等.EPO对大鼠脑缺血再灌注后脑水肿及MMP-9的影响〔J〕.山西医科大学学报,2012;43(7):481-4,561.
6 Bor-Seng-Shu E,de Lima Oliveira M,Teixeira MJ.Traumatic brain injury and metabolism〔J〕.J Neurosurg,2010;112(6):1351-3.
7 Chamoun R,Suki D,Gopinath SP,etal.Role of extracellular glutamate measured by cerebral microdialysis in severe traumatic brain injury〔J〕.J Neurosurg,2010;113(3):564-70.
8 赵柏雄,田衍平,蔡其燕,等.新生大鼠慢性脑缺血损伤中氯离子通道ClC2的表达及其与白质发育影响作用的研究〔J〕.中国组织化学与细胞化学杂志,2015;24(1):1-8.
9 Bartnik-Olson BL,Oyoyo U,Hovda DA,etal.Astrocyte oxidative metabolism and metabolite trafficking after fluid percussion brain injury in adult rats〔J〕.J Neurotrauma,2010;27(12):2191-202.
10 郑海燕,洪 远,陈 高,等.Nrf2-ARE在大鼠创伤性脑损伤模型中的表达及意义〔J〕.中华神经外科杂志,2013;29(1):80-4.
11 吴 丹.HO-1调控Nrf2-ARE信号通路对脑出血后神经保护作用的实验研究〔D〕.南昌:南昌大学医学院,2014.
12 林 正,曾 博,尹 康,等.Nrf2-ARE信号通路在外伤性脑损伤神经保护作用的机制研究〔J〕.中国现代医生,2013;51(11):11-3.
〔2015-02-19修回〕
(编辑 苑云杰)
福建省属高校科研专项项目(No.JK2012021)
薛毅辉(1962-),男,副主任医师,主要从事颅脑损伤和颅底中线肿瘤研究。
R285.6
A
1005-9202(2016)20-4953-03;
10.3969/j.issn.1005-9202.2016.20.006
1 深圳市第二人民医院功能神经科

