含油酸培养基培养对重组解脂耶氏酵母全细胞催化合成反10,顺12-共轭亚油酸的影响
宋宇航,倪丽娟,张白曦,陈卫,张灏
(江南大学 食品科学与工程学院,江苏 无锡,214000)
含油酸培养基培养对重组解脂耶氏酵母全细胞催化合成反10,顺12-共轭亚油酸的影响
宋宇航,倪丽娟,张白曦,陈卫,张灏*
(江南大学 食品科学与工程学院,江苏 无锡,214000)
亚油酸异构酶(PAI)在解脂耶氏酵母细胞内成功表达,以添加外源c9,c12-亚油酸(c9,c12-LA)为底物,全细胞催化合成反10,顺12-共轭亚油酸(trans10,cis12-conjugated linoleic acid,t10,c12-CLA)。解脂耶氏酵母在分别含0.0(对照组)、0.1、0.5、1.0、5.0、10.0 g/L油酸的培养基中生长,收集菌体转移至磷酸盐缓液中进行全细胞催化,比较各组菌体的t10,c12-CLA产率,含5.0 g/L油酸组产物产率最高,达到1.34 g/g,是不含油酸组的1.4倍左右。通过PAI酶活分析及Western blot检测PAI表达量,结果表明,培养基中油酸含量越高,重组解脂耶氏酵母的PAI表达量越低;对比不含油酸组和含5.0 g/L油酸组全细胞催化不同时间的t10,c12-CLA产量,含5.0 g/L油酸组t10,c12-CLA产量最高点的时间比不含油酸组提前约20 h;透射电子显微镜观察2组的菌体状态,含5.0 g/L油酸组细胞壁和细胞膜间隙扩大,该变化可能增加了全细胞催化过程中底物和产物进出细胞的速率,从而提高t10,c12-CLA的转化效率。
重组解脂耶氏酵母;油酸;反10,顺12-共轭亚油酸;转化效率
共轭亚油酸(conjugated linoleic acid,CLA)是具有共轭双键的十八碳二烯酸的统称,在7与9位、8与10位、9与11位、10与12位、11与13位或12与14位碳原子处含有顺式或反式共轭双键[1]。其中反10,顺12-共轭亚油酸(t10,c12-CLA)是最重要的活性单体之一,主要有抗癌生理活性及减少人类脂肪细胞中甘油三酯积累的功效[2-5]。
来源于痤疮丙酸杆菌(Propionibacteriumacnes)的亚油酸异构酶(PAI)可作用于亚油酸(c9,c12-LA)分子的C9双键,生成高度专一的t10,c12-CLA单体[6]。本实验室将PAI在解脂耶氏酵母细胞内成功重组表达,并证明该重组菌株是适合t10,c12-CLA合成的微生物系统[7]。全细胞催化拥有许多优势:能为酶反应提供稳定环境、高效、可多批次转化、产物易分离、易控制等[8]。利用完整的重组解脂耶氏酵母细胞作为催化剂,外源添加底物c9,c12-LA,全细胞催化合成t10,c12-CLA(图1)。但是,重组解脂耶氏酵母细胞壁和细胞膜的阻碍是影响底物c9,c12-LA进入细胞内与酶PAI接触,产物t10,c12-CLA高效输出的主要因素。增加细胞壁和细胞膜的通透性,可促进底物进入细胞内与酶接触并迅速开始催化反应,从而提高产物的合成效率,缩短整个全细胞催化反应的时间。
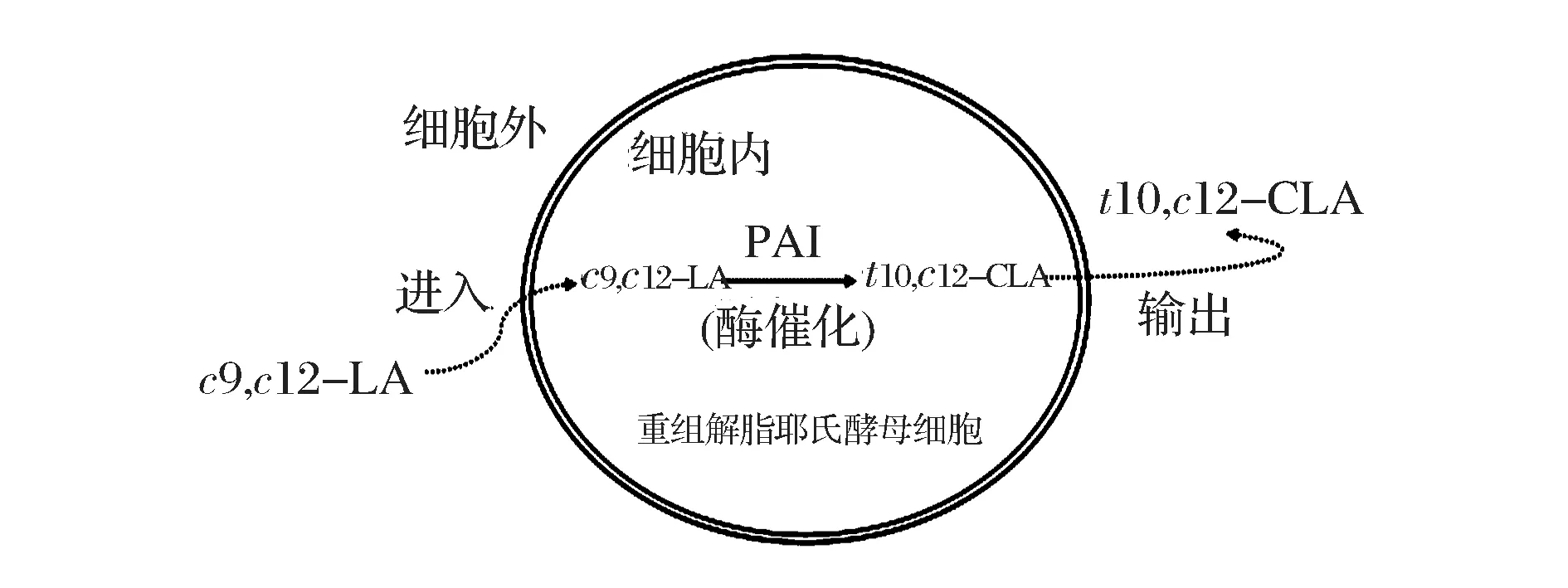
图1 重组解脂耶氏酵母全细胞催化反应的过程Fig.1 Process of whole-cell catalysis using recombinant Y. lipolitca
目前,关于c9,c12-LA、t10,c12-CLA以及其他脂肪酸在解脂耶氏酵母的运输机制还存在争议,可能是简单扩散、促进扩散或二者同时存在[9-10]。解脂耶氏酵母能够以疏水性物质为唯一碳源生长繁殖,并偏好利用油酸[11]。当其在含油酸的培养基中生长繁殖,细胞的表面会发生改变,形成突起;壁膜间隙扩大,利于脂肪酸进出菌体;而且形态和生理都发生改变,更加适合在含疏水性物质的环境中生存[12]。本文研究了重组解脂耶氏酵母在含不同浓度油酸培养基中的生长状态,PAI表达量及对应的全细胞催化生成t10,c12-CLA的产率。旨在寻找一种新的重组解脂耶氏酵母培养基,增加细胞壁和细胞膜的通透性,提高脂肪酸底物和产物进出菌体的速率,进一步提高重组解脂耶氏酵母全细胞催化生成t10,c12-CLA的转化效率。
1 材料与方法
1.1 菌种
重组耶氏解脂酵母(YarrowialipolyticaCCFM-JU277-9)菌株,构建于本实验室,现保藏于中国微生物菌株保藏管理委员会普通微生物中心,其保藏号为CCFM-JU277-9。
1.2 材料与试剂
葡萄糖:国药集团化学试剂有限公司;酵母粉:Oxoid公司;胰蛋白胨:Oxoid公司;游离亚油酸:安庆中创生物工程有限公司;盐酸-甲醇溶液:如东宝湾利昌化工有限公司;十七烷酸甲酯标准品:sigma公司;t10,c12-共轭亚油酸标准品:sigma公司;游离亚油酸标准品:sigma公司;Bradford蛋白浓度测定试剂盒:上海碧云天生物技术有限公司;无硫酸铵&无氨基酸酵母氮源:上海生工生物工程公司;鼠抗兔抗体:Southern Biotechnologies Associates公司;吐温-80、Na2HPO4、KH2PO4、NaOH、甲醇、正己烷、甲苯、NaCl、过硫酸铵、十二烷基磺酸钠等均为国产市售分析纯。
1.3 仪器与设备
GC-2010气相色谱仪,岛津公司(配FID检测器);UV2450型分光光度计,岛津公司;透射电子显微镜H-7650,日立公司;高精度三层摇床,上海知楚仪器有限公司;超声波破碎仪,美国索尼克斯公司;分析天平,METTLER TOLEDO 公司;DK-8D型电热恒温水浴锅,上海精宏实验设备有限公司;RJ-TGL-16C台式高速离心机,上海百盛仪器设备有限公司;落地式高速冷冻离心机,Thermo Scientific公司;快速核酸提取仪FastPrep-24,MP Biomedicals;恒温培养箱,上海智诚分析仪器制造有限公司;漩涡振荡器,IKA公司;热风干燥箱,BINDER公司;真空冷冻干燥机,LABCONCO公司;MLS-3750型高压蒸汽灭菌锅,三洋公司。
1.4 实验方法
1.4.1 菌种活化及培养
菌种来源于含30%甘油保菌管(-80 ℃保存),接种YNBD平板培养基(葡萄糖20 g/L,无氨基酵母氮源)1.7 g/L,(NH4)2SO45 g/L,琼脂粉20 g/L,调pH至5.5),培养皿中28℃恒温培养箱培养4~5 d;再挑取单菌落接种5 mL的YNBD液体种子培养基(葡萄糖20 g/L,无氨基酵母氮源)1.7 g/L,(NH4)2SO45 g/L,调pH至5.5),10 mL试管28 ℃,200 r/min摇床培养48 h;2%接种量接种20 mL的YPD培养基(葡萄糖20 g/L,酵母提取物10 g/L,蛋白胨 20 g/L调pH至6.5)或含不同浓度油酸培养基(油酸浓度0.1、0.5、1.0、5.0、10.0 g/L,代替对应浓度的葡萄糖,使培养基中的碳源和氮源的比例基本一致,酵母提取物10 g/L,蛋白胨20 g/L调pH至6.5,油酸母液200 g/L,加入吐温-80至浓度为6.25 g/L,超声乳化),100 mL锥形瓶28 ℃,200 r/min条件下摇床培养。
1.4.2 全细胞催化剂制备
重组解脂耶氏酵母摇瓶培养后,收集培养液,4 ℃、8 000 r/min离心10 min,并用灭菌生理盐水洗涤2次,收集酵母菌泥,作为全细胞催化剂。
1.4.3 底物亚油酸乳化母液制备
配置200 g/L亚油酸母液,加入吐温-80至浓度为6.25 g/L,使用超声细胞破碎仪,功率200 W冰浴超声5 min。
1.4.4 全细胞催化方法
转化体系共20 mL,转化介质为50 mmol/L的磷酸氢二钠/磷酸二氢钾缓冲液(pH 6.8),加入酵母菌泥至100 g/L,底物亚油酸乳化液至25 g/L。置于摇床中,28 ℃,200 r/min催化反应。
1.4.5 生长曲线测定
取不同时间的生长培养液,4℃ 8 000 r/min离心10 min,生理盐水洗涤菌体2次,收集菌体,真空冷冻干燥,称量菌体干重,以培养时间为横坐标,菌体干重为纵坐标,画出生长曲线[13]。
1.4.6 生物量测定
全细胞转化液25 ℃ 8 000 r/min离心10 min,收集菌体,并将上清收集于干净的离心管中,用0.85%的NaCl溶液洗涤菌体2次;洗涤后的菌体真空冷冻干燥,称量菌体干重,减去胞内脂质总量,即为无脂质生物量。洗涤菌体后的上清液与转化液上清合并,进行细胞外脂肪酸的测定与分析。
1.4.7 细胞外脂肪酸提取及分析
取100 μL转化液上清于5 mL干净玻璃瓶中,加入50 μL十七烷酸脂肪酸内标和1 mL 10%盐酸-甲醇,50 ℃水浴保温2 h,冷却至室温,再加入1 mL正己烷和1 mL饱和氯化钠溶液,剧烈振荡30 s,3 000 r/min离心3 min,取上层溶液,原体系中加入1 mL正己烷再次萃取,合并2次萃取的溶液,氮气吹干,加入1 mL正己烷,振荡混匀,转入气相瓶,高效气相色谱定性、定量分析。
1.4.8 细胞内脂肪酸提取及分析
称取20~25 mg真空冷冻干燥的菌体于5 mL玻璃瓶中,加入50 μL的十七烷酸脂肪酸内标(5 mg/ml)、1 mL 10%盐酸-甲醇和500 μL正己烷,50 ℃水浴保温3 h(每30 min振荡1 min),冷却至室温,加入500 μL正己烷和1 mL饱和NaCl振荡混匀,3 000 r/min离心3 min,取上层溶液,再向原体系中加入1 mL正己烷再次萃取,合并2次萃取的溶液,氮气吹干,加入1 mL正己烷,振荡混匀,转入气相瓶,高效气相色谱定性、定量分析。
1.4.9 高效气相色谱分析条件
色谱柱为DB-WAX(30 m×0.32 mm,φ0.25 μm;Agilent,美国),氢火焰离子(FID)检测器检测;氮气为载气,流量为2 mL/min,采用分流方式进样1 μL,分流比为15∶1,进样口温度为240 ℃;升温程序如下:120 ℃保持3 min,以5 ℃/min升温速度至190 ℃,再以1 ℃/min升温速度至温度达到210 ℃,保持3 min。
脂肪酸甲酯标准品气相色谱分析,并通过保留时间对样品脂肪酸定性;十七烷酸甲酯为内标物,通过面积归一法计算共轭亚油酸的含量,进行定量分析。
t10,c12-CLA产量(g/L)=细胞内和细胞外的t10,c12-CLA含量(g)/转化体系体积(L)
t10,c12-CLA产率(g/g)=t10,c12-CLA产量(g/L)/菌体无脂质生物量(g/L)
1.4.10 透射电子显微镜(TEM)观察
收集菌体,在3%戊二醛溶液中(0.1 mol/L磷酸缓冲液,pH=7.2)前固定,0.1 mol/L磷酸缓冲液漂洗后,用锇酸后固定,接着用0.1 mol/L磷酸缓冲液漂洗,再用乙醇梯度脱水,利用812树脂浸透包埋,超薄切片,柠檬酸铅染色,最后置于透射电子显微镜下观察拍照。
1.4.11 亚油酸异构酶( PAI)粗酶液制备
按1.4.2的方法收集菌体,100 mmol/L Tri/HCl 缓冲液(pH 7.5)重悬至100 mg/mL,通过测定OD600调节菌悬液至同一浓度,加入等体积的直径为0.5 mm的酸洗玻璃珠,快速核酸提取仪FastPrep-24振荡破损5 min;收集破碎液4 ℃,15 000 g离心30 min;取上清,上清在4 ℃,45 000 g条件下离心90 min,收集上清即得粗酶液。
1.4.12 亚油酸异构酶(PAI)酶活测定
酶反应在1.5 mL的石英比色皿中,加入50 μL粗酶液,950 μL 100 mmol/L Tri/HCl 缓冲液(pH 7.5),3 μL底物亚油酸(20 mg/mL,溶于乙醇),25 ℃条件下,紫外可见光分光光度计实时记录1 min内,波长234 nm的吸光值变化,并依据t10,c12-CLA在波长234 nm的标准曲线,计算PAI的酶活。
1.4.13 亚油酸异构酶(PAI)表达的Western Blot分析方法
Bradford蛋白浓度测定试剂盒测定粗酶液的蛋白浓度,取80 μL粗酶液加入20 μL 5×loading buffer,沸水处理10 min,冷却后样品20 μL上样,通过12% SDS-PAGE分离后,转至硝酸纤维素膜上,先后用一抗(1∶10 000稀释)和二抗(1∶5 000)孵育结合,通过HRP-ECL化学发光法及X-光曝光定影显影。
2 结果与分析
2.1 重组解脂耶氏酵母在含不同浓度油酸培养基中的生长曲线
由图2可知,重组解脂耶氏酵母分别在含0.0(不含油酸,对照组)、0.1、0.5、1.0、5.0、10.0 g/L油酸培养基中生长,保持6组培养基碳源和氮源比例基本一致,各实验组大约都在培养36 h时开始进入稳定期,无脂质生物量依次为11.47、11.46、11.73、11.69、11.68和10.6 g/L,重组解脂耶氏酵母在葡萄糖为唯一碳源(不含油酸组)、葡萄糖和油酸共碳源(分别含0.1、0.5、1.0、5.0 g/L油酸组)培养基中生长时,无脂质生物量高于油酸为唯一碳源的培养基培养的菌体(含10.0 g/L油酸组);这可能是解脂耶氏酵母更偏好利用葡萄糖生长繁殖[13]。重组解脂耶氏酵母在稳定期初期时,生物量和PAI的表达量会达到最高[14],所以收集稳定期初期的菌体,作为后期实验的全细胞催化剂,再转移至磷酸盐缓冲液中,加入底物c9,c12-LA,全细胞催化合成t10,c12-CLA。
2.2 重组解脂耶氏酵母全细胞催化合成t10,c12-CLA
收集分别在不含油酸,含0.1、0.5、1.0、5.0、10.0 g/L油酸培养基中培养36 h的重组解脂耶氏酵母细胞,转移至20 mL磷酸盐缓冲液中,再添加底物c9,c12-LA,40 ℃全细胞催化反应24 h,测定细胞内和细胞外的总t10,c12-CLA含量,并计算产物产率。

A-不含油酸;B-含0.1 g/L油酸;C-含0.5 g/L油酸;D-含1.0 g/L油酸;E-含5.0 g/L油酸;F-含10.0 g/L油酸图2 重组解脂耶氏酵母在含不同浓度油酸培养基中的生长曲线Fig.2 Growing curve of recombinant Y. lipolitca in medium in medium containing different concentration oleic acid
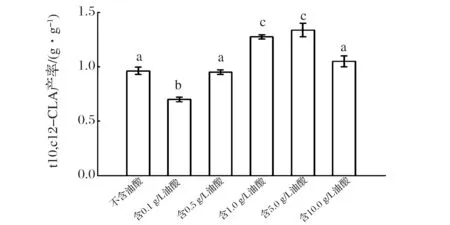
图3 不同浓度油酸培养重组解脂耶氏酵母全细胞催化合成t10,c12-CLA的产率Fig.3 Yield of t10,c12-CLA by whole-cell catalysis using recombinant Y. lipolitca cultivated in medium containing different concentration oleic acid(注:重复3次,不同字母代表组间差异显著,P<0.05)
由图3可知,含5.0 g/L油酸的培养基培养获得的重组解脂耶氏酵母菌体,用于全细胞催化的t10,c12-CLA产率最高,达到1.34 g/g;其余组产率由高到低分别为含1.0 g/L油酸组1.27 g/g、含10.0 g/L油酸组1.05 g/g、不含油酸组0.96 g/g、含0.5 g/L油酸组0.95 g/g、含0.1 g/L油酸组0.70 g/g。可推测,存在2个造成t10,c12-CLA产率差异的主要原因:一是各组的亚油酸异构酶(PAI)在菌体中的表达量存在差异;二是含不同浓度油酸培养基培养的菌体生理状态发生变化,更适合在疏水性物质中生存,菌体细胞壁、细胞膜脂肪酸成分和状态也发生改变,从而改变了细胞通透性,更利于c9,c12-LA和t10,c12-CLA进出解脂耶氏酵母菌体。
2.3 重组解脂耶氏酵母在含不同浓度油酸培养基中的PAI表达情况
取不同浓度油酸培养基中的重组解脂耶氏酵母菌体,在菌体量一致的条件下,破碎细胞并收集PAI粗酶液,测定酶活。由图4可知,不含油酸的培养基中以葡萄糖为唯一碳源(不含油酸组),测得PAI的酶活最高;只有油酸为碳源时(含10.0 g/L油酸组),PAI的酶活最低;培养基中油酸含量越高,PAI酶活越低。
进一步通过图5的Western blot图分析PAI的表达量,使用Quantity One软件分析目标条带的光密度值,只含油酸为碳源培养重组解脂耶氏酵母菌体时(含10.0 g/L油酸组),PAI表达量最低;以葡萄糖为唯一碳源培养细胞时(不含油酸组),PAI表达量最高;其余油酸和葡萄糖共碳源组的PAI表达量基本一致(分别含0.1、0.5、1.0、5.0 g/L油酸组)。该结果与酶活测定结果的趋势基本一致,相比于油酸为碳源,葡萄糖为碳源时更利于重组解脂耶氏酵母中的PAI合成。
如果只考虑PAI表达情况这一因素,含5 g/L油酸组全细胞催化合成t10,c12-CLA的产率应该低于不含油酸组,然而,结合图3中对应的t10,c12-CLA的产率,含5 g/L油酸组的产率明显高于不含油酸组,说明PAI表达不是影响全细胞催化合成t10,c12-CLA的唯一因素;可能还存在另一个主要影响因素,即本文2.2最后提到,造成t10,c12-CLA的产率差异的第二个原因:细胞通透性发生改变。
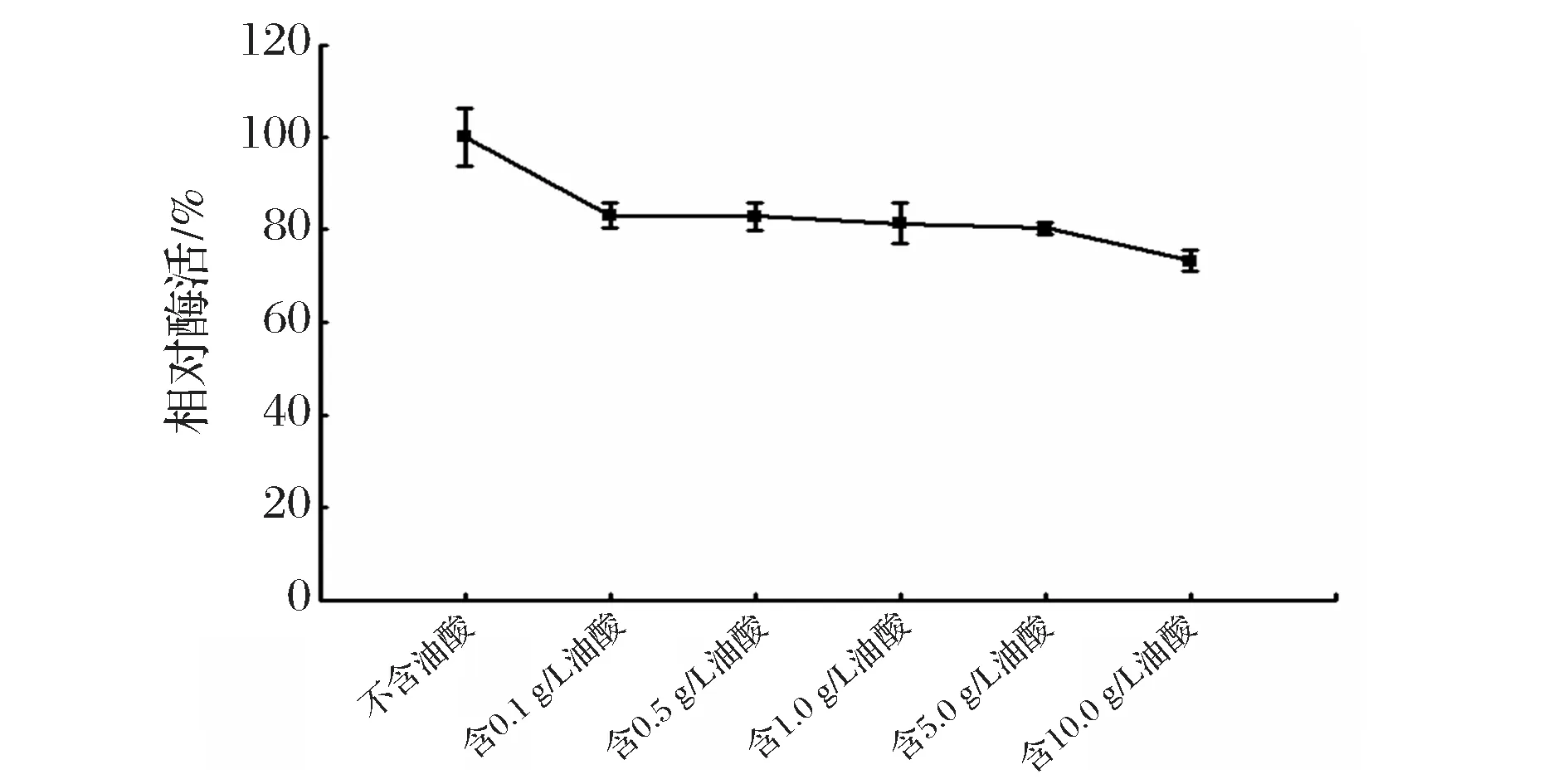
图4 含不同浓度油酸培养重组解脂耶氏酵母表达PAI的酶活对比Fig.4 Relative activity of PAI from recombinant Y. lipolitca cultivated in medium containing different concentration oleic acid
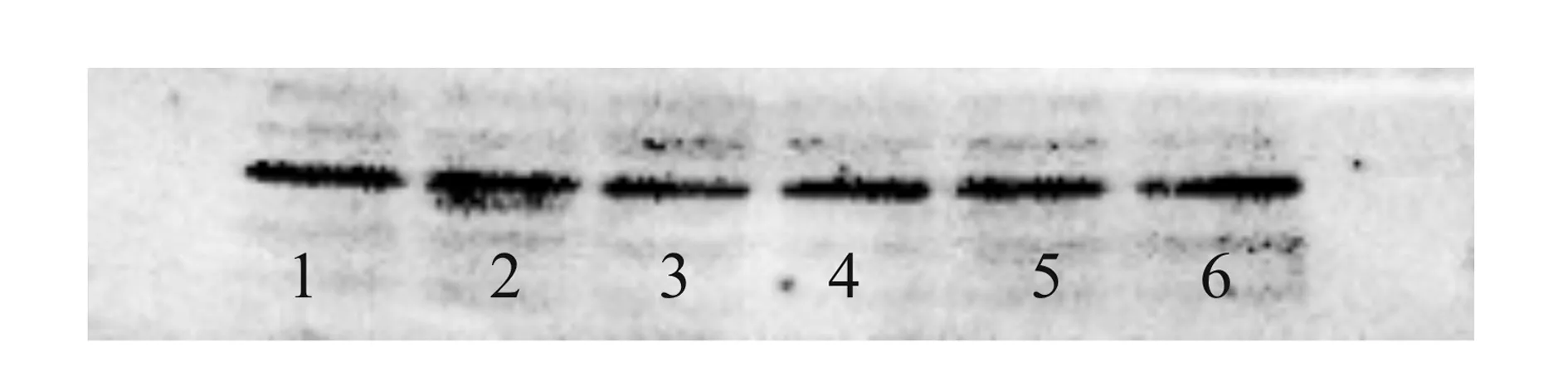
1-不含油酸;2-含0.1 g/L油酸;3-含10.0 g/L油酸;4-含0.5 g/L油酸;5-含1.0 g/L油酸;6-含5.0 g/L油酸图5 蛋白质免疫印迹法分析含不同浓度油酸培养重组解脂耶氏酵母PAI的表达Fig.5 Expression of PAI from recombinant Y. lipolitca cultivated in medium containing different concentration oleic acid by western blot method
2.4 重组解脂耶氏酵母全细胞催化合成t10,c12-CLA产量随时间的变化
利用不含油酸的培养基和含5 g/L油酸的培养基获得的菌体作为全细胞催化剂,合成t10,c12-CLA。图6表示全细胞催化过程中,细胞内的t10,c12-CLA含量随催化时间的变化,不含油酸组在42小时左右达到最高,而含5 g/L油酸组在22 h达到最高;图7中对应细胞外的t10,c12-CLA含量随时间的变化,也存在相同的趋势;综合图8,比较两实验组在全细胞催化不同时间点的t10,c12-CLA产量(细胞内外t10,c12-CLA总含量),含5 g/L油酸组在22 h左右产量达到最高,约10.1 g/L,不含油酸组在42 h左右产量达到最高,约9.5 g/L,前者产量略高于后者,催化时间缩短约20 h,可以推测,含较高浓度的油酸培养基培养重组解脂耶氏酵母,可以提高细胞通透性,在全细胞催化过程中,提高脂肪酸底物和产物进出菌体的速率。5 g/L是培养基中油酸含量的最优浓度,油酸浓度含量过高(含10 g/L油酸组),导致解脂耶氏酵母PAI表达量远低于不含油酸组(图4和图5),即使该条件下培养的细胞通透性可能更好,但t10,c12-CLA产率与不含油酸组无显著性差异(图3);油酸浓度含量过低(含0.1 g/L油酸组),细胞通透性可能未发生理想的变化,PAI表达量低于不含油酸组(图4和图5),致使t10,c12-CLA产率低于不含油酸组(图3)。
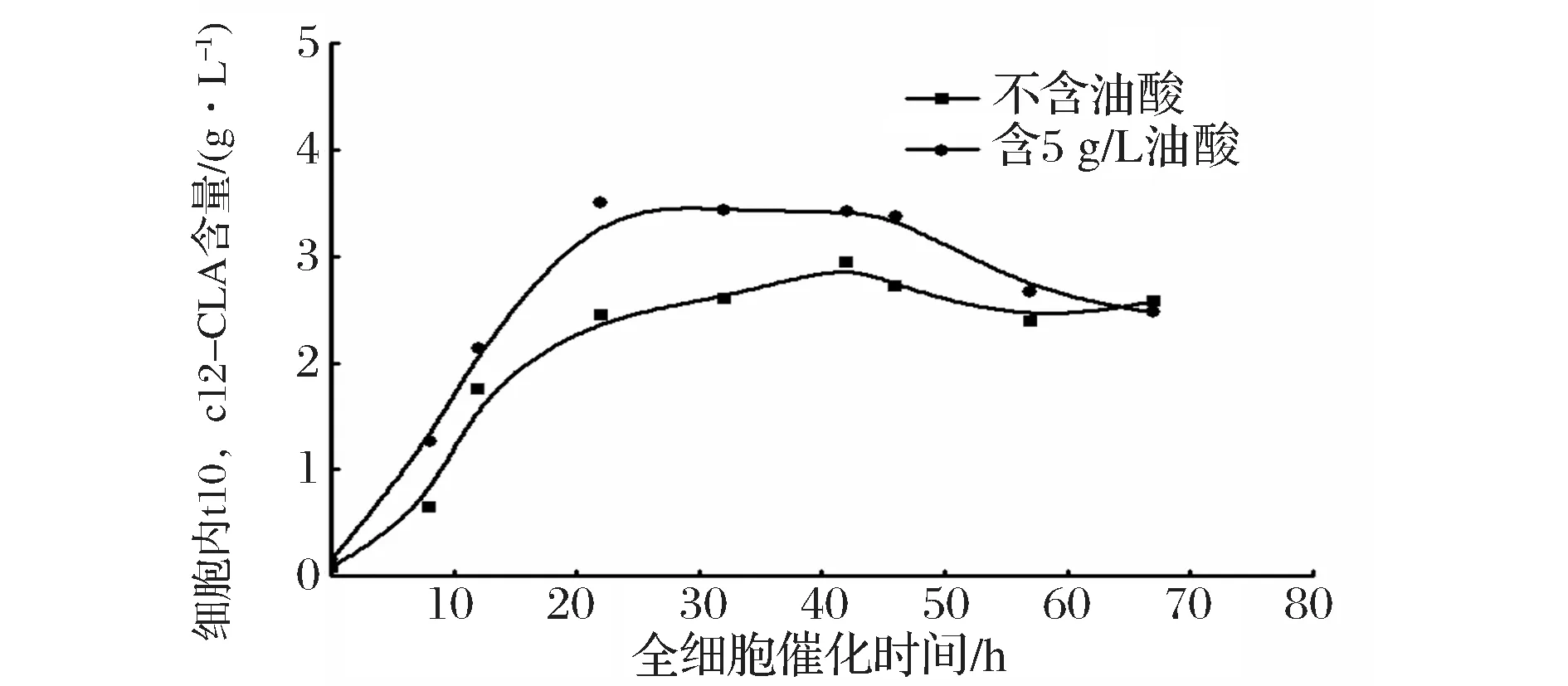
图6 重组解脂耶氏酵母全细胞催化细胞内不同时间点的t10,c12-CLA含量Fig.6 Production of intracellular t10,c12-CLA at different time during whole-cell catalysis using recombinant Y. lipolitca
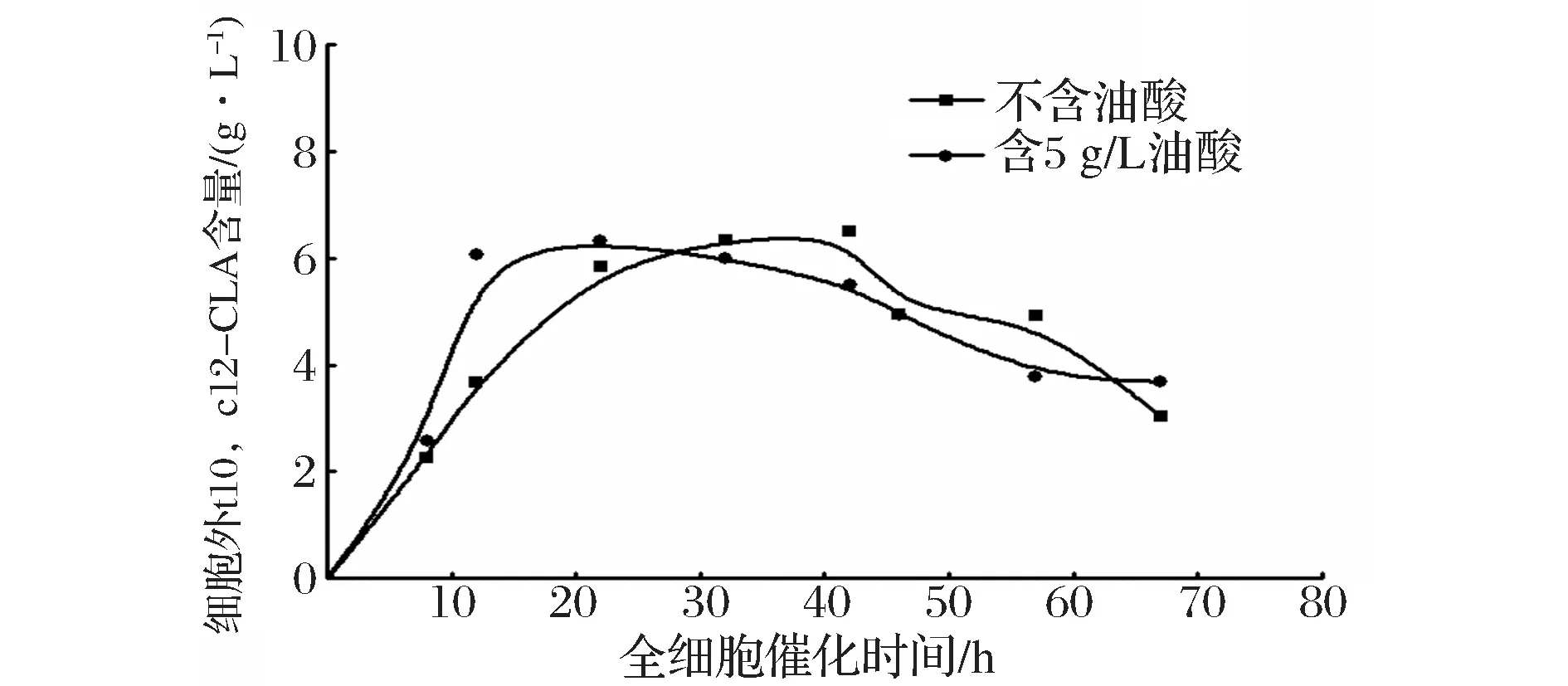
图7 重组解脂耶氏酵母全细胞催化细胞外不同时间点的t10,c12-CLA含量Fig.7 Production of extracellular t10,c12-CLA at different time during whole-cell catalysis using recombinant Y. lipolitca
目前,关于全细胞催化合成单一的t10,c12-CLA文献报道较少,HE将亚油酸异构酶(PAI)在酿酒酵母中成功异源表达,使PAI定位在细胞表面,外源添加c9,c12-LA为底物,全细胞催化20 h,优化反应条件后,仅仅获得25.4 mg/L的t10,c12-CLA产量,远远低于本实验未优化反应条件下10.1 g/L的t10,c12-CLA产量[15]。

图8 重组解脂耶氏酵母全细胞催化不同时间点的t10,c12-CLA产量Fig.8 Production of total t10,c12-CLA at different time during whole-cell catalysis using recombinant Y. lipolitca
2.5 透射电子显微镜(TEM)观察重组解脂耶氏酵母细胞
由图9的TEM图可以观察到,含5 g/L油酸(疏水性物质)培养基培养细胞,细胞壁和细胞膜之间的间隙明显扩大,而不含油酸培养基(葡萄糖为碳源)培养细胞壁膜间隙无明显变化,根据文献报道,该结构的变化与脂肪酸进入和输出解脂耶氏酵母相关[10]。
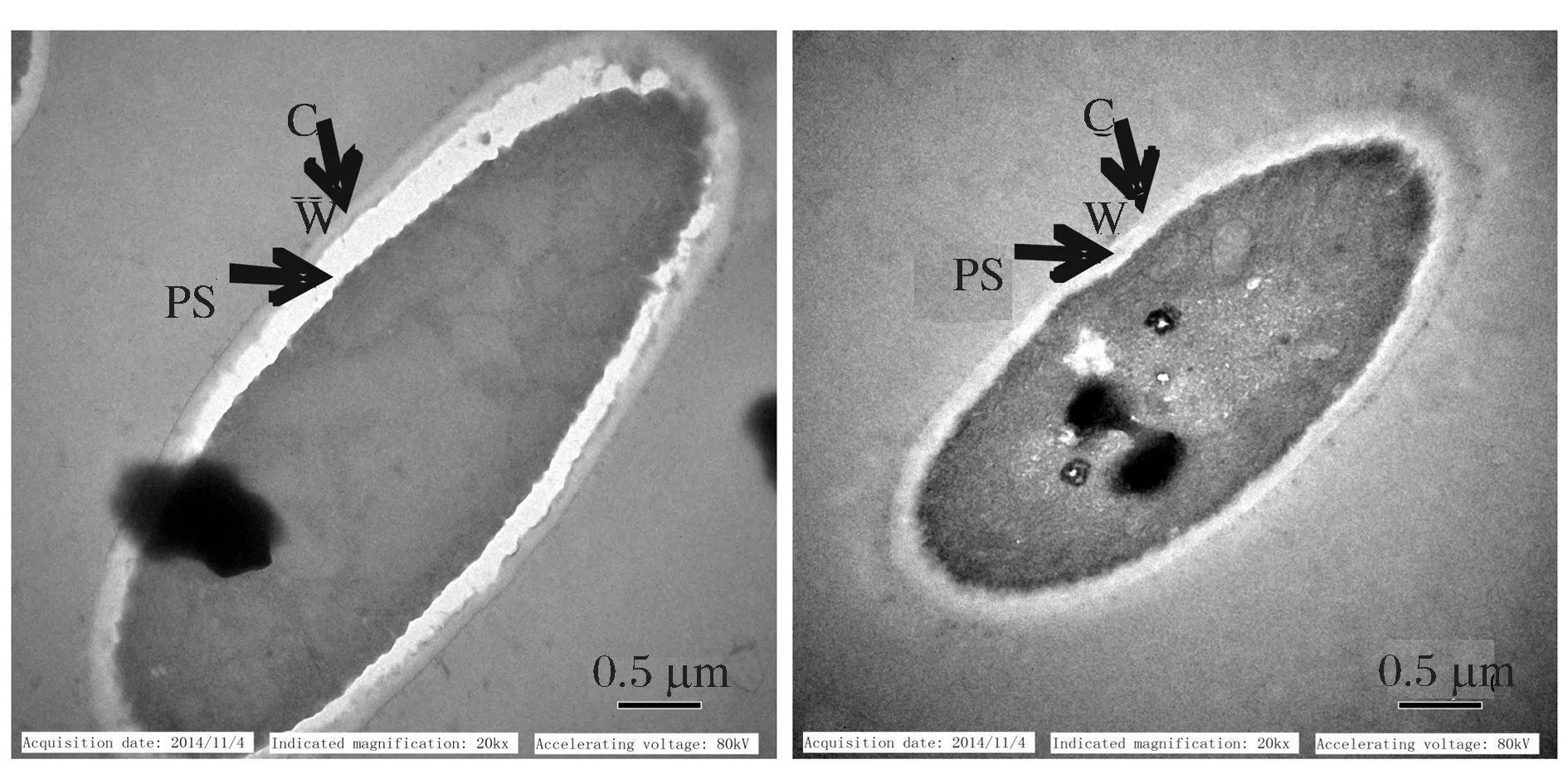
CW-细胞壁;PS-周质空间图9 含5.0 g/L油酸组(左)和不含油酸组(右)培养细胞TEM图Fig.9 TEM of cells from different medium: containing 5.0 g/L oleic acid(left) and no oleic acid(right)CW-cell wall, PS-periplasmic space
解脂耶氏酵母在脂肪酸(油酸)和烷烃类(癸烷、十六烷烃)等疏水性物质为碳源培养基中生长,表面会形成高约50 nm,宽约150 nm的突起结构;细胞的形态和生理状态也会发生明显变化,油酸为碳源中生长的解脂耶氏酵母,内质网、过氧化物酶体、脂质体和线粒体中关于疏水性物质降解的酶增多;周质空间由80 nm左右增加到150 nm左右,细胞壁由40 nm左右变薄为25 nm左右,这些变化提高了解脂耶氏酵母细胞在疏水性物质中的耐受性,也提高了疏水性物质在细胞中的运输效率[10,12]。根据本文的实验结果以及已有文献报道,进一步证明上述推测,利用含5 g/L油酸培养基培养解脂耶氏酵母,用于全细胞催化合成t10,c12-CLA,能够提高细胞通透性,进而缩短底物c9,c12-LA转化时间,提高t10,c12-CLA产物产量。
3 结论
含5 g/L油酸的培养基是培养重组解脂耶氏酵母细胞用于全细胞催化合成t10,c12-CLA的最优培养基,t10,c12-CLA产率为1.34 g/g,是不含油酸组(对照组)的1.4倍左右。通过对不同浓度油酸培养的重组解脂耶氏酵母中亚油酸异构酶(PAI)的表达量比较,发现油酸浓度越高,PAI的表达量越低。含5 g/L油酸组全细胞催化t10,c12-CLA产量达到最高点的时间为约22 h,不含油酸组约为42 h,催化反应可缩短约20 h,转化效率明显提高;透射电子显微镜观察到含5 g/L油酸组的重组解脂耶氏酵母细胞细胞壁和细胞膜的间隙扩大,可推测含油酸培养提高了细胞通透性,进而提高了全细胞催化过程中c9,c12-LA和t10,c12-CLA进出菌体的速率。综上所述,后期的重组解脂耶氏酵母全细胞催化合成t10,c12-CLA研究中,可选择含5 g/L油酸的培养基培养重组解脂耶氏酵母细胞,制备全细胞催化剂,高效合成t10,c12-CLA。
[1] PARIZA M W.Conjugated linoleic acid,a newly recognized nutrient[J].Chemistry & Industry,1997,16:464-466.
[2] Ma D W,FIELD C J,CLANDININ M T,et al.Countecurrent approach to the enrichment of Δ9c,11t- and Δ10,12c-18: 2 isomers by urea complexation[J]. Journal of the American Oil Chemists' Societ,2002,79(8):755-758.
[3] MASSO-WELCH P A,ZANGANI D,Ip C,et al.Inhibition of angiogenesis by the cancer chemopreventive agent conjugated linoleic acid[J].Cancer Research,2002,62(15):4 383-4 389.
[4] BROWN J M, MCINSTOSH M K.Conjugated linoleic acid in humans: regulation of adiposity and insulin sensitivity[J].The Journal of Nutrition,2003,133(10):3 041-3 046.
[5] RODRIGUEZ E, RIBOT J, PALOU A,et al.Trans-10,cis-12, but notcis-9,trnas-11 CLA isomer inhibits brown adipocyte thermogenic capacity[J].American Journal of Physiology,2002,282(6):R1789-R1797.
[6] LIAVONCHANKA A.Structure and biochemistry of polyunsaturated fatty acid double bond isomerase fromPropionibacteriumacnes[D].Göttingen:Georg August University, 2007:45-94.
[7] 张白曦.亚油酸异构酶基因在产油真菌中的异源表达及产物的生物合成[D].无锡:江南大学食品学院,2013:29-63.
[8] CARLA C.C.R, dE CARVALHO.Enzymatic and whole cell catalysis: Finding new strategies for old processes[J].Biotechnology Advances,2011,29:75-83.
[9] SEPP DIETER KOHLWEIN, FRITZ PALTAUF.Uptake of fatty acids by the yeasts,SaccharomycesuvarumandSaccharomycopsislipolytica[J].Biochimica et Blophysica Acta.1983,792:310-317.
[10] THEVENIEAU F, BEOPOULOS A, DESFOUGERES T,et al.Uptake and assimilation of hydrophobic substrates by the oleaginous yeastYarrowialipolytica[M].Handbook of Hydrocarbon and Lipid Microbiology,2010:1 514-1 525.
[11] SERAPHIM PAPANIKOLAOU,ISABELLE ChEVALOT,Michael KOMAITIS,et al.Kinetic profile of the cellular lipid composition in an oleaginousYarrowialipolyticacapable of producing a cocoa-butter substitute from industrial fats[J].Antonie van Leeuwenhoek,2001,80:215-224.
[12] KATERINA MLICKOVA,EMELINE ROUX,KARIN ATHENSTAEDT,et al.Lipid accumulation, lipid body formation, and acyl coenzyme A oxidases of the yeastYarrowialipolytica[J].Applied and Environmental Microbiology,2004,7:3 918-3 924.
[13] AMAL NAJJAR,SYLVIE ROBERT CLEMENCE GUERIN.Quantitative study of lipase secretion, extracellular lipolysis, and lipid storage in the yeastYarrowialipolyticagrown in the presence of olive oil: analogies with lipolysis in humans[J].Applied Microbiolal and Cell Physiology,2011,89:1 947-1 962.
[14] 李敏.重组耶氏解脂酵母合成反-10,顺-12-共轭亚油酸影响因素的研究[D].无锡:江南大学食品学院,2014:14-15.
[15] HE Xi-hong,SHANG Ji-ling,LI Fan,et al.Yeast cell surface display of linoleic acid isomerase fromPropionibacteriumacnesand its application for the production oftrans-10,cis-12 conjugated linoleic acid[J].Biotechnology and Applied Biochemistry, 2015,62(1):1-8.
Influence of medium containing oleic acid on synthesis of the trans 10, cis 12-conjugated linoleic acid by whole-cell catalysis using recombinant Yarrowia lipolitca
SONG Yu-hang,NI Li-juan,ZHANG Bai-xi,CHEN Wei,ZHANG Hao*
(School of Food Science and Technology,Jiangnan University,Waxi 21422, China)
The linoleic acid isomerase (PAI) has been successfully expressed inYarrowialipolyticato producetrans10,cis12-conjugated linoleic acid(t10,c12-CLA) by whole-cell catalysis using exogenous free linoleic acid (LA) as substrate. Whole cells were cultivated in medium containing oleic acid of different concentration (0.0, 0.1, 0.5, 1.0, 5.0, 10.0 g/L), and catalyzed in phosphate buffer. The highest yield oft10,c12-CLA was 1.34 g/g from culture containing 5.0 g/L oleic acid, which was 1.4 times of yield in experiment group without oleic acid. The PAI relative enzyme activity was analyzed and protein expression was checked by western blot. Results showed that the medium with more oleic acid leaded to lower expression of PAI. As for the production oft10,c12-CLA at different whole-cell catalysis time, the time of highestt10,c12-CLA production of experiment group with 5.0 g/L oleic acid was 20 h ahead of that of control group with 0.0 g/L oleic acid. We also investigated cell condition by transmission electron microscopy (TEM). Results showed that cells cultivated in the medium containing 5.0 g/L oleic acid displayed the wider space between cell wall and cell membrane, which might improve transporting/exporting speed of substrates and products between cells and environments, and finally increase conversion rate oft10,c12-CLA.
recombinantYarrowialipolitca; oleic acid;trans10,cis12-conjugated linoleic acid; conversion rate
10.13995/j.cnki.11-1802/ts.201610001
硕士研究生(张灏教授为通讯作者,E-mail:zhanghao@jiangnan.edu.cn)。
江苏省自然科学基金青年基金项目(BK20150144)
2016-02-27,改回日期:2016-04-06

