重组毕赤酵母产果糖基转移酶发酵条件的优化
郭文文,陈献忠,沈微,许菲,杨海泉*
1(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122) 2(江南大学生物工程学院,糖化学与生物技术教育部重点实验室,江苏 无锡,214122)
重组毕赤酵母产果糖基转移酶发酵条件的优化
郭文文1,陈献忠1,沈微1,许菲2,杨海泉2*
1(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122) 2(江南大学生物工程学院,糖化学与生物技术教育部重点实验室,江苏 无锡,214122)
果糖基转移酶(EC 2.4.1.9)是利用蔗糖为底物制备低聚果糖的关键酶。利用前期构建的产果糖基转移酶的重组毕赤酵母为出发菌株,对其进行发酵优化。最适发酵产酶条件为:装液量30 mL/250 mL、V(甘油)∶V(甲醇)=1∶20、初始pH为5.5、诱导温度为30 ℃、初始甲醇浓度为1.0%、后续甲醇浓度为1.5%、硫酸铵浓度10 g/L、诱导时间为120 h。在优化的发酵产酶条件下,重组果糖基转移酶酶活力达218.3 U/mL,较优化前提高了5倍。
果糖基转移酶;毕赤酵母;发酵条件;优化
低聚果糖(fructooligosaccharides)是一种新型保健食品[1],可促进人体肠道中益生菌的增殖、矿物质元素的吸收、抑制有害细菌和病源菌的生长等[2-3]。近年来,因其优越的生理功能而成为国际食品市场中广泛流行的功能性食品配料[4]。
果糖基转移酶(fructosyltransferase,EC 2.4.1.9),作为一种合成低聚果糖的酶类,是一种具有转移果糖基活力的水解酶[5]。果糖基转移酶具有广泛受体活性,能以乳糖、蔗糖为原料,合成果乳糖、蔗果三糖、蔗果四糖等低聚糖。因此,人们对果糖基转移酶生产低聚果糖越来越关注。微生物来源的果糖转移酶,因其不受季节限制,极具工业生产意义[6]。已报道的关于果糖基转移酶的生产主要集中在野生型微生物发酵、固定化[7]及少量关于重组酶表达方面的研究。LATEEF等[8]对黑曲霉(Aspergillusniger)菌株产果糖基转移酶分别进行了液态发酵和固态发酵产酶研究。在液态发酵过程中,30 ℃发酵120 h,发酵至48 h时酶活力达到最大酶,为24.49 U/mL。A.niger来源的果糖基转移酶基因在酿酒酵母(Saccharomycescerevisiae)中异源表达,在YPD培养基中30 ℃发酵48 h后重组果糖基转移酶最高酶活力可达19.8 U/mL[3]。
在前期研究工作中,我们构建了1株产果糖基转移酶的重组毕赤酵母(Pichiapastoris)GS-fru-4菌株,并对重组酶酶学性质进行了测定与分析[9]。本研究对上述已构建生产果糖基转移酶的菌株进行了系列发酵条件优化以提高酶的产量,这对重组果糖基转移酶的工业化生产与应用具有指导意义。
1 材料与方法
1.1 菌株与质粒
重组菌株P.pastorisGS-fru-4为实验室前期构建、保藏[9]。
1.2 培养基
YPD培养基:1% 酵母提取物、2% 胰蛋白胨、2% 葡萄糖。BMGY培养基:1% 酵母提取物、2% 胰蛋白胨、0.34% YNB、1%硫酸铵、1%甘油、4×10-5g/L 生物素、0.1 mol/L 磷酸缓冲液(pH 6.0)。BMMY培养基:除了用1%甲醇代替甘油外,其余成分均与BMGY相同。
YPD培养基在115 ℃灭菌15 min。BMGY、BMMY培养基均在110 ℃灭菌10 min, 生物素与甲醇均过滤除菌,待灭菌后加入。
1.3 培养方法
将重组P.pastorisGS-fru-4在YPD固体培养基上划线,30 ℃静置培养72 h。挑取重组P.pastoris单菌落,接种于BMGY培养基中,30 ℃、200 r/min 培养24 h。离心收集菌体,转接至BMMY培养基中,30 ℃、200 r/min发酵培养,每隔24 h补加甲醇使其终体积分数为1%,诱导培养96 h,停止发酵。
1.4 酶活定义及测定方法
将发酵液在4 ℃、8 000 r/min 离心10 min,收集上清,参照文献报道方法测定酶活力[10-11]。用pH 5.5的0.1 mol/L的柠檬酸-磷酸氢二钠缓冲液配制25%的蔗糖溶液为底物750 μL,加入250 μL稀释合适倍数的酶液,45 ℃反应30 min,沸水浴加热15 min,终止反应。酶活力单位定义为:在上述反应条件下,酶催化蔗糖每分钟产生1 μmol蔗果三糖所需的酶量为1个酶活单位(U)[12]。
1.5 装液量对产酶的影响
将重组P.pastorisGS-fru-4转接至不同装液量的发酵培养基(250 mL三角瓶装液量分别为15、20、25、30、35、40、45、50 mL)诱导培养,取样测定果糖基转移酶酶活力。
1.6 诱导阶段甘油添加对产酶的影响
将重组P.pastorisGS-fru-4转接至分别添加不同浓度(0、0.2%、0.5%、0.7%、1%)的甘油和1%甲醇的发酵培养基诱导培养,取样测定果糖基转移酶酶活力。
1.7 初始pH对产酶的影响
将重组P.pastorisGS-fru-4转接至不同初始pH值的发酵培养基诱导培养,取样测定果糖基转移酶酶活力。初始pH值分别为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5。
1.8 诱导温度对产酶的影响
将重组P.pastorisGS-fru-4转接至发酵培养基,在不同温度下(28、30、37 ℃)进行诱导培养,取样测定果糖基转移酶酶活力。
1.9 甲醇初始添加量对产酶的影响
将重组P.pastorisGS-fru-4转接至发酵培养基,选用不同的甲醇浓度(0.25%、0.5%、0.75%、1%、1.25%、1.5%、1.75%、2%)进行第一次甲醇诱导,每隔24 h添加1%浓度的甲醇诱导培养,取样测定果糖基转移酶酶活力。
1.10 甲醇添加量对产酶的影响
将重组P.pastorisGS-fru-4转接至不同甲醇浓度(0.5%、1%、1.5%、2%)的发酵培养基进行诱导培养,取样测定果糖基转移酶酶活力。
1.11 诱导阶段培养基中硫酸铵的浓度对产酶的影响
将重组P.pastorisGS-fru-4转接至不同硫酸铵浓度(3、5、7、10、12 g/L)的发酵培养基中诱导培养,取样测定果糖基转移酶酶活力。
1.12 诱导时间对产酶的影响
采用上述最优化培养条件,将重组P.pastorisGS-fru-4转接至发酵培养基中进行诱导发酵,每24 h取样测定果糖基转移酶酶活力和菌体干重变化情况。
2 结果与讨论
2.1 导阶段装液量对产酶的影响
在重组P.pastoris诱导培养过程中,溶氧控制是重要的一个因素。由于P.pastoris是好氧微生物,溶解氧浓度对菌体的生长和产物的生成均有较大影响。因此,较高的溶氧条件是提高发酵效率和产酶的一个重要保证。在摇瓶培养条件下,装液量对培养基中的溶解氧浓度具有重要影响。实验中分析了诱导阶段不同装液量对产酶和干重的影响,结果如图1所示。当装液量低于30 mL时,果糖基转移酶酶活力和干重逐渐增高。装液量为30 mL时,重组P.pastorisGS-fru-4发酵产果糖基转移酶的酶活力到达最大,为79.4 U/mL。此时,菌体干重也达到最高,为5.5 g/L。当装液量大于30 mL时,果糖基转移酶酶活力和干重随着装液量的增加而逐渐降低。这是因为装液量过大,会直接导致溶氧不足,进而影响菌体生长和果糖基转移酶的分泌表达。

图1 装液量对发酵产酶及菌体生长的影响Fig.1 Effect of the medium volume on producing fructosyltransferase and cell growth
2.2 诱导阶段甘油添加量对产酶的影响
为考察诱导阶段甘油添加对重组果糖基转移酶表达的影响,在诱导阶段改变了单一的甲醇诱导方式,采取了甲醇(M)、甘油(G)混合补料。实验过程中,每隔24 h分别补加1% (v/v)的甲醇以及0、0.2%、0.5%、0.7%、1.0%的甘油。结果如图2所示,果糖基转移酶酶活力在G/M=0.5时达到最大,为82.5 U/mL。但在其他G/M比例条件下,重组P.pastorisGS-fru-4表达果糖基转移酶酶活力均呈下降趋势。在G/M比例分别为0、0.2、0.7、1.0时,重组P.pastorisGS-fru-4表达果糖基转移酶酶活力分别为73.2、76.9、58.3、51.2 U/mL。从图2可以看出,随着G/M的增大,重组P.pastorisGS-fru-4菌体干重也逐渐增大。在G/M分别为0、0.2、0.5、0.7、1.0时,重组P.pastorisGS-fru-4的干重分别为5.76、6.89、8.56、9.31、9.78 g/L。这主要是因为甘油的添加能够提供有利于重组菌株生长所需的碳源和能量,但不宜过量否则会产生底物抑制效应[13]。
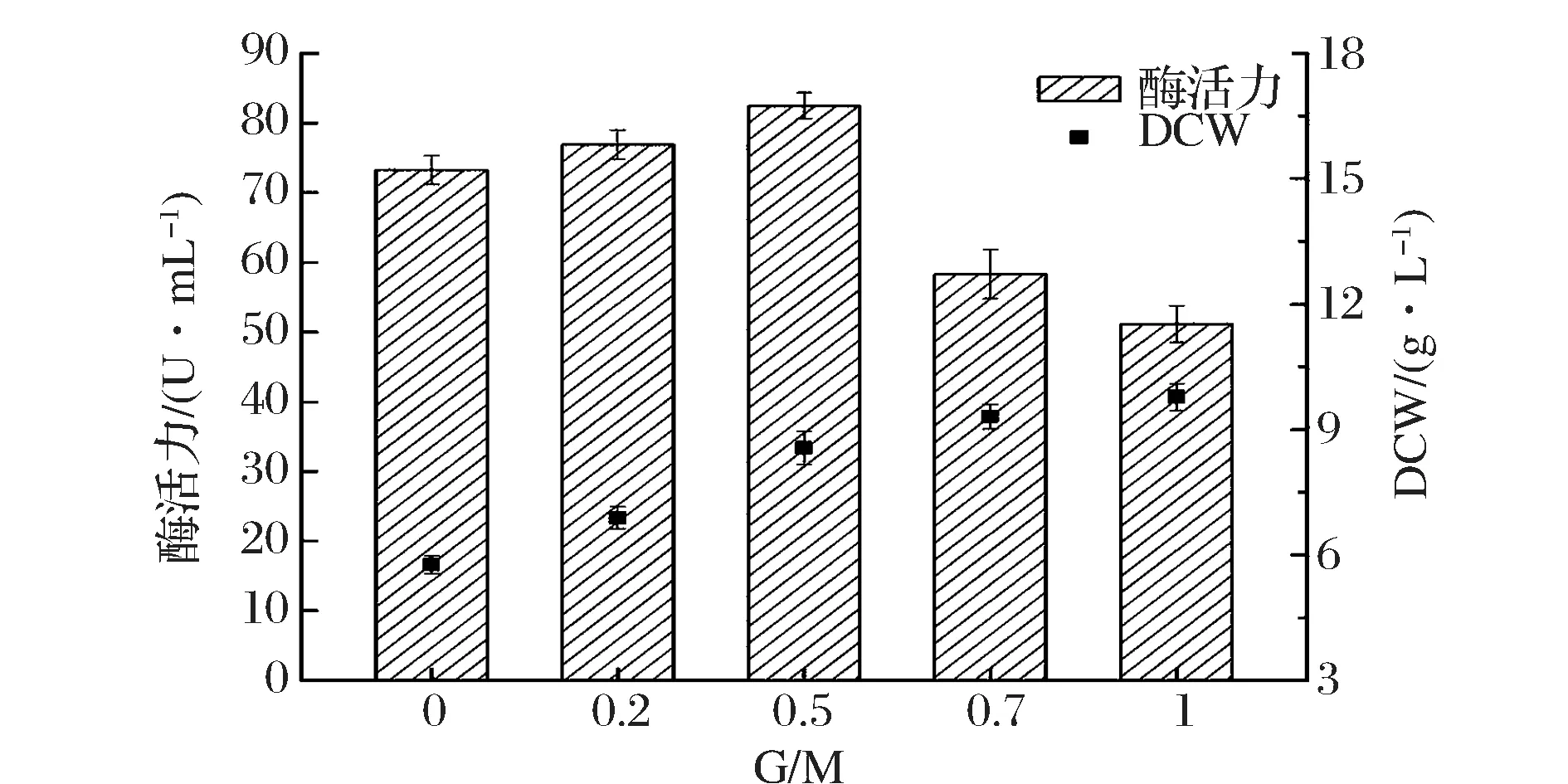
图2 甘油添加对产酶及菌体生长的影响Fig.2 Effect of glycerin addition on producing fructosyltransferase and cell growth
2.3 初始pH对产酶的影响
实验中分析了初始pH对重组P.pastorisGS-fru-4产酶及菌体生长的影响。如图3所示,发酵培养基初始pH为5.5时,重组P.pastorisGS-fru-4产果糖基转移酶的酶活力最高,达到92.1 U/mL。发酵培养基的pH过高或过低时,均导致重组P.pastorisGS-fru-4产果糖基转移酶的酶活力有所下降。智晓燕等[14]对P.pastoris重组菌表达白地霉脂肪酶(Geotrichumcandidumlipase,GCL)的初始pH等条件进行优化,确定最适初始pH为7.0。在该pH条件下,GCL酶活力最高(600 U/mL),比初始pH 6.0时提高了40%。如图3所示,当发酵培养基初始pH为6.0时,重组P.pastorisGS-fru-4细胞干重(DCW)最高,达到13.1 g/L。但是pH为6.0时,果糖基转移酶酶活力为87.1 U/mL,低于pH 5.5时的酶活力。说明pH 6.0更有利于重组P.pastoris菌体生长,却不利于产酶。
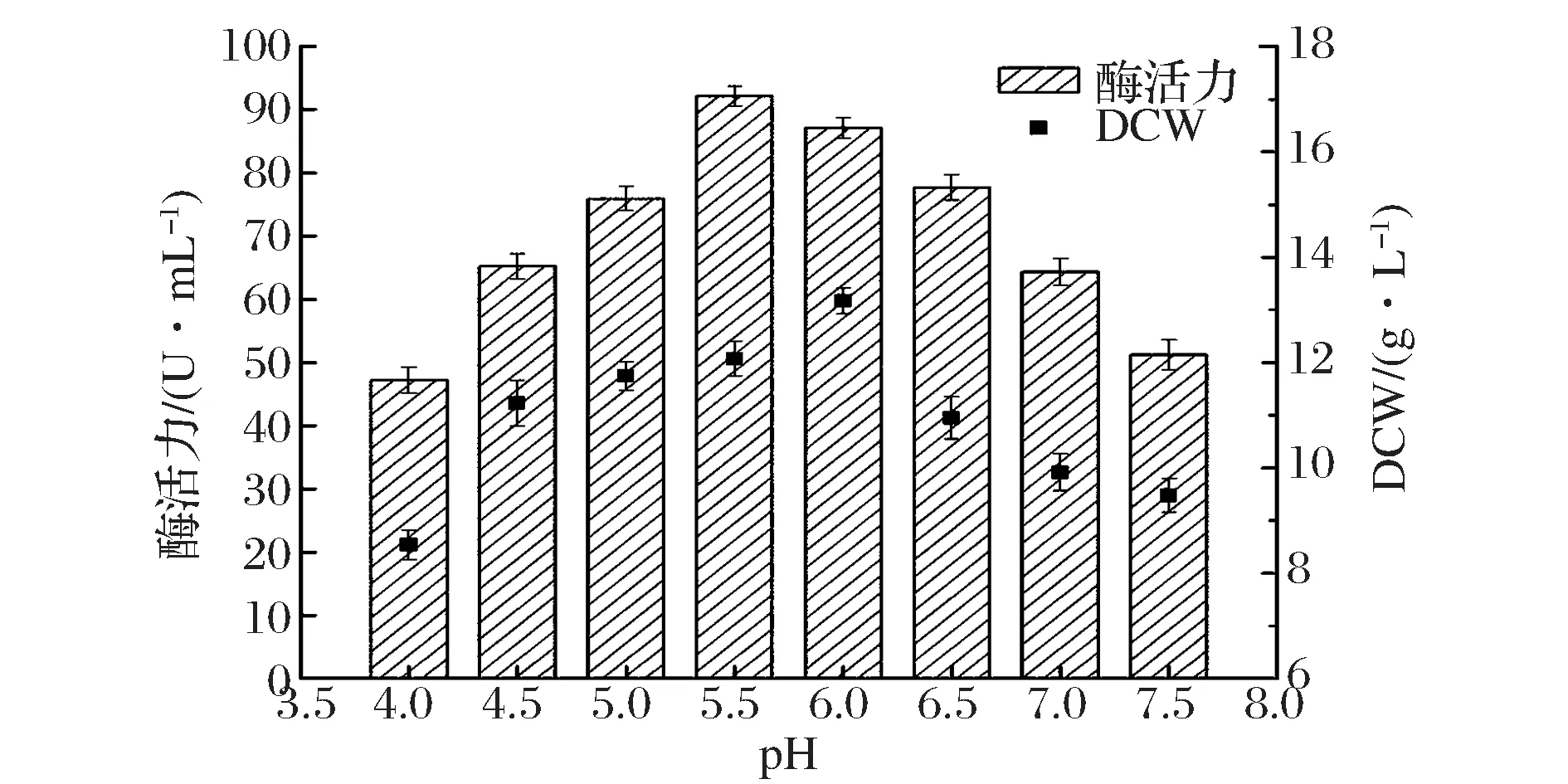
图3 初始pH对产酶和菌体生长的影响Fig.3 Effect of the initial pH on producing fructosyltransferase and cell growth
2.4 诱导温度对产酶的影响
温度主要通过影响发酵动力学特性、微生物代谢调节机制、菌体代谢产物合成的方向和发酵液的理化性质等方面,从而影响产物的合成和菌体的生长[15-17]。实验结果如图4所示,重组P.pastorisGS-fru-4菌株发酵生产果糖基转移酶的最适诱导温度是30 ℃,此温度下果糖基转移酶最高酶活力为93.2 U/mL。此时重组P.pastorisGS-fru-4细胞干重达到最大,为12.0 g/L。这说明重组P.pastorisGS-fru-4在30 ℃时,最适合该重组菌株的生长和生产重组果糖基转移酶。诱导温度为37 ℃时,重组P.pastorisGS-fru-4细胞干重和菌株产酶量都有所下降。
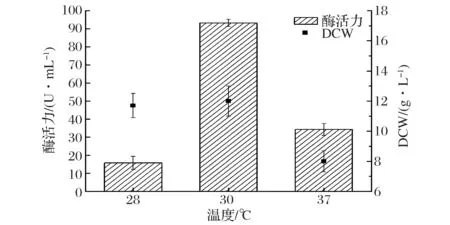
图4 温度对发酵产酶和菌体生长的影响Fig.4 Effect of the temperature on producing fructosyltransferase and cell growth
2.5 诱导阶段甲醇添加量对产酶的影响
甲醇浓度过高会使细胞中毒,且产生的过量过氧化氢也会使细胞中毒。因此,在诱导初期要控制培养基甲醇的初始浓度,使酵母逐渐适应甲醇环境,进一步促进细胞生长与产酶。实验中考察了不同初始甲醇添加量对重组P.pastorisGS-fru-4表达果糖基转移酶的影响,如图5所示。
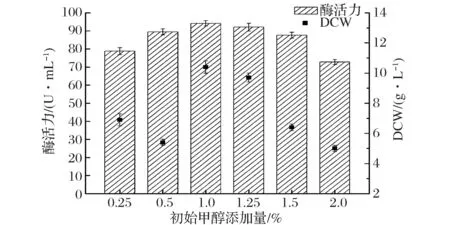
图5 初始甲醇添加量对产酶和菌体生长的影响Fig.5 Effect of the initial methanol concentration on producing fructosyltransferase and cell growth
在250 mL摇瓶发酵过程中,当初始甲醇添加量为1.0% (v/v)时,重组P.pastorisGS-fru-4表达果糖基转移酶的酶活力最高,达到94.2 U/mL。但其他初始甲醇添加浓度条件下,重组果糖基转移酶酶活力均会下降。同时,当初始甲醇添加量为1.0% (v/v)时,重组P.pastorisGS-fru-4细胞干重最大,为10.4 g/L。随着初始甲醇添加量的增加,重组P.pastorisGS-fru-4细胞干重下降。当初始甲醇添加量为2.0% (v/v)时,重组P.pastorisGS-fru-4细胞干重降为5.0 g/L。
在诱导中后期,这时菌体已经适应了甲醇环境,可以适当增加甲醇的添加量,实现重组酶过量表达。研究过程中,考察了诱导阶段不同甲醇添加量对重组P.pastorisGS-fru-4表达果糖基转移酶的影响。如图6所示,当甲醇添加量控制在1.0%~1.5% (v/v)时,果糖基转移酶酶活力较高。但当甲醇添加量较高(>1.5%)或较低(< 1.0%)时,果糖基转移酶酶活力下降则比较显著,最多下降30%以上。当甲醇添加量为1.5% (v/v)时,重组P.pastorisGS-fru-4诱导产果糖基转移酶酶活力最高,达到101.2 U/mL。同时,甲醇添加量对细胞生长会造成一定的影响。如图6所示,甲醇添加量为1.0% (v/v)最有利于重组P.pastorisGS-fru-4细胞生长,诱导96 h后其干重达到最大,为8.0 g/L。因此,1.5% (v/v)甲醇添加量更适合重组P.pastorisGS-fru-4表达果糖基转移酶,而1.0% (v/v)甲醇添加量更适合重组P.pastorisGS-fru-4菌体生长。

图6 甲醇添加量对产酶及菌体生长的影响Fig.6 Effect of the methanol concentration on producing fructosyltransferase and cell growth
2.6 诱导阶段培养基中不同硫酸铵添加量对产酶的影响
硫酸铵作为重组P.pastoris菌株在诱导阶段的氮源之一,有助于细胞生长,同时对合成重组蛋白质也具有重要意义。实验中分析了不同硫酸铵浓度对重组P.pastorisGS-fru-4产果糖基转移酶的影响。结果如图7所示,不同浓度的硫酸铵添加对重组P.pastorisGS-fru-4产果糖基转移酶具有明显影响。随着硫酸铵浓度的增加,重组P.pastorisGS-fru-4产果糖基转移酶的酶活力逐渐增大,细胞干重也逐渐增加。当硫酸铵浓度为10 g/L时,果糖基转移酶酶活力达到最高,为102.3 U/mL。此时,重组P.pastorisGS-fru-4细胞干重也达到最大,为13.3 g/L。
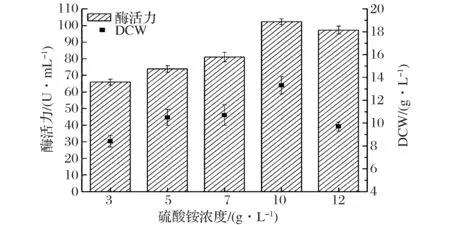
图7 不同硫酸铵添加量对产酶和菌体生长的影响Fig.7 Effect of the ammonium sulfate concentration on producing fructosyltransferase and cell growth
2.7 诱导时间对产酶的影响
综合上述优化结果,对诱导时间对产酶的影响进行了测定分析。如图8所示,随着诱导时间的延续,重组P.pastorisGS-fru-4菌株发酵生产果糖基转移酶酶活力逐渐提高,菌体干重也出现了相应趋势。甲醇诱导120 h时,重组P.pastorisGS-fru-4菌株发酵生产果糖基转移酶酶活力达到最高(218.3 U/mL),此时P.pastoris细胞干重为8.7 g/L。在甲醇诱导144 h时,重组P.pastorisGS-fru-4细胞干重达到最大(9.7 g/L),此时果糖基转移酶的酶活力下降为94.4 g/L。继续诱导发酵,果糖基转移酶的酶活力和细胞干重都下降,这可能是因为营养物质的消耗、代谢产物的积累、生长空间限制等导致了菌体衰退、老化。

图8 诱导时间对产酶和菌体生长的影响Fig.8 Effect of inducing time on producing fructosyltransferase and cell growth
3 结论
P.pastoris是甲醇营养型酵母,能够利用甲醇作为唯一碳源和能源进行代谢。以甲醇为碳源,P.pastoris会代偿性地产生大量的酶。调控生产醇过氧化氢酶的启动子也是驱动P.pastoris外源基因表达的启动子。实验中采用已构建可表达果糖基转移酶的重组P.pastorisGS-fru-4为出发菌株,对其进行发酵优化研究。研究发现装液量、甘油:甲醇、pH、温度、甲醇浓度、硫酸铵浓度等条件对P.pastorisGS-fru-4生产重组果糖基转移酶具有重要意义。其中,获得的最优产酶条件为:装液量30 mL、甘油∶甲醇=1∶20、初始pH 5.5、诱导温度30℃、初始甲醇浓度为1.0%、后续甲醇浓度为1.5%、硫酸铵浓度10 g/L、诱导时间为120 h。在该最优条件下,果糖基转移酶酶活力为218.3 U/mL。由实验结果可以看出,重组果糖基转移酶的生产与P.pastoris菌体的生长基本成正相关关系。过高或过低的甲醇浓度均不利于重组果糖基转移酶的生产,这主要是因为甲醇浓度过低时碳源不足,菌体生长欠佳影响了产酶量;甲醇浓度过高时,过高的甲醇浓度对菌体细胞具有毒害作用,影响了细胞的生产和产酶量。研究结果对重组果糖基转移酶的工业化生产及应用具有重要指导意义。
[1] 胡学智,伍剑锋.低聚果糖的生理功能及生产、应用[J].中国食品添加剂,2007(6):148-157.
[2] 杭锋,伍剑锋,王荫榆,等.低聚果糖调节人体肠道菌群功能的研究[J].乳业科学与技术,2010(3):108-111.
[3] 王一恬,张玲,沈微,等.果糖基转移酶在酿酒酵母中异源表达及酶学性质分析[J].食品与发酵工业,2015,41(6):24-28.
[4] SANGEETHA P T,RAMESH M N,PRAPULLAa S G.Production of fructosyltransferase byAspergillusoryzaeCFR 202 in solid-state fermentation using agricultural by-products [J].Applied Microbiology and Biotechnology,2004,65(5):530-537.
[5] DHAKE A B,PATIL M B.Effect of substrate feeding on production of fructosyltransferase byPenicilliumpurpurogenum[J].Brazilian Journal of Microbiology,2007,38(2):194-199.
[6] 王立梅.Aspergillusjaponicus果糖基转移酶及其改性大豆低聚糖的研究[D].无锡:江南大学,2006.
[7] 姚盟成,杨丽萍,司建华,等.果糖基转移酶的固定化及其性质研究[J].食品工业科技,2012,33(20):164-167.
[8] LATEEF A,OLOKE J K,GUEGUIM-KANA E B,etal.Production of fructosyltransferase by a local isolate ofAspergillusnigerin both submerged and solid substrate media [J].ACTA ALIMENTARIA,2012,41(1):100-117.
[9] GUO Wen-wen,YANG Hai-quan,QIANG Shu-min,etal,Overproduction,purification,and property analysis of an extracellular recombinant fructosyltransferase [J].European Food Research and Technology,2015,doi:10.1007/s00217-015-2620-x.
[10] SALINAS M A,PEROTTI N I.Production of fructosyltransferase byAureobasidiumsp. ATCC 20524 in batch and two-step batch cultures [J].Journal of Industrial Microbiology & Biotechnology,2009,36(1):39-43.
[11] ARRIZONJ,MORELl S,GSCHAEDLERA,et al.Fructanase and fructosyltransferase activity of non-Saccharomycesyeasts isolated from fermenting musts of Mezcal[J].Bioresource Technology,2012,110:560-565.
[12] 蒋波.高活力果糖基转移酶的菌种选育及生产工艺优化研究[D].广州:华南理工大学,2014.
[13] 宋留君,周长林,窦洁,等.甘油对毕赤酵母高密度发酵表达重组水蛭素Ⅱ的影响[J].中国药科大学学报,2006,37(4):371-374.
[14] 智晓燕,汪小锋,孙永川,等.多拷贝毕赤酵母重组菌表达GCL摇瓶优化和高密度发酵[J].中国生物工程杂志,2012,32(2):82-89.
[15] WEI Gong-yuan,LI Yin,DU Guo-cheng,et al.Application of a two-stage temperature control strategy for enhanced glutathione production in the batch fermentation byCandidautilis[J].Biotechnology Letters,2003, 25(11): 887-890.
[16] 史文婷,刘寅,赵越,等.米曲霉产果糖基转移酶发酵条件优化与分离纯化[J].食品工业科技,2014,35(14):211-215.
[17] 杨宇,李娜,李秀娜,等.毕赤酵母表达Q8008发酵条件的优化研究[J].蛇志,2014,26(4):367-373.
Optimization of fermentation conditions for fructosyltransferase production by recombinant Pichia pastoris
GUO Wen-wen1, CHEN Xian-zhong1, SHEN Wei1, XU Fei2, YANG Hai-quan2*
1 (Key Laboratory of Industrial Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, China) 2 (Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, China)
Fructosyltransferase (EC 3.2.19) is used in the production of fructooligosaccharides using sucrose as the substrate. A recombinantP.pastorisstrain previously constructed as original strain was optimized to over-express fructosyltransferase. In this study, the optimal fermentation conditions were as follows: medium volume 30 mL/250 mL, glycerol∶methanol=1∶20 (v/v), the initial pH 5.5, inducing temperature 30 ℃, the initial methanol concentration 1.0%, the subsequent methanol concentration 1.5%, ammonium sulfate concentration 10 g/L and inducing time 120 h. Under the optimal condition, the yield of recombinant fructosyltransferase reached 218.3 U/mL, which was 5-fold higher than that before optimization.
fructosyltransferase;Pichiapastoris;fermentation conditions; optimization
10.13995/j.cnki.11-1802/ts.201610007
硕士研究生(杨海泉副教授为通讯作者,E-mail: haiquanyang@jiangnan.edu.cn)。
工业生物技术教育部重点实验室(江南大学)开放课题基金(KLIB-KF201404)
2016-02-25,改回日期:2016-04-13

