高氧气调包装对双孢蘑菇抗氧化活性及褐变的影响
程曦,赵春霞,李云云,李婧,张敏
(西南大学食品科学学院,农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆市特色食品工程技术研究中心,重庆,400715)
高氧气调包装对双孢蘑菇抗氧化活性及褐变的影响
程曦,赵春霞,李云云,李婧,张敏*
(西南大学食品科学学院,农业部农产品贮藏保鲜质量安全风险评估实验室(重庆),重庆市特色食品工程技术研究中心,重庆,400715)
研究高氧气调包装对双孢蘑菇褐变及其抗氧化能力的影响。采用80%O2+20%N2高氧气调对双孢蘑菇进行包装处理,检测其贮藏过程中的白度、丙二醛(MDA)含量、相对电导率、抗氧化酶以及抗氧化活性物质。结果表明,高氧气调包装能显著提高双孢蘑菇的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性,并维持较高过氧化物酶(POD)活性和总酚含量,抑制超氧阴离子产生速率。同时,高氧气调包装可以显著延缓丙二醛(MDA)含量及相对电导率的增加,维持细胞膜的完整性,抑制褐变。根据指标间的相关性分析推测,高氧气调抑制双孢蘑菇的褐变可能与高氧气调提高其抗氧化能力有关。
高氧气调包装;双孢蘑菇;褐变;抗氧化性
双孢蘑菇是世界上产量最高、消费量最大的一种食用菌,含有多种氨基酸、蛋白质、维生素和矿物质等。此外,双孢蘑菇还具有较高的药用价值,经常食用可以预防坏血病、肿瘤等疾病。双孢蘑菇采后因无角质层等保护膜的保护,易受机械损伤和微生物侵染,常温下2 d内即变色变质。有研究表明[1],高氧气调包装能有效抑制果蔬生理活性变化,防止褐变及微生物侵染,从而延长果蔬的保鲜期。正常状态下,植物体内的活性氧自由基含量极低且处于平衡状态,但当处于逆境条件下时,其产生和清除变化失去平衡。当果蔬处于冷冻、低氧或高氧等环境胁迫条件下时,细胞内的活性氧自由基增多。过多的活性氧自由基会加速组织的脂质氧化,对细胞膜造成损伤,细胞膜损伤导致的酶和底物隔离分布减弱是引发褐变的直接诱因[2]。细胞中的活性氧自由基清除体系会清除过多的活性氧自由基,保持膜的稳定性和完整性,为细胞提供免疫防护。陈学红[3]等研究表明, 高氧处理能有效抑制草莓果实Vc 含量的下降, 促进总酚和花青素含量及自由基清除能力的上升, 从而提高了草莓果实的抗氧化活性。对鲜切莴苣的研究也显示出一致的效果[4]。目前,针对不同果蔬品种,高氧气调对其抗氧化性的影响不尽相同,而关于高氧气调对双孢蘑菇褐变及抗氧化活性影响的研究也鲜有报道。本实验室前期研究表明,80%O2对双孢蘑菇的总体保鲜效果最好[5]。在此基础上,本实验主要通过对双孢蘑菇进行高氧气调包装,研究高氧气调包装对双孢蘑菇褐变、细胞膜完整性、抗氧化酶以及抗氧化活性物质的影响,深入研究高氧气调包装在双孢蘑菇贮藏期间对其抗氧化活性及褐变的影响。
1 材料与方法
1.1 原料
新鲜双孢蘑菇购于北碚天生农贸市场。要求同批采收,无病虫害和机械损伤,菇体颜色均匀,成熟度、大小、形状一致。
乙二胺四乙酸二钠、EDTA、二硫苏糖醇、三氯乙酸、2-硫代巴比妥酸、无水乙醇、无水对氨基苯磺酸、α-萘胺、盐酸羟胺、30%过氧化氢、福林酚,成都科龙化工试剂厂;L-蛋氨酸、核黄素、氯化硝基氮蓝四唑,重庆川东化工试剂公司;愈创木酚、TritonX-100、PVP、PEG6000,重庆北碚化学试剂厂。
1.2 主要仪器设备
MAP-500D气调包装机,上海炬钢机械制造有限公司;HWS低温恒温恒湿箱,宁波东南仪器有限公司;UltraScan® PRO测色仪,美国HunterLab公司;H1650R台式高速冷冻离心机,湖南湘仪;DDS-307A电导率仪,上海雷磁公司;UV-2450PC紫外可见分光光度计,日本岛津公司;722可见分光光度计,上海菁华科技仪器有限公司。
1.3 试验方法
1.3.1 样品制备
双孢蘑菇购买后立即运送到实验室进行高氧气调包装。实验组为80%O2+20%N2,对照组为空气。蘑菇要求色泽洁白,无病虫害,无机械损伤,菌柄长度不超过1cm,子实体直径(5.5±1) cm,放置在15 cm×15 cm的塑料托盘上,装入30 cm×40 cm的40 μPE(O2透过量为2.25×10-3cm3/m2·d·Pa,CO2透过量为7.13×10-3cm3/m2·d·Pa)塑料袋中,每袋(100±5) g。将包装后的双孢蘑菇放于(5±1) ℃,RH 90%条件下贮藏。每2 d测1次指标。
1.3.2 白度值测定
参考JAWORSKA等[6]方法。采用UltraScan® PRO测色仪测量双孢蘑菇伞盖的白度值,用L*表示。L*值越大,表示颜色越白,白度程度越大。
1.3.3 SOD活性
参考GIANNOPOLITIS等[7]方法并稍作修改。称取3.0g样品、3.0mL提取缓冲液,在冰浴下用研钵研磨成浆,于4℃、12 000 r/min离心30 min,收集上清液即为酶提取液。取一指形玻璃管,分别加入1.7 mL 50 mmol/L pH 7.8磷酸缓冲液、0.3mL 130 mmol/LL-蛋氨酸、0.3 mL 750 μmol/L 氮蓝四唑溶液、0.3 mL 100 μmol/L EDTA-Na2溶液,最后加入0.3 mL 20 μmol/L 核黄素溶液和0.1 mL 酶提取液。2支对照管中加入50 mmol/L pH 7.8磷酸缓冲液,一支置于暗处,另一支和其他管置于30 W日光灯下反应30 min后立即取出,放于暗处终止反应。以不照光管为参比调零,于560 nm处测吸光度值。以每克果蔬样品每分钟的反应体系对氮蓝四唑光化还原的抑制为50%为1个SOD活性单位,计算SOD活性。
1.3.4 CAT活性
参考AEBI等[8]方法并稍作修改。称取3.0 g样品、3.0 mL提取缓冲液(含有5 mmol/L DTT、5%PVP、0.1 mol/L pH 7.8磷酸缓冲液),在冰浴条件下用研钵研磨成浆,于4 ℃、12 000 r/min离心30 min,收集上清液即为酶提取液。酶促反应体系由0.2 mL酶液、1.5 mL pH 7.8磷酸缓冲液、1 mL蒸馏水、0.3 mL 0.1 mol/L H2O2组成。在240 nm处测吸光度值,以每克果蔬样品每分钟吸光度变化值减少0.01为1个过氧化氢酶活性单位,计算CAT活性。
1.3.5 POD活性
参考MOERSCHBACHER等[9]方法并稍作修改。称取3.0 g样品、3.0 mL提取缓冲液,在冰浴下用研钵研磨成浆,于4 ℃、12 000 r/min离心30 min,收集上清液即为酶提取液。取一试管,加入3 mL 25 mmol/L愈创木酚溶液、0.5 mL酶提取液、200 μL 0.5 mol/LH2O2溶液后开始计时。在470 nm处测吸光度值,以每克果蔬样品每分钟吸光度变化值增加0.01为1个过氧化物酶活性单位,计算POD活性。
1.3.6 总酚含量测定
参考SINGLETON等[10]方法并稍作修改。取1 g样品、4 mL 80%乙醇溶液,在冰浴中研磨成浆,用蒸馏水定容到10 mL,于4 ℃下避光提取20 min,期间摇动数次,过滤。将滤液稀释10倍后备用。取0.1 mL稀释后的样品、0.5 mL福林酚、1.5 mL 20%碳酸钠于10 mL容量瓶中,摇匀,75 ℃反应10 min,冷却后于760 nm处测吸光度值。然后以不同浓度的没食子酸制作标准曲线,计算总酚含量(μg/g)。
1.3.7 超氧阴离子产生速率测定
参考YAN等[11]方法。取3 g样品、3 mL提取缓冲液(1 mmol/L EDTA、0.3%TritonX-100、2%PVP、50 mmol/L pH 7.8磷酸缓冲液),在冰浴条件下用研钵研磨成浆,于4 ℃、12 000×g离心30 min,收集上清液即为酶提取液。取1 mL酶提取液,加入1.0 mL 50 mmol/L pH 7.8磷酸缓冲液和1.0 mL 1 mmol/L盐酸羟胺溶液,摇匀并在25 ℃保温20 min。取出后加入1.0 mL 17 mmol/L对氨基苯磺酸溶液和1.0 mL 7 mmol/L α-萘胺溶液。混匀后在25 ℃保温20 min进行显色反应后在530 nm处测其吸光度值。由标准曲线查的超氧阴离子物质的量,以每分钟每克双孢蘑菇产生的超氧阴离子的物质的量作为其产生速率[μmol/(min·g)]。
1.3.8 MDA含量测定
参考HEATH等[12]方法并稍作修改。取1 g样品、5 mL 100 g/L 三氯乙酸在冰浴中研磨成浆,于4 ℃、4 000 r/min离心20 min后,低温保存备用。取上清液2 mL、2 mL 0.67%硫代巴比妥酸,混匀后于95 ℃下加热15 min,并在冰浴下快速冷却。4 000 r/min离心10 min后在450 nm、532 nm、600 nm处测其吸光度值。
MDA浓度c/(μmol·L-1)=6.45(A532-A600)-0.56A450
(1)
MDA含量/(nmol·L-1)=c×提取液体积×稀释倍数/样品鲜重
(2)
1.3.9 相对电导率测定
参考曹建康等[13]方法。取双孢蘑菇5 g,用打孔器切成厚3 mm、直径3 mm的圆片,放于40 mL重蒸水(25 ℃恒温)中1 h。搅拌均匀后测电导率(γ0),然后将浸有样品的重蒸水加热至沸腾,30 min后拿出自然冷却至25 ℃,加重蒸水至原刻度,测其电导率(γ1)。相对电导率为γ0/γ1×100%。
1.4 数据分析
用SPSS 13.0软件进行统计分析,Duncan法进行显著性分析,Pearson法进行相关性分析;采用Origin 7.5制图。
2 结果与讨论
2.1 高氧气调包装对白度值的影响
白度是衡量双胞蘑菇商品价值的重要指标之一,蘑菇的采后褐变会降低其食用和商品价值。如图1所示,在整个贮藏期,L*值均呈下降趋势,其中,贮藏前期和贮藏后期下降明显,第6~10天变化较平缓。相同贮藏条件下,80%O2处理组L*值最高,与对照组差异显著(P<0.05)。而有研究表明[14],双孢蘑菇的L*值在80以下时,已不具备商品性。所以,80%O2处理组在第12天时仍能受到消费者青睐,而对照组在第6天时已失去其销售价值。高氧能明显维持双孢蘑菇较高的白度值,与DUAN等[15]使用纯氧对荔枝进行处理得出的结论一致。

图1 高氧气调包装对双孢蘑菇白度的影响Fig.1 Effect of high oxygen modified atmosphere packaging on the browning of the Agaricus bisporus
2.2 高氧气调包装对SOD活性的影响
SOD是果蔬体内活性氧自由基清除酶系统的重要防御酶,能有效抑制细胞内活性氧的增加,防止膜脂过氧化[16]。如图2所示,在贮藏第2天,21%O2处理组SOD活性上升,而80%O2处理组活性呈下降趋势,这可能是因为在未受到高氧胁迫前,细胞内活性氧自由基与自由基清除酶系统保持在稳定状态,而初始的高浓度氧气产生了大量的活性氧自由基,导致SOD活性降低。在2d后,80%O2处理组SOD活性持续上升,并在第8天达到最大值,与21%O2处理组差异显著(P<0.05)。由此可知,80%O2处理组能明显提高SOD的活性,从而抑制超氧化物自由基的增加,降低细胞中活性氧水平。这与MAGHOUMI等[17]对石榴皮进行高氧处理后,表面高氧处理能明显提高SOD活性的结果一致。
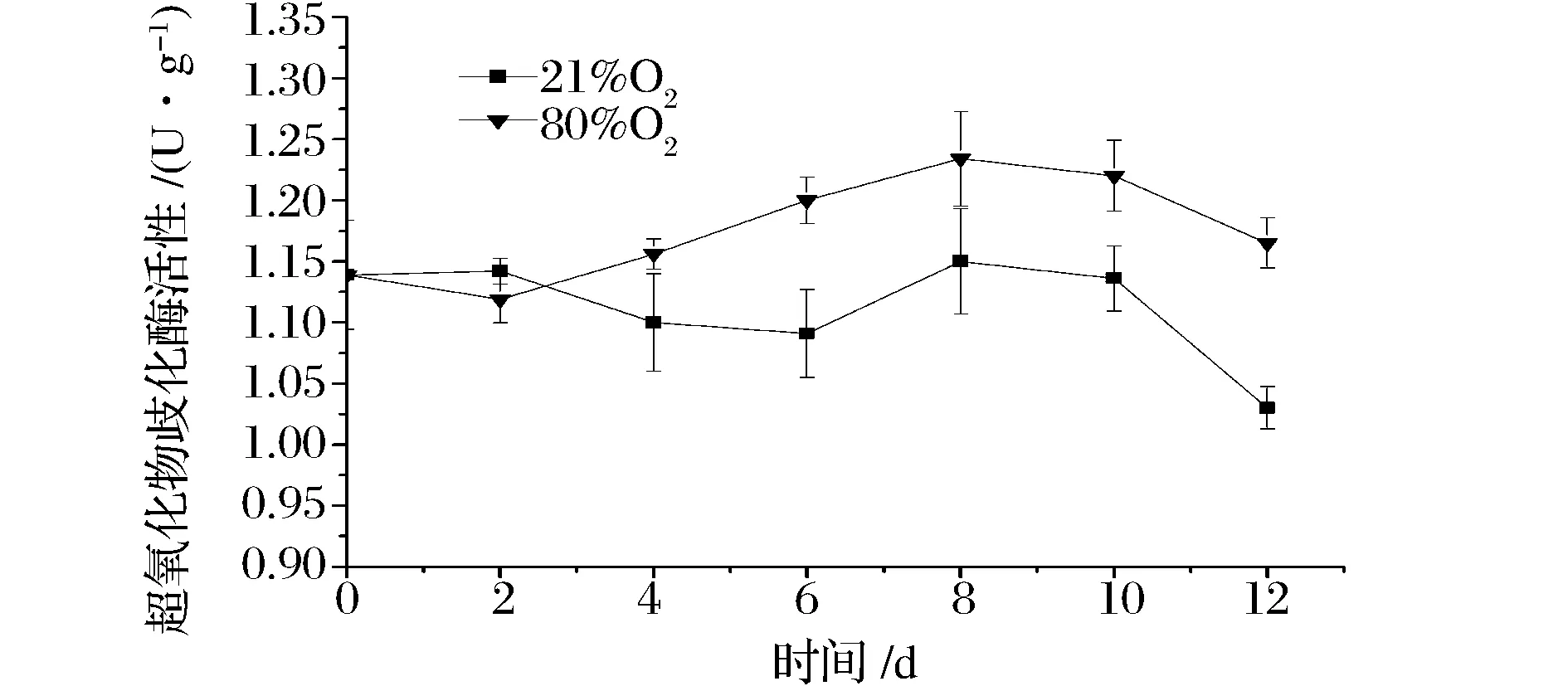
图2 高氧气调包装对双孢蘑菇SOD活性的影响Fig.2 Effect of high oxygen modified atmosphere packaging on the SOD activity of the Agaricus bisporus
2.3 高氧气调包装对CAT活性的影响
CAT是一种重要的活性氧自由基清除酶,其主要作用是防止体内过多的H2O2对细胞产生毒害作用,控制H2O2的含量[18]。如图3所示,在贮藏前6 d,21%O2处理组呈先上升后下降的趋势,而80%O2处理组CAT则一直保持较低活性,且与对照组差异显著(P<0.05)。在第6天以后,80%O2处理组则是先上升后下降,并在第8天达到最大值P<0.01。可能是因为在第8天时SOD活性达到最大值,从而歧化超氧化物自由基产生大量H2O2,诱导CAT活性增强。在第10 d后,80%O2处理组CAT活性下降趋势减缓,而21%O2处理组加速下降,两处理组差异极显著(P<0.01)。由此表明,高氧可以明显维持较高的CAT活性,从而减少双孢蘑菇中H2O2对细胞膜系统的损伤。LIU等[19]对蘑菇进行连续高氧处理后发现,高氧处理能明显保持较高的CAT活性,与本实验得出的结论一致。

图3 高氧气调包装对双孢蘑菇CAT活性的影响Fig.3 Effect of high oxygen modified atmosphere packaging on the CAT activity of the Agaricus bisporus
2.4 高氧气调包装对POD活性的影响
如图4所示,在前6d,80%O2和21%O2处理组的POD活性均逐渐增加,2组差异不显著(P>0.05)。在第8天,80%O2处理组POD活性快速增加,并达到最大值,与21%处理组差异极显著(P<0.01);而21%O2处理组却呈下降趋势。在第10天,80%O2处理组显著增加,可能是因为在第10天后高氧处理组的CAT活性下降趋势减缓,但随着贮藏时间的延长,果蔬组织内会形成更多的H2O2。有研究表明[20],POD反应的关键底物可能是H2O2,H2O2增多会在一定程度诱导POD活性增大。YANG等[21]对杨梅进行纯氧处理后,结果表明纯氧能使杨梅POD活性快速增加并维持在较高的活性值,与本文的结论一致。综上所述,高氧处理能维持较高的SOD、CAT、POD活性,从而更好地清除细胞内的活性氧,维持细胞膜的完整性,延缓果蔬衰老。

图4 高氧气调包装对双孢蘑菇POD活性的影响Fig.4 Effect of high oxygen modified atmosphere packaging on the POD activity of the Agaricus bisporus
2.5 高氧气调包装对总酚含量的影响
总酚可以清除活性氧自由基,是一种天然的抗氧化剂,其含量与体内抗氧化活性呈正相关[22]。如图5所示,在贮藏前2 d,80%O2处理组总酚含量缓慢下降,而21%O2处理组逐渐上升。在2~4天,80%O2处理组总酚含量显著增加(P<0.05),在第4天后,总酚含量缓慢下降,但一直维持较高水平,与21%O2处理组差异显著(P<0.05)。可能是因为在高氧胁迫下,加快了苯基丙酸类合成途径,促使酚类物质的合成与积累。但环境胁迫引起的次生代谢产物如黄酮类、酚类物质的积累是由植物内源性信号介导的,如H2O2。在第4天后,CAT活性逐渐上升,H2O2含量则应缓慢下降,这可能是80%O2处理组总酚含量在第4天后缓慢下降的原因。总酚是果蔬体内重要的自由基消除剂之一,80%O2处理组在贮藏后期能保持较高的总酚含量,表明高氧对抑制活性氧的增加有明显的作用。

图5 高氧气调包装对双孢蘑菇总酚含量的影响Fig.5 Effect of high oxygen modified atmosphere packaging on the total phenolic content of the Agaricus bisporus
2.6 高氧气调包装对超氧阴离子产生速率的影响
细胞内的活性氧包括羟基自由基、超氧阴离子自由基、H2O2、单线态氧等。过多的活性氧会造成细胞膜损伤、膜脂过氧化、加速衰老[23]。如图6所示,在第2天,各处理组均呈缓慢增加。而在2~10 d,80%O2处理组超氧阴离子产生速率逐渐上升,21%O2处理组先上升后下降,但80%O2处理组一直维持较低的超氧阴离子产生速率,与21%O2处理组差异显著(P<0.05),这可能是因为高氧胁迫激发了细胞的抗氧化保护系统,如SOD活性。而80%O2处理组SOD活性持续上升,可能是因为高氧促进了活性氧自由基的形成。在第10天后,80%O2处理组超氧阴离子产生速率明显高于21%O2处理组。在前10 d,高氧能明显抑制超氧阴离子产生速率,从而在一定程度上抑制活性氧的产生。这与DUAN等[15]的结果一致。

图6 高氧气调包装对双孢蘑菇超氧阴离子产生速率的影响Fig.6 Effect of high oxygen modified atmosphere packaging on the superoxide radical production rate of the Agaricus bisporus
2.7 高氧气调包装对MDA含量的影响
活性氧中的非脂性自由基如超氧阴离子自由基会与类脂中的不饱和脂肪酸发生自由基反应,从而引发膜脂过氧化。而丙二醛是细胞膜脂过氧化的产物之一,可以直接对细胞产生毒害作用,增加膜通透性,加速细胞老化[24]。如图7所示,在贮藏前4 d,各处理组MDA含量均缓慢下降。在第4天,21%O2与80%O2处理组MDA含量呈明显上升趋势,6天之后,呈缓慢上升趋势。但80%O2处理组能明显抑制MDA含量的增加,与对比组差异显著(P<0.05)。可能是因为高氧能明显抑制超氧阴离子自由基的产生速率,降低了活性氧的含量,从而抑制了MDA含量的增加。涂宝军等[25]对绿芦笋进行80%O2处理后,结果表明80%O2能极显著的减缓MDA含量的积累。

图7 高氧气调包装对双孢蘑菇MDA含量的影响Fig.7 Effect of high oxygen modified atmosphere packaging on the malondialdehyde content of the Agaricus bisporus
2.8 高氧气调包装对相对电导率的影响
相对电导率即为溶液中电解质的渗出率,从而间接表示细胞膜的完整性。由图8可知,双孢蘑菇的相对电导率随着贮藏时间的增长而逐渐增大。其中,在前8 d,80%O2处理组的相对电导率缓慢增加,与对照组差异显著(P<0.05)。在第8天后,相对电导率快速增加。但在整个贮藏期,80%O2处理组能较好地抑制相对电导率的增加,保持较低的相对电导率值,从而保持细胞膜的完整性。可能是因为细胞膜的膜脂过氧化作用会直接导致膜脂组分改变,而较低的MDA含量会抑制膜蛋白交联聚合,防止膜相由液晶态转为凝胶态、膜结构破坏、离子渗透增加,从而抑制相对电导率的提高。

图8 高氧气调包装对双孢蘑菇相对电导率的影响Fig.8 Effect of high oxygen modified atmosphere packaging on the membrane permeability of the Agaricus bisporus
2.9 80%高氧气调处理组各指标间的相关性分析
对80%高氧处理组各项指标进行相关性分析,结果如表1所示,CAT、POD活性分别与MDA含量呈现显著的相关性(r(0.05)=0.776,r(0.05)=0.775),SOD活性与MDA含量也具有一定的相关性(r=0.51);MDA含量与电导率及超氧阴离子产生速率呈极显著相关性(r(0.01)=0.883,r(0.01)=0.904);电导率、超氧阴离子产生速率分别与白度值呈显著负相关性(r(0.05)=-0.871,r(0.05)=-0.768)。由此可知,虽然相关性并不意味着因果关系,但可以推测高氧气调包装抑制双孢蘑菇的褐变及提高其抗氧化活性与其维持细胞膜的完整性有关,即高氧气调包装能显著提高双孢蘑菇的抗氧化能力,从而抑制活性氧对细胞膜的损伤,维持膜的稳定性和完整性,更好的抑制褐变发生。DENG等[26]对葡萄进行80%O2处理后,也表明高氧处理能明显保持葡萄细胞膜的完整性,从而对果实褐变产生一定的抑制作用。
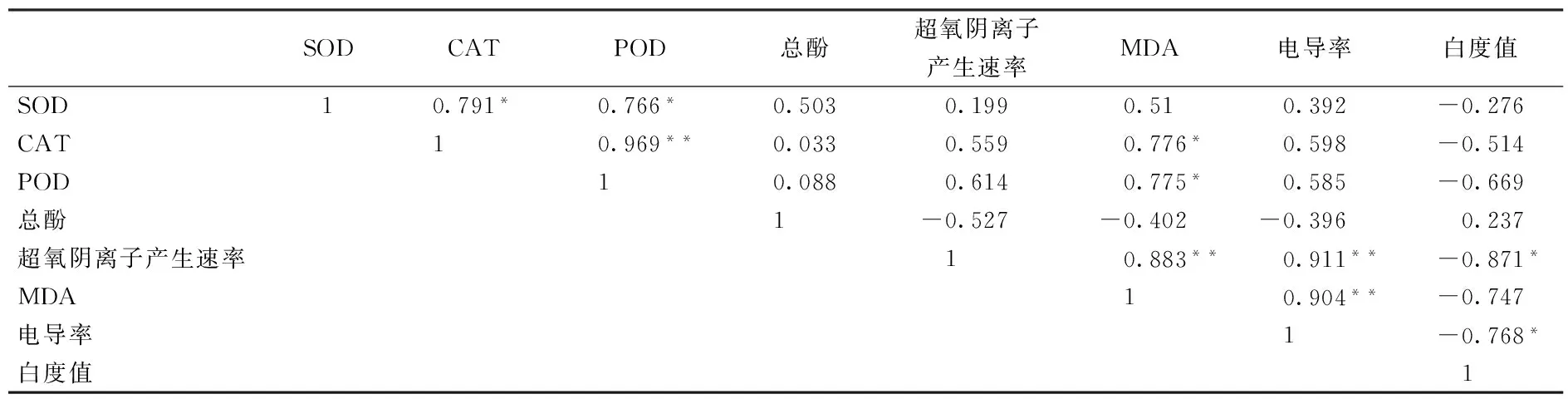
表1 80%高氧气调处理组贮藏期间各指标之间的相关系数
注:**相关系数显著水平为0.01,* 相关系数显著水平为0.05。
3 结论
实验结果表明,在贮藏期间,80%高氧气调包装能较好地维持双孢蘑菇的白度值,明显提高双孢蘑菇SOD活性(P<0.05)和CAT活性(P<0.05),在贮藏后期维持较高的POD活性和总酚含量,并在前10d,高氧气调包装能明显抑制超氧阴离子产生速率。同时,高氧气调包装能显著抑制MDA含量的增加(P<0.05)并较好地抑制相对电导率的增加,维持较低的相对电导率。相关性分析表明,高氧气调抑制双孢蘑菇的褐变,可能与高氧气调提高了其抗氧化能力有关。即高氧气调包装能增强双胞蘑菇抗氧化能力,抑制活性氧对细胞膜的损伤,维持细胞膜完整,从而抑制双孢蘑菇褐变的发生。
[1] VAN DER STEEN C,JACXSENS L,DEVLIEGHERE F, et al. Combining high oxygen atmospheres with low oxygen modified atmosphere packaging to improve the keeping quality of strawberries and raspberries[J]. Postharvest Biol Tec, 2002, 26 (1): 49-58.
[2] JOLIVET S, ARPIN N, Wichers H J, et a1. Agaricus bisporus browning: a review[J]. Mycological Research, 1998, 102 (12):1 459-1 483.
[3] 陈学红,郑永华,杨震峰,等. 高氧处理对草莓果实抗氧化活性的影响[J]. 食品与发酵工业,2006,32(4):5-8.
[4] 陈学红,秦卫东,马利华,等. 高氧气调包装对鲜切莴苣抗氧化活性的影响[J]. 食品科学,2011,32(8):313-317.
[5] 赵春霞,李大虎,程玉娇,等. 高氧气调包装对双孢蘑菇品质的影响[J]. 包装工程, 2014, 35(15): 5-10.
[6] JAWORSKA G, BEFNAS E. The effect of preliminary processing and period of storage on the quality of frozen Boletus edulis (Bull: Fr.) mushrooms[J]. Food Chem, 2009, 113 (4): 936-943.
[7] GIANNOPOLITIS C N, RIES S K. Superoxide Dismutases.I. Occurrence In Higher-Plants[J]. Plant Physiol., 1977, 59 (2): 309-314.
[8] AEBI H. Catalase in vitro[J]. Methods Enzymol, 1984, 105: 121-126.
[9] MOERSCHBACHER B M, NOLL U M, FLOTT B E, et al. Lignin biosynthetic-enzymes in stem rust infected, resistant and susceptible near-isogenic wheat lines[J]. Physiol. Mol. Plant Pathol., 1988, 33 (1): 33-46.
[10] SINGLETON V L, J.A. R J. Colorimetry of total phenolics with phosphomolybdic-phosphotungstic acid reagents[J].Cc/Agr Biol Environ, 1965, 16 (3): 144.
[11] YAN B, DAI Q J, LIU X Z, et al.Flooding-induced membrane damage, lipid oxidation and activated oxygen generation in corn leaves[J]. Plant and Soil, 1996, 179 (2): 261-268.
[12] HEATH R L, PACKER L. Photoperoxidation in isolated chloroplasts .I. kinetics and stoichiometry of fatty acid peroxidation[J]. Arch Biochem Biophys, 1968, 125 (1): 189-198.
[13] 曹建康,姜微波. 果蔬采后生理生化实验指导[M]. 北京: 中国轻工业出版社, 2007.
[14] BRIONES G L, VAROQUAUX P, CHAMBROY Y, et al. Storage of common mushroom under controlled atmospheres[J]. Int J Food Sci Tec h, 1992, 27 (5): 493-505.
[15] DUAN X W, LIU T, ZHANG D D, et al. Effect of pure oxygen atmosphere on antioxidant enzyme and antioxidant activity of harvested litchi fruit during storage[J]. Food Res Int, 2011, 44 (7): 1 905-1 911.
[16] 刘战丽,王相友,朱继英,等. 高氧气调对果蔬采后生理和品质影响研究进展[J]. 农业机械学报, 2009, 40 (7): 112-118.
[17] MAGHOUMI M, GOMEZ P A, MOSTOFI Y, et al. Combined effect of heat treatment, UV-C and superatmospheric oxygen packing on phenolics and browning related enzymes of fresh-cut pomegranate arils[J]. Lwt-Food Sci Technol, 2013, 54 (2): 389-396.
[18] LI T H, ZHANG M. Effects of modified atmosphere package (MAP) with a silicon gum film window and storage temperature on the quality and antioxidant system of stored Agrocybe chaxingu[J]. Lwt-Food Sci Technol, 2010, 43 (7): 1 113-1 120.
[19] LIU Z, WANG X. Changes in color, antioxidant, and free radical scavenging enzyme activity of mushrooms under high oxygen modified atmospheres[J]. Postharvest Biol Tec, 2012, 69: 1-6.
[20] CANTOS E, TUDELA J A, GIL M I, et al. Phenolic compounds and related enzymes are not rate-limiting in browning development of fresh-cut[J]. J Agr Food Chem, 2002, 50(10): 15-23.
[21] YANG Z-F, ZHENG Y-H, CAO S-F, et al. Inhibition of postharvest decay and induction of defensive enzymes by pure oxygen in Chinese bayberry fruit[J]. Zhiwu Shengli yu Fenzi Shengwuxue Xuebao, 2005, 31 (4): 425-430.
[22] VELIOGLU Y S, MAZZA G, GAO L, et al. Antioxidant activity and total phenolics in selected fruits, vegetables, and grain products[J]. J Agr Food Chem, 1998, 46 (10): 4 113-4 117.
[23] BUCHANAN-WOLLASTON V, EARL S, HARRISON E, et al. The molecular analysis of leaf senescence - a genomics approach[J]. Plant Biotechnol J, 2003, 1 (1): 3-22.
[24] WU Y, DENG Y, LI Y F. Changes in enzyme activities in abscission zone and berry drop of 'Kyoho' grapes under high O-2 or CO2atmospheric storage[J]. Lwt-Food Sci Technol, 2008, 41 (1): 175-179.
[25] 涂宝军,秦卫东,姜松. 高氧和高二氧化碳处理对绿芦笋采后品质的影响[J]. 食品科学, 2009, 30 (22): 379-382.
[26] DENG Y, WU Y, LI Y F, et al.Effects of high O2pretreatment and gibberellic acid on sensorial quality and storability of table grapes [J]. Food Sci Technol Int, 2006, 12 (4): 307-303.
Effects of high oxygen atmosphere packaging on antioxidant ability and browning in Agaricus bisporus
CHENG Xi, ZHAO Chun-xia, LI Yun-yun, LI Jing, ZHANG Min*
(College of Food Science, Southwest University, Laboratory of Quality & Safety Risk Assessment for Argo-products on Storage and Preservation(Chongqing),Mimnistry of Agriculture,Chongqing Special Food Programme and Technology Research Center, Chongqing 400715, China)
Effects of high oxygen modified atmosphere packaging on the whiteness and antioxidant activity ofAgaricusbisporuswere investigated. TheAgaricusbisporuswere packaged using 80%O2+20%N2high oxygen modified atmosphere, and its whiteness, malondialdehyde (MDA) content, relative electric conductivity, antioxidant enzymes and antioxidant activity during storage were tested. Results showed that high oxygen atmosphere significantly increased superoxide dismutase (SOD) activity, catalase(CAT) activity ofAgaricusbisporus, and maintained a high activity of peroxidase(POD) and total phenolic contents during the final stage of storage, and high oxygen atmosphere could inhibit superoxide dismutase production rate. During the whole storage period, high oxygen atmosphere could inhibit the increases of MDA content and conductivity by maintaining the integrity of the cell membrane, and effectively inhibit browning. According to the correlation analysis among indexes, it is speculated that the browning of theAgaricusbisporusmay be associated with the improved antioxidant capacity of high oxygen atmosphere.
high oxygen atmosphere packaging;Agaricusbisporus;browning;antioxidant capacity
10.13995/j.cnki.11-1802/ts.201610012
硕士研究生(张敏教授为通讯作者,E-mail:zmqx123@163.com)。
重庆市科技攻关应用技术研发类重点项目(cstc2012 ̄gg-yyjsB80003);中央高校基本科研业务费专项(XDJK2013C130)
2016-03-04,改回日期:2016-03-30

