免疫增强剂对猪伪狂犬灭活疫苗的免疫增强作用
耿文学,唐 波,华 涛,侯继波,张道华,许家荣,*
(1.南京农业大学 动物医学院,江苏 南京 210095; 2.江苏省农业科学院 国家兽用生物制品工程技术研究中心,江苏 南京 210014)
免疫增强剂对猪伪狂犬灭活疫苗的免疫增强作用
耿文学1,唐 波2,华 涛2,侯继波2,张道华2,许家荣1,*
(1.南京农业大学 动物医学院,江苏 南京 210095; 2.江苏省农业科学院 国家兽用生物制品工程技术研究中心,江苏 南京 210014)
为了评价免疫增强剂VA5对猪伪狂犬病毒灭活疫苗的免疫增强作用,将VA5与灭活疫苗混合并制成疫苗。通过常规Bartha-K61株灭活疫苗、含免疫增强剂灭活疫苗和Bartha-K61活疫苗3组免疫效力对比试验,首次免疫后14和35d对猪进行采血,并且进行中和实验以及对相关细胞因子进行检测。结果表明,该免疫增强剂能够显著地提高猪伪狂犬灭活疫苗血清中抗体产生,同时能显著提高猪外周血淋巴细胞(PBMC)中IL-2和IFN-γ mRNA表达。交叉中和试验表明,VA5能够显著地提高猪伪狂犬灭活疫苗对伪狂犬流行变异株的中和作用。试验表明,VA5能够显著提升猪伪狂犬病毒灭活疫苗体液与细胞免疫,为研制免疫效果更好的灭活疫苗提供了依据。
免疫增强剂;伪狂犬病毒灭活疫苗;Bartha-K61株;免疫效力
伪狂犬病毒(Pseudorabiesvirus,PRV)属于猪疱疹病毒 I型双股DNA病毒,其感染症状主要体现在神经、呼吸以及生殖系统三个方面[1]。小猪感染伪狂犬病毒主要出现神经症状,怀孕母猪则会导致死胎或者流产。伪狂犬病毒在宿主外周神经系统中建立潜在感染,当潜在病毒被重新激活或者受到压力刺激就会产生感染性病毒[2]。
一直以来,gE基因缺失疫苗Bartha-K61是非常安全有效的伪狂犬疫苗,使用gE基因缺失活疫苗可以有效地控制猪伪狂犬病。然而,近年来在我国许多免疫的猪场中伪狂犬病毒出现流行变异株。新的伪狂犬变异株对各个年龄阶段的猪都表现出很强的致病性[3]。大量流行病学调查显示,我国伪狂犬病毒已经发生变异,变异的伪狂犬病毒在抗原性上不同于传统毒株[4]。研究表明,由于抗原性发生变化,常规活疫苗对变异伪狂犬病毒株交叉保护能力有限[5]。因此,研制能够有效抵抗变异伪狂犬流行毒株的灭活疫苗是非常必要的。加大对灭活疫苗的开发研究,对解决减毒活疫苗在猪群中使用的潜在危害具有重大意义。
灭活疫苗安全性好,但不能诱生细胞免疫反应,然而细胞免疫在PRV保护性免疫中起主导作用。研究表明,使用免疫增强剂能够有效提升灭活疫苗细胞免疫指标[6]。细胞因子是一种重要的免疫调节因子,作为细胞间信号分子在机体免疫网络中发挥重要的作用,可以用来评价疫苗的免疫效果[7]。
在疫苗中加入免疫增强剂是一种快速并且有效地提高疫苗的免疫效果的方法[8],在本次研究中我们对有效提升禽用灭活疫苗免疫效力的VA5复方免疫增强剂进行研究,在伪狂犬灭活苗中加入免疫增强剂以此来评价其免疫增强效果。
1 材料与方法
1.1 主要试剂
RPMI-1640培养液,Hyclone公司生产;小牛血清,杭州四季青公司生产;猪外周血淋巴细胞分离液和红细胞裂解液,天津市灏洋生物制品科技有限公司生产;Real time PCR荧光染料和PrimeScript Ⅱ RTase,TaKaRa公司生产。
1.2 疫苗和毒株
伪狂犬活疫苗Bartha-K61,南京天邦生物科技有限公司生产;灭活疫苗为本室制备,疫苗毒株为Bartha-K61株。中和抗体检测使用的流行变异毒株是PRV-NJ株,为本室分离鉴定。
1.3 试验动物
猪伪狂犬病毒血清抗体阴性健康后备母猪20头,由江苏省农业科学院六合动物基地提供。
1.4 含免疫增强剂疫苗的配制
含VA5免疫增强剂疫苗的配制详见专利(申请号:201210235427.0) 。在磷酸盐缓冲液(0.03mol·L-1PBS,pH7.2) 中加入PolyI∶C、胞壁酰二肽和左旋咪唑,然后加入吐温-80,配制成水相溶液;在白油中加入雷西莫特、咪喹莫特,然后加入司盘-80配制成油相溶液;将含免疫增强剂的水相溶液与油相混合,制备成油乳剂的疫苗伴侣。将该疫苗伴侣与事先制备的常规灭活疫苗或商品灭活疫苗按体积比为1∶9混合,即为含VA5免疫增强剂的伴侣疫苗[8]。
1.5 中和抗体检测
将血清无菌处理,56℃灭活30min用于中和试验。用维持液将血清进行1∶2,1∶4,1∶8,……倍比稀释,与200TCID50PRV-NJ株病毒液混合,37℃孵育1h;接种96孔板BHK-21细胞,100μL·孔-1,每个血清稀释度设4个重复孔。置于5% CO2细胞培养箱37℃培养5d,观察细胞病变(CPE)记录病变孔数目。按Reed-Muench法计算中和抗体效价。
1.6 猪的免疫
选健康后备母猪20头,分别设常规灭活疫苗免疫组、加免疫增强剂的灭活疫苗免疫组、活疫苗组和空白对照组,每组5头。活疫苗组每头肌肉注射1次1头份,加免疫增强剂的灭活疫苗组和常规的灭活苗免疫组分别每头肌肉注射2.0mL疫苗,14d后以同等剂量加强免疫一次。首次免疫后14d,35d分别采血,分别检测血清中各项免疫指标。
1.7 外周血淋巴细胞的分离
在猪首次免疫后14d和35d采血,分离猪外周血淋巴细胞,用10% RPMI-1640培养液稀释细胞至1×106cells·mL-1,将稀释好的细胞分为3组加到12孔细胞板中,分别为PRV组、刀豆蛋白A(Con A)组和对照组,每孔加入1mL。PRV组的细胞中每孔接种MOI=1的PRV流行毒株,Con A组每孔加入20μL的Con A,对照组加入20μL的10% RPMI-1640,每组设3个重复,24h后收集细胞。
1.8 用qRT-PCR的方法检测相关细胞因子的mRNA水平
用TRIZOL按照其说明书的方法提取外周血淋巴细胞的RNA,以Oligo(dT)18按照AMV的说明书来进行反转录,从而获得cDNA,之后用qRT-PCR的方法进行IL-2,IFN-γ,IL-4,IL-10的mRNA含量测定(引物见表1);β-actin作为内参。
1.9 数据处理与统计分析
经qRT-PCR反应后,根据每个样品中的相关细胞因子以及管家基因拷贝数,应用2-ΔΔCt法对各组的细胞因子进行比较,数据用SPSS进行统计学分析,并进行差异性分析。
2 结果与分析
2.1 中和抗体的测定
免疫后14d和35d的血清样品进行中和抗体的检测,各灭活疫苗免疫组在免疫后14d可以检测到特异性中和抗体1∶23~1∶25;活疫苗免疫组部分转阳;灭活疫苗免疫组在加强免疫后,中和抗体水平持续升高,免疫后35d特异性中和抗体效价均可达1∶25以上,显著高于活疫苗免疫组特异性中和抗体1∶23~1∶24。含免疫增强剂疫苗组各检测时间点抗体水平均明显高于常规灭活疫苗与活疫苗免疫组(P<0.05)(图1)。
2.2 猪外周血淋巴细胞中IL-2、IFN-γ、IL-4、IL-10mRNA的变化情况
表1 用于细胞因子检测的qRT-PCR引物
Table 1 The qRT-PCR primers for detecting cytokine
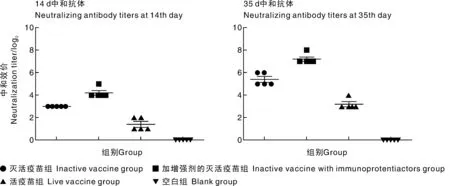
图1 免疫后血清的中和效价Fig.1 Titer of neutralizing antibody after immunization
首次免疫后14d,活疫苗组外周血淋巴细胞中,IL-2和IFN-γ含量上升最为明显;含免疫增强剂灭活疫苗组的外周血淋巴细胞中,IL-2和IFN-γ的含量也有很大幅度的提升;IL-4和IL-10含量有小幅上升但没有IL-2和IFN-γ上升明显;而在常规灭活疫苗组和空白组的外周血淋巴细胞中,IL-2、IFN-γ、IL-4和IL-10的含量上升幅度均不明显(图2)。
首次免疫后35d,活疫苗组外周血淋巴细胞中,IL-2和IFN-γ含量有了明显的上升;此时,含免疫增强剂的灭活疫苗组为二免后3周,IL-2和IFN-γ含量也有了很大幅度的提升;而常规的灭活疫苗组和空白组的IL-2和IFN-γ含量还是处于比较低的水平。活疫苗组和加增强剂的灭活疫苗组IL-4和IL-10含量均有小幅度的提升;常规的灭活疫苗组和空白组提升幅度也不明显(图3)。
3 讨论
研究表明,PolyI∶C、胞壁酰二肽(MDP)、咪唑喹啉类、雷西莫特等均为与动物相关模式识别受体结合的配体。在禽病上,唐应华等[8]用含该成分免疫增强剂的禽流感疫苗免疫,抗体提前一周达到标准水平,第3、4周的抗体效价和常规的疫苗相比要显著提升。毛明光等[9]证实了免疫新城疫疫苗同时注射PolyI∶C能够明显提高血清中新城疫抗体的滴度;Zhang等[10]将PolyI∶C和PRRS灭活疫苗混合免疫动物后也诱导机体产生高滴度的抗体。
在本研究中,在猪伪狂犬灭活疫苗中加入VA5后所产生的抗体明显高于传统的活疫苗组和常规灭活疫苗组,说明免疫增强剂VA5和猪伪狂犬灭活疫苗混合后可以刺激机体产生更强的免疫应答,诱导机体产生更多的特异性抗体。此外,在伪狂犬灭活苗中加入VA5免疫增强剂后,IL-2和IFN-γ等细胞因子的表达量明显高于活疫苗组和常规灭活疫苗组,这是由于VA5免疫增强剂中的多种模式识别受体的配体成分均能使得IFN-γ等细胞因子的表达量增加,增强机体的细胞免疫应答,提高CD4+/CD8+T细胞的数量,提高动物机体抗病毒感染的能力[11]。

组别:1,活疫苗组PBMC用PRV刺激;2,活疫苗组PBMC用Con A刺激;3,加增强剂的灭活疫苗组PBMC用PRV刺激;4,加增强剂的灭活疫苗组PBMC用Con A刺激;5,常规灭活疫苗组PBMC用PRV刺激;6,常规灭活疫苗组PBMC用Con A刺激;7,空白组PBMC用PRV刺激;8,空白组PBMC用Con A刺激Groups: 1,PBMC of live vaccine group stimulated by PRV; 2,PBMC of live vaccine group stimulated by Con A; 3,PBMC of inactive vaccine with immunopotentiator group stimulated by PRV; 4,PBMC of inactive vaccine with immunopotentiator group stimulated by Con A; 5,PBMC of conventional inactive vaccine group stimulated by PRV; 6,PBMC of conventional inactive vaccine group stimulated by Con A; 7,PBMC of blank group stimulated by PRV; 8,PBMC of blank group stimulated by Con A
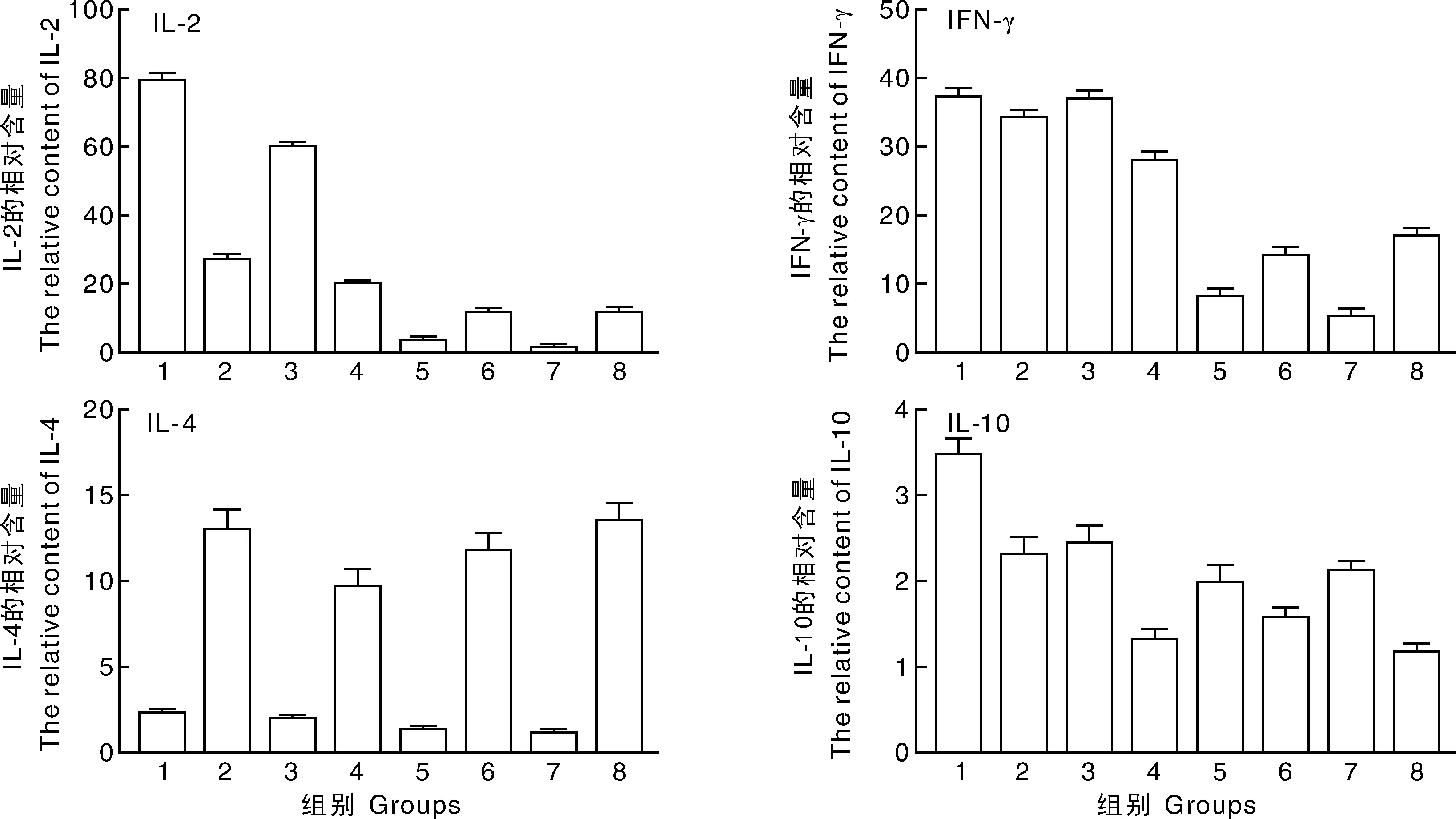
组别:1.活疫苗组PBMC用PRV刺激;2.活疫苗组PBMC用Con A刺激;3.加增强剂的灭活疫苗组PBMC用PRV刺激;4.加增强剂的灭活疫苗组PBMC用Con A刺激;5.常规灭活疫苗组PBMC用PRV刺激;6.常规灭活疫苗组PBMC用Con A刺激;7.空白组PBMC用PRV刺激;8.空白组PBMC用Con A刺激Group: 1,PBMC of live vaccine group stimulated by PRV; 2,PBMC of live vaccine group stimulated by Con A; 3,PBMC of inactive vaccine with immunopotentiator group stimulated by PRV; 4,PBMC of inactive vaccine with immunopotentiator group stimulated by Con A; 5,PBMC of conventional inactive vaccine group stimulated by PRV; 6,PBMC of conventional inactive vaccine group stimulated by Con A; 7,PBMC of blank group stimulated by PRV; 8,PBMC of blank group stimulated by Con A
该免疫增强剂含有天然免疫受体中Toll-like receptor(TLR) 激动剂的成分。根据对TLR的研究结果,不同TLR在不同免疫类型的细胞上的丰度以及在细胞表面的位置均有差异[12],且不同信号通路最终所激活的免疫刺激因子略有差异[6],但均能有效提高机体的细胞免疫[13]。因此,在本研究中,含VA5的灭活疫苗组IL-2和IFN-γ含量大幅上升,细胞免疫水平得到提高。
机体Th1和Th2细胞分泌的细胞因子可以进行相互调节,Th1细胞分泌的IFN-γ等细胞因子可以抑制Th2细胞的增殖,从而影响IL-10等细胞因子的分泌[14]。在本次试验中,含增强剂灭活疫苗组的IL-2和IFN-γ的含量有了非常明显的上升,而IL-4和IL-10的含量上升幅度不明显,这与Th1和Th2细胞分泌的细胞因子的相互调节有关[7]。
总的来说,含增强剂的灭活疫苗可以增强机体的免疫应答,对伪狂犬流行毒株的免疫效果明显优于传统活疫苗,这不但可以避免活疫苗所导致的毒力返强等安全问题,而且其免疫效果要优于弱毒活疫苗。现如今,传统的猪伪狂犬疫苗对猪伪狂犬病毒变异株的免疫保护力大大降低,含VA5的猪伪狂犬灭活疫苗的研究有着重要的意义!
[1] OLIVER R E.Aujeszky’s disease[J].AustralianVeterinary,1989,66(3):432-433.
[2] LUO Y,LI N,CONG X,et al.Pathogenicity and genomic characterization of a pseudorabies virus variant isolated from Bartha-K61-vaccinated swine population in China[J].VeterinaryMicrobiology,2014,174(1/2):107-115.
[3] ZHANG C,GUO L,JIA X,et al.Construction of a triple gene-deleted Chinese Pseudorabies virus variant and its efficacy study as a vaccine candidate on suckling piglets[J].Vaccine,2015,33(21):2432-2437.
[4] GU Z,DONG J,WANG J,et al.A novel inactivated gE/gI deleted pseudorabies virus (PRV) vaccine completely protects pigs from an emerged variant PRV challenge[J].VirusResearch,2015,195:57-63.
[5] AN T Q,PENG J M,TIAN Z J,et al.Pseudorabies virus variant in Bartha-K61-vaccinated pigs,China,2012[J].EmergingInfectiousDiseases,2013,19(11):1749-1755.
[6] KAWAI T,AKIRA S.The roles of TLRs,RLRs and NLRs in pathogen recognition[J].InternationalImmunology,2009,21(4):317-337.
[7] FISCHER T,BÜTTNER M,RZIHA H J.T helper 1-type cytokine transcription in peripheral blood mononuclear cells of pseudorabies virus (Suidherpesvirus1)-primed swine indicates efficient immunization[J].Immunology,2000,101(3):378-387.
[8] 唐应华,陆吉虎,吴培培,等.免疫增强剂提高禽流感疫苗效力的研究[J].江苏农业学报,2014,30(2):344-348.
TANG Y H,LU J H,WU P P,et al.Evaluation of immunopotentiators for improving the efficacy of avian influenza vaccine[J].JiangsuJournalofAgriculturalSciences,2014,30(2):344-348.(in Chinese with English abstract)
[9] 毛明光,尹立杰,王印庚,等.聚肌胞对雏鸡新城疫抗体水平的影响[J].中国家禽,2009,31(14):26-28.
MAO M G,YIN L J,WANG Y G,et al.Effect of polyinosinic-polycytidylic acid on antibody response to newcastle disease vaccine in chickens[J].ChinaPoultry,2009,31(14):26-28.(in Chinese with English abstract)
[10] ZHANG L L,BAI J,LIU J,et al.Toll-like receptor ligands enhance the protective effects of vaccination against porcine reproductive and respiratory syndrome virus in swine[J].VeterinaryMicrobiology,2013,164(3/4):253-260.
[11] TANG Y H,LU J H,WU P P,et al.Inactivated vaccine with adjuvants consisting of pattern recognition receptor agonists confers protection against avian influenza viruses in chickens[J].VeterinaryMicrobiology,2014,172(1/2):120-128.
[12] IWASAKI A,MEDZHITOV R.Regulation of adaptive immunity by the innate immune system[J].Science,2010,327(5963):291-295.
[13] GORDON S.Pattern recognition receptors: doubling up for the innate immune response[J].Cell,2002,111(7):927-930.
[14] 司兴奎,郭鑫,杨汉春.猪圆环病毒2型感染后猪外周血淋巴细胞IL-2、IL-4、IL-10、IL-12p40、IFN-γ和TNF-α mRNA转录的变化[J].畜牧兽医学报,2009,40(1):78-82.
SI X K,GUO X,YANG H C.The effects of PCV2experimental infection on transcriptional levels of IL-2,IL-4,IL-10,IL-12p40,IFN-γ and TNF-α mRNA of peripheral blood lymphocytes[J].ActaVeterinariaetZootechnicaSinica,2009,40(1): 78-82.(in Chinese with English abstract)
(责任编辑 卢福庄)
Improved immune efficiency of inactivated vaccine of pseudorabies virus by immunopotentiator
GENG Wen-xue1,TANG Bo2,HUA Tao2,HOU Ji-bo2,ZHANG Dao-hua2,XU Jia-rong1,*
(1.CollegeofVeterinaryMedicine,NanjingAgriculturalUniversity,Nanjing210095,China; 2.NationalResearchCenterofVeterinaryBiologicalsEngineeringandTechnology,JiangsuAcademyofAgriculturalSciences,Nanjing210014,China)
To evaluate the effect of immunopotentiator VA5on immunity potency of inactive vaccine of pseudorabies virus (PRV),inactive vaccine was mixed with VA5.The comparison test of the immunity potency was conducted by using conventional inactive vaccine of Bartha-K61strain of PRV,inactive vaccine mixed with VA5and attenuated vaccine of Bartha-K61strain.Blood samples were collected at 14and 35days after the first immunization, respectively.Neutralization experiments and cytokine detection were performed.The results showed that,compared with live and inactive vaccine of Bartha-K61strain of PRV,the inactive vaccine with VA5could induce higher neutralizing antibody against the heterologous strain of PRV and increase the expression levels of IL-2and IFN-γ mRNA in porcine peripheral blood lymphocytes (PBMC).Neutralization test showed that VA5could significantly increase the level of neutralizing antibody against the epidemic variation strain of PRV.This experiment showed that VA5could improve the humoral and cellular immunity of inactive PRV vaccine,and provide a basis for paving the better immune effect of inactivated PRV vaccine.
immunopotentiator; inactive PRV vaccine; Bartha-K61strain; immunity potency
10.3969/j.issn.1004-1524.2016.11.04
2016-04-18
江苏省农业科技自主创新基金项目[CX(11)2047];农业公益性行业科研专项(201303046); 江苏省优质学科(20150101)
耿文学(1990—),男,山东淄博人,硕士研究生,从事预防传染病学研究。E-mail: 13951692816@163.com
*通信作者,许家荣,E-mail: xjr@njau.edu.cn
S851.35
A
1004-1524(2016)11-1828-06
浙江农业学报ActaAgriculturaeZhejiangensis,2016,28(11): 1828-1833
http://www.zjnyxb.cn
耿文学,唐波,华涛,等.免疫增强剂对猪伪狂犬灭活疫苗的免疫增强作用[J].浙江农业学报,2016,28(11): 1828-1833.

