黄河三角洲盐碱地土壤真菌多样性及其与土壤理化性质的关系
王艳云,郭笃发
(山东师范大学 地理与环境学院,山东 济南 250000)
黄河三角洲盐碱地土壤真菌多样性及其与土壤理化性质的关系
王艳云,郭笃发*
(山东师范大学 地理与环境学院,山东 济南 250000)
采用454高通量测序(454high throughput sequencing)分析方法,研究不同覆被(光板地和柽柳群落以及白茅群落)类型下土壤真菌组成、多样性及与理化性质的关系。该研究共获得5门174属真菌,不同土样中真菌种类和多样性有所不同,其中,白茅群落真菌的种类较多,尤其是HZ3A(白茅0~20cm)中真菌属数量最多,其真菌属分别是HZ1A(光板地0~20cm)、HZ1B(光板地20~40cm)、HZ2A(柽柳0~20cm)、HZ2B(柽柳20~40cm)、HZ3B(白茅20~40cm)的2.23、1.74、1.24、2.18和1.38倍。此外,白茅群落真菌多样性高于柽柳群落和光板地。碱解氮对土壤真菌多样性和分布的影响最大,其与Knufia、旋孢腔菌属(Cochliobolus)、毛霉属(Mucor)、马拉色氏霉菌属(Malassezia)的相对丰度呈负相关,与其余真菌属的相对丰度呈正相关。
黄河三角洲;454高通量测序;土壤真菌;真菌多样性;碱解氮
土壤盐碱化包括土壤的盐化和碱化[1],土壤盐碱化当前已经成为一个全球性的问题。据估计,全球的盐碱土面积以每年100万~150万hm2的速度增长[2]。黄河三角洲位于渤海西岸,区内大部分是高度盐碱化土壤。土壤盐碱重,自然条件极差,使得黄河三角洲地区自然分布着种类和数量极为丰富的耐盐植物,盐地柽柳、白茅、旱柳以及碱蓬等植物为优势种[3]。到目前为止,对黄河三角洲耐盐植被的研究涉及重金属与盐生植被[4]、盐生植物种类与分布[5]、盐生植物与土壤盐分的关系[6],但对黄河三角洲耐盐植被下土壤真菌的研究极少,且多集中在对某一特定真菌的研究,尤其是黄河三角洲优势耐盐植被下土壤真菌的研究鲜有报道。实际上,土壤中的生物种类繁多,而真菌组成了土壤生物量的很大部分。真菌作为重要的微生物,通过分解动植物残体和排泄物等,对土壤系统的物质与能量循环起着至关重要的作用。同时,真菌在改善土壤结构方面也发挥着重要作用。因此,采用通量高、读长长的454焦磷酸测序技术研究土壤真菌的多样性及其与土壤理化因子的关系具有重要意义。
本研究主要利用454高通量测序技术分析光板地和耐盐植被群落(柽柳、白茅)下土壤真菌种类及其数量,探究真菌与土壤理化因子的关系,为全面了解盐碱条件下土壤真菌多样性和分布特征以及黄河三角洲重度盐碱退化滨海湿地的生态修复提供理论依据。
1 材料与方法
1.1 土样采集
于2012年5月在黄河三角洲的中心城市——东营市河口区进行采样。具体方法如下:依据该区域植被的演替顺序,以空间代替时间,分别在光板地、柽柳地、白茅地各设置3个200cm×200cm的样方,在样方内采用对角线5点取样法,分层(0~20、20~40cm)测定地下生物量,4次重复。将在多个地点采集的土壤分别进行充分混合并除去根系等杂物后,分成2份,每份约200g,编号:HZ1A(光板地0~20cm)、HZ1B(光板地20~40cm)、HZ2A(柽柳0~20cm)、HZ2B(柽柳20~40cm)、HZ3A(白茅0~20cm)和HZ3A(白茅20~40cm)。1份封于灭菌袋中,4℃冷冻干燥保存,用于土壤理化性质分析;另1份放入液氮罐带回实验室,保存在-80℃,用于分子生物学研究。
1.2 土壤理化性质的测定
在野外采集土样的同时用TDR100土壤水分探测器测各采样点0~20和20~40cm的水分。
样品风干后测定土壤理化性质,每个理化性质设4次重复,除去偏差较大的结果,最后取各自平均值作为理化性质最终结果。速效磷含量测定采用Olsen法(恒温水浴振荡浸提),全氮含量测定采用凯氏定氮法[7],碱解氮含量测定采用碱解扩散法[8],铵态氮含量测定采用钠试剂比色法,硝态氮含量测定采用紫外双波长分光光度法,土壤粒径分析参考Kettler等[9]的方法。
1.3 土壤DNA提取与PCR扩增
称取0.5g土壤,用Omega DNA试剂盒(D5625-01)依据说明书提取土壤总DNA。
PCR扩增体系:模板DNA 10ng、10×buffer、0.4mmol·L-1dNTP(0.5μL)、5U·μL-1TaqDNA聚合酶(0.5μL)、1μL Bar-PCR primer F (50μmol·L-1)、1μL primer R (50μmol·L-1)。PCR反应程序:94℃ 5min;95℃ 45s,57℃ 30s,72℃ 45s,30个循环;72℃ 5min,10℃保存PCR产物。PCR扩增采用Roche 454FLX测序平台的通用引物,即18sF(Bar-PCR primer F)(5’-CGTATCGCCTCCTCGCGCCATCAG+bar+CAGTAGTCATATGCTTGTCT-3’)、18sR(5’-primer R)(5’-CTATGCGCCTTGCCAGCCCGCTCAGGCTGCTGGCACCAGACTTGC-3’)。扩增产物使用罗氏公司454测序仪(Roch GS FLX sequencer)进行测序。
1.4 数据分析
主要利用Excel和Canoco 5进行数据分析。OTU聚类:将多条序列根据其序列之间的距离对它们进行聚类,然后根据序列之间的相似性(97%)作为域值分成操作分类单元(OTU)。物种分类:直接blast比对数据库将序列进行物种分类。相似性分析则是基于Unifrac metric来比较多组样本之间的差别度量。Unifrac metric是一种基于系统发育树的计算值,可较好地用于衡量样本间物种组成的相似度[12],值在0~1之间,值越小说明样本间相似度越高。
2 结果与分析
2.1 黄河三角洲土壤真菌种类
利用454高通量测序技术分析光板地和耐盐植被群落(柽柳、白茅)下土壤真菌种类,共获得5门174属。在门的分类水平上主要包括:子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、毛霉亚门(Mucoromycotina)、壶菌门(Chytridiomycota)和球囊菌门(Glomeromycota),其中,子囊菌门在所有样本中的丰度为1.1%~42.22%(图1-A),为最优势门,远高于次优势门——担子菌门(0.83%~16.39%),子囊菌门表现出非常明显的优势地位。在属分类水平上,优势类群(相对丰度>0.8%)主要包括Knufia、小脆柄菇属(Psathyrella)、旋孢腔菌属(Cohliobolus)、茎点霉属(Phoma)、焦孢壳属(Diatrype)、亡革菌属(Thanatephorus)、光柄菇属(Pluteus)、Lulwoana、肉座菌属(Hypocrea)、Rhizophydium、毛霉属(Mucor)、潮间海属(Pontogneia)、被孢霉属(Mortierella)、Coniochaeta、马拉色氏霉菌属(Malassezia),其中,最优势属是Diatrype,它在HZ1A、HZ1B、HZ2A、HZ2B、HZ3A、HZ3B中的相对丰度依次为9.69%、0.24%、0.11%、4.47%、0.58%、0.06%(图1-B)。
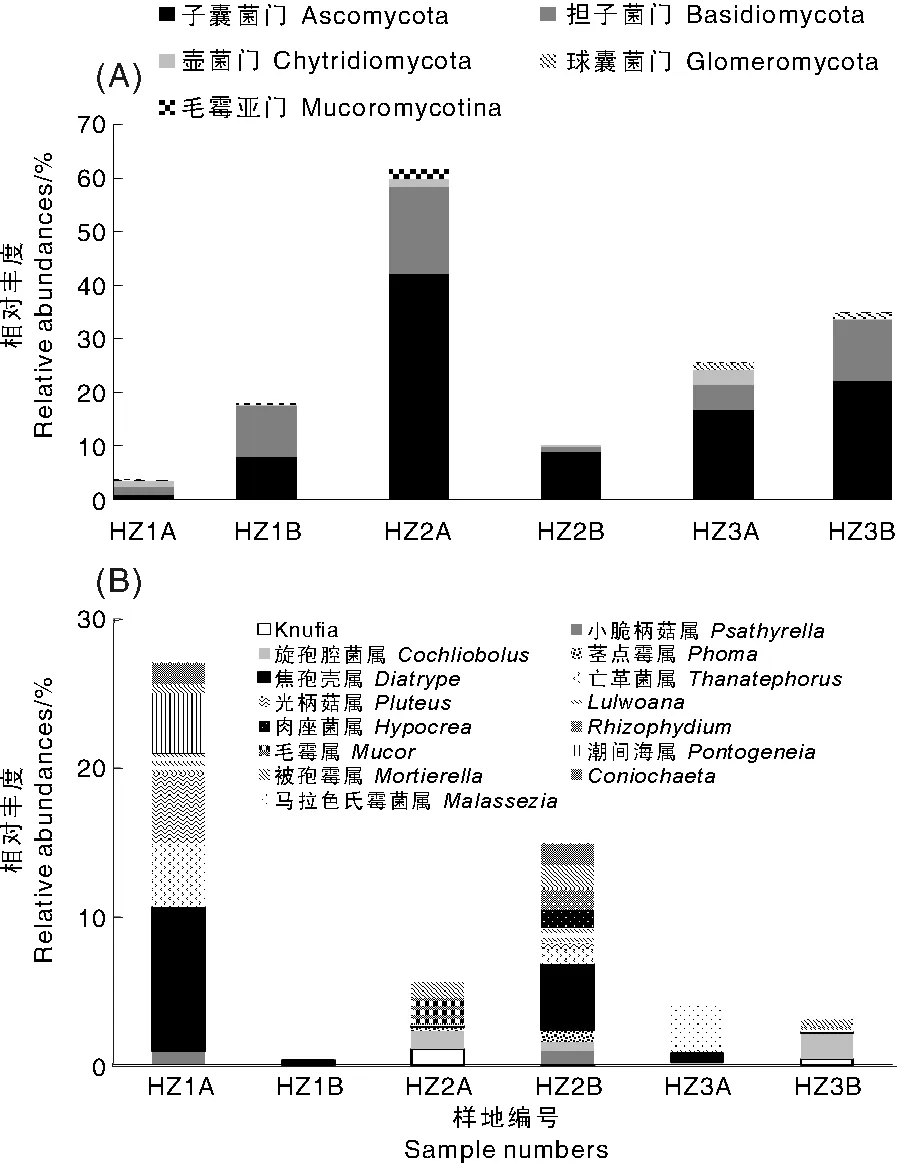
A,门;B,属A,phylum; B,genus
2.2 不同深度土壤真菌的分布
土壤真菌种类及其数量在不同样地中均存在差异。如光板地中,焦孢壳属(Diatrype)相对丰度较高;柽柳群落中,被孢霉属(Mortierella)、Cochliobolus相对丰度较高;而白茅群落中,马拉色氏霉菌属(Malassezia)相对丰度较高。此外,HZ1A、HZ1B、HZ2A、HZ2B、HZ3A和HZ3B中依次获得39属、50属、70属、40属、87属、63属真菌,说明HZ3A中真菌属的数量最多,HZ2A中次之,HZ1A最少。因此,从整体上看,真菌种类从高到低依次为白茅群落、柽柳群落、光板地,说明真菌种类随着盐生植被正向演替有不断增多的趋势。光板地土壤中,0~20cm土壤真菌种类少于20~40cm土壤;在柽柳群落和白茅群落中,0~20cm土壤真菌种类多于20~40cm。土壤真菌相对丰度的变化规律与种类上的变化规律基本一致,除光板地外,同一真菌,其在0~20cm的相对丰度普遍大于20~40cm的相对丰度。因此,随土壤深度的增加,光板地中真菌种类和相对丰度呈现出增多的趋势,而在柽柳和白茅群落中随土壤深度增加,真菌种类和相对丰度有不断减少的趋势。
2.3 土壤真菌多样性
由表1可知,6个土样中土壤真菌覆盖率均高于89%,表明本次实验测序深度较合理,基本能代表各样本土壤真菌的真实情况。在各样地中,OTUs数以及Chao1依次为白茅群落>光板地>柽柳群落;Shannon指数、ACE指数依次为白茅群落>柽柳群落>光板地,表明白茅群落真菌种类最为丰富,与前文分析结果一致。6个土样中OTUs数依次为HZ3A>HZ1A>HZ2A>HZ3B>HZ1B>HZ2B;Shannon指数平均值依次为HZ3A>HZ2A>HZ1A>HZ2B>HZ1B>HZ3B;ACE指数以及Chao1指数平均值均为HZ3A>HZ2A>HZ1A>HZ1B>HZ3B>HZ2B,其中,HZ3A的OTUs数是HZ2B的2.37倍,HZ3A的Shannon指数平均值是HZ3B的1.36倍,HZ3A的ACE指数以及Chao1指数平均值分别是HZ2B的3.08和2.71倍。由此可知,白茅群落真菌种类较多,尤其是0~20cm土壤中真菌种类最为丰富,多样性最高。
表1 土壤真菌群落多样性
Table 1 Community diversity of soil fungi

样地Samples有效序列数Seq可操作分类单元OTUs多样性指数ShannonACEChao1覆盖率Coverage/%HZ1A66268744.851775.921437.6493.93HZ2A44688585.532340.181670.9189.66HZ3A662713076.242476.632036.7591.38HZ1B41676894.681597.971179.4191.72HZ2B49215514.73804.94750.8195.67HZ3B56526904.591077.381042.5694.78
2.4 土壤真菌的相似性
从表2可知,HZ1B与HZ2B真菌群落间的Unifrac metric值最小,为0.2355;HZ1A与HZ1B以及HZ1B与HZ3B真菌群落间的Unifrac metric值较小(0.2671、0.2822);HZ2B与HZ3A真菌群落间的Unifrac metric值最大,为0.7197,说明HZ1B与HZ2B间真菌群落间的相似性最大,HZ1A与HZ1B间以及HZ1B与HZ3B间真菌群落间的相似性较大,而HZ2B与HZ3A间真菌群落间相似性最小。
2.5 土壤真菌多样性与土壤理化性质的关系
对黄河三角洲土壤中的优势真菌属和多样性指数及土壤理化性质进行RDA分析,第1轴可以解释所有信息的67.06%,第2轴可解释17.58%(图2)。由RDA排序图可知,土壤碱解氮、速效磷、铵态氮、硝态氮对土壤真菌属及其多样性的分布作用较大。其中,土壤碱解氮最大,它与Knufia、Cochliobolus、毛霉属(Mucor)、马拉色氏霉菌属(Malassezia)、Shannon、ACE、Chao1呈负相关,与其余真菌属呈正相关。土壤铵态氮、硝态氮以及电导率与土壤真菌属及其多样性的相关规律与土壤碱解氮基本一致。而土壤速效磷、全氮与土壤真菌属和其多样性的相关规律与土壤碱解氮完全相反。土壤含水率仅与马拉色氏霉菌属、Shannon、ACE、Chao1成正相关,与其余真菌属成正相关。
表2 土壤真菌群落间Unifrac metric值
Table 2 Unifrac metric in soil fungi community

样地SamplesHZ1AHZ1BHZ2AHZ2BHZ3AHZ3BHZ1A1.0000HZ1B0.26711.0000HZ2A0.65460.68641.0000HZ2B0.37750.23550.69011.0000HZ3A0.58610.63700.58000.71971.0000HZ3B0.33650.28220.65070.32100.57951.0000

a、b、c、d、e、f、g、h、j、k、l、m、n、o、p、q、r、s分别代表Knufia、小脆柄菇属、旋孢腔菌属、茎点霉属、焦孢壳属、亡革菌属、光柄菇属、Lulwoana、肉座菌属、Rhizophydium、毛霉属、潮间海属、被孢霉属、Coniochaeta、马拉色氏霉菌属、以及Shannon指数、ACE指数、Chao1指数a,b,c,d,e,f,g,h,j,k,l,m,n,o,p,q,r and s represent Knufia,Psathyrella,Cochliobolus,Phoma,Diatrype,Thanatephorus,Pluteus,Lulwoana,Hypocrea,Rhizophydium,Mucor,Pontogeneia,Mortierella,Coniochaeta,Malassezia,Shannon,ACE,Chao1,respectively
3 结论与讨论
由于土壤真菌数量巨大,种类繁多[10-11],而传统的培养法遗漏了土壤中的一部分真菌,难以反映真菌群落多样性全貌[12],虽然变性梯度凝胶电泳(denatured gradient gel electrophoresis,DGGE)和末端限制性片段长度多态性(terminal-restriction fragment length polymorphism,T-RFLP)法具有高通量的优势,能指示不同群落结构的差别,但其对微生物的认识有限[13],常用的克隆文库分析则存在耗时耗力、通量低、文库小以及分辨率低等缺点[14]。454高通量测序相对于传统的培养法、DGGE、T-RFLP以及克隆文库等常规的分子生态学研究方法,拥有数据产出通量高、获得信息丰富、快捷和读长长等优点[15],能够研究高度复杂的真菌群落和稀有的微生物类群[16-18]。借鉴前人经验[15,19-22],本研究在土样采集时已经将多点混匀,因此未对同一样品设置重复,若实验条件允许,可在此方面进行后续研究。
在门以及属分类水平上,黄河三角洲柽柳和白茅群落的真菌种类以及相对丰度普遍高于光板地,推测植物能影响并增加土壤真菌种类及相对丰度,可能与植物体释放的根系分泌物有关[23]。通过Shannon指数、ACE指数分析可知,白茅群落和柽柳群落土壤真菌多样性也普遍高于光板地,表明植物种类的多样性也会影响土壤真菌的多样性,同Rovira[24]的研究结果一致。
在同一样地中,光板地中上层和下层真菌群落间的相似度最高,土壤深度对其真菌种类的影响最小,而柽柳和白茅群落中上层和下层真菌群落间相似度较低,可能是植物的出现加速了真菌的改变,使得真菌种类增多。在0~20cm土层中,光板地与柽柳群落间的Unifrac metric值为0.6546,与白茅群落间的Unifrac metric值为0.5861,柽柳与白茅群落间的Unifrac metric值为0.5800,表明在0~20cm土层中,柽柳与白茅群落的真菌相似度最高,光板地与白茅群落的真菌相似度次之,光板地与柽柳群落的真菌相似度最低。在20~40cm土层中,光板地与柽柳群落间的Unifrac metric值为0.2355,与白茅群落间的Unifrac metric值为0.2822,柽柳与白茅群落间的Unifrac metric值为0.3210,表明在20~40cm土层中,光板地与柽柳群落的真菌相似度最高,光板地与白茅群落的真菌相似度次之,柽柳与白茅群落的真菌相似度最低,与0~20cm土层的真菌相似度顺序相反。另外,0~20cm土层中,真菌群落间的相似度明显大于20~40cm土层,表明后者真菌种类较前者少,真菌群落变化速率慢,丰富度低,可能与植物、土壤透气性以及营养物质有关。
用454高通量测序方法研究光板地、柽柳群落和白茅群落土壤真菌组成及多样性及其与土壤真菌与理化因子的关系,结果表明,(1)从整体上看,真菌种类及其多样性随着正向演替有不断增多的趋势,白茅20~40cm真菌属种类最多,柽柳20~40cm次之,光板地0~20cm最少;同时,OTUs数、Chao1指数、Shannon指数、ACE指数平均值均是白茅群落>光板地>柽柳群落。(2)随土壤深度的增加,光板地真菌种类和相对丰度呈现出增多的趋势,而柽柳和白茅群落则与之相反;此外,0~20cm土层中菌群落间的相似度明显大于20~40cm土层,表明随土壤深度的增加,真菌种类减少。(3)土壤碱解氮对土壤真菌属和其多样性的分布影响最大,与Knufia、旋孢腔菌属(Cochliobolus)、毛霉属(Mucor)、马拉色氏霉菌属(Malassezia)、Shannon指数、ACE指数、Chao1指数呈负相关,与其余真菌属呈正相关。
[1] 陈怀满.环境土壤学[M].北京: 科学出版社,2005: 382-390.
[2] 马晨,马履一,刘太祥,等.盐碱地改良利用技术研究进展[J].世界林业研究,2010,23(2): 28-32.
MA C,MA L Y,LIU T X,et al.Research progress on saline land improvement technology[J].WorldForestryResearch,2010,23(2): 28-32.(in Chinese with English abstract)
[3] 左明,张士华,刘艳芬,等.黄河三角洲地区耐盐乡土植物种类及生态价值研究[J].中国野生植物资源,2014,33(3): 40-43.
ZUO M,ZHANG S H,LIU Y F,et al.Study on the kinds and ecological value of salt-tolerant native plants in Yellow River Delta[J].ChineseWildPlantResources,2014,33(3): 40-43.(in Chinese with English abstract)
[4] 宋红丽,孙志高,牟晓杰,等.黄河三角洲新生湿地不同生境下翅碱蓬锰和锌含量的季节变化[J].湿地科学,2012,10(1): 65-73.
SONG H L,SUN Z G,MOU J X.Seasonal changes of manganese and zinc contents inSuaedasalsain different growth conditions of the new-born wetlands in the Yellow River Delta[J].WetlandScience,2012,10(1): 65-73.(in Chinese with English abstract)
[5] 宋创业,黄翀,刘庆生,等.黄河三角洲典型植被潜在分布区模拟——以翅碱蓬群落为例[J].自然资源学报,2010(4): 677-685.
SONG C Y,HUANG C,LIU Q S,et al.Simmulation ofSuaedaheteropterapotential distribution in the the Yellow River Delta by using generalized additive models[J].JournalofNaturalResources,2010(4): 677-685.(in Chinese with English abstract)
[6] 马玉蕾,王德,刘俊民,等.黄河三角洲典型植被与地下水埋深和土壤盐分的关系[J].应用生态学报,2013,24(9): 2423-2430.
MA Y L,WANG D,LIU J M,et al.Relationships between typical vegetations,soil salinity and groundwater depth in the Yellow River Delta of China[J].ChineseJournalofAppliedEcology,2013,24(9): 2423-2430.(in Chinese with English abstract)
[7] 倪中应,王京文,石一珺,等.浙东北油菜产区土壤肥力状况及其评价[J].浙江农业学报,2014,26(2): 415-420.
NI Z Y,WANG J W,SHI Y J,et al.The status and evaluation of soil fertility in rapeseed production district in northeast Zhejiang[J].ActaAgriculturaeZhejiangensis,2014,26(2): 415-420.(in Chinese with English abstract)
[8] 陈贵,张红梅,沈亚强,等.绿肥和小麦秸秆与化肥配施对水稻生长和青紫泥土壤肥力的影响[J].浙江农业学报,2015,27(10): 1797-1801.
CHEN G,ZHANG H M,SHEN Y Q,et al.Influence of incorporation of green manure,wheat straw and chemical fertilizer on rice growth and fertility of purple clay-based paddy soil[J].ActaAgriculturaeZhejiangensis,2015,27(10): 1797-1801.(in Chinese with English abstract)
[9] KETTLER T A,DORAN J W,GILBERT T L.Simplified method for soil particle-size determination to accompany soil-quality analyses[J].SoilScienceSocietyofAmericaJournal,2001,65(3): 849-852.
[10] LOZUPONE C,KNIGHT R.UniFrac: a new phylogenetic method for comparing microbial communities[J].AppliedandEnvironmentalMicrobiology,2005,71(12): 8228-8235.
[11] GRANTINA L,SEILE E,KENIGSVALDE K.The influence of the land use on abundance and diversity of soil fungi: Comparison of conventional and molecular methods of analysis[J].EnvironmentalandExperimentalBiology,2011(9): 9-21.
[12] ZHANG L M,HU H W,SHEN J P,et al.Ammonia-oxidizing archaea have more important role than ammonia-oxidizing bacteria in ammonia oxidation of strongly acidic soils[J].TheISMEJournal,2012,6(5): 1032-1045.
[13] 何苑皞,周国英,王圣洁,等.杉木人工林土壤真菌遗传多样性[J].生态学报,2014,34(10): 2725-2736.
HE Y H,ZHOU G Y,WANG S J,et al.Fungal diversity inCunninghamialanceolataplantation soil[J].ActaEcologicaSinica,2014,34(10): 2725-2736.(in Chinese with English abstract)
[14] RAINA V,SUAR M,SINGH A,et a1.Enhanced biodegradation of hexachlorocyclohexane (HCH) in contaminated soils via inoculation withSphingobiumindicumB90A[J].Biodegradation,2008,19(1): 27-40.
[15] 华蔚颖,徐昭,张梦晖,等.CVTree在454高通量测序分析菌群结构中的应用[J].中国微生态学报,2010,22(4): 312-316.
HUA W Y,XU Z,ZHANG M H.The application of CVTree in structural analysis of microbial communities by 454pyrosequencing[J].ChineseJournalofMicroecology,2010,22(4): 312-316.(in Chinese with English abstract)
[16] 袁超磊,贺纪正,沈菊培,等.一个红壤剖面微生物群落的焦磷酸测序法研究[J].土壤学报,2013,50(1): 138-149.
YUAN C L,HE J Z,SHEN J P,et al.Pyosequencing approach to study microbial composition in a red soil profile[J].ActaPedologicaSinica,2013,50(1): 138-149.(in Chinese with English abstract)
[17] 张文力.高通量测序数据分析现状与挑战[J].集成技术,2012,1(3): 20-24.
ZHANG W L.Status and challenges on data analysis of high throughput sequencing[J].JournalofIntegrationTechnology,2012,1(3): 20-24.(in Chinese with English abstract)
[18] 贺纪正,袁超磊,沈菊培,等.土壤宏基因组学研究方法与进展[J].土壤学报,2012,49(1): 155-164.
HE J Z,YUAN C L,SHEN J P,et al.Methods for and progress in research on soil metagenomics[J].ActaPedologicaSinica,2012,49(1): 155-164.(in Chinese with English abstract)
[19] BUÉE M,REICH M,MURAT C,et al.454pyrosequencing analyses of forest soils reveal an unexpectedly high fungal diversity[J].NewPhytologist,2009,184(2): 449-456.
[21] LAUBER C L,HAMADY M,KNIGHT R,et al.Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale[J].AppliedandEnvironmentalMicrobiology,2009,75(15): 5111-5120.
[22] JONES R T,ROBESON M S,LAUBER C L,et al.A comprehensive survey of soil acidobacterial diversity using pyrosequencing and clone library analyses J].TheISMEJournal,2009,3(4): 442-453.
[23] BATES S T,BERG-LYONS D,CAPORASO J G,et al.Examining the global distribution of dominant archaeal populations in soil[J].TheISMEJournal,2011,5(5): 908-917.
[24] ROVIRA A D.Interactions between plant roots and soil microorganisms[J].AnnualReviewofMicrobiology,1965,19: 241-266.
(责任编辑 侯春晓)
欢迎订阅2017年《浙江农业学报》(月刊)
《浙江农业学报》——全国中文核心期刊,英国CAB文摘数据库收录期刊,中国科学引文数据库(CSCD)核心库收录期刊,中国科技核心期刊。据中国学术期刊影响因子(2015版)报告,该刊5年复合影响因子达1.151。该刊曾被浙江省推荐为国家期刊奖候选期刊,获全国优秀农业期刊奖、第五届华东地区优秀期刊和浙江省优秀期刊一等奖。
该刊为月刊,大16开本,封面彩色铜版纸,每月25日出版。国内统一连续出版物号:CN 33-1151/S,国际标准连续出版物号:ISSN 1004-1524。国内每期定价10.00元,全年12期120元。该刊系参加“全国非邮发报刊联合征订”的期刊,请广大订户直接向“全国非邮发报刊联合征订服务部”订阅,地址:300385天津市大寺泉集北里别墅17号联合征订服务部;电话:(022)23973378,23692479;E-mail: LHZD@public.tpt.tj.cn;需要联合征订目录者,可直接向征订服务部函索或上网查阅。网址:www.LHZD.com,欢迎上网,下载“电子订单”订阅。漏订者请直接与该刊编辑部联系。
欢迎登录《浙江农业学报》网上投稿系统进行投稿和查阅,网站还提供论文免费下载。
唯一官网http://www.zjnyxb.cn
E-mail: zjnyxb@126.com
电 话:(0571)86404055(订刊,稿件查询);86404190,88923181(编辑部)
传 真:(0571)86404190
地 址:310021 杭州石桥路198号浙江省农业科学院
Soil fungal diversity and its relationship with soil physical and chemical properties in saline alkali soil of Yellow River Delta
WANG Yan-yun,GUO Du-fa*
(CollegeofGeographyandEnvironment,ShandongNormalUniversity,Ji’nan250000,China)
Soil fungal diversity and the relationship between physical and chemical properties were studied using 454high-throughput sequencing under bare land,Tamarixchinensiscommunity andApocynumvenetumcommunity.Total of 174genera and 5phyla were obtained in this study.The species and diversity of these fungi in different soil samples were different.Many kinds of fungi were obtained inA.venetumcommunity,and HZ3A had the most fungi species.The genus of HZ3A was 2.23times as much as HZ1A,1.74times as much as HZ1B,1.24times as much as HZ2A,2.18times as much as HZ2B,1.38times as much as HZ3B.In addition,soil fungal diversity ofA.venetumcommunity was higher than those of bare land andT.chinensiscommunity.Alkali-hydrolyzable nitrogen (AN) had the greatest impact on distribution and diversity of soil fungal genera.AN was negatively correlated with the relative abundances ofKnufia,Cochliobolus,Mucor,Malasseziaand was positively correlated with the other fungi.
Yellow River Delta; 454high throughput sequencing; soil fungi,fungal diversity; alkali-hydrolyzable nitrogen
10.3969/j.issn.1004-1524.2016.11.15
2016-03-22
山东省自然科学基金项目(ZR2012DM013)
王艳云(1990—),女,山东临沂人,硕士研究生,主要从事土壤真菌研究。E-mail: 1786582634@qq.com
S287;Q939.5
A
1004-1524(2016)11-1901-07
浙江农业学报ActaAgriculturaeZhejiangensis,2016,28(11): 1901-1907
http://www.zjnyxb.cn
王艳云,郭笃发.黄河三角洲盐碱地土壤真菌多样性及其与土壤理化性质的关系[J].浙江农业学报,2016,28(11): 1901-1907.
*通信作者,郭笃发,E-mial: guodufa@163.com

