中国被毛孢有性发育启动前后cDNA文库的构建
谢 放,常黎明,李建宏,张 育,张亚军,刘 帅
(兰州交通大学 化学与生物工程学院,甘肃 兰州 730070)
中国被毛孢有性发育启动前后cDNA文库的构建
谢 放,常黎明,李建宏,张 育,张亚军,刘 帅
(兰州交通大学 化学与生物工程学院,甘肃 兰州 730070)
构建了中国被毛孢有性发育启动前后的cDNA文库。采用Total RNA Kit Ⅰ法提取总RNA,磁珠法分离mRNA,反转录合成双链cDNA。获得的cDNA经蛋白酶K与SfiⅠ消化酶切并纯化,连接到载体pUC19上,采用电转化法将其转化到感受态细胞DH-5α中。之后测定文库的克隆数、重组率、插入片段大小。结果显示,文库1含1.09×106个重组体,蓝白斑实验显示重组率为92.5%;文库2含1.13×106个重组体,蓝白斑实验显示重组率为92%;两文库重组DNA片段的大小范围均在500~2000bp。说明本试验中所提取的 RNA 其纯度很好,完全可以达到后续研究的要求。
中国被毛孢;有性发育;cDNA文库
冬虫夏草Ophiocordycepssinensis(Berk.) G.H.Sung,J.M.Sung,Hywel-Jones &Spatafora是我国青藏高原所特产的一种珍稀中药材,因独特药用价值和产地生态条件的特殊性[1-2],赋予其极高的经济价值,近年来,市场价格更是飙升到相当于黄金的程度。自20世纪80年代起,我国学者就对冬虫夏草进行了广泛的研究,如沈南英等[3]最早分离出该菌种并研究了冬虫夏草的菌丝的生长特性;本课题组从冬虫夏草虫体上分离出一株真菌并对它的生长特性及其与冬虫夏草菌的相互关系进行了研究[4];梁宗琦等[5]对冬虫夏草子囊孢子的发育进行了观察研究,揭示了子囊孢子发育过程的特点和规律;莫名和等[6]、刘作易等[7]分别对冬虫夏草的微循环产孢和子囊孢子的发育过程进行了研究;此外,李黎等[8]对子囊孢子的发育与弹射、李玉玲[9]对青海玉树冬虫夏草子囊孢子的生长发育进行观察研究;焦彦朝等[10]将冬虫夏草的生物活性物质及其药用作用进行了系统综述。但是,由于中国被毛孢人工培养技术的限制,前人对其研究几乎都是从细胞学、形态学等方面进行的,是静态的分析测定,没有与生长发育相联系。对于冬虫夏草菌——中国被毛孢Hirsutellasinensis子实体发育的规律,国内外目前仍是空白,而解决这一问题,将有助于了解冬虫夏草发育的奥秘,同时对最终实现人工栽培也具有十分重要的意义。本课题组利用自己分离出的甘肃产地的菌种,成功地在培养基上培育出了冬虫夏草子实体,其形态与天然子实体相同,经多代转接,反复试验,均能稳定地形成子实体。这一突破为中国被毛孢子实体发育规律的研究奠定了基础。
cDNA文库在研究某类特定细胞中基因组的表达状态以及在表达基因的功能鉴定方面具有特殊的优势,从而使它在个体发育[11]、细胞分化、细胞周期调控等方面的研究中备受研究者青睐。本研究以课题组[12]已经获得的中国被毛孢子实体人工培养技术为基础,分别在子实体发育前和子实体发育原基期取样并构建cDNA文库,旨在为进一步研究其发育的分子机制奠定基础。
1 材料与方法
1.1 试验材料
供试菌种分离自甘肃冬虫夏草主产地甘南榨油沟产冬虫夏草子实体;已经结合DNA序列比对研究鉴定为中国被毛孢H.sinensis.X.J.Liu[13],经本课题组特殊培养处理,令其在人工培养基上产生子实体[12],分别在子实体发育前(1号样品)和子实体发育原基期(2号样品)取样 (图1)。
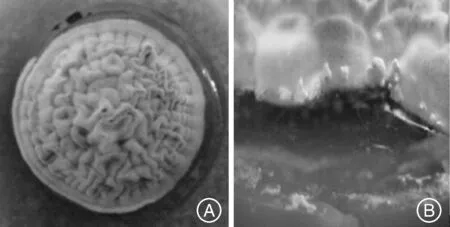
A,子实体发育前菌落;B,形成中的子实体原基A,Colony before the fruiting body development; B,The formating primordia of the fruiting body
1.2 试剂及仪器
1.2.1 主要试剂
Total RNA KitⅠ(Omega);PolyATtractmRNA Isolation System Ⅲ(Promega);SMART cDNA Library Construction Kit(Clontech);QIAquick PCR Purification Kit(Qiagen);Advantage 2Polymerase Mix(Clontech);SfiⅠ(NEB);DL2000Marker(TaKaRa).
1.2.2 主要仪器及耗材
台式离心机Centrifuge 5418R(eppendorf);PCR仪MyCycler(Bio-rad);电泳仪HE-120(Tanon);凝胶成像仪2500(Tanon);紫外分光光度计Nano Drop 2000(Thermo);各型号tip,离心管(Axygen)。
1.3 方法
1.3.1 RNA提取
Total RNA KitⅠ试剂盒提取,分别进行琼脂糖凝胶电泳和紫外分析测定。琼脂糖凝胶电泳采用1%琼脂糖凝胶浓度,120V电压15min。
1.3.2 mRNA的分离
采用PolyATtractmRNA Isolation System Ⅲ(磁珠法)分离纯化mRNA,取mRNA溶于60μL DEPC水中,取6μL测D值,确定其含量。
1.3.3 cDNA第一链合成
(1)在0.2mL PCR管中依次加入总RNA(1μg),SMART Ⅳ Oligonucleotide(1μL),CDS Ⅲ/3′ PCR Primer(1μL),ddH2O(2μL)构成5μL反应体系;(2)72℃温浴2min;(3)冰浴2min,离心后依次加入5×First-Strand Buffer(2μL),20mmol·L-1DTT(1μL),10mmol·L-1dNTP Mix (1μL),PowerScript Reverse Transcriptase(1μL)构成5μL反应体系;(4)42℃温浴1h。
1.3.4 LD-PCR
(1)将PCR仪预热到95℃;(2)在0.2mL反应管中依次加入cDNA第一链产物(2μL),ddH2O(80μL),10×Advantage 2PCR Buffer (10μL),CDS Ⅲ/3′ PCR Primer(2μL),50×dNTP Mix(2μL),5′ PCR Primer(2μL),50×Advantage 2Polymerase Mix(2μL)构成100μL反应体系;(3)1000r·min-1离心1min后放至已预热的PCR仪中;(4)PCR程序设置:95℃预变性1min,95℃变性15s,66℃退火20s,72℃延伸1min,18个循环后72℃延伸4min。
1.3.5 蛋白酶K消化
(1)每50μL扩增的双链cDNA中加入20μL蛋白酶K(20μg·μL-1);(2)混匀并短暂离心;(3)45℃温浴20min,离心30s;(4)加入等体积酚/氯仿/异戊醇混合液剧烈振荡2min;(5)14000r·min-1离心5min;(6)收集上层液体到另一干净的离心管中,弃去中间层和下层溶液;(7)加入等体积的氯仿/异戊醇混合液剧烈振荡1~2min;(8)14000r·min-1离心5min;(9)收集上层液体到另一干净的离心管中,弃去中间层和下层溶液;(10)加入1/10体积的3mol·L-1乙酸钠,2.5倍体积95%的室温乙醇,室温条件下于14000r·min-1离心20min;(11)弃上清,用100μL 80%乙醇洗沉淀物;(12)空气干燥沉淀物约10min;(13)加85μL去离子水溶解沉淀;(14)取5μL样品电泳检测。
1.3.6 SfiⅠ消化
(1)在1.5mL离心管中依次加入2μg ds-cDNA (79μL),10×Sfi Buffer(10μL),SfiⅠ(10μL),100×BSA(1μL)构成100μL反应体系;(2)充分混匀,50℃温浴2h。
1.3.7 酶切cDNA纯化
(1)加入等体积酚/氯仿/异戊醇混合液剧烈振荡2min;(2)14000r·min-1离心5min;(3)收集上层液体到另一干净的离心管中,弃去中间层和下层溶液;(4)加入等体积的氯仿/异戊醇混合液剧烈振荡2min;(5)14000r·min-1离心5min;(6)收集上层液体到另一干净的离心管中,弃去中间层和下层溶液;(7)加入1/10体积的3mol·L-1乙酸钠,2.5倍体积95%的室温乙醇,室温条件下立即14000r·min-1离心20min;(8)弃去上清,用100μL 80%乙醇洗沉淀物;(9)空气干燥沉淀物约10min;(10)加100μL去离子水溶解沉淀。
1.3.8 cDNA 与pUC19载体连接
在0.2mL PCR管中依次加入ds-cDNA 5μL,50ng·mL-1Vector 1μL,10×Ligation Buffer 1μL,10mmol·L-1ATP 1μL,T4DNA Ligase 1μL,ddH2O 1μL构成10μL体系后4℃反应过夜(所用克隆载体为pUC19的改造载体)。
1.3.9 质粒的转化
(1)取200μL感受态宿主菌(DH-5α),放置冰上融化;(2)加入上述1μL连接液,轻轻混匀后置于冰上30min;(3) 42℃水浴热休克90s,迅速放入冰上2min;(4)加入300μL SOC培养基(不含抗生素),置于37℃摇床,转速200r·min-1,复苏45min;(5)菌液涂布于15cm培养皿上(Apr-IPTG/x-gal LB固体培养基),37℃过夜培养。
1.3.10 文库克隆鉴定
(1)挑克隆,37℃,200r·min-1培养过夜,取1μL菌液作为PCR模板,在PCR管中依次加入10×PCR Buffer 2.5μL,50×dNTP Mix 0.5μL,引物M13F:5’-GGT AAC GCC AGG GTT TTC C-3’;M13R:5’-CAG GAA ACA GCT ATG ACC-3’各0.5μL,rTaq0.5μL,PCR模板1.0μL,ddH2O 19.5μL构成25μL反应体系;(2)轻拍混匀各组分,1000r·min-1离心1min后放至已预热的PCR仪中;(3)PCR程序设置:94℃预变性3min,94℃变性30s,68℃退火30s,72℃延伸1min,36个循环后72℃延伸5min;(4)从各管中分别取5μL电泳检测。
2 结果与分析
2.1 RNA抽提、纯化及质检
如表1和图2所示:测定1号样品(M1)总RNA的D260/D280=2.14,计算浓度为0.0277μg·μL-1琼脂糖凝胶电泳总RNA显示28S和18S两条带,亮度比例约2∶1,分离纯化的mRNA测D值,计算浓度为100μg·mL-1;测定2号样品(M2)总RNA的D260/D280=1.96,计算浓度为0.0163μg·μL-1。琼脂糖凝胶电泳总RNA显示28S和18S两条带,亮度比例约2∶1,但2号样品相应条带的总亮度较1号样品明显降低,分离纯化的mRNA测D,计算浓度为100μg·mL-1。在28S和18S核糖体带之间一般可以看到一片弥散的EB染色物质,可能是由mRNA和其他异型RNA组成。
2.2 cDNA合成检测
取产物于10g·L-1琼脂糖凝胶电泳检测如图3,可见分布在500bp以上呈长瀑布状条带,显示cDNA smear较长。
2.3 计算菌落数及重组率
构建的文库进行蓝白斑筛选,如图4。1号文库共有菌落数为1098个,其中蓝斑82个,重组率为92.5%,2号文库菌落数为1132个,其中蓝斑91个,重组率为92%。
2.4 文库检测
取5μL子座部分cDNA电转化后的菌液涂布平板,37℃过夜培养后1号文库共长了1090个单菌落,转化后共得1000μL菌液,所以库容为1.09×106。2号文库共长了1130个单菌落,转化后共得1000μL菌液,所以库容为1.13×106。两个文库分别挑取24个克隆做PCR后接着做琼脂糖凝胶电泳鉴定,插入片段鉴定电泳结果如图5。从图5可知,1号文库的插入片段的大小范围在500~2000bp之间,达到了cDNA文库构建要求[14]。
表1 RNA检测结果
Table 1 RNA test results

样本Sample浓度Concentration/(μg·μL-1)D260/D280体积Volume/L总量Amount/μgM10.02772.14401.1M20.01631.96400.7
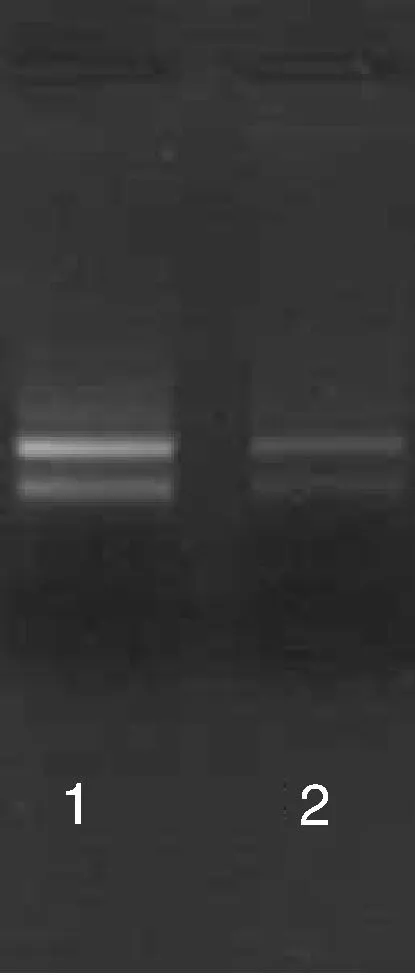
图2 RNA电泳图Fig.2 RNA electrophoresis gel image
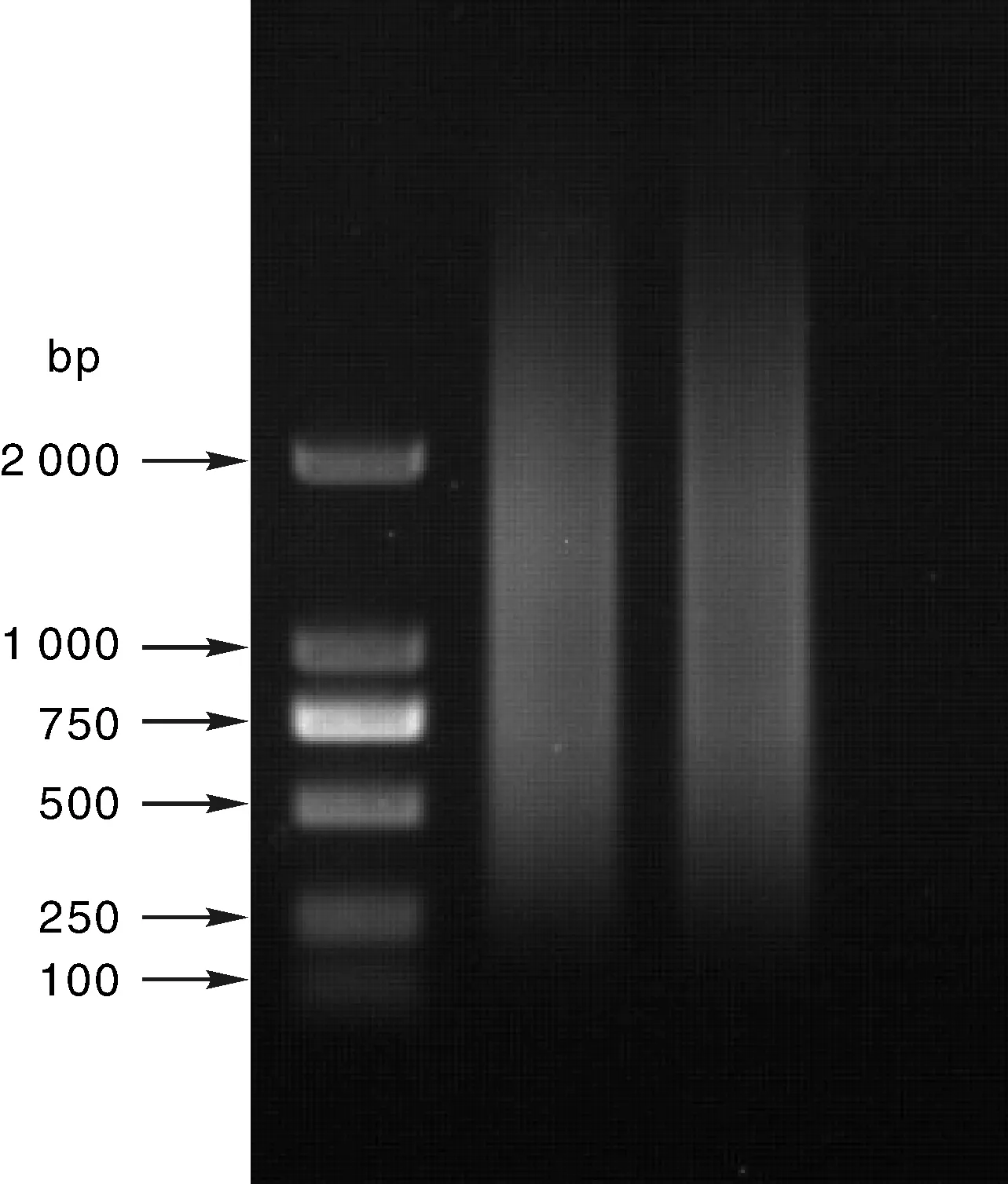
所用marker为TaKaRa公司的DL2000,从上到下条带依次为2000、1000、750、500、250、100bpThe size of Marker from top to bottom is 2000,1000,750,500,250and 100bp,respectively
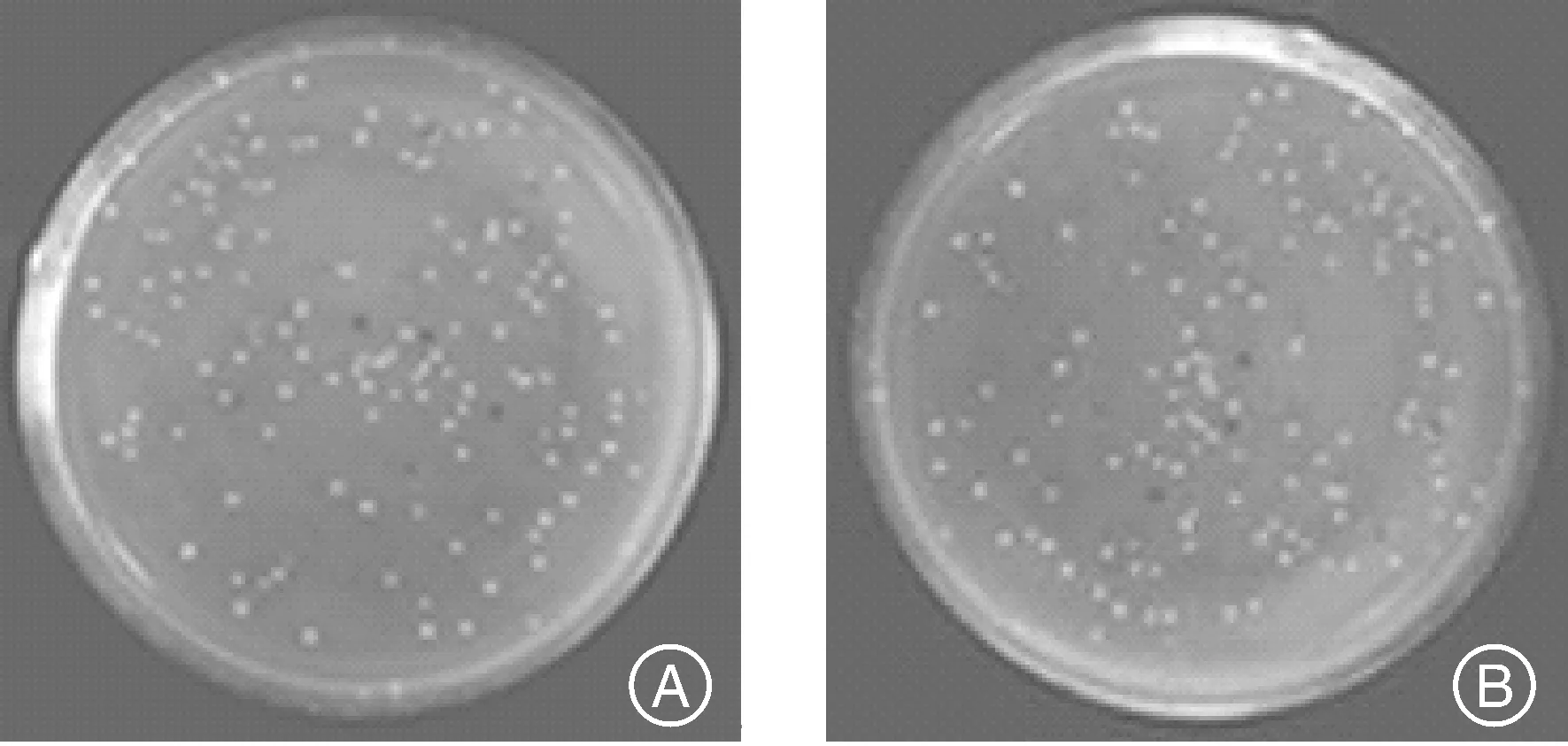
图4 1号(A)和2号(B)cDNA文库蓝白斑结果Fig.4 The results of the blue and white test for cDNA library 1and library 2
3 讨论
基因序列是基因研究的基础,而基因专利则是基因产业的基础。因而,基因资源是国际上争夺的重要战略资源。那么中药基因资源的保护与开发,对未来中药产业的发展关系重大。有关冬虫夏草的研究多集中于活性组分和药理特性的研究,而对于功能基因的研究,目前仅见于Zhang等[15]的工作。因此,冬虫夏草相关功能基因的研究已成为一项非常迫切的任务,而cDNA文库技术又是功能基因研究的基础,本研究只针对有性发育过程cDNA文库构建的方法做了阐述,而对于其深层次生物信息的挖掘,有待进一步的研究。对于冬虫夏草cDNA文库的研究,刘燕南等[16]、冯辉[17]曾分别将子座部分和菌核部分构建了两个cDNA文库,然而,其所用材料为野生冬虫夏草,对于人工条件下子实体的发育过程和发育机理仍然是空白,本研究首次以人工培养的子实体为材料,构建cDNA文库,旨在为进一步揭示冬虫夏草发育规律和次级代谢产物发育基因奠定基础。
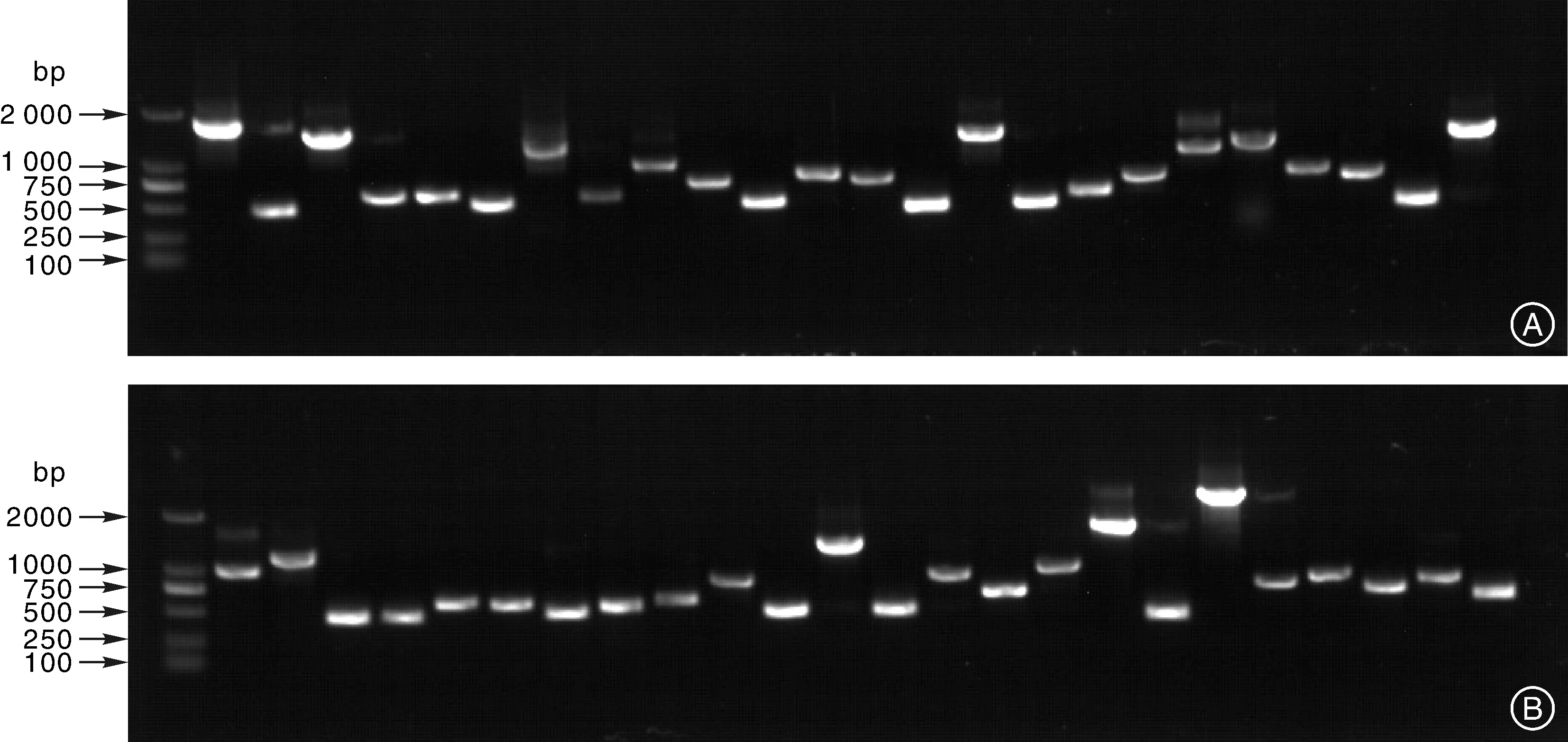
所用marker为TaKaRa公司的DL2000,从上到下条带依次为2000、1000、750、500、250、100bpMarker for TaKaRa DL2000,from top to bottom with the following sequence is 2000,1000,750,500,250and 100bp,respectively
[1] 孙爱红,左雪枝.冬虫夏草研究进展[J].安徽农业科学,2007,35(27):8521-8522,8598.
SUN A H,ZUO X Z.Study progress ofOphiocordycepssinensis[J].JournalofAnhuiAgriculturalSciences,2007,35(27):8521-8522,8598.(in Chinese with English abstract)
[2] 李玉玲.冬虫夏草菌研究与利用概况[J].青海畜牧兽医杂志,2007,37(4):35-36.
LI Y L.The research and utilization ofOphiocordycepssinensis[J].ChineseQinghaiJournalofAnimalandVeterinarySciences,2007,37(4):35-36.(in Chinese)
[3] 沈南英,曾璐,张显耻,等.冬虫夏草真菌的分离[J].食用菌,1983(5):1-5.
SHEN N Y,ZENG L,ZHANG X C,et al.The separation ofOphiocordycepssinensis[J].EdibleFungi,1983(5):1-5.(in Chinese)
[4] 谢放,张育,朱玉兰.一株冬虫夏草相关菌株的生物学特性[J].浙江农业学报,2016,28(2):306-311.
XIE F,ZHANG Y,ZHU Y L.Biological characteristics of a strain ofOphicordycepssinensisrelated fungi[J].ActaAgriculturaeZhejiangensis,2016,28(2): 306-311.(in Chinese with English abstract)
[5] 梁宗琦,刘爱英,刘作易.冬虫夏草子囊孢子的发育[J].真菌学报,1995,14(2):148-152.
LIANG Z Q,LIU A Y,LIU Z Y.The development of ascospores ofOphiocordycepssinensis(Berk.)SACC[J].ActaMycologicaSinica,1995,14(2):148-152.(in Chinese with English abstract)
[6] 莫明和,迟胜起,张克勤.冬虫夏草的微循环产孢及其无性型的分离[J].菌物系统,2001,20(4):482-485.
MO M H,CHI S Q,ZHANG K Q.Microcycle conidiation ofCordycpssinensisand anamorph isolation[J].Mycosystema,2001,20(4):482-485.(in Chinese)
[7] 刘作易,梁宗琦,辛智海.冬虫夏草显微结构再观察和子囊孢子发育研究[J].贵州科学,2003,21(2):51-57,68.
LIU Z Y,LIANG Z Q,XIN Z H .Microscopic re-observation ofCordycepssinensisand study of its ascosporal development[J].GuizhouScience,2003,21(2):51-57,68.(in Chinese)
[8] 李黎,尹定华,陈仕江.康定冬虫夏草子囊孢子的生长发育[J].中国中药杂志,2000,25(8):501-502.
LI L,YI D H,CHEN S J .The growth and development of Kangding spores cordyceps science[J].ChinaJournalofChineseMateriaMedica,2000,25(8):501-502.(in Chinese)
[9] 李玉玲.冬虫夏草子囊孢子的初步研究[J].中国食用菌,2002,21(4):9-10.
LI Y L.Research on ascospores ofCordycepssinensis[J].EdibleFungiofChina,2002,21(4):9-10.(in Chinese)
[10] 焦彦朝,梁宗琦,刘爱英.虫草生物活性物质研究概况[J].贵州农业科学,1990(3):53-58.
JIAO Y C,LIANG Z Q,LIU A Y.Research situation of bioactive substances inCordycepssinensis[J].JourualofGuizhouAgriculturalSciences,1990(3):53-58.(in Chinese)
[11] 沈颖越,顾敏,蔡为明,等.秀珍菇子实体发育相关消减杂交cDNA文库的构建与分析[J].浙江农业学报,2014,26(2): 330-334.
SHEN Y Y,GU M,CAI W M,et al.Construction and analysis of a suppressive subtractive hybridisation cDNA library related to fruiting body formation ofPleurotuspulmonariusafter cold stimulation[J].ActaAgriculturaeZhejiangensis,2014,26(2): 330-334.(in Chinese with English abstract)
[12] 李建宏,赵春巧,朱子雄.冬虫夏草菌有性发育的初步研究[C].中国菌物学会.2012年中国菌物学会学术年会会议摘要.北京: 2012.
[13] 朱子雄,谢放,张楠.甘肃省冬虫夏草遗传多样性的ISSR分析[J].菌物学报,2011,30(3):501-507.
ZHU Z X,XIE F,ZHANG N.Genetic diversity ofOphiocordycepssinensisin Gansu Province based on infer-simple sequence repeat(ISSR)analyses[J].Mycosystema,2011,30(3):501-507.(in Chinese with English abstract)
[14] 卢圣栋.现代分子生物学实验技术[M].北京:高等教育出版社,1993.
[15] ZHANG Y J,LIU X Z,WANG M.Cloning,expression,and characterization of two novel cuticle-degrading serine proteases from the entomopathogenice fungusCordycepssinensis[J].ResearchinMicrobiology,2008,159(6): 462-469.
[16] 刘燕南,金永三,刘震.冬虫夏草cDNA文库的构建和鉴定[J].中国中医药信息杂志,2006,13(9):43-45.
LIU Y N,JIN Y S,LIU Z.CordycepssinensiscDNA library construction and indentification[J].ChineseJournalofInformationonTraditionalChineseMedicine,2006,13(9):43-45.(in Chinese with English abstract)
[17] 冯辉.野生冬虫夏草cDNA文库构建、表达序列标签测序及部分功能基因分析[D].北京:北京中医药大学,2008.
FENG H.WildCordycepssinensiscDNA library construction,EST sequencing and functional genes analysis[D].Beijing: Beijing University of Chinese Medicine,2008.(in Chinese with English abstract)
(责任编辑 张 韵)
Construction of cDNA libraries from Hirsutella sinensis before and after sexual development
XIE Fang,CHANG Li-ming,LI Jian-hong,ZHANG Yu,ZHANG Ya-jun,LIU Shuai
(SchoolofChemicalandBiologicalEngineering,LanzhouJiaotongUniversity,Lanzhou730070,China)
The cDNA libraries were constructed fromHirsutellasinensisbefore and after the sexual development,respectively.Total RNA KitⅠ method was used to extract total RNA.The mRNA was separated by magnetic particles,and then double stranded cDNA was synthesized by reverse transcription.The obtained cDNA was purified by proteinase K andSfiⅠdigestive enzymes and connected to the carrier pUC19,then transferred into strain DH-5α with competent cells,by electrotransformation.Afterwards,the clone number,reconstruction ratio and the size of the insert fragment of the library were measured.The results showed that library 1contained 1.09×106recombinants,the blue and white test showed the reconstruction ratio was 92.5%,library 2contained 1.13×106recombinants,and the blue and white test showed the reconstruction ratio was 92%.The size of reconstructed DNA fragments in two libraries ranged from 500to 2000bp.It showed that RNA extracted in this experiment had good purification degree,which was enough to meet the requirements for subsequent research.
Hirsutellasinensis; sexual development; cDNA library
10.3969/j.issn.1004-1524.2016.11.14
2016-03-16
国家自然科学基金项目(215069)
谢放(1962—),男,甘肃兰州人,副教授,研究方向为资源与环境微生物。 E-mail: xfrankf@163.com
Q93
A
1004-1524(2016)11-1895-06
浙江农业学报ActaAgriculturaeZhejiangensis,2016,28(11): 1895-1900
http://www.zjnyxb.cn
谢放,常黎明,李建宏,等.中国被毛孢有性发育启动前后cDNA文库的构建[J].浙江农业学报,2016,28(11): 1895-1900.

