砷胁迫对黄瓜种子萌发与苗期生长的影响
巩 健
(淄博职业学院 制药与生物工程系,山东淄博 255314)
砷胁迫对黄瓜种子萌发与苗期生长的影响
巩 健
(淄博职业学院 制药与生物工程系,山东淄博 255314)
对不同质量浓度的砷对黄瓜种子萌发、苗期生长及其生理指标的影响进行初步研究。结果表明,5 mg/L 的砷可激发与黄瓜种子萌发、生长相关的生理调控因子,如过氧化物酶(POD)、可溶性糖等,对其有一定的促进作用(P>0.05);但随着砷质量浓度的增加,黄瓜种子萌发特性受到显著抑制,苗期根长、茎长和鲜质量也逐渐下降,并显著小于对照组(P<0.05);与生长相关的各项生理指标亦受到负面影响,其中丙二醛(MDA)质量摩尔浓度有显著增加趋势(P<0.05),而叶绿素质量分数、根系活力、过氧化物酶活性、可溶性糖与蛋白质质量分数等参数呈下降趋势,并显著低于对照组(P<0.05)。试验还表明,过量的砷对黄瓜种子萌发与幼苗生长均具有胁迫作用,且毒害严重。
砷;黄瓜;萌发;苗期;生理指标
近年来,随着工业生产的快速发展,环境污染也变得日益严重,尤其是重金属危害生态系统的问题越发突出。砷已被世界卫生组织确定为高毒致癌物质,它在自然界中的分布异常广泛,并与人类的生产活动关系密切,在饲料、农药、冶金与防腐等50多种行业中均有应用。长期以来,由于人类对砷的频繁利用,使得大量砷逸散在环境中不断蓄积与流转,使得人和动植物的健康安全常常受到危害。近日报道,中国有1 958万人口暴露于砷污染之中,其危害的严重性不可轻视[1]。另有不少研究反映,砷对粮食与蔬菜也已构成威胁[2-3]。砷本非植物所必需的矿物元素,正常情况下叶片中含砷量小于3 mg/kg[4]。大量研究显示,砷的蓄积性很强,对动植物毒性都很大。当砷毒害达到一定程度时,植物会表现出生长缓慢、植株矮小、褪绿与枯黄等中毒症状,严重影响农作物的生理机能、产量及其质量[5]。危害更大的是砷还能经过食物链损害人类健康,人出现急性中毒时将发生流涎、呕吐、腹泻、便血,以至肠肌痉挛、体温下降、虚脱,严重者出现中枢神经系统症状甚至死亡,慢性中毒的患者还将伴随致畸、致癌、致突变等病变[6-8]。
黄瓜(CucumissativusL.)是世界各地广为栽培的重要蔬菜作物,在中国蔬菜供应中也占有非常重要的地位,为设施栽培的主要蔬菜之一。目前,由于砷污染日益严重,致使黄瓜在栽培期间也经常遭受到不同程度的胁迫,造成其生长、代谢与生物量积累受到负面影响[9]。因此,研究砷污染影响黄瓜生长具有重要的现实意义。然而,当前有关砷胁迫对黄瓜苗期生长及其生理指标的研究却鲜有报道,其胁迫机制仍未被揭示。本研究以黄瓜为材料,探讨不同质量浓度的砷胁迫对黄瓜种子萌发、苗期生长及其可溶性糖、丙二醛(MDA)质量摩尔浓度、过氧化物酶(POD)活性等理化指标的影响,以进一步阐明砷在蔬菜种植过程中造成的毒害作用及其机制,从而有助于实现对砷污染的预测、评价与防治,并为蔬菜安全的应对措施提供科学依据。
1 材料与方法
1.1 供试品种
黄瓜品种为‘新泰密刺’,购自市面种子公司。
1.2 试验处理
选取健康饱满的黄瓜种子浸种24 h,然后以质量分数为10%的NaClO溶液消毒8 min,再用去离子水洗净,并用滤纸将水吸干。将以上种子以每皿36粒均匀排列在铺有双层脱脂纱布的培养皿中,再分别滴加含As5+0、5、10、30、50 mg/L质量浓度的处理液100 mL(以1/2强度的Hoagland营养液将Na2HAsO4·7H2O 配成含砷营养液),每处理组设5个重复,置于25 ℃恒温光照培养箱中培养。每天用称量法调节水分,观察种子发芽情况,按国际标准以胚根与种子等长为发芽标准[10]。待发芽结束后第8 天,测定黄瓜幼苗的生长指标及其生理指标等。
1.3 种子萌发参数测定
发芽率(Gp)=n/N×100%,式中n为规定日期7 d内发芽种子数,N为供检种子数;发芽势=发芽初期3 d内正常发芽种子数/供检种子数×100%;发芽指数(Gi)=∑(Gt/Dt),式中Gt为7 d内的发芽数,Dt为相应的发芽天数;活力指数(Vi)=S×∑(Gt/Dt),S表示为第7天单株幼苗的平均鲜质量[11-12];采用碱液滴定脂肪酸法测定脂肪酶活性[13]。
1.4 生物积累量测定
每个处理组取黄瓜苗植株40株(每皿取8株),以去离子水冲洗干净,拭干后按常规方法测量植株地上部分与地下部分鲜质量及株高(茎基部到生长点)、茎粗(茎基部)等指标,再将各植株置于105 ℃杀青15 min,70 ℃烘至恒质量,以测定其干物质量。
1.5 生理指标测定
利用分光光度法和Arnon的计算公式测定黄瓜苗叶片相对叶绿素质量分数[14];采用考马斯亮蓝G250法测定可溶性蛋白质量分数[15];以愈创木酚法测定过氧化物酶(POD)活性[16];采用硫代巴比妥酸法测定丙二醛(MDA)质量摩尔浓度和蒽酮比色法测定可溶性糖质量分数[13,17];根系活力采用TTC还原量表示[18]。
1.5 数据处理
均采用SPSS 14.0统计软件(SPSS Inc., USA)进行Duncan’s多重比较法对试验结果进行分析(P<0.05),数据以“平均值±标准差” (mean±SD) 表示。
2 结果与分析
2.1 砷胁迫对黄瓜种子萌发的影响
从表1看出,当砷离子质量浓度为5 mg/L时与对照组相比,对黄瓜种子萌发特性的负面影响并不明显,其中发芽率、发芽势与脂肪酶活性还反映出该剂量略有促进种子萌发的作用;但随着砷离子质量浓度进一步升高,黄瓜种子发芽率、发芽势、发芽指数与活力指数均呈快速下降趋势;当砷离子质量浓度达到50 mg/L时,黄瓜种子发芽势、发芽率、发芽指数、活力指数与脂肪酶活性均达到极显著差异(P<0.01)。
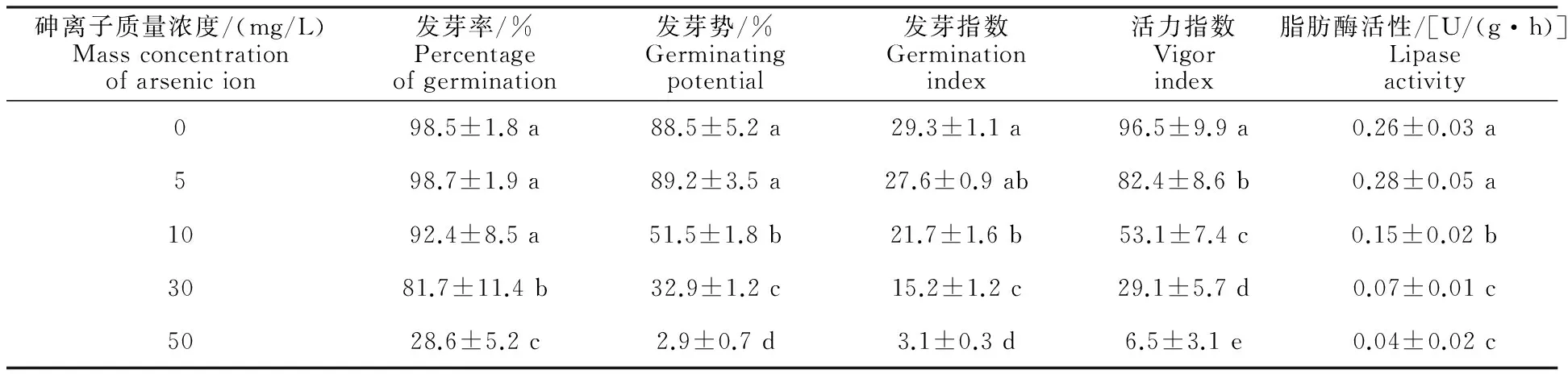
表1 砷胁迫对黄瓜种子萌发的影响
2.2 砷胁迫对黄瓜苗期生物积累量的影响
由表2可知,与对照组相比,当砷离子质量浓度为5 mg/L时,黄瓜苗期生物积累量的增加较为明显,但正向促进作用并未达到显著水平(P>0.05);随着砷离子质量浓度的逐渐增加,黄瓜苗期生长参数大部分显著降低,只有根冠比呈上升趋势。可见,高质量浓度砷离子对黄瓜苗期的生长性能具有毒害胁迫作用,且对地上部分的影响强于地下部分。
2.3 砷胁迫对黄瓜苗期生理指标的影响
从表3可见,与对照组相比,黄瓜幼苗受到5 mg/L砷离子胁迫时,可显著增加叶绿素质量分数、根系活力(P<0.05),并明显提高蛋白质与可溶性糖质量分数,增强POD活性,降低MDA质量摩尔浓度(P>0.05);当砷离子质量浓度为10 mg/L时,黄瓜苗期叶绿素质量分数、根系活力与对照组相比有促进趋势,但不显著,却能显著提高POD活性,以应对胁迫,其他生理指标也反映砷胁迫的毒害性;当砷离子质量浓度达到30 mg/L以上时,砷胁迫作用愈加严重,各项生理指标与对照组相比呈显著差异性(P<0.05)。可见,砷胁迫可使黄瓜幼苗体内多项生理指标发生变化,从而影响黄瓜苗期的生理代谢与生长发育。
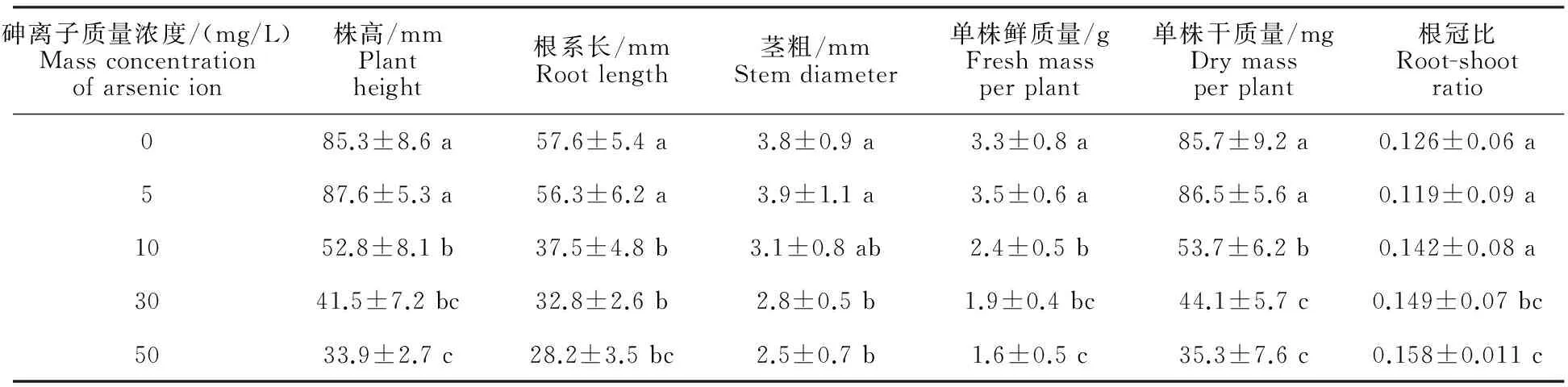
表2 砷胁迫对黄瓜幼苗生物量的影响

表3 砷胁迫对黄瓜幼苗生理指标的影响
3 讨 论
3.1 砷胁迫对黄瓜种子萌发与苗期生长的影响
种子的萌发特性,在很大程度上反映其种用价值与对环境的耐受性,可作为种子选育与环境评价的参考依据。而种子萌发的好坏常以种子发芽力、生活力相关的生物学指标来进行判定。如发芽率高低与活种子多少或环境好坏有关;发芽势大小表明种子活力的强弱;发芽指数与活力指数则进一步放大种子发芽活力的特征,增加其差异性;脂肪酶的重要作用是降解油脂为发芽提供能量,并促进细胞活力与幼苗生长[18]。万梦雪等[20]进行绿豆和黑豆加砷砂种子萌发试验后报道,1 mg/kg低质量分数的砷盐对绿豆与黑豆种子萌发质量均有一定的促进作用,大约可提高12%;超出5 mg/kg时,则表现明显的抑制作用。本研究发现,低质量浓度砷离子胁迫对黄瓜种子发芽率、发芽势和脂肪酶活性均无显著性影响;但砷离子质量浓度超出10 mg/L时,黄瓜种子萌发随即受到显著的抑制作用。可见,环境中的砷污染严重危害黄瓜种植业的正常生产。该研究结果与砷胁迫影响大豆种子萌发的报道也较为一致,可见,砷对种子萌发的胁迫作用在不同作物间存在相似性[21-22],即重金属对植物种子萌发和幼苗生长的影响一般认为存在一个较低浓度下的刺激效应和较高浓度下的抑制效应[23]。
生长量是植物对环境响应的综合体现与反映。本试验结果反映,砷虽非黄瓜等植物生长所必需的元素,却在微量范围内对种子萌发和植株生长有明显的刺激作用,但超出一定浓度后即对植物的正常生长产生胁迫作用,该结果和相关文献报道比较接近。新近研究显示,与对照相比,质量浓度为0.3 mg/L砷可显著提高黑藻的生物积累量[24]。而小麦在低质量分数(小于60 mg/kg)砷液下也可增加产量,但在高质量分数(80~100 mg/kg)砷的胁迫下产量显著降低[25]。以上研究结果不尽相同,其原因可能与砷自身的甲基化,或影响其他元素的吸收、机体内生理活性成分等方面存在差异性有关[26-28]。此外,不同植物本身对砷的耐受性也具有很大的差异,一般表现为旱生作物对砷的忍耐性大于禾谷类作物,而水生作物大于豆类和蔬菜作物[29]。
3.2 砷胁迫对黄瓜苗期生理机能的影响
砷对黄瓜生长的胁迫作用,也是通过影响其生理机能而实现的。因此,本研究通过检测黄瓜苗期多项生理指标如叶绿素、根系活力、蛋白质、可溶性糖、过氧化物酶的变化,可为揭示砷胁迫植物机体的毒害机制提供理论依据。
叶绿素为植物光合作用的物质基础,其质量分数变化可揭示叶片衰老或光合作用程度[30]。根系活力则是反映植物吸收能力大小与合成代谢强弱的重要指标,可溶性蛋白质与可溶性糖类一样是机体内重要的渗透性物质,可增加生理保水能力,对植物抗胁迫发挥协同作用,对植物具有保护功能。POD可避免膜脂的过氧化作用,维护细胞膜的正常代谢功能,从而使植物生理范围内适应、耐受、减缓或抵抗逆境胁迫。而MDA是细胞膜受伤害后膜脂过氧化的产物,可直接反映细胞膜损害程度,常作为检测脂膜过氧化程度的重要指标[31]。徐莹[32]研究了砷胁迫对水培条件下杨树材料生理特性的影响,结果发现随砷离子处理浓度的增加,叶绿素及可溶性蛋白含量显著降低,根、叶SOD活性呈先增加后降低的趋势,而POD活性、GSH、MDA含量均显著增加。对水稻秧苗响应无机砷胁迫的生理特性研究表明,随着砷离子浓度的增加,水稻组织的根部与叶部SOD、POD、CAT活性都被明显抑制,并且抑制率随着砷离子浓度的增大而升高[33]。另一研究证实,随着As3+浓度的增加,麻风树幼苗叶片的可溶性蛋白、叶绿素含量以及POD活性呈先上升后下降的趋势,而游离脯氨酸、可溶性糖、MDA含量则呈上升的趋势[34]。对紫茉莉的研究发现,SOD、CAT、POD活性均随着砷浓度的升高,表现为先升后降的趋势,说明紫茉莉对低浓度的砷胁迫具有一定的耐受性[35]。 本试验结果表明,低质量浓度(5 mg/L)的砷离子对黄瓜苗期叶绿素质量分数、根系活力、可溶性蛋白质与糖类及其POD活性具有激活功能,以适应环境中砷的胁迫;而随着砷质量浓度的逐渐增大,对以上生理指标转为抑制作用,并显著增加了MDA质量摩尔浓度,进一步造成机体组织和器官不可逆的损害,严重影响植株正常的生命活动,阻碍其生长发育与健康。该现象与砷胁迫大叶井口边草、玉米生长及生理指标的研究结论较为一致[36-37],相关机制的探讨仍需进一步深入。
4 小 结
本研究通过不同质量浓度的砷胁迫黄瓜种子萌发与苗期生长,发现低质量浓度砷胁迫对黄瓜种子萌发与生长有一定的促进作用,其危害性不容易被察觉。但随着质量浓度的增加,砷对黄瓜种子的萌发特性具有显著抑制作用,并对黄瓜苗期生长生物积累量及其相关生理指标产生巨大的负面影响,严重迫害黄瓜的生长发育,可造成巨大的损失。
Reference:
[2]田应桥,蒲朝文,张仁平,等.重庆市涪陵区部分粮食蔬菜中部分重金属污染调查[J].职业卫生与病伤,2014(5):372-373.
TIAN Y Q,PU CH W,ZHANG R P,etal.Survey on part of heavy metal pollution in food and vegetables in Fuling district,Chongqing[J].JournalofOccupationalHealthandDamage,2014(5):372-373(in Chinese).
[3]潘鲁生.土壤中砷的迁移转化以及对农作物的影响[J].安徽农业科学,2014,42(24):8150-8151.
PAN L SH.Migration of arsenic in soil and its effects on crops[J].JournalofAnhuiAgriculturalSciences,2014,42(24):8150-8151(in Chinese with English abstract).
[4]KABATA-PENDIAS A,PENDIAS H.Trace Elements in Soils and Plants [M].Boca Raton:CRC Press,1991:203-209.
[5]CLIJSTERS H,VAN ASSCHE F.Inhibition of photosynthesis by heavy metals [J].PhotosynthesisResearch,1985,70:31-40.
[6]陈保卫,那仁满都拉,吕美玲,等.砷的代谢机制、毒性和生物监测[J].化学进展,2009(Z1):474-482.
CHEN B W,Narenmandula,LÜ M L,etal.Arsenic metabolism,toxicity and biological monitoring [J].ProgressinChemistry,2009(Z1):474-482(in Chinese with English abstract).
[7]TORU H,YAYOI K,XING C,etal.A new metabolic pathway of arsenite:arsenic-glutathione complexes are substrates for human arsenic methyltransferase Cyt19[J].ArchivesofToxicology,2005,79(4):183-191.
[8]CHEN B W,CAO F L,YUAN C G,etal.Arsenic speciation in saliva of acute promyelocytic leukemia patients undergoing arsenic trioxide treatment[J].AnalyticalandBioanalyticalChemistry,2013,405(6):1903-1911.
[9]陈同斌,宋 波,郑袁明,等.北京市蔬菜和菜地土壤砷含量及其健康风险分析[J].地理学报,2006(3):297-310.
CHEN T B,SONG B,ZHENG Y M,etal.Arsenic levels in vegetables and vegetable soil of Beijing and health risk analysis[J].Geography,2006(3):297-310(in Chinese with English abstract).
[11]赵檀方,阎先喜,胡延吉.盐胁迫对大麦种子吸胀萌发及根尖细胞结构的影响[J].大麦科学,1994(4):17-20.
ZHAO T F,YAN X X,HU Y J.Effects of salt stress on imbibition germination and apical cell structures of of barley grain[J].BarleyScience,1994(4):17-20(in Chinese).
[12]赵海泉,洪法水.汞毒害对小麦幼苗的影响[J].农业环境保护,1998,17(1):18-19.
ZHAO H Q,HONG F SH.Effects of mercury poisoning on wheat seedlings[J].AgriculturalEnvironmentalProtection,1998,17(1):18-19(in Chinese).
[13]张志良,瞿伟菁.植物生理学实验指导[M].第2版.北京:高等教育出版社,2004:67-70,274-276,258-259.
ZHANG ZH L,QU W J.Plant Physiology Experiment guide[M].Second Edition.Beijing:Higher Education Press,2004:67-70,274-276,258-259(in Chinese).
[14]ARNON D.Copperenzymes in isolated chloroplasts poluphenoloxidase inBetavulgarris[J].PlantPhysiology,1999,24(1):1-15.
[15]段辉国.亚精胺对小麦离体叶片水溶性蛋白的影响[J].四川大学学报(自然科学版),1999,36(3):566-568.
DUAN H G.Effects of spermidine on water-soluble proteins of isolated wheat leaves[J].JournalofSichuanUniversity(NaturalScienceEdition),1999,36(3):566-568(in Chinese with English abstract).
[16]吴 佳,涂书新.植物根系分泌物对污染胁迫响应的研究进展[J].核农学报,2010,24(6):1320-1327.
WU J,TU SH X.Research progress on response of plant root exudates to pollution stress[J].JournalofNuclearAgriculturalSciences,2010,24(6):1320-1327(in Chinese with English abstract).
[17]王学奎.植物生理生化试验原理和技术[M].北京:高等教育出版社,2006:76-77.
WANG X K.Plant Physiological and Biochemical Principles and Techniques [M].Beijing:Higher Education Press,2006:76-77(in Chinese).
[18]ZHANG X.Measurement of wheat and pollen vigor by TTC reduction method[J].PlantPhysiologyCommunication,1982(3):48-50.
[19]PADHAM A K,MARIANNE T H,TZANN W W,etal.Characterization of aplastidtriacy lglycerol lipase fromArabidopsis[J].PlantPhysiology,2007,143:1372-1384.
[20]万梦雪,王 敏,周馥荔,等.砷对绿豆和黑豆种子萌发的影响[J].湖北大学学报(自然科学版),2013(3):288-293.
WAN M X,WANG M,ZHOU F L,etal.Effects of arsenic on seed germination of Mung bean and black bean [J].JournalofHubeiUniversity(NaturalScienceEdition),2013(3):288-293(in Chinese with English abstract).
[21]胡家恕,童富淡,邵爱萍,等.砷对大豆种子萌发的伤害[J].浙江农业大学学报,1996,22(22):121-125.
HU J SH,TONG F D,SHAO A P,etal.Arsenic harm on seed germination [J].JournalofZhejiangAgriculturalUniversity,1996,22(22):121-125(in Chinese with English abstract).
[22]ROSSMAN T G.Molecular and genetic toxicology of arsenic[M].Amsterdam:Gordon and Breach Publishers,1998,171-187.
[23]韦小丽,廖 明.钙浸种对马尾松种子发芽的影响[J].种子,2005,24(4):34-36.
WEI X L,LIAO M.Effects of calcium soaking on seed germination of Mason pine[J].Seeds,2005,24 (4):34-36(in Chinese).
[24]李红梅,王宏镔,王海娟,等.不同形态砷对黑藻植物络合素合成的影响[J].生态学杂志,2012,31(5):1233-1240.
LI H M,WANG H B,WANG H J,etal.Effects of different forms of arsenic on phytochelatin synthesis ofHydrillaverticillata[J].ChineseJournalofEcology,2012,31(5):1233-1240(in Chinese with English abstract).
[25]LIU Q,ZHENG C,HU C X,etal.Effects of high concentrations of soil arsenic on the growth of winter wheat (TriticumaestivumL.) and rape (Brassicanapus) [J].PlantSoilEnvironment,2012,58(1):22-27.
[26]VERBRUGGEN N,HEMANS C,SCHAT H.Mechanisms to cope with arsenic or cadmium excess in plants[J].CurrentOpinionPlantBiology,2009,12(3):364-372.
[27]CARBONELL A A,AARABI M A,DELAUNE R D,etal.Arsenic in wetland vegetation:availability,phytotoxicity,up-take and effects on plant growth and nutrition [J].TheScienceoftheTotalEnvironment,1998,217:189-199.
[28]GEISZINGER A,GOESSLER W,KOSMUS W.Organoarsenic compounds in plants and soil on top of an ore vein[J].AppliedOrganometallicChemistry,2002,16:245-249.
[29]夏立江,华 珞,韦东普.部分地区蔬菜的含砷量[J] .土壤,1996(2):105-110.
XIA L J,HUA L,WEI D P.Arsenic content of vegetables in parts of districts[J].Soil,1996(2):105-110(in Chinese).
[30]CAO X Q.The effect of membrane-lipid peroxidation on cell and body[J].ProgressinBiochemistryandBiophysics,1986(2):17-23.
[31]赵惠新,覃建兵,祝长青,等.铅胁迫对甜瓜种子胚芽酶系统及MDA含量的影响[J].种子,2009,28(12):82-83.
ZHAO H X,QIN J B,ZHU CH Q,etal.Effects of lead stress on enzyme system and MDA content in embryo of melon seeds[J].Seeds,2009,28 (12):82-83(in Chinese).
[32]徐 莹.砷胁迫对水培条件下三个杨树材料生理特性及体内砷积累的影响[D].武汉:华中农业大学,2012.
XU Y.Arsenic stress on physiological characteristics and arsenic accumulation in the body of three kinds of poplar under hydroponic culture condition[D].Wuhan:Huazhong Agricultural University,2012(in Chinese with English abstract).
[33]牛变红.水稻秧苗响应无机砷胁迫的生理特性分析[D].福州:福建农林大学,2009.
NIU B H.Physiological characteristics of the responses of rice seedling to inorganic arsenic stress[D].Fuzhou:Fujian Agriculture and Forestry University,2009(in Chinese with English abstract).
[34]曾小飚,黄 斌,陈冠喜,等.砷胁迫对麻风树幼苗生理生化指标的影响研究[J].安徽农学通报,2015(21):38-40.
ZENG X B,HUANG B,CHEN G X,etal.Effects of arsenic stress on physiological and biochemical indexes ofJatropha[J].AnhuiAgriculturalBelletin,2015(21):38-40(in Chinese with English abstract).
[35]徐玲玲,李娅迪,冯旭东,等.砷胁迫对紫茉莉生理生化特性的影响[J].山地农业生物学报,2015(4):13-17.
XU L L,LI Y D,FENG X D,etal.Effects of arsenic stress on physiological and biochemical characteristics ofMirabilis[J].JournalofMountainAgricultureandBiology,2015(4):13-17(in Chinese with English abstract).
[36]谷兆萍,王 昕,潘义宏,等.两种培养方式下砷对大叶井口边草生理生化的影响[J].农业环境科学学报,2010(7):1254-1260.
GU ZH P,WANG X,PAN Y H,etal.Effects of arsenic on physiology and biochemistry ofPterisnervosaThunb under twoculture methods[J].JournalofAgro-EnvironmentScience,2010(7):1254-1260(in Chinese with English abstract).
[37]郭 凌,卜玉山,张 曼,等.煤基腐殖酸对外源砷胁迫下玉米生长及生理性状的影响[J].环境工程学报,2014(2):758-766.
GUO L,BU Y SH,ZHANG M,etal.Effect of coal-based humic acid on the growth and physiological characteristics of maize under exogenous arsenic stress[J].ChineseJournalofEnvironmentalEngineering,2014(2):758-766(in Chinese with English abstract).
Received 2015-12-03 Returned 2016-02-02
Foundation item Science and Technology Development Plan Project of Zibo City, Shandong Province(No.2010GG01124).
About author GONG Jian,female,associate professor.Research area:application of biological technology. E-mail:sunrose520@126.com
(责任编辑:潘学燕 Responsible editor:PAN Xueyan)
Effects of Arsenic Stress on Seed Germination and Seedling Growth of Cucumber
GONG Jian
(Department of Pharmaceutical and Biological Engineering, Zibo Vocational Institute, Zibo Shandong 255314, China)
In this study, the effects of different concentrations of arsenic ion on cucumber seed germination, seedling growth and physiology indexes were investigated. Results showed that 5 mg/L arsenic stress could promote cucumber seed germination and growth (P>0.05). However, with the increase of arsenic mass concentration, compared to the control, cucumber seed germination was significantly inhibited, and root length, shoot length and fresh mass of seedling were gradually decreased (P<0.05).Furthermore, the growth and physiology related indexes were negatively influenced. The molality of malondialdehyde was increased significantly (P<0.05), while chlorophyll mass fraction, root activity, peroxidase activity, soluble sugar and protein mass fraction were decreased significantly in comparison with the control (P<0.05). In conclusion, excessive level of arsenic ion had stress influences on cucumber seed germination and seedling growth, and the toxicity was serious.
Arsenic; Cucumber; Germination; Seedling; Physiology index
2015-12-03
2016-02-02
山东省淄博市科学技术发展计划(2010GG01124)。
巩 健,女,大学本科,副教授,主要从事应用生物技术的教研工作。 E-mail:sunrose520@126.com
日期:2016-10-20
S642.2;S143.7+9
A
1004-1389(2016)10-1502-06
网络出版地址:http://www.cnki.net/kcms/detail/61.1220.S.20161020.1655.024.html

