RP-HPLC法测定大鼠血浆中槲皮素含量
潘瑜 孙建枢 金瓯 蔡茜茜 陈引蕾
RP-HPLC法测定大鼠血浆中槲皮素含量
潘瑜 孙建枢 金瓯 蔡茜茜 陈引蕾
目的 建立大鼠血浆中槲皮素的反相高效液相色谱(RP-HPLC)测定方法,研究菟丝子水提取液中槲皮素在正常大鼠血浆中的药物代谢动力学过程。方法 给予大鼠灌胃菟丝子水提取液后,于不同时间点采血。血浆样品经酸化后乙酸乙酯萃取,RP-HPLC法进行检测,采用Hypersil ODS柱(250mm×4.6mm,5μm),流动相为甲醇-0.5%磷酸水(60∶40),流速1.0ml/min,柱温25℃,检测波长为360nm。应用药物代谢动力学软件DAS 2.1.1拟合房室模型,并计算药物代谢动力学参数。结果 槲皮素在0.5~6μg/ml线性关系良好,最低检测限为0.5μg/ml,高、中、低(含槲皮素5、2.5和1μg/ml)3种浓度的平均回收率均为90%~105%,日内和日间相对标准偏差均<5%。槲皮素的血药浓度-时间曲线符合二室模型,槲皮素的消除半衰期为4.589h,0~t时刻药时AUC为13.498μg/(L·h),药时总AUC为20.765μg/(L·h)。结论 建立了测定菟丝子水提取液中槲皮素在血浆的RP-HPLC测定方法,此方法简便、灵敏、准确、稳定,适用于测定槲皮素的血药浓度及在大鼠体内的药物代谢动力学研究。
RP-HPLC 菟丝子 槲皮素 药物代谢动力学
槲皮素为旋花科一年生寄生性蔓草菟丝子或大菟丝子成熟种子菟丝子中提取的一种黄酮类化合物。许多植物的花、叶、果实中都含槲皮素,多以甙的形式存在,如槲皮甙、芦丁、金丝桃甙等,经酸水解可得到槲皮素,具有较广泛的药理活性,如抗炎[1]、抗氧化[2]、抗菌[3]、抗病毒[4-5]、抗肿瘤[6]等。中医方剂用药的基本形式都是水煎剂,而目前报道尚无菟丝子水煎剂中槲皮素的药物代谢动力学研究报道。本实验在相关文献的基础上,建立了大鼠口服菟丝子水提取液血浆中槲皮素浓度的反相高效液相色谱(reversed-phase high performance liquid chromatography,RP-HPLC)测定方法,并利用此方法研究了菟丝子中的槲皮素在大鼠体内的药物代谢动力学过程。
1 材料和方法
1.1 材料
1.1.1 仪器 Agilent 1100高效液相色谱系统(美国Agilent公司)[配在线脱气机(G1379A)、四元低压泵(G1311A)、手动进样器、柱温箱(G1316A)、紫外检测器(G1314A)、仪器控制和数据采集分析使用ChemStation工作站)];XW-80A型漩涡混合器(上海医科大学仪器厂);TU-1901型双光束紫外可见分光光度计(北京普析通用仪器有限责任公司);FD-1C型冷冻干燥机(北京德天佑科技发展有限公司);AllegraTM64R型号低温高速离心机(美国BECKMAN有限公司);D10-12型ANGEL氮气吹扫仪 (杭州奥盛仪器有限公司);Sartorius BS224S电子天平[赛多利斯科学仪器(北京)有限公司]。
1.1.2 药品与试剂 槲皮素标准品(中国药品生物制品检定所,批号100081-200907);甲醇(美国Spectrum公司,色谱纯);乙酸乙酯、10mol/L盐酸、磷酸均为分析纯;超纯水(Milli-Q系统);槲皮素(由温州市中西医结合医院中药房提供)。定量药材加6~8倍水煎煮40min后倒出药液并收集药渣,加适量水煎煮30min,然后收集药液,弃去药渣,合并滤液,并将滤液用4层纱布过滤,收集滤液冷冻干燥成粉后4℃保存,给药时用超纯水配制成浓度为0.15g/ml。
1.1.3 实验动物 5只雄性SD大鼠,6~7周龄,体重(250±20)g,温州医科大学实验动物中心 [动物许可证号:SCXK(浙)2005-0019]提供。
1.2 方法
1.2.1 色谱条件 分析柱:Hypersil ODS柱(250mm× 4.6mm,5μm,大连依利特分析仪器有限公司);保护柱:SB-C18(12.5mm×4.6mm,5μm,美国Agilent公司);流动相:甲醇-0.5%磷酸水(60∶40);流速:1.0ml/min;柱温:25℃;检测波长:360nm;进样量:20μl。
1.2.2 给药及采血 5只SD大鼠,禁食不禁水12h,按照1ml/100g的剂量,灌胃给予菟丝子水提取液。于灌胃后0、0.167、0.333、0.5、0.75、1、1.5、2、4、8和12h尾静脉取血,每次约0.5ml,置于肝素化离心管中,13 000r/min离心10min,分离血浆,-20℃保存待测。
1.2.3 血浆样品处理 取血浆室温下冻融,准确吸取甲醇1ml于10ml具塞试管中,加入10mol/L的盐酸0.4ml,混匀后精密吸取待测大鼠血浆样品200μl加入其中,密闭涡旋之后于90℃水浴5h,冷却后精密加入2ml乙酸乙酯,涡旋(5 000r/min)10min,转移上清液于另一刻度离心管中,氮气吹扫仪中吹干。用200μl甲醇复溶,过滤,进样20μl进行RP-HPLC分析。
1.3 统计学处理 将各时间点及其对应的槲皮素浓度输入药理学计算软件DAS 2.1.1,得到主要药物代谢动力学参数。
2 结果
2.1 色谱行为 紫外光谱扫描显示,槲皮素在360nm处有一个明显吸收峰,经预试选定此波长为检测波长。在1.2.1色谱条件下,空白血浆、含药血浆和含标准品血浆的色谱如图1所示,各组分色谱峰充分分离,不受内源性杂质峰干扰,槲皮素的保留时间为8.959min。

图1 大鼠RP-HPLC色谱图(a:空白血浆;b:含标准品血浆;c:含药血浆)
2.2 标准曲线 取槲皮素标准品适量,精密称定,加甲醇制成每1ml含槲皮素100μg的标准品储备液。将上述配制好的槲皮素标准品储备液用甲醇依次稀释为浓度分别为60、40、20、10、7.5和5μg/ml的槲皮素标准品稀释液。取大鼠空白血浆200μl,精密加入上述配制好的槲皮素标准品稀释液,得到一系列不同浓度分别含槲皮素6、4、2、1、0.75和0.5μg/ml的标准含药血浆。按照方法中1.2.3进行操作。以血浆中待测物槲皮素浓度为横坐标,相应峰面积为纵坐标进行回归计算,得到标准曲线方程Y=21.198X-9.428 4,决定系数R2=0.998,见图2。槲皮素在0.5~6μg/ml线性关系良好,最低检测限(S/ N>3)为0.5μg/ml。
2.3 回收率和精密度 取大鼠空白血浆200μl,精密加入已配制好的槲皮素标准品稀释溶液,配成高、中、低浓度(含槲皮素5、2.5和1μg/ml),按照方法中1.2.3进行操作,每一浓度进样3次,进行样本分析,计算求得其在大鼠血浆中的相对回收率和绝对回收率,在1d内不同时间进样,测得3种浓度标准血浆的日内相对标准偏差(RSD)及相同浓度的标准血浆在3d内的日间RSD,结果见表1。
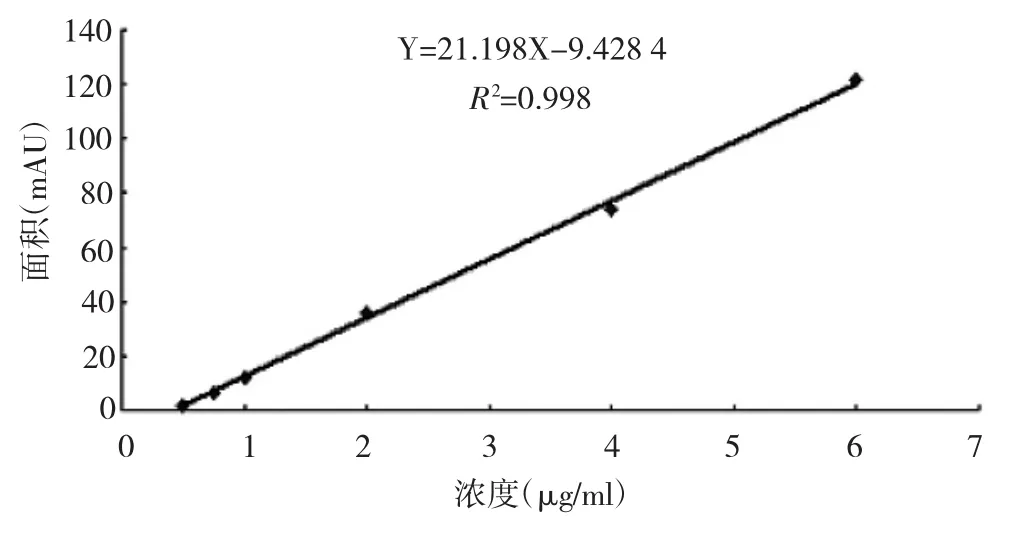
图2 大鼠槲皮素血浆标准曲线

表1 回收率和RSD试验结果(%)
2.4 稳定性考察 制备高、中、低(含槲皮素5、2.5和1μg/ml)的质量控制样品,分别室温放置12h,反复冻融2次,-20℃冻存1d,1周后测定。结果样品在室温放置12h、冻融前、冻融1次、冻融2次、冷冻1d和7d后,测定的标准偏差均<5%,稳定性良好。
2.5 槲皮素在大鼠体内的药物代谢动力学研究 大鼠灌胃菟丝子水提取液后,于不同时间点采集的血样,按照方法中1.2.3进行操作,得到的槲皮素在大鼠血浆中的血药浓度-时间曲线见图3。血药浓度经药理学计算软件DAS 2.1.1处理,自动推算、模型、权重选择,拟合的血药浓度-时间曲线符合二室模型,有关药物代谢动力学参数见表2。
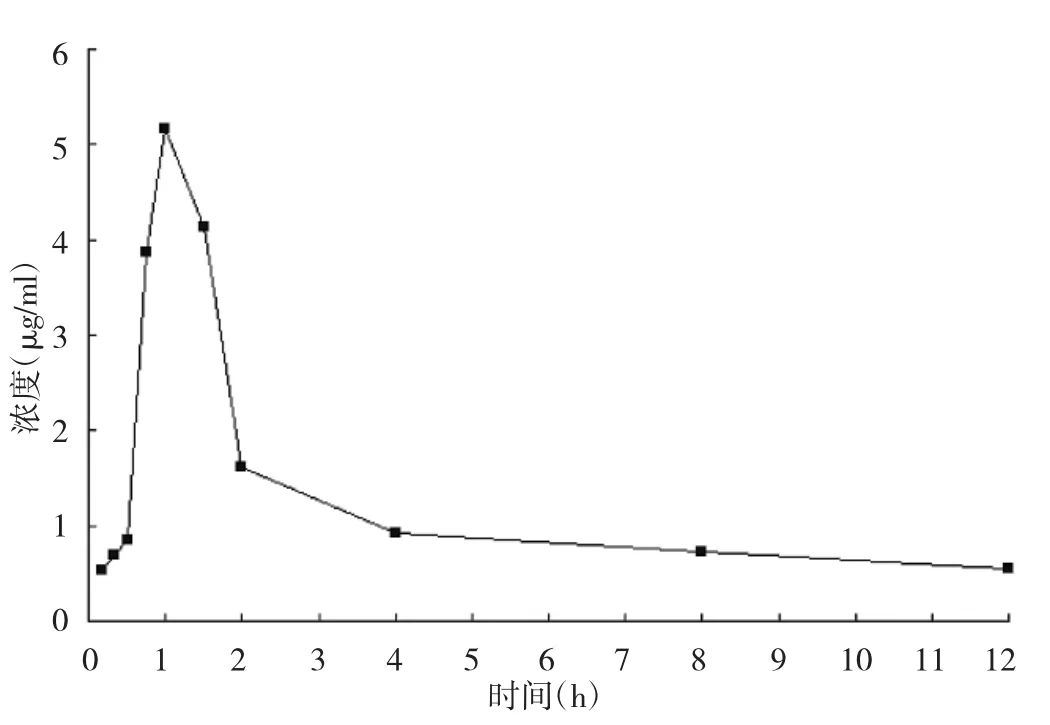
图3 大鼠血浆中槲皮素的血药浓度-时间曲线
3 讨论
目前国内尚未有针对菟丝子水提取液内槲皮素进行药物代谢动学的研究,本实验建立了RP-HPLC测定槲皮素在大鼠体内血药浓度的方法,并进行了药物代谢动力学研究。本实验分别考察了直接蛋白沉淀法和有机溶剂萃取法,结果发现直接蛋白沉淀法沉淀不完全,干扰较大,因此采用有机溶剂萃取法,并进行不同浓度的盐酸酸化,经过实验比对,结果表明10mol/L的盐酸酸化后结合乙酸乙酯萃取的方法可排除干扰,获得满意提取效果。在流动相的选择上,本法分离黄酮成分时候有拖尾现象,在流动相中加入少量磷酸后明显改善。
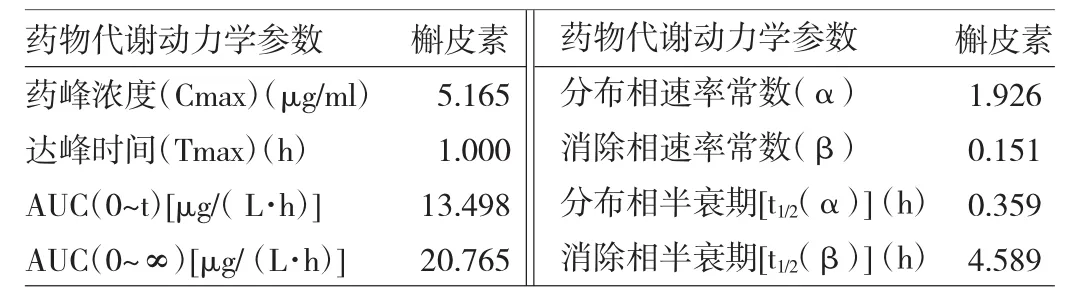
表2 大鼠体内槲皮素的药物代谢动力学参数
RP-HPLC法的药物体内分析通常因提取方法对含量准确测定影响较大而采用内标法,朱红岗等[7]曾用内标法进行槲皮素灌胃后大鼠体内槲皮素的药物代谢动力学研究,但内标法测定操作过程较繁琐,成本高。本实验采用传统水煎法提取方式,血样处理操作简单易行,经方法学验证,精密度较好,回收率高,故选择外标法进行含量测定,进而简化了实验操作步骤,节约了实验成本。
药物代谢动力学处理结果表明,大鼠灌胃服用菟丝子水提取液后的药物代谢动力学过程用二室模型描述较为合理。灌服菟丝子水提取液后槲皮素的血药浓度在1h达到峰值,槲皮素进入大鼠体循环后迅速分布(α=1.926),发挥药效迅速。血浆中槲皮素的消除速率常数β为0.151,血中的t1/2(α)=0.359h,t1/2(β)=4.589h,t1/2(β)>t1/2(α),提示大鼠灌服菟丝子提取液后槲皮素在体内消除也迅速,属于吸收快、消除快的代谢过程,表明该化合物在体内不容易蓄积,较安全。
经方法学验证,本方法简便、快速、稳定,重现性和准确度均较好,回收率、精密度均符合生物样本中微量测定要求,可用于菟丝子水煎剂药物代谢动力学研究,为含有槲皮素成分的中药材及其复方制剂的药物代谢动力学研究提供科学依据。
[1] 周东生,梁志清,秦青,等.槲皮素对大鼠非酒精性脂肪性肝病的疗效及其机制[J].中华肝病杂志,2013,21(2):134-137.
[2] Papiez M A,Krzysciak W.The antioxidant quercetin protects HL-60 cells with high myeloperoxidase activity against pro-oxidative and apoptotic effects of etoposide[J].Acta BiochimicaPolonica,2014,61(4):795-799.
[3] 秦晓蓉,张铭金,高绪娜,等.槲皮素抗菌活性的研究[J].化学与生物工程,2009,26(4):55-58.
[4] Fatima K,Mathew S,Suhail M,et al.Docking studies of Pakistani HCVNS3 helicase:a possible antiviral drug target[J].PLoS One, 2014,9(9):1-12.
[5] Guo L,Hu W R,Lian J H,et al.Anti-hyperlipidemic properties of CM108(a flavone derivative)in vitro and in vivo[J].European Journal of Pharmacology,2006,511(1-3):80-86.
[6] Czepas J,Gwozdzinski K.The flavonoid quercetin:Possible solution for anthracycline-induced cardiotoxicity and multidrug resistance[J].Biomed Pharmacother,2014,68(8):1149-1159.
[7] 朱红岗,凌明.大鼠体内槲皮素的血药浓度测定及其药物代谢动力学研究[J].中国药业,2013,22(2):14-15.
(本文编辑:陈丽)
《浙江医学》对图表的要求
稿件中若有图表,分别按其在正文中出现的先后次序连续编码。每幅图应冠有图题。说明性的文字应置于图下方注释中,并在注释中标明图表中使用的全部非公知公用的缩写。线条图应墨绘在白纸上,高宽比例以5∶7为宜。以计算机制图者应提供激光打印图样。照片图要求有良好的清晰度和对比度;图中需标注的符号(包括箭头)请用另纸标上,不要直接写在照片上。每幅图的背面应贴上标签,注明图号、方向及作者姓名。若刊用人像,应征得本人的书面同意,或遮盖其能被辨认出系何人的部分。大体标本照片在图内应有尺度标记。病理照片要求注明染色方法和放大倍数。图表中如有引自他刊者,应注明出处。电子版投稿中图片建议采用JPG格式。表格建议采用三横线表(顶线、表头线、底线),如遇有合计和统计学处理内容(如t值、P值等),则在此行上面加一条分界横线;表内数据要求同一指标有效位数一致,一般按标准差的1/3确定有效位数。
本刊编辑部
Determination of quercetin concentration in rat plasma by RP-HPLC
PAN Yu,SUN Jianshu,JIN Ou,et al.Department of Pharmacy,Wenzhou Hospital of Integrated Traditional Chinese Medicine and Western Medicine,Wenzhou 325000,China
【 Abstract】 Objective To establish a RP-HPLC method for determination of quercetin in rat plasma and to investigate its pharmacokinetics after oral administration of dodder extract in rats. Methods After oral administration of dodder extract,rat blood samples were collected at different time points.Plasma samples were extracted by ethyl acetate,the analysis was performed on a Hypersil ODS column,the mobile phase was composed of methanol-0.5%phosphoric acid water(60:40)with the flow rate of 1.0ml/min and the column temperature of 25℃and UV wave length of 360nm.The data obtained were fitted with DAS 2.1.1 program and the pharmacokinetic parameters were calculated. Results Linear calibration curve obtained with the peak area of quercetin versus drug concentration was found to be linear between the ranges of 0.5~6μg/ml.The lowest detectable concentration was 0.5μg/ml.The average recoveries were 90%~105%.The inter-and intra-day RSDs were all less than 5%.The plasma concentration-time data fit to a two-compartment model.Elimination half lives of quercetin was 4.589 h.The area under the concentration-time curve(AUC0-t)was 13.498μg/(L·h),and the total area under the concentration-time curve (AUC0-∞)was 20.765μg/(L·h). Conclusion A validated reversed-phase HPLC method has been developed for determining quercetin in rat plasma.The assay method is proved to be simple,sensitive,precise and reliable enough for the pharmacokinetics study of quercetin in rats after oral administration.
RP-HPLC DodderQuercetin Pharmacokinetics
2016-04-12)
325000 温州市中西医结合医院药剂科(潘瑜、金瓯、蔡茜茜、陈引蕾);温州市第二人民医院药剂科(孙建枢)
潘瑜,E-mail:everydayisbetter@126.com

