弱酸性条件下丙酸富集培养物的降解特性
张立国,刘建忠,班巧英*,李建政(.山西大学环境与资源学院,山西 太原 030006;.哈尔滨工业大学市政与环境工程学院,黑龙江 哈尔滨 50090)
弱酸性条件下丙酸富集培养物的降解特性
张立国1,刘建忠1,班巧英1*,李建政2(1.山西大学环境与资源学院,山西 太原 030006;2.哈尔滨工业大学市政与环境工程学院,黑龙江 哈尔滨 150090)
为阐明厌氧生物处理系统中 pH降低对丙酸降解的影响,考察了弱酸性条件下丙酸富集培养物的降解特征.在污泥接种量为 0.22g MLVSS/L,初始丙酸浓度为1000mg/L条件下,对照组(pH7.0)的丙酸能够被该富集培养物快速降解,在接种第6d时,丙酸去除率达到了98.5%.当pH从7.0分别降低至6.5和6.0时,丙酸降解速度立即下降.但经过2~3d的适应后,丙酸降解速率恢复到对照的水平,并分别在培养至第8d和9d时其去除率达到了97%以上.当pH为5.5时,丙酸降解被完全抑制.在整个实验过程中,均未检测到氢气,而乙酸也只有在培养初期有过短暂的积累.该结果表明,在该丙酸富集培养物中,产甲烷菌对弱酸性环境具有更好的耐受性和适应性.
丙酸;富集培养物;弱酸性条件;降解特性
有机物厌氧生物处理是在一系列微生物的协同代谢作用下完成的,包括水解发酵菌群,产氢产乙酸菌群,同型产乙酸菌群和产甲烷菌群[1-3].丙酸是厌氧生物处理过程中重要的中间代谢产物之一.在厌氧反应器中,丙酸的主要来源于脂肪,油脂以及碳水化合物等产生的奇数链脂肪酸[4-5].它的厌氧氧化是一个高度吸能的过程.当厌氧消化系统遭受温度,有机负荷,氢分压等冲击时,丙酸很容易在系统中积累,导致系统pH下降,酸化,进而使系统运行失败[6-8].由此可见,丙酸的高效降解对于维持厌氧消化系统的运行效能和稳定性具有重要意义.
在产甲烷系统中,丙酸的厌氧降解是在丙酸氧化菌和产甲烷菌的共同作用下完成的[9].一方面,丙酸氧化菌将丙酸转化成乙酸和 H2/CO2,为产甲烷菌提供底物.反过来,产甲烷菌通过消耗乙酸和H2/CO2为丙酸降解解除反馈抑制作用[10-11].最新研究表明,厌氧消化过程中除种间氢传递机制外,直接种间电子传递(DIET)机制同样存在,这在一定程度上缓解了氢分压对丙酸厌氧降解的抑制作用[12-13].pH 作为厌氧生物处理反应器重要调控因子之一,直接影响着反应器的处理效能
[14].丙酸氧化菌特殊的代谢特征使其对 pH更加敏感[15].然而,关于丙酸氧化菌在弱酸性环境中代谢活性的相关研究还很少.因此,本研究丙酸富集培养为对象,研究弱酸性条件下丙酸的降解特征,其结果将为厌氧生物处理反应器的调控提供理论依据.
1 材料与方法
1.1 接种污泥
接种污泥取自本实验室的一个中温丙酸富集培养物.初始污泥为厌氧颗粒污泥,经过 15代连续传代培养后污泥形态转化为絮状.该富集培养物的MLSS和MLVSS分别为1410mg/L和1100mg/L,污泥活性为 0.78.在 35℃,pH7.0,初始丙酸浓度 1000mg/L条件下,该富集培养物的丙酸降解速率为757.6mg/(g MLVSS·d).
1.2 静态摇瓶试验
静态摇瓶试验采用间歇培养方式进行,实验容器为150mL血清瓶.每个血清瓶中加入10mL丙酸富集培养物(MLVSS为1100mg/L)和40mL液体培养基,其中碳源为丙酸(1000mg/L).将培养液pH值用1mol/L HCl或1mol/L NaOH分别调至7.0,6.5,6.0和5.5,充氮气3min,确保血清瓶中为厌氧环境.然后将血清瓶置于恒温空气浴摇床(35℃)进行培养.每个pH梯度做3个平行样,数据分析取其平均值.每24h测定一次产气量、气体组成和挥发酸组成.
1.3 分析项目及方法
pH值和生物量(挥发性悬浮固体总量MLVSS)采用标准方法测定[16],甲烷发酵产气量通过10~50mL的玻璃注射器排气计量.发酵气体的组分和挥发酸浓度分别采用山东鲁南瑞虹化工仪器有限公司的 SP-6800A型(TCD检测器)和SP-6890型(FID检测器)气相色谱测定.累计甲烷产量参照Owen法进行计算[17].
1.4 COD平衡计算
COD物质平衡按照以下公式计算,其中COD残留(mg/L)为剩余 COD,即剩余丙酸和乙酸COD当量;CH4(mgCOD/L)为累计产甲烷量所消耗的COD;COD初始(mg COD/L)为初始COD含量.
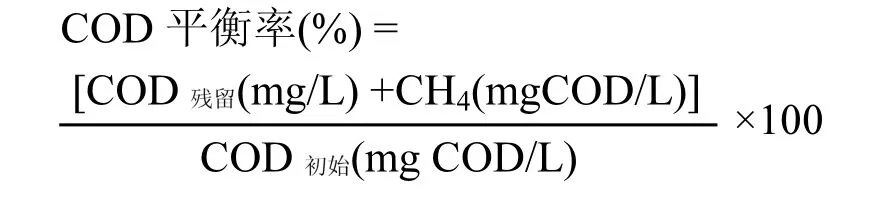
2 结果与分析
2.1 丙酸降解特性
丙酸是有机废水厌氧生物处理过程中重要的中间代谢产物之一,复杂有机物转化成甲烷时30%左右的甲烷来自丙酸的氧化[15].本研究以丙酸富集培养物为实验对象,通过间歇培养方式考察了该丙酸富集培养物在弱酸性条件的降解特性.前期的研究发现该丙酸富集培养物中的主要丙酸氧化菌在分类学上属于互营杆菌属(Syntrophobacte),而产甲烷菌在分类学上属于产甲烷杆菌属(Methanobacterium)和产甲烷丝状菌属(Methanosaeta)[9].Syntrophobacte spp.降解丙酸需要产甲烷菌的协同作用,且其生长的 pH范围为6.0~8.8[18-19].Methanobacterium属的产甲烷菌只能利用 H2/CO2或甲酸进行生长代谢产甲烷,而Methanosaeta属只能以乙酸为底物[20].
本研究探讨了 pH7.0,pH6.5,pH6.0,pH5.5条件下的丙酸降解特征.pH不仅是有机物厌氧生物处理过程中重要的运行参数之一,同时也会直接影响相关微生物的生长和代谢.pH影响着微生物代谢的多个方面,包括对碳源和能源的利用,底物降解速率,蛋白质及各种储能物质的合成和代谢产物的释放等[21].如图1所示,当pH为 7.0时,该丙酸富集培养物表现出了较强的降解丙酸能力,接种第6d时,培养液中98.5%丙酸已经被转化.然而,当pH为6.5和6.0时,丙酸降解速度立即下降.富集培养物对丙酸的降解出现了短暂的停滞期.但经过 2~3d的适应后,丙酸降解速率恢复到对照(pH7.0)水平,并分别在培养至第8d和9d时其去除率达到了98.7%和97.6%.当pH为5.5时,该富集培养物对丙酸的降能力丧失,即使连续培养 9d后丙酸去除率仍然几乎为 0.这与Syntrophobacte spp.纯培养的研究结果相一致[15].以上结果表明,低 pH(≤5.5)会对系统中的丙酸氧化菌群的代谢活性产生显著的抑制作用.
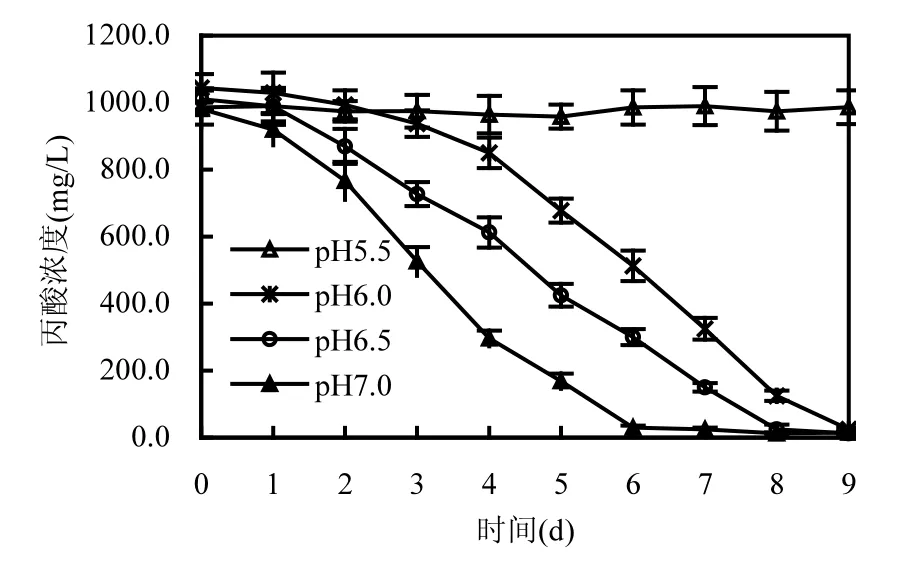
图1 弱酸性条件下丙酸降解历时曲线Fig.1 The curve of propionate degradation at slightly acidic conditions
2.2 累计产甲烷量
在产甲烷环境中,丙酸的转化主要依赖丙酸氧化菌群和产甲烷菌群的协同作用来完成的.因此,产甲烷活性的高低对于丙酸的氧化是十分重要的.如图2所示,累计产甲烷量的变化趋势与丙酸降解过程一致.pH为7.0时,在接种后第1d就表现出较高的活性,在第6d时累计产甲烷量就达到平台期,为26.9mL.然而,当pH为6.5和6.0时,培养前期产甲烷速率较对照组低,然后随着培养时间的延续逐渐提高.
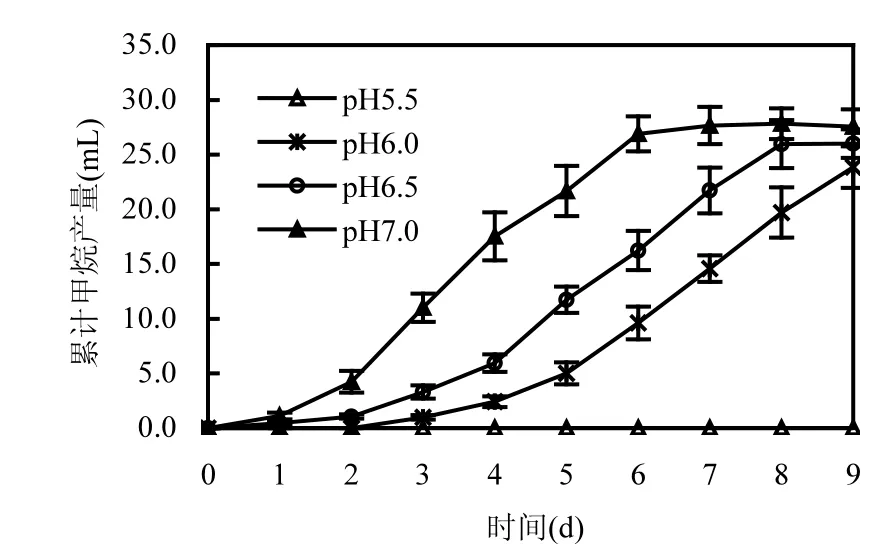
图2 弱酸性条件下累积产甲烷量特征Fig.2 The accumulative methane production at slightly acidic conditions
在pH 6.5和6.0条件,累积产甲烷量分别在第8d和9d达到最大值26.0mL和23.9mL.当pH为5.5时,没有甲烷生成.尽管多数产甲烷菌在中性环境中的代谢活性较高[15].但是以前的研究也表明,在 pH5.5时氢营养型产甲烷菌仍然具有较高的活性[22].由图1可知,作为唯一的碳源和能源物质,丙酸在pH5.5时不能被分解.所以,pH5.5时没有甲烷生成是由于产甲烷菌没有可以利用的底物所致.
2.3 乙酸生成量
产甲烷菌根据可利用底物的不同可分为氢营养型产甲烷菌和乙酸营养型产甲烷菌.在整个实验过程中,几乎检测不到 H2积累.可见,在pH7.0~5.5范围内,pH高低对氢营养型产甲烷菌的活性没有显著的影响.当pH为7.0时,在接种后第 1~2d,乙酸发生了短暂的积累(约为128mg/L)(图3).这可能是由于pH为7.0条件下丙酸氧化菌的活性较高,而作为食物链下游的乙酸营养型产甲烷菌的生长和代谢与之不匹配,导致乙酸发生了短暂的积累.经过2d的调整适应后,乙酸营养型产甲烷菌活性得到恢复,并在第3d将乙酸降至52.4mg/L,在随后的培养过程中乙酸都保持较低的浓度(≤44.6mg/L).
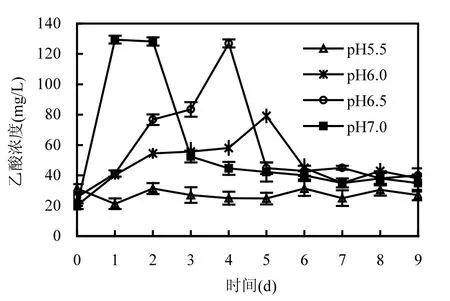
图3 不同pH条件下乙酸含量变化过程Fig.3 The acetate concentration at different pH conditions
当pH为6.5时,在培养第2~4d乙酸发生了积累(76.8~127.0mg/L),随后积累被消除并保持较低水平.由图1可知,从培养的第2d开始丙酸的降解速率加快,致使生成的乙酸迅速增加,而产甲烷菌的数量和活性难以与之适应.培养至第5d时,乙酸浓度降低至 50mg/L以下,可见乙酸型产甲烷菌的种群功能被增强.类似地,pH 6.0条件下在培养的第5d乙酸发生了短暂积累.当pH为5.5时,乙酸浓度始终保持在接种前的水平,因为在培养过程中丙酸降解完全被抑制(图1),也就不会有乙酸积累现象的发生.
由此可见,氢营养型产甲烷菌和乙酸营养型产甲烷菌对于 pH的响应有所不同.弱酸性环境(pH6.5~6.0)对氢营养型产甲烷菌的活性不会造成明显的抑制作用,但对乙酸营养型产甲烷菌可产生一定的影响.以前的研究也表明,氢营养型产甲烷菌比乙酸营养型产甲烷菌更耐酸[22-23].
计算物质平衡可以了解厌氧发酵过程中代谢产物的分布[24].表1表明了弱酸性条件下丙酸降解生成的产物与初始底物之间的COD物质平衡.本研究中,COD物质平衡率达到了 90.9%~109.6%,说明本实验获得的数据是合理的.
综合上述,弱酸性环境(pH5.5~6.5)对丙酸降解造成了不同程度的影响.pH6.0~6.5可以使丙酸降解出现短暂的停滞,随后降解速率增加,且经过较长时间的培养后总去除率与对照组(pH7.0)没有显著差异(表2).但是pH5.5却导致丙酸几乎不能氧化.除此之外,本研究还发现,乙酸和H2/CO2没有显著积累,暗示了产甲烷菌对弱酸环境的适应能力要高于丙酸氧化菌.
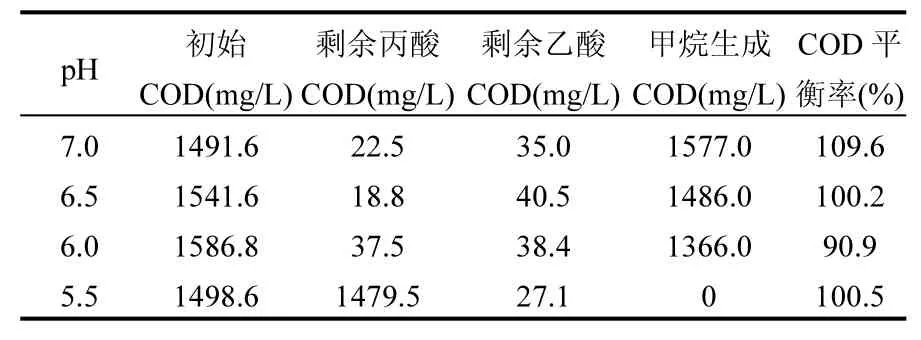
表1 不同pH条件下的COD物质平衡Table 1 COD mass balance under different pH conditions
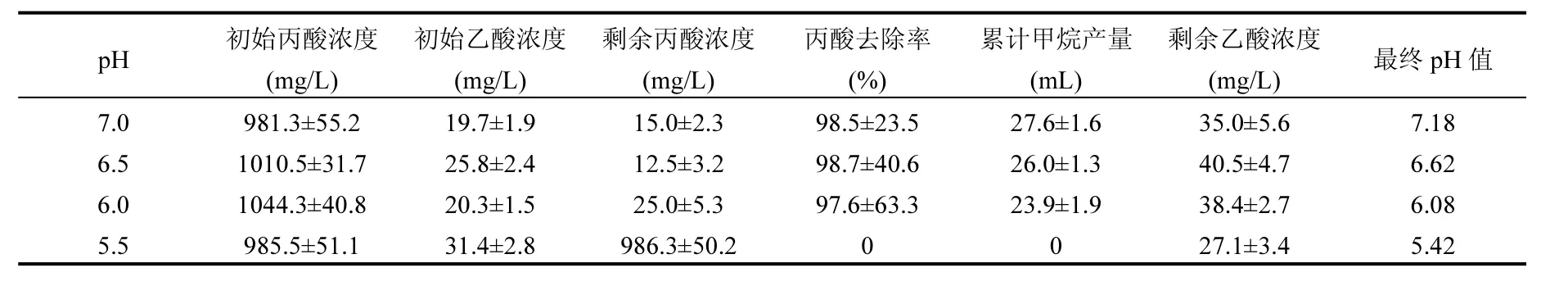
表2 弱酸性条件下的丙酸降解特征Table 2 Propionate degradation characteristics at slightly acidic conditions
3 结论
3.1 当初始丙酸浓度为1000mg/L时,弱酸性环境条件(pH5.5~6.5)可对丙酸富集培养物的降解能力造成不同程度的抑制.pH 6.5和pH 6.0使丙酸降解延长2~3d,而pH 5.5导致丙酸降解完全被抑制.
3.2 弱酸性条件未导致 H2和乙酸的持续积累,表明在该丙酸富集培养物中,产甲烷菌对弱酸性环境具有更好的耐受性和适应性.
[1] 何 强,孙兴福,艾海男,等.两相一体式污泥浓缩消化反应器运行效能及其微生物特性 [J]. 中国环境科学, 2012,32(11):2039-2046.
[2] 张立国,李建政,班巧英,等.pH对UASB运行效能及产甲烷互营菌群的影响 [J]. 哈尔滨工业大学学报, 2013,45(8):44-49.
[3] 马海玲,郑明月,龚淑芬,等.不同乙酸钠浓度对 UASB中颗粒污泥形成的影响 [J]. 环境工程学报, 2016,10(3):1065-1069.
[4] Bai J, Liu H, Yin B, et al. Modeling of enhanced VFAs production from wasteactivated sludge by modified ADM1with improved particle swarm optimization for parameters estimation [J]. Biochemical Engineering Journal, 2015,103:22-31.
[5] 王 权,蒋建国,张昊巍,等.油脂对餐厨废弃物单相厌氧定向制酸的影响 [J]. 中国环境科学, 2015,35(5):1436-1441.
[6] Dhaked R K, Waghmare C K, Alam S I, et al. Effect of propionate toxicity on methanogenesis of night soil at phychrophilic temperature [J]. Bioresource Technology, 2003,87:299-303.
[7] Gallert C, Winter J. Propionic acid accumulation and degradation during restart of a full scale anaerobic biowaste digester [J]. Bioresource Technology, 2008,99:170-178.
[8] Pullammanappallil P C, Chynoweth D P, Lyberatos G, et al. Stable performance of anaerobic digestion in the presence of a high concentration of propionic acid [J]. Bioresource Technology,2001,78:165—169.
[9] Ban Q, Li J, Zhang L, Jha A K, et al. Microbialcommunity composition and response to temperature shock of a mesophilic propionate-degrading methanogenic consortium [J]. International Journal of Agriculture and Biology, 2013,15:915-920.
[10] Worm P, Stams A J M, Cheng X, et al. Growth- and substratedependent transcription of formate dehydrogenase and hydrogenase coding genes in Syntrophobacter fumaroxidans and Methanospirillum hungatei [J]. Microbiology, 2011,157:280-289.
[11] 徐 恒,汪翠萍,颜 锟,等.颗粒型厌氧生物膜改善高氢分压下丙酸降解抑制研究 [J]. 中国环境科学, 2016,36(5):1435-1441.
[12] Rotaru A E, Shrestha P M, Liu F, et al. A new model for electron flow during anaerobic digestion: direct interspecies electron transfer to Methanosaeta for the reduction of carbon dioxide to methane [J]. Energy & Environmental Science, 2014,7(1):408-415.
[13] Li H, Chang J, Liu P, et al. Direct interspecies electron transfer accelerates syntrophic oxidation of butyrate in paddy soil enrichments [J]. Environmental Microbiology, 2015,17(5):1533-1547.
[14] 高靖伟,赫婷婷,程 翔,等.EGSB-MBR 组合工艺处理糖蜜发酵废水效能研究 [J]. 中国环境科学, 2015,35(5):1416-1422.
[15] Li J, Ban Q, Zhang L, et al. Syntrophic propionate degradation in anaerobic digestion: a review [J]. International Journal of Agriculture and Biology, 2012,14(5):843-850.
[16] 国家环保局《水和废水监测分析方法》编委会.水和废水监测分析方法 [M]. 北京:中国环境科学出版社, 2002.
[17] Owen W F, Stuckey D C, Healy J B, et al. Bioassay for monitoring biochemical methane potential and anaerobic toxicity [J]. Water Research, 1979,13:485-492.
[18] Wallrabenstein C, Hauschild E, Schink B. Syntrophobacter pfennigii sp. nov., new syntrophically propionate-oxidizing anaerobe growing in pure culture with propionate and sulfate [J]. Archives of Microbiology, 1995,164:346-352.
[19] Harmsen H J M, van Kuijk B L M, Plugge C M, et al. Syntrophobacter fumaroxidans sp. nov., a syntrophic propionatedegrading sulfate-reducing bacterium [J]. International Journal of Systematic Bacteriology, 1998,48:1383-1387.
[20] Liu Y, Whitman W B. Metabolic, phylogenetic, and ecological diversity of the methanogenic archaea [J]. Annals of the New York Academy of Sciences, 2008,1125:171-189.
[21] Mu Y, Wang G, Yu H, Response surface methodological analysis on biohydrogen production by enriched anaerobic cultures [J]. Enzyme and Microbial Technology, 2006,38:905-913.
[22] Ban Q, Li J, Zhang L, et al. Phylogenetic Diversity of methanogenic archaea and kinetics of methane production at slightly acidic conditions of an anaerobic sludge [J]. International Journal of Agriculture and biology, 2013,15:347-351.
[23] Kim I S, Hwang M H, Jang N J, et al. Effect of low pH on the activity of hydrogen utilizing methanogen in bio-hydrogen process [J]. International Journal of Hydrogen Energy, 2004,29: 1133-1140.
[24] Chen X, Sun Y, Xiu Z, et al. 2006. Stoichiometric analysis of biological hydrogen production by fermentative bacteria [J]. International Journal of Hydrogen Energy, 2006,31:539-549.
Degradation characteristics of a propionate enriched culture at slightly acidic conditions.
Z HANG Li-guo1, LIU Jian-zhong1, BAN Qiao-ying1*, LI Jian-zheng2(1.College of Environment and Resource, Shanxi University, Taiyuan 030006, China;2.School of Municipal and Environmental Engineering, Harbin Institute of Technology, Harbin 150090, China). China Environmental Science, 2016,36(12):3724~3728
To clarify the effects of pH on propionate degradation in an anaerobic system, the degradation characteristics of a propionate enriched culture at slightly acidic conditions were investigated. Under the biomass of 0.22g MLVSS/L and initial propionate of 1000mg/L conditions, propionate was rapidly oxidized at pH7.0 (control) and propionate removal achieved 98.5% after 6days cultivation. pH decrease, from 7.0 to 6.5 and 6.0, resulted in propionate removal rate was decreased instantaneously. But propionate degradation rate was recovered to the value at pH 7.0 after 2~3 days adaptation. Propionate removal at pH 6.5 and pH 6.0 were reached above 97% after 8 days and 9 days cultivation, respectively. Propionate was hardly decomposed at pH 5.5 during the whole cultivation. During the whole experiment, no hydrogen was detected and acetate was transient accumulation in the early culture. These results indicated methanogens were more acid resistance than propionate-oxidizing bacteria.
propionate;enriched culture;slightly acidic conditions;degradation characteristics
X703.5
A
1000-6923(2016)12-3724-05
张立国(1980-),男,河南安阳人,讲师,博士,主要从事废水厌氧生物处理研究.发表论文12篇.
2016-04-20
国家自然科学基金项目(51508316);山西省基础研究项目(2015021136, 2015021134)
* 责任作者, 讲师, banqiaoying@163.com

