泥炭发酵产甲烷过程中古菌群落结构演替
郝思雯,马力通,2*
(1.内蒙古科技大学化学与化工学院,内蒙古 包头 014010;2.生物煤化工综合利用内蒙古自治区工程研究中心,内蒙古 包头 014010)
泥炭地是有泥炭赋存的地段,由于自然及人为因素的影响导致泥炭地退化,泥炭分解加剧,因此,抢救性开发退化泥炭地的泥炭资源具有重要的现实意义。泥炭是未完全腐败分解的沼泽动植物残体,在潮湿偏酸环境中经时间与压力积累形成有机质矿体[1],主要用于育苗基质和有机肥生产。泥炭通过厌氧发酵可直接转化为生物甲烷[2-3],实现泥炭资源就地转化。但泥炭转化存在甲烷产量较低的问题,高效稳定的微生物生态系统是厌氧发酵产甲烷的保证,是甲烷转化反应体系稳定运行的关键,而微生物群落结构决定其生态系统功能,因此,深入解析微生物群落结构特征,是指导泥炭发酵产甲烷的关键。杨秀清等[4]研究了褐煤厌氧发酵过程中乙醇对微生物群落结构的影响,发现产甲烷古菌主要为甲烷杆菌属(Methanobacterium)和甲烷八叠球菌属(Methanosarcina),其中甲烷八叠球菌属相对丰度达60%,为褐煤厌氧发酵体系优势古菌菌属。贾璇等[5]研究了芦苇厌氧联产氢气-甲烷过程中古菌群落结构特征,发现产氢阶段优势古菌为unculturedMethanosarcinalesarchaeon,产甲烷阶段优势古菌为Methanoculleusbourgensis。Han等[6]研究了青海高原沼气池微生物群落结构,发现产甲烷古菌分属于10个属,其中产甲烷菌属(Methanogenium,38.5%)为优势菌属。Ciccoli等[7]研究了菊芋厌氧发酵产甲烷的产量和微生物群落结构,发现风干菊芋发酵产甲烷的产量较高,优势菌属为甲烷囊菌属(Methanoculleus)。以上关于发酵产甲烷过程微生物群落结构演替的文献报道涉及不同原料,但目前未见涉及泥炭的研究。鉴于此,作者以草本泥炭为原料进行厌氧发酵,利用多聚酶链式反应(PCR)-变性梯度凝胶电泳(DGGE)技术对泥炭发酵产甲烷过程中古菌群落结构特征进行分析,为进一步改进泥炭发酵产甲烷工艺、提高甲烷产量、促进泥炭生物转化提供理论基础。
1 实验
1.1 材料
活性污泥,采自包头市南郊污水处理厂,经厌氧驯化后储存于4 ℃冰箱中;草本泥炭,购自吉林省敦化市。
1.2 方法
1.2.1 泥炭发酵产甲烷
采用AMPTS Ⅱ型全自动甲烷潜力测试系统进行泥炭发酵产甲烷实验。将40 g粉碎至粒径为150 μm(100目)的草本泥炭和200 mL活性污泥置于发酵瓶中,调节初始pH值为7.0,加蒸馏水至发酵总体积为400 mL,充氮气120 s(提供厌氧条件),发酵温度35 ℃。在发酵过程中,通过电机自动控制搅拌时间1 min,每次间隔30 min。在发酵第1 d、第6 d、第12 d、第18 d、第24 d取样,编号分别为S-1、S-6、S-12、S-18、S-24。
1.2.2 DNA提取
采用改良CTAB法提取样品基因组DNA。
1.2.3 PCR扩增
以样品基因组DNA为模板,进行巢式PCR扩增:首先采用引物Arch21F:5′-TTCCGGTTGATCCYGCCGGA-3′,1492r:5′-GGCTACCTTGTTACGA CTT-3′对样品进行PCR扩增;然后采用引物1106f-GC/1378r对产甲烷古菌进行PCR扩增。
1.2.4 PCR扩增产物的DGGE分析
取10 μL PCR扩增产物进行DGGE分析。变性梯度为32%~62%,采用8%聚丙烯酰胺凝胶,在1×TAE缓冲液中于85 V、60 ℃下电泳16 h。
1.2.5 DGGE优势条带的回收、测序与分析
用灭菌的手术刀切下DGGE优势条带,回收后,以2 μL回收产物为模板、1106f-GC/1378r为引物进行PCR扩增。
将重新扩增的DNA片段切胶回收、纯化后,连接到pMD18-T载体上,并转化至DH5α感受态细胞中,筛选阳性克隆,进行序列测定。
采用Quantity One软件对DGGE图谱中条带数目、条带灰度进行数字化分析,采用Canoco软件进行主成分分析(PCA)。采用DNAstar和Cluster软件对测序结果进行分析,下载最相似的菌株序列作为系统发育树的参考序列。采用MEGA软件,通过Neighbor-Joining法构建系统发育树,自展数(bootstrap)为1 000。
2 结果与讨论
2.1 PCR扩增结果
以样品基因组DNA为模板,进行巢式PCR扩增,5种样品PCR扩增产物的DGGE图谱(图1)均显示得到约350 bp的DNA片段,扩增效果良好,可进行DGGE分析。

图1 5种样品PCR扩增产物的DGGE图谱Fig.1 DGGE profile of PCR amplification products of five samples
2.2 PCR扩增产物的DGGE分析及多样性分析
DGGE只能对菌群数量大于1%的微生物群落进行分析,DGGE图谱中的条带灰度、数目和位置代表微生物群落菌群的丰度及多样性,条带的出现或消失说明相应的菌群可能发生变化[8]。对5种样品PCR扩增产物进行DGGE分析,利用Quantity One软件绘制对应的模式图,结果如图2所示。

图2 5种样品PCR扩增产物的DGGE图谱及其对应的模式图Fig.2 DGGE profile of PCR amplification products of five samples and corresponding pattern diagram
由图2可知,DGGE图谱条带清晰,表明PCR扩增结果得到预期效果。5种样品(不同发酵时期)产甲烷古菌菌群条带数目、位置及灰度存在差异:发酵初期条带数目较多,但条带灰度较低,表明发酵初期古菌菌群丰富,具有多样性,但菌群丰度较低;随着发酵的进行,条带3、4、11、13的灰度逐渐升高,而条带1、2、7、12的灰度逐渐降低甚至消失,其余条带则始终维持较高灰度,未受发酵进程影响。不同发酵时期DGGE图谱有许多相同条带,如条带2、4、6、8、9、10,这些条带对应的古菌为整个发酵进程共有,而一些条带只在特定时期出现,为某发酵时期特征条带,如条带1、5、7为发酵初期特征条带,条带14为发酵末期特征条带。以上表明,随着泥炭发酵产甲烷的进行,产甲烷古菌群落结构发生了演替。
DGGE图谱中的条带灰度代表微生物丰度。从5种样品DGGE图谱条带灰度(表1)可知,在发酵初期,条带8的灰度最高(232.93),表明此古菌丰度最高,为产甲烷优势古菌;随着发酵的进行,优势古菌及其丰度发生改变,发酵6 d时条带9的灰度最高(235.37),发酵18 d时条带8的灰度又达到最高(236.70),发酵末期条带8的灰度仍维持最高。表明在泥炭发酵产甲烷进程中优势古菌发生了演替。
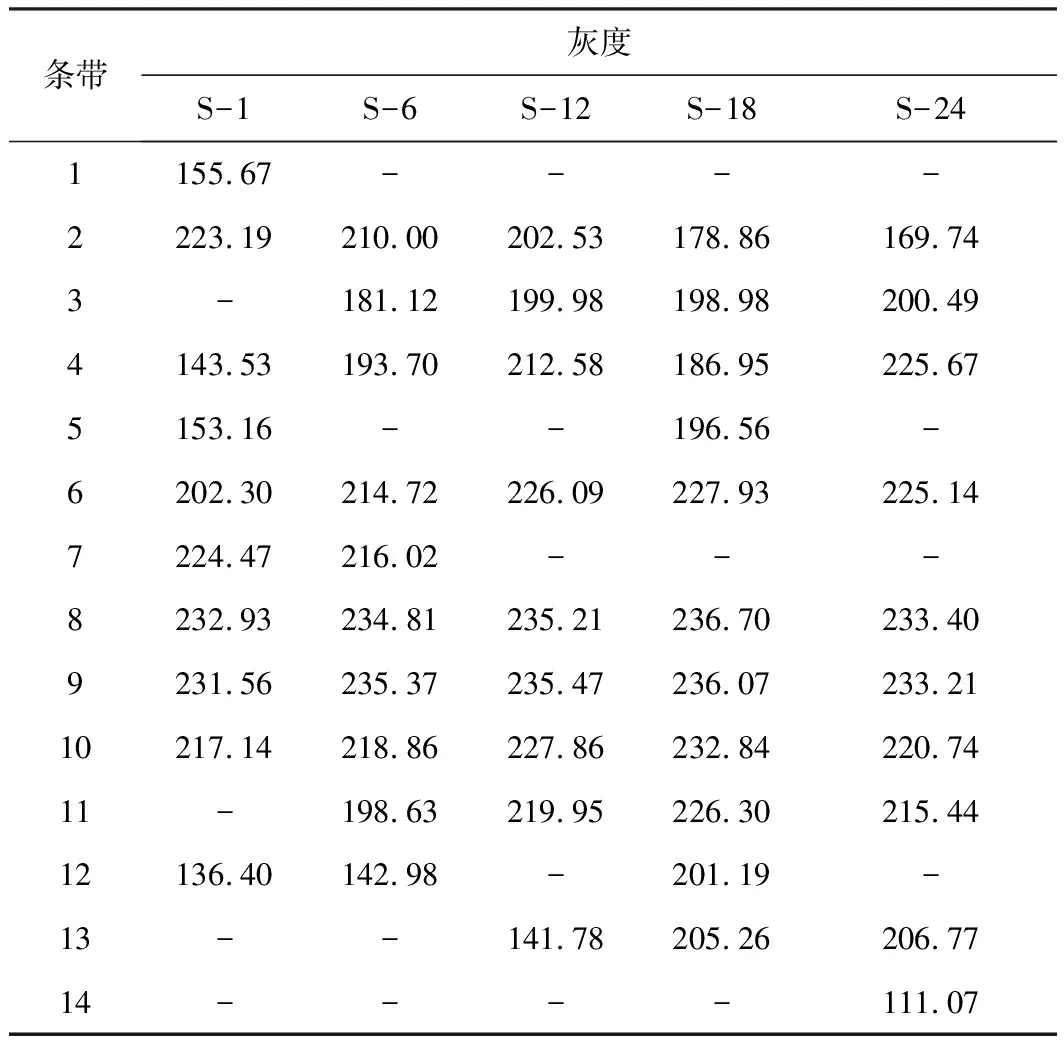
表1 5种样品DGGE图谱条带灰度
对5种样品DGGE图谱进行分析,得到泥炭发酵产甲烷过程中古菌群落结构特征指数,见表2。

表2 泥炭发酵产甲烷过程中古菌群落结构特征指数
由表2可知,泥炭发酵产甲烷过程中,古菌群落结构特征指数(香农指数、均一度指数和丰富度指数)虽有差异,但变化趋势相同,均在发酵18 d时达到最大值,香农指数为2.393 4,均一度指数为0.998 1,丰富度指数为11。5种样品(不同发酵时期)的丰富度指数均达到或超过9,表明泥炭发酵产甲烷过程中古菌菌群丰富,其中样品S-18(发酵第18 d)的丰富度指数达到11,表明发酵18 d时古菌群落含有11种产甲烷古菌,其群落多样性高于其它时期[9]。
2.3 不同发酵时期泥炭产甲烷古菌群落结构相似性分析
依据PCR-DGGE图谱,分析5种样品(不同发酵时期)古菌群落结构的相似性,结果见表3。

表3 5种样品古菌群落结构的相似性
由表3可知,泥炭发酵产甲烷初期与其它时期产甲烷古菌群落结构存在较大差异,其中发酵初期(第1 d)与发酵末期(第24 d)时的古菌群落结构差异最大,相似性最低,仅为0.50;发酵第6 d与第12 d时的古菌群落结构基本相似,相似性达0.88;发酵第18 d与第12 d时的古菌群落结构相似性较高,达0.85;发酵第24 d与第18 d时的古菌群落结构相似性达0.80。
泥炭发酵产甲烷古菌的聚类分析(图3)表明:发酵第6 d与第12 d时的古菌群落结构相似度高达0.88;而发酵第18 d与第12 d、第6 d时的古菌群落结构相似度降为0.81;发酵第24 d与第18 d、第12 d、第6 d时的古菌群落结构相似度又有所下降,降至0.77;发酵第1 d与其它发酵时期的古菌群落结构相似度最低,为0.65。泥炭发酵产甲烷古菌的主成分分析(图4)表明:发酵第12 d和第24 d时的古菌群落结构相似,发酵初期与其它发酵时期的古菌群落结构差异明显。以上表明,随着泥炭发酵产甲烷的进行,产甲烷古菌群落结构发生了演替。
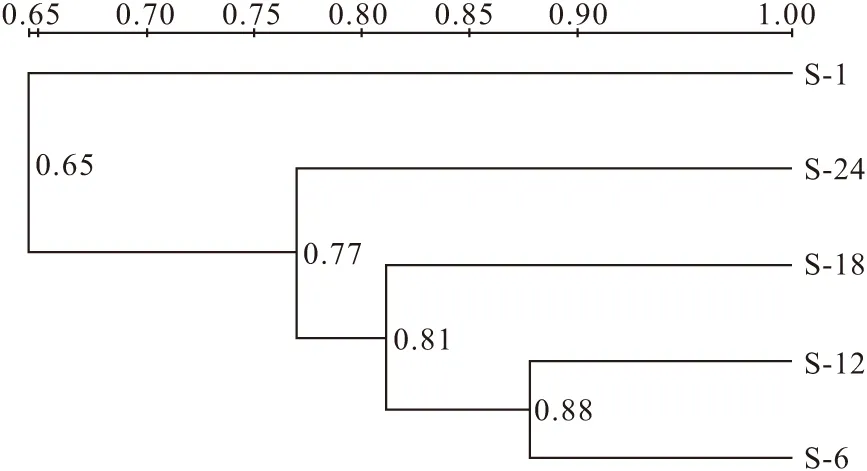
图3 泥炭发酵产甲烷古菌的聚类分析Fig.3 Cluster analysis of archaea in methanogenesis with peat

图4 泥炭发酵产甲烷古菌的主成分分析Fig.4 PCA of archaea in methanogenesis with peat
2.4 DGGE图谱条带的序列比对
对图2中具代表性的14个条带进行克隆测序,并与GenBank数据库中的已有序列进行比对分析,得到泥炭发酵产甲烷过程中古菌群落结构的同源性信息(表4),并构建系统发育树(图5)。
由表4和图5可知,泥炭发酵产甲烷过程中古菌群落结构具有多样性,各条带序列与近缘种的相似度为0.84~1.00,条带4、9最相似菌株为Methanosaetaharundinacea,条带7、8、11最相似菌株为Methanosaetaconcilii,条带10、12、13、14最相似菌株为Methanolineatarda,条带3最相似菌株为Methanobacteriumbeijingense,条带6最相似菌株为Methanobacteriumsubterraneum,条带1、2、5最相似菌株为Methanobrevibacterruminantium。 产甲烷古菌均属于广古菌门(Euryarchaeota),分属于3个古菌菌目,包括甲烷八叠球菌目(Methanosarcinales)、甲烷杆菌目(Methanobacteriales)和甲烷微菌目(Methanomicrobiales),分属于4个古菌菌属,包括甲烷鬃菌属(Methanosaeta)、甲烷绳菌属(Methanolinea)、甲烷杆菌属(Methanobacterium)和甲烷短杆菌属(Methanobrevibacter),其中甲烷鬃菌属为泥炭发酵产甲烷过程中的优势菌属。
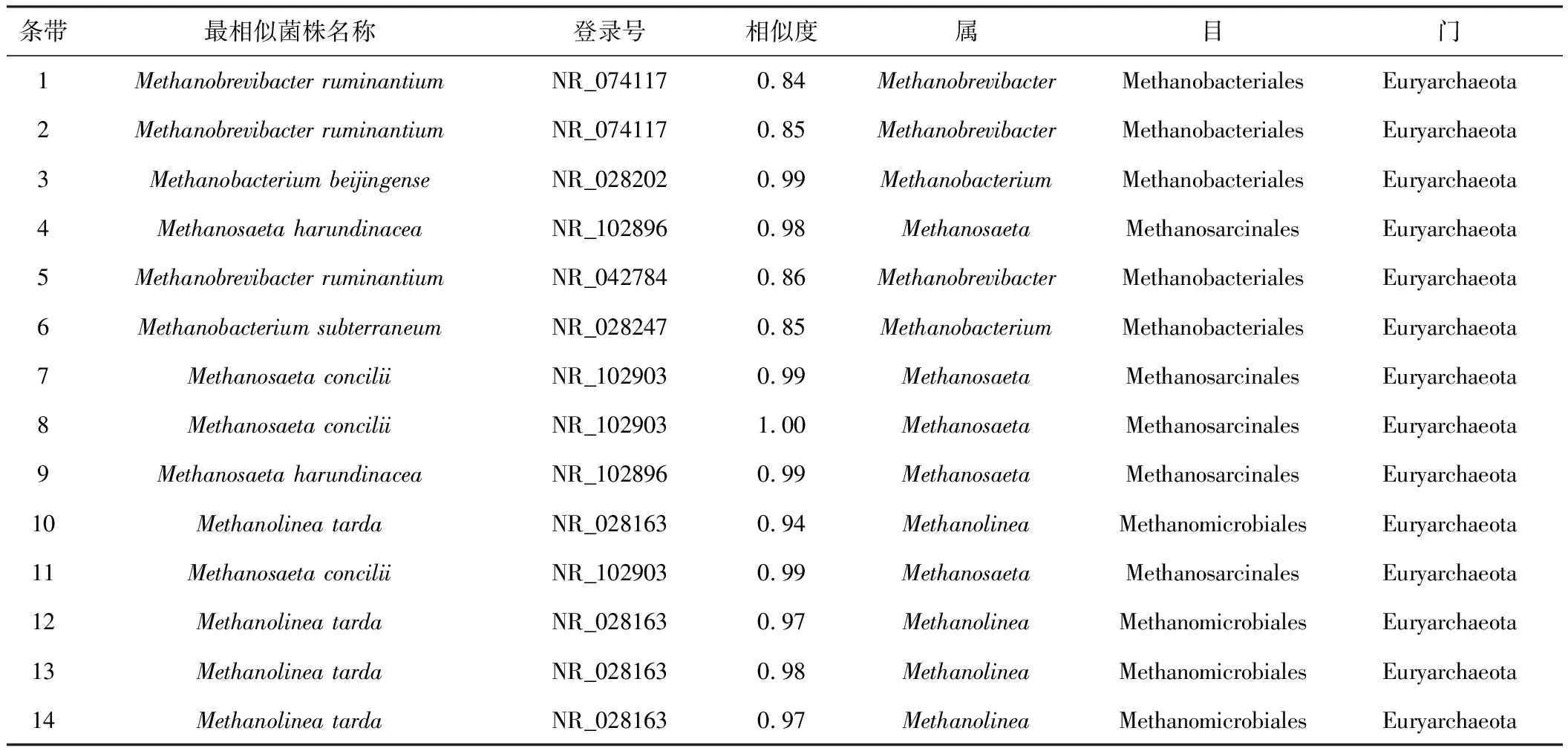
表4 泥炭发酵产甲烷过程中古菌群落结构的同源性信息

图5 泥炭发酵产甲烷古菌的系统发育树Fig.5 Phylogenetic tree of archaea in methanogenesis with peat
2.5 泥炭发酵产甲烷过程中古菌群落结构演替
从泥炭发酵产甲烷过程中的古菌菌群相对丰度(图6)可知,随着泥炭发酵产甲烷的进行,古菌群落结构发生变化,其中甲烷鬃菌属(Methanosaeta)的相对丰度呈先升高后降低的趋势,维持在36.37%~50.00%之间,是泥炭发酵产甲烷过程中的优势菌属;甲烷绳菌属(Methanolinea)的相对丰度由20.00%逐渐升至30.00%;甲烷杆菌属(Methanobacterium)的相对丰度先升高后趋于稳定,发酵末期相对丰度为20.00%;而甲烷短杆菌属(Methanobrevibacter)的相对丰度由30.00%降至10.00%。表明泥炭发酵产甲烷过程中古菌群落结构发生了演替。

图6 泥炭发酵产甲烷过程中的古菌菌群相对丰度Fig.6 Relative abundance of archaea in methanogenesis with peat
泥炭富含有机质,有机质厌氧降解产生短链脂肪酸(VFA)、H2/CO2和各种醇类化合物,产甲烷古菌可以利用系统中的乙酸及H2/CO2转化产甲烷,保证有机质厌氧降解持续稳定进行[10-11]。其中优势菌属甲烷鬃菌属只利用乙酸产甲烷,是专性乙酸营养型产甲烷古菌,常见于厌氧反应器和湖底沉积物微生物群落中[12-13];甲烷绳菌属和甲烷杆菌属均利用H2/CO2生长,为氢营养型产甲烷古菌,常见于厌氧反应器、水稻田、冻土层、淡水和海洋沉积物微生物群落中[14-17];甲烷短杆菌属利用H2/CO2生长,为氢营养型产甲烷古菌,常见于哺乳动物粪便、白蚁肠道和厌氧反应器中[18-19]。
2.6 不同原料发酵产甲烷过程中的优势古菌分析(表5)
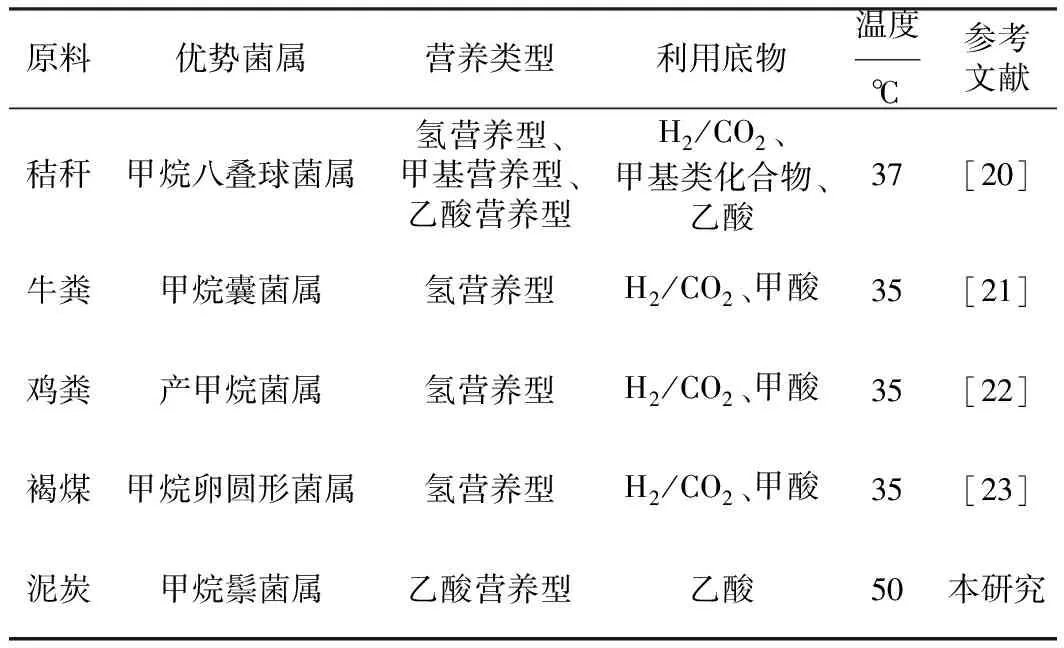
表5 不同原料发酵产甲烷过程中的优势古菌分析
由表5可知,发酵原料不同,产甲烷过程中的优势菌属不同,产甲烷途径也存在差异。当发酵原料为秸秆[20]时,优势菌属为甲烷八叠球菌属,属于氢营养型、甲基营养型和乙酸营养型混合古菌,可利用H2/CO2、甲基类化合物、乙酸底物转化生成甲烷[11];当发酵原料为牛粪[21]时,优势菌属为甲烷囊菌属,属于氢营养型古菌,可利用H2/CO2、甲酸转化生成甲烷[11];当发酵原料为鸡粪[22]时,优势菌属为产甲烷菌属,属于氢营养型古菌;当发酵原料为褐煤[23]时,优势菌属为甲烷卵圆形菌属(Methanocalculus),属于氢营养型古菌,可利用H2/CO2、甲酸转化生成甲烷;本研究以泥炭为发酵原料,优势菌属为甲烷鬃菌属,是专性乙酸营养型产甲烷古菌,只能利用乙酸产甲烷,将乙酸分子的甲基转化为甲烷[24]。甲烷绳菌属、甲烷杆菌属和甲烷短杆菌属属于氢营养型产甲烷古菌,通过CO2还原途径产甲烷,以H2作为电子供体,通过氢酶作用还原CO2,进而转化生成甲烷[25]。泥炭发酵产甲烷过程中的优势菌属为甲烷鬃菌属,与其它发酵基质产甲烷古菌优势菌属不同,泥炭发酵产甲烷的途径主要为乙酸营养型代谢类型,同时伴随氢营养型代谢类型。
3 结论
泥炭发酵产甲烷过程中的古菌菌群均属于广古菌门,包括甲烷鬃菌属、甲烷绳菌属、甲烷杆菌属和甲烷短杆菌属,其中甲烷鬃菌属为优势菌属;研究泥炭发酵产甲烷过程古菌群落结构有利于进一步改进泥炭发酵产甲烷工艺,提高甲烷产量,促进泥炭就地转化。
在泥炭发酵产甲烷过程中,古菌菌群的丰度发生波动。随着发酵的进行,甲烷鬃菌属的相对丰度最高,维持在36.37%~50.00%之间,甲烷绳菌属和甲烷杆菌属的相对丰度分别升至30.00%和20.00%,而甲烷短杆菌属的相对丰度逐渐降低,发酵末期仅为10.00%。泥炭发酵产甲烷过程实质上是多种古菌菌群的物质代谢和能量代谢过程,对古菌群落结构演替的认知有助于构建出可以服务于生物甲烷工业生产的人工混合菌群,通过调节环境条件中的温度、pH值等参数,有效协调菌群间的关系,使其达最佳生态水平,发挥泥炭转化甲烷最大效应。
泥炭发酵产甲烷途径主要为乙酸营养型代谢类型,同时伴随氢营养型代谢类型。甲烷鬃菌属为优势古菌,是专性乙酸营养型产甲烷古菌,只利用乙酸产甲烷;甲烷绳菌属、甲烷杆菌属和甲烷短杆菌属属于氢营养型产甲烷古菌,利用H2/CO2转化生成甲烷。不产甲烷微生物群落结构的动态演替及其与产甲烷古菌群落之间的协同作用机理有待进一步深入研究。

