表面增强拉曼光谱定量分析技术研究进展
高嘉敏,张卓旻,李攻科
(中山大学 化学学院,广东 广州 510275)
综 述
表面增强拉曼光谱定量分析技术研究进展
高嘉敏,张卓旻*,李攻科*
(中山大学 化学学院,广东 广州 510275)
表面增强拉曼光谱(SERS)技术具有适于现场快速分析等优点,从而引起众多分析科学家的关注。但在实际分析过程中,SERS信号易受基体干扰,重现性欠佳,因此SERS技术目前多应用于定性或半定量分析,SERS定量分析技术仍亟待发展完善。随着科技的不断发展,人们对准确度更高的表面增强拉曼光谱定量技术的需求日益强烈。该文综述了目前外标法、内标法和化学计量学定量方法等主流SERS定量分析技术在近年来的研究进展,并展望了SERS定量分析技术的未来发展趋势。
表面增强拉曼光谱;定量技术;研究进展;综述
表面增强拉曼光谱(Surface enhanced Raman spectroscopy,SERS)从1974年发现至今已历经40多年的发展。SERS技术能够提供丰富的化学分子结构信息,具有高灵敏度、高选择性、受水和荧光信号干扰小的优点,在食品、农业、工业、生物医学等众多领域得到了广泛应用。但实际分析过程中,由于样品基体效应的影响,SERS信号波动性较大,分析重现性欠佳,目前SERS技术在实际中多用于样品的定性和半定量分析,采用SERS技术对实际样品中的痕量目标物进行定量分析仍为一大难点。伴随近年来SERS技术的不断成熟,采用SERS准确定量分析目标物含量的需求越来越强烈,SERS定量分析技术亟待完善发展,而开发可靠的定量方法亦成为近年来SERS技术的研究热点。本文综述了外标法、内标法、计量学多元分析方法等目前主流的SERS定量分析技术在近年来的研究进展,并展望了SERS定量分析技术的未来发展趋势。
1 SERS外标法定量技术
根据目标物质某一特征拉曼峰的峰强度(峰高或峰面积)随物质浓度变化产生相应梯度变化的标准曲线进行定量的技术称为SERS外标法定量技术,是最常用的SERS定量分析技术。根据目标物是否具有SERS响应,SERS外标法定量技术又可分为直接定量及间接定量技术。
1.1 直接定量法
对于具有SERS响应的目标物,可将其与SERS活性基底结合,直接进行检测,然后依据某一可反映分析物浓度变化的特征峰作为定量峰绘制标准曲线,从而实现对样品中的目标物进行外标法定量分析。为获得准确的定量结果,基底的性能起着至关重要的作用。商品化的SERS基底材料是最易得的均一、稳定且重现性好的增强基底,为许多SERS测定带来了便利。李攻科教授课题组通过应用厦门大学田中群院士课题组研发的商品化金纳米溶胶CP-1或CP-2成功地检测了多种食品中的添加剂或农兽药残留[1-3]。然而商品化的基底并不适用于每个检测体系,有一定的局限性,如灵敏度不够,选择性不强等。因此,许多研究者致力于制备高选择性、高重现性和高SERS活性的基底[4-5]。根据文献报道,苯乙烯微球[6]、嵌段聚合物[7]、MOFs[8]、核壳微粒[9]等纳米材料和自组装[10]、化学刻蚀[11]、多孔阳极氧化铝(AAO)模板[12]等纳米技术均已被用来合成SERS基底以定量检测目标物。Hu等[13]利用金属有机骨架化合物(Metal-organic frameworks,MOFs)材料MIL-101合成的SERS基底,实现了环境水中有机污染物的超痕量定量检测,检出限低于1.0 ng/mL,灵敏度获得大大提高。直接定量法虽然操作十分简单,但难以避免基底自身物理差异带来的误差和影响,定量结果的可靠性相对内标法较差。
1.2 间接定量法
通过标记间接测定目标物的方式在生物分子检测中应用更为广泛,最为经典的当属Porter等[18]提出的捕获抗体-抗原-标记抗体三明治结构。在修饰有标记分子的金纳米颗粒上再连接抗体来捕获目标抗原,然后通过标记分子的特征峰进行定量分析[19]。通过对基底结构进行改进,此类标记方法也可应用于DNA、生物小分子的定量检测。例如,Cao等[20]构建新型“捕获DNA-目标DNA-探针DNA”的三明治结构。总体上,间接SERS定量方法增强了基底对目标物的吸附,扩大了SERS的可检测物质范围。为突出SERS外标法定量的实用性和普适性,根据液态、固态和气态样品状态的不同,表1归纳了SERS外标法定量技术近年来的应用实例。采用外标法进行SERS定量分析时,由于SERS的信号强度受测试基底均匀性及测试条件波动等因素的影响而易产生波动,使得SERS分析的重现性及定量准确性降低,从而使其应用范围受限,并有逐渐被其他定量技术取代的趋势。

表1 SERS外标法定量技术的应用
(续表1)

SamplestatusAnalyteShiftofquantitativepeak(cm-1)QuantitativetechnologyDetectionlimitReferenceSolidstateThiramonapplesurface1375Directquantification460×10-7mol/L[26]2,4⁃Dinitrotolueneinfingerprint1340Directquantification120ng/cm2[27]Malachitegreenonfishsurface1174Directquantification010nmol/L[28]Anthraceneinsoil1408Directquantification300×102pmol/L[29]GaseousstateSO2inredwine600Directquantification010μg/mL[30]Formaldehydeinaquaticproduct1275Indirectquantification017μg/L[15]Toluenesteam1003Directquantification060mg/L[31]Trinitrotoluene1434Directquantification16×10-17g/cm3[32]
2 SERS内标法定量技术
内标法定量技术根据定量峰与内标峰的相对强度值和目标物浓度之间的关系曲线对样品中目标物进行SERS定量分析。内标物的存在可以用来标准化由于拉曼激光强度波动、基底活性不均、测量环境改变等不稳定因素引起的全光谱强度变化,使定量结果更为可靠准确。采用SERS内标法进行定量分析,不仅要考虑内标物和目标物的性质、内标峰和目标峰的关联,还要考虑SERS基底本身的性质,在保证内标峰信号不对分析物SERS信号产生干扰的前提下,要求内标物含量明确、分布均一,并且内标峰响应信号能及时反映基底活性和测定条件变化带来的影响。根据内标物的不同理化性质及添加方式,常见的SERS内标定量分析方法可分为外添加内标法、同位素标记内标法、嵌入内标法及固有内标法,具体方法可依据实际需求进行选择,以使得整个操作过程更加快速高效。
2.1 外添加内标法

此外,因常作为SERS检测或固态SERS基底承载平台的硅片在光谱图中520 cm-1位移处有一明显的特征峰,且此峰位与其他物质的拉曼峰重叠的可能性很小,所以有不少研究者将其作为一内标物对目标物检测结果进行校正,使定量结果更加准确[36]。
2.2 同位素标记内标法
同位素标记内标法(Isotopic edited internal standard,IEIS)是选择分子振动模式与待测物一致,SERS谱图峰形也相一致,但标记后由于分子质量发生变化,与标记元素有关的振动会发生峰位迁移,采用同位素标记物为内标物进行定量分析的方法[37]。添加待测物质相应的同位素取代物作为内标物,不仅能保证两者化学性质上的相似,而且两者对同一物质的吸附能力及环境因素改变引起的信号变化程度也相同,用两者特征峰强度之比进行定量分析,可得到准确的分析结果。
IEIS方法简单可靠,但也有一定局限性,如分析物要存在相应的同位素取代物;两者定量峰位移差异要足够大;结构相似的两者对目标物可能产生额外竞争吸附等。从已报道的文献来看,只有尼古丁-d0[38]、吡啶-d0[38]、罗丹明6G-d0[39]等少数物质能够应用IEIS方法实现SERS的定量检测。
2.3 嵌入内标法
为减少假阳性结果的发生,提高定量结果的重现性,嵌入内标方法应运而生。该法在SERS活性基底内部嵌入常见的拉曼探针分子,并以其作为内标分子进行定量分析。嵌入内标物是可独立于基底结构存在的,不参与目标物吸附检测过程的,特意添加具有类似于标记物作用的,可作为内标进行定量分析的物质。
嵌入式内标多见于核壳型纳米结构基底中,Zhou等[40]和任斌等[41]均制备了嵌有拉曼信号分子作为内标物的Au/Ag核壳型SERS基底用于定量分析。任斌教授课题组制备的核壳材料中不仅嵌入内标分子4-巯基吡啶(4-Mpy),还嵌入了半胱胺分子作为骨架以便于形成壳层。这大大减轻了内标分子的“负担”,且因内标分子不需要作为连接分子而大大扩展了其存在区域,显著提高了基底检测灵敏度。同时,处于壳层的嵌入式内标分子响应信号受外界干扰因素的影响非常小,与待测分子不会产生竞争吸附,这使得SERS准确可靠的定量分析得以实现。嵌入内标的定量方法相较于外添加内标和IEIS法,使用的基底更具特色,需要巧妙的基底制备方法,虽增加了繁琐的制备步骤,但得到的基底更加均匀稳定,内标参与竞争吸附的可能性大大减少,显著提高了定量结果的准确性。
2.4 固有内标法
固有内标法中的内标峰也源于SERS基底的本底峰,与嵌入内标法不同的是,其内标物不是特意添加至基底中的SERS标记分子,而是制备基底时所需要的原料或检测某一类物质需要的特殊媒介物。固有内标法中的内标物不仅作为内标物存在,还是基底制备过程中不可或缺的结构物质。
基于纳米微球、纳米阵列模板等合成SERS基底是一种常见的手段,其中一些后期未通过刻蚀等方式除去的功能分子因自身也能产生SERS响应,而有可能成为内标物。但应用于内标法定量分析时,需要注意定量峰强度与内标峰强度不能相互影响。Péron等[6,42]基于聚苯乙烯(PS)纳米微球表面制备SERS基底,其基底本底SERS谱图中出现了稳定的聚苯乙烯特征峰(1 004 cm-1)。将该峰作为内标峰进行定量分析,但因为内标物与目标物存在竞争吸附,每次需经乙醇溶液清洗基底后再测定一次空白基底才可得到准确的内标峰响应值。为弥补这一不足,Ingram等[43]采用在PS纳米微球模板表面包覆一层纳米银膜(Silver film over nanospheres,AgFONs)的方法制备SERS活性基底,可以同时测出目标定量峰和内标峰的强度,从而实现对目标物的直接定量分析。
对于超痕量或难吸附物质的检测,研究者通过在合成过程中增加修饰特殊结构物质的步骤来提高方法检测灵敏度。而其中有些修饰物在SERS测定过程中也能产生SERS响应,当其满足作为内标物的要求时,可用来校正目标物信号,提高定量准确度。如Jiang等[44]采用含有己烷硫醇(Hexane mercaptan,HT)结构的固有内标SERS活性基底,富集并定量分析了环境样品中的痕量多环芳烃(PAHs)。同理,Jiang等[45]还利用经可通过静电相互作用预富集目标物氯苯酚且有SERS信号响应的半胱胺分子修饰的基底,实现了高灵敏度和高准确度的SERS定量分析,检出限可低至0.2 μmol/L。这种依据检测目标物的需要而有目的地选择某一特殊物质来修饰基底的方法具有很强的可控性、可操作性以及实用性。固有内标法在嵌入内标法的基础上简化了制备过程,保留了稳定性、定量准确性特点,但最终制备出的基底中是否存在可作为SERS定量分析的内标峰具有一定的不可预知性,这在一定程度上限制了固有内标基底的研发。表2 列出了部分SERS内标法定量技术的应用。
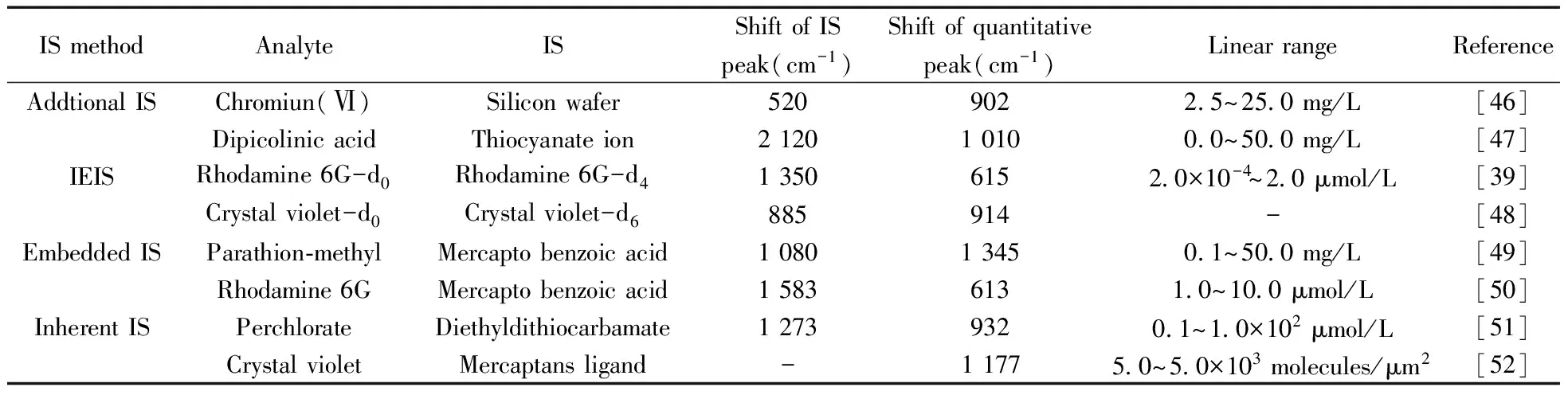
表2 SERS内标法定量技术的应用
(续表2)

ISmethodAnalyteISShiftofISpeak(cm-1)Shiftofquantitativepeak(cm-1)LinearrangeReferenceDopaminePolyacrylicacid1130147500~05mmol/L[53]AminothiophenolPolyacrylicacid925107700~10μmol/L[53]
3 化学计量学定量技术
复杂体系的SERS定量分析准确度不仅由目标物浓度决定,还受样品中其他具有SERS响应的组分、增强基底的物理性质(如颗粒尺寸、形状、聚集程度)、测试条件等因素影响[54],使用传统的基于峰高或峰面积的单变量SERS定量法有时较难获得准确结果。化学计量学方法与SERS定量技术相结合,可从大量数据中快速提取有用的化学信息,能有效地消除干扰组分对获取目标信号的影响以及原始数据中可能的实验误差,提高定量的准确度和可靠性。
3.1 多元校正方法
上述提及的外标法和内标法是SERS分析中常用的定量方式,但若样品复杂,干扰物质将会对这两种单变量分析方法的定量结果产生极大影响。即使内标法在一定范围内可减小基底表面物理性质差异及测试条件变化带来的影响,也难适用于复杂体系中物质的定量分析。而采用多元数据校正方法,如偏最小二乘法(Partial least squares,PLS)[55-58]、多元线性回归(Multiple linear regression,MLR)[59]、遗传算法(Genetic algorithm,GA)[60-61]以及人工神经网络(Artificial neural network,ANN)[62]等建立光谱校正模型,可将复杂基质中的重叠峰区分开,有效消除干扰组分对信号的影响,在一定程度上提高了目标物SERS定量结果的准确性。
但是,多元数据校正法并不能有效消除SERS基底物理性质差异、仪器测试条件变化对定量结果的影响,因而在实际样品分析中十分受限。所以发展能阐明SERS基底物理性质等其他条件变化与SERS信号强度变化之间定量关系的新型计量学模型对于提高复杂体系SERS定量分析的准确度是十分必要的[63]。
3.2 新型化学计量模型
进行复杂体系中目标物定量分析时,由基底及样本物理性质间的差异引发的乘子效应会严重影响定量结果的可信度,使用普通多元数据校正法并不能有效解决这一问题,建立新的新型化学计量模型迫在眉睫。为解决这一难题,湖南大学俞汝勤院士课题组在结合化学计量学方法提高SERS定量分析准确性方面做了大量工作,成果丰硕[64-65],并提出了用于SERS定量检测的乘子效应模型(Multiplicative effects model for SERS,MEMSERS)[66-67]。MEMSERS模型中引入了乘子效应参数用以探索非均匀性对定量信号强度的影响,并可将干扰信号与定量信号分离开,实现准确定量[68]。为进一步消除基底物理性质差异带来的影响,该课题组将在一定程度上能消除物理性质差异的内标法和MEMSERS结合起来发展了内标加入法[69]、内标标记法和基于广义比率型SERS探针[70]的3种新型MEMSERS模型。该方法的内标物与传统的内标物有着很大不同,内标峰即使与待测样本中所有组分的SERS光谱有重叠也不会影响定量结果,能进一步提高分析结果的准确性。这种将内标技术与化学计量学方法相结合的想法是SERS计量学定量分析的一大突破,对将来SERS定量技术逐渐向常规技术发展具有重要的指导意义。
4 结语与展望
SERS分析技术便携快速、操作简单、适于现场分析,已应用于很多领域的定量检测,但对SERS定量技术的普适性和准确性提出了更高的要求。SERS外标定量法操作简单方便,但重现性较差,提高分析准确度需依赖研发均一稳定、重现性好的SERS基底。SERS内标定量法方式多样,虽可能存在内标物与目标物的竞争吸附,但能最大限度地消除复杂样品分析过程中的基体干扰,分析结果重现性好、准确度高。而化学计量学定量法可从数据解析层面上对SERS信号中的干扰因素进行剥离及降噪,从而进一步消除SERS内外标定量技术过程残留的基体效应影响,该方法是对SERS内外标定量技术的有效提升。
如何提高SERS定量技术的准确性并使之成为常规的定量检测技术,是未来SERS定量技术的发展方向。首先,发展灵敏、均一、稳定的SERS活性基底合成方法,以减小基底物理性质差异对SERS定量过程带来的影响,提高分析过程的重现性。其次,在SERS定量分析过程中,需严格规范操作,减少或避免数据获取、激光强度设置、温度差异等带来的误差,以提高分析结果的准确性。另外,对于基体复杂的样品,可将SERS技术与高效便携的前处理技术联用,以提高SERS定量过程的抗干扰能力,从而进一步提高SERS定量技术的准确度,拓宽其应用范围。
[1] Huang M Y,Li G K,Hu Y L.Chin.J.Anal.Chem.(黄梅英,李攻科,胡玉玲.分析化学),2015,43(8):1218-1223.[2] Chen Y,Zhang K G,Hu Y L,Li G K.J.Instrum.Anal.(陈漾,张凯歌,胡玉玲,李攻科.分析测试学报),2014,33(4):432-436.
[3] Chen Y,Li G K,Hu Y L.J.Anal.Sci.(陈漾,李攻科,胡玉玲.分析科学学报),2015,(3):307-312.
[4] Zhao Y Q,Huang J A,Zhang Z Y,Chen X F,Zhang W J.J.Mater.Chem.A,2014,2(26):10218-10224.
[5] Kaminska A,Kowalska A A,Snigurenko D,Guziewicz E,Lewinski J,Waluk J.Analyst,2015,140(15):5090-5098.[6] Péron O,Rinnert E,Compère C,Toury T,Chapelle M L.Am.Inst.Phys.,2010,1(1267):1071-1072.
[7] Zu X H,Jian Z H,Yi G B,Huang H L,Zhong B B,Luo H S,Huang J R,Wang C.Chin.J.Polym.Sci.,2015,33(10):1470-1476.
[8] Jiang Z W,Gao P T,Yang L,Huang C Z,Li Y F.Anal.Chem.,2015,87(24):12177-12182.
[9] Chen B,Meng G W,Huang Q,Huang Z L,Xu Q L,Zhu C H,Qian Y W,Ding Y.Appl.Mater.Interfaces,2014,6(18):15667-15675.
[10] Shen Y L,Liu Y J,Wang W,Xu F,Yan C,Zhang J H,Wang J,Yuan A H.RSCAdv.,2016,6:38716-38723.[11] Qi G H,Jia K Q,Fu C C,Xu S P,Xu W Q.J.Opt.,2015,17:114020-114026.
[12] Pan X H,Zhang Q,Guo W,Chen F H.Spectrosc.SpectralAnal.(潘晓会,张芹,郭伟,陈发河.光谱学与光谱分析),2015,35(6):1556-1561.
[13] Hu Y L,Liao J,Wang D M,Li G K.Anal.Chem.,2014,86(8):3955-3963.
[14] Jiao L S,Niu L,Shen J,You T Y,Dong S J,Ivaska A.Electrochem.Commun.,2015,7:219-222.
[15] Zhang Z M,Zhao C,Ma Y J,Li G K.Analyst,2014,139:3614-3621.
[16] Huang Y F,Zhu H P,Liu G K,Wu D Y,Ren B,Tian Z Q.J.Am.Chem.Soc.,2010,132:9244-9246.
[17] Hardy M,Doherty M D,Krstev I,Maier K,Möller T,Müller G,Dawson P.Anal.Chem.,2014,86(18):9006-9012.[18] Ni J,Lipert R J,Dawson G B,Porter M D.Anal.Chem.,1999,71:4903-4908.
[19] Wei X P,Su S,Guo Y Y,Jiang X X,Zhong Y L,Su Y Y,Fan C H,Lee S T,He Y.Small,2013,9(15):2493-2499.
[20] Cao Y W C,Jin R C,Mirkin C A.Science,2002,297:1536-1540.
[21] Gu X,Camden J P.Anal.Chem.,2015,87(13):6460-6464.
[22] Ma P Y,Liang F H,Diao Q P,Wang D,Yang Q Q,Gao D J,Song D Q,Wang X H.RSCAdv.,2015,(5):32168-32174.
[23] Knauer M,Ivleva N P,Niessner R,Haisch C.Anal.Bioanal.Chem.,2012,402(8):2663-2667.
[24] Han Z Z,Liu H L,Wang B,Weng S H,Yang L B,Liu J H.Anal.Chem.,2015,87(9):4821-4828.
[25] Fu C C,Wang Y,Chen G,Yang L Y,Xu S P,Xu W Q.Anal.Chem.,2015,87(19):9555-9558.
[26] Lv D,Cao Y,Lou Z Y,Li S J,Chen X F,Chai Y F,Lu F.Anal.Bioanal.Chem.,2015,407(5):1313-1325.
[27] Gong Z J,Du H J,Cheng F S,Wang C,Wang C C,Fan M K.Appl.Mater.Int.,2014,6(24):21931-21937.
[28] Zhong L B,Yin J,Zheng Y M,Liu Q,Cheng X X,Luo F H.Anal.Chem.,2014,86(13):6262-6267.
[29] Jones C L,Bantz K C,Haynes C L.Anal.Bioanal.Chem.,2009,394(1):303-311.
[30] Deng Z,Chen X X,Wang Y R,Fang E H,Zhang Z G,Chen X.Anal.Chem.,2015,87(1):633-640.
[31] Myoung N S,Yoo H K,Hwang I W.J.Nanophotonics,2014,(8):083083.
[32] Wang J P,Yang L,Liu B H,Jiang H H,Liu R Y,Yang J W,Han G M,Mei Q S,Zhang Z P.Anal.Chem.,2014,86(7):3338-3345.
[33] Wang C,Cheng F S,Wang Y H,Gong Z J,Fan M K,Hu J M.Anal.Methods,2014,6(18):7218.
[34] Bai X,Li D M,Chang Z Y,Fan D J,Liu J P,Wang H.J.Radioanal.Nucl.Chem.,2015,305(2):643-652.
[35] Xu L J,Lei Z C,Li J X,Zong C,Yang C Y J,Ren B.J.Am.Chem.Soc.,2015,137(15):5149-5154.
[36] Peksa V,Jahn M,Atolcová L,Schulz V,Proška J,Procházka M,Weber K,Cialla-May D,Popp J.Anal.Chem.,2015,87(5):2840-2844.
[37] Tao Q,Dong J,Qian W P.Prog.Chem.(陶琴,董健,钱卫平.化学进展),2013,(6):1031-1041.
[38] März A,Ackermann K R,Malsch D,Bocklitz T,Henkel T,Popp J.J.Biophotonics,2009,2(4):232-242.
[39] Zhang D M,Xie Y,Deb S K,Davison V J,Ben-Amotz D.Anal.Chem.,2005,(77):3563-3569.
[40] Zhou Y,Ding R,Joshi P,Zhang P.Anal.Chim.Acta,2015,874:49-53.
[41] Shen W,Lin X,Jiang C Y,Li C Y,Lin H X,Huang J T,Wang S,Liu G K,Yan X M,Zhong Q L,Ren B.Angew.Chem.Int.Ed.,2015,54(25):7308-7312.
[42] Péron O,Rinnert E,Toury T,Chapelle M L,Compère C.Analyst,2011,136:1018-1022.
[43] Ingram W M,Han C Q,Zhang Q J,Zhao Y P.J.Phys.Chem.C,2015,119(49):27639-27648.
[44] Jiang X H,Lai Y C,Yang M,Yang H,Jiang W,Zhan J H.Analyst,2012,137(17):3995.
[45] Jiang X H,Yang M,Meng Y J,Jiang W,Zhan J H.Appl.Mater.Int.,2013,5(15):6902-6908.
[46] Jin J W,Chen Z P,Li L M,Yang J,Yu R Q.SurfaceEnhancedRamanSpectroscopyQuantitativeAnalysisoftheNewStrategy.Chengdu:The 28th Annual Seminar Chinese Chemical Society(金竞文,陈增萍,李丽梅,杨静,俞汝勤.表面增强拉曼光谱定量分析新策略.成都:中国化学会第28届学术年会),2012.
[47] Xiao J,Meng Y Y,Zhang P L,Wen W,Liu Z M,Zhang T.LaserSpectrosc.,2012,10(22):1481-1488.
[48] Bell S E J,Mackle J N,Sirimuthu N M S.Analyst,2005,130(4):545-549.
[49] Deb S K,Davis B,Ben-Amotz D,Davison V J.Appl.Spectrosc.,2008,9(62):1001-1007.
[50] Fang W,Zhang X W,Chen Y,Wan L,Huang W H,Shen A G,Hu J M.Anal.Chem.,2015,87(18):9217-9224.[51] Fales A M,Vo-Dinh T.J.Mater.Chem.C,2015,3(28):7319-7324.
[52] Zhu S,Zhang X L,Cui J C,Shi Y,Jiang X H,Liu Z,Zhan J H.Analyst,2015,140(8):2815-2822.
[53] Chen H Y,Lin M H,Wang C Y,Chang Y M,Gwo S.J.Am.Chem.Soc.,2015,137(42):13698-13705.
[54] Joshi P,Zhou Y,Ahmadov T O,Zhang P.J.Mater.Chem.C,2014,(2):9964-9968.
[55] Lai K Q,Zhai F L,Zhang Y Y,Wang X C,Rasco B A,Huang Y Q.Sens.Instrum.FoodQual.Saf.,2011,5(3/4):91-96.
[56] Barman I,Dingari N C,Kang J W,Horowitz G L,Dasari R R,Feld M S.Anal.Chem.,2012,84(5):2474-2482.[57] Zhang Y Y,Lai K Q,Zhou J L,Wang X C,Rasco B A,Huang Y Q.J.RamanSpectrosc.,2012,43:1208-1213.[58] Lee K M,Herrman T J,Nansen C,Yun U.J.CerealSci.,2013,1(1):1-14.
[59] Lai K Q,Zhang Y Y,Du R,Zhai F L,Rasco B A,Huang Y Q.Sens.Instrum.FoodQual.Saf.,2011,5(1):19-24.
[60] Siddhanta S,Wróbel M S,Barman I.Chem.Commun.,2016,52:9016-9019.
[61] Li S X,Li L F,Zeng Q Y,Zhang Y J,Guo Z Y,Liu Z M,Jin M,Su C K,Lin L,Xu J F,Liu S H.Sci.Rep.,2015,5:9582-9588.
[62] Seifert S,Merk V,Kneipp J.J.Biophotonics.,2016,9(1/2):181-189.
[63] Zuo Q,Shi C X,Chen Y,Chen Z P.Chin.J.Anal.Chem.(左奇,石彩霞,陈瑶,陈增萍.分析化学),2015,43(11):1656-1663.
[64] Chen Z P,Li L M,Jin J W,Nordon A,Littlejohn D,Yang J,Zhang J,Yu R Q.Anal.Chem.,2012,84(9):4088-4094.
[65] Chen Y,Chen Z P,Jin J W,Yu R Q.Chemometr.Intell.Lab.,2015,142:166-171.
[66] Xia T H,Chen Z P,Chen Y,Jin J W,Yu R Q.Anal.Methods,2014,(6):2363-2370.
[67] Song J,Chen Z P,Jin J W,Chen Y,Yu R Q.Chemometr.Intell.Lab.,2014,135:31-36.
[68] Yu R Q,Hu M,Chen Z P,Chen Y,Shi C X.Chin.J.Anal.Chem.(俞汝勤,胡敏,陈增萍,陈瑶,石彩霞.分析化学),2015,43:759-764.
[69] Long S Y,Chen Z P,Chen Y,Yu R Q.J.RamanSpectrosc.,2015,46(7):605-609.
[70] Chen Y,Chen Z P,Long S Y,Yu R Q.Anal.Chem.,2014,86(24):12236-12242.
Research Progress of Quantitative Analysis Techniques for Surface Enhanced Raman Spectroscopy
GAO Jia-min,ZHANG Zhuo-min*,LI Gong-ke*
(School of Chemistry,Sun Yat-sen University,Guangzhou 510275,China)
Surface enhanced Raman spectroscopy(SERS) technique has attracted the attention from analysts due to its advantage of potential capability for on-site rapid analysis and so on.However,the SERS signals would be easily influenced by the complex sample matrixes during real analytical processes,acquiring poor reproducibility.Thus,SERS technique is mostly used in qualitative or semi-quantitative analysis projects at present,and reliable SERS quantitative analysis technique still remains to be improved.With the continuous development of science and technology,an increased demand of people for more accurate surface enhanced Raman quantitative techniques is developed.Herein,the research progress of currently popular SERS quantitative analysis techniques is reviewed,including external standard methods,internal standard methods and chemometrics quantitative methods,in recent years.In addition,the development trend of SERS quantitative analysis technology is prospected in the future.
surface enhanced Raman spectroscopy(SERS);quantitative analysis technology;research progress;review
2016-06-20;
2016-08-18
国家自然科学基金项目(21275168,21475154,21475153);国家重大科学仪器设备开发专项(2011YQ0301240901);广东省自然科学基金(2015A030311020);广东省公益研究与能力建设专项(2015A030401036);广州市民生科技重大专项资助项目(201604020165)
10.3969/j.issn.1004-4957.2016.12.024
O657.3;G353.11
A
1004-4957(2016)12-1647-07
*通讯作者:张卓旻,博士,副教授,研究方向:食品安全分析,Tel:020-84110922,E-mail:zzm@mail.sysu.edu.cn 李攻科,博士,教授,研究方向:色谱光谱分析、复杂体系分离分析,Tel:020-84110922,E-mail:cesgkl@mail.sysu.edu.cn

