阳离子脂质体介导肽核酸转染K562细胞的研究
王偲颖 林靖 韩媛媛 张华 黄盛文△
(1.贵州医科大学附属贵州省人民医院检验科;2.贵州医科大学附属贵州省人民医院输血科,贵州 贵阳 550002)
·论 著·
阳离子脂质体介导肽核酸转染K562细胞的研究
王偲颖1林靖2韩媛媛1张华1黄盛文1△
(1.贵州医科大学附属贵州省人民医院检验科;2.贵州医科大学附属贵州省人民医院输血科,贵州 贵阳 550002)
目的 优化阳离子脂质体介导肽核酸(PNA)转染K562细胞的条件。方法 以阳离子脂质体lipofectamine 2000为载体,将标记有FITC荧光基团的PNA转染K562细胞,在荧光显微镜下观察并计算其转染效率,采用Cell Counting Kit(CCK-8)检测其细胞毒性。应用正交试验筛选出最佳的PNA和脂质体的用量及比例,并优化稀释用培养基血清浓度,以获得最优的转染效果。结果 以2.5×105/mL~3×105/mL的细胞密度接种,100 μL/孔的培养基中加入PNA 6.25 pmol,PNA与脂质体的体积比为1∶3.5,稀释用培养基未加胎牛血清时,细胞转染效率和细胞毒性最佳,转染效率为87.2%,细胞存活率(RGR)为94.1%。结论 PNA可通过阳离子脂质体转染进入K562细胞,优化条件后得到的细胞转染效率和细胞存活率能够满足基因表达研究的实验要求。
K562细胞; 肽核酸; 脂质体转染; 细胞毒性
β-地中海贫血(简称β地贫)是我国南方各省常见的常染色体隐性遗传病,目前尚无有效的根治方法[1]。重新激活β地贫患者体内的γ-珠蛋白基因表达,提高HbF的合成量是治疗这类疾病的重要策略[2]。PYR是一种SWI/SNF类染色质重组复合体,通过转录因子Ikaros与相应的DNA序列结合,其结合位点在δ-珠蛋白基因上游1 kb处一段250 bp长富含嘧啶碱基的序列。研究[3]表明,PYR与相应DNA序列结合在γ→β珠蛋白基因的转换过程中起重要作用。我们设想与这一序列特异性结合的肽核酸(PNA)可有效阻断γ→β珠蛋白基因的转换,使γ-珠蛋白基因持续高表达。本研究以阳离子脂质体lipofectamine 2000为载体,介导特异性设计的PNA转染K562细胞,通过优化转染条件,以期待获得相对较高的转染效率和较低的细胞毒性,为进一步研究PNA对γ-珠蛋白基因表达的影响奠定基础。
1 资料与方法
1.1 临床资料 K562细胞株购自中国科学院上海细胞生物学研究所;PNA由成都川抗派德生物技术有限公司合成;脂质体Lipofectamine 2000转染试剂购自invitrogen公司;Cell Counting Kit(CCK-8)购自东仁化学科技(上海)有限公司;胎牛血清购自浙江天杭生物技术有限公司;改良型RPMI-1640培养基购自Hyclone公司;倒置显微镜OLYMPUS-IX51-FL(OLYMPUS公司);荧光显微镜OLYMPUS-BX61(OLYMPUS公司);酶标仪MULTISKAN FC型(Thermo公司);细胞培养箱IGO150型(Thermo公司)。
1.2 PNA设计 本研究所设计的PNA序列为5’- TCCTTCTTCTCCTCCA,与PYR的DNA结合序列互补,用于阻断γ→β珠蛋白基因开关。PNA的5’端标记有FITC荧光基团。
1.3 细胞培养 K562细胞用含10%胎牛血清的改良型1640培养基培养,培养液中青霉素和链霉素各100 U/mL,于37 ℃,体积分数为5%的CO2培养箱中,在饱和湿度条件下培养,在细胞汇合率90%左右可传代或者进行转染及细胞毒性实验。
1.4 细胞转染 按照3个因素3个水平(表1)设计正交试验,共有9种不同条件的组合(F1~F9),用于筛选细胞转染的最佳的PNA和脂质体浓度及转染时间。正交实验的各实验组,在转染前将细胞用不含抗生素的改良型1640培养基洗涤重悬3次,用不含双抗的含10%胎牛血清的改良型1640培养基培养2 d。然后以2.5×105~3×105个/mL的细胞密度接种于96孔板,100 μL/孔培养24 h。分别用25 μL的含10%胎牛血清的改良型1640培养基稀释不同浓度的PNA和脂质体,3 min后将稀释的PNA和脂质体混合并孵育25 min,再将50 μL的PNA脂质体混合物加入96孔板中,分别转染24、36、48 h后在荧光显微镜下进行观察和分析,每个条件组合做5个复孔。转染成功细胞因带有FITC荧光基团呈绿色,未转染成功细胞呈蓝色。转染效率(%)=(绿色荧光细胞数/总细胞数)×100%。

表1 正交试验的因素和水平
注:*体积比,PNA母液浓度为0.05 nmol/μL。
1.5 细胞转染效率测定 转染时间到后收集各组细胞悬液10 000r/min 离心2 min,弃掉多余上清只留取200 μL上清将离心的转染细胞吹散打匀制成玻片在荧光显微镜(OLYMPUS-BX61)下观察,在物镜10×和目镜15×放大倍数DAPI系统下拍照,绿色荧光下计数荧光细胞,紫外光下计数总细胞,绿色荧光阳性的细胞占细胞总数的百分比即为转染效率,每次实验随机观察4个视野取其平均值用于转染效率的统计。
1.6 细胞毒性测定 细胞转染时设置空白调零孔和对照组。空白调零孔即铺板时不加细胞只加入100 μL培养基,在转染时不加PNA和脂质体,只加入50 μL的1640培养基;对照组即在转染时不加PNA和脂质体,只加入50 μL的1640培养基。到转染时间后,每孔按10%反应体系体积的量加入CCK-8试剂,孵育合适时间[保证测试孔吸光度值(OD值)在0.8~1.5]后,用空白调零孔进行调零,用酶标仪在450 nm处测定每孔的OD值,并根据吸光度值计算其细胞抑制率以得出其RGR值。细胞抑制率=[(对照孔OD值-实验孔OD值)/对照孔OD值]×100%,细胞存活率RGR=(1-细胞抑制率)。
1.7 稀释用培养基血清浓度的优化 在转染前将细胞用不含抗生素的1640培养基洗涤重悬3次,用不含双抗的含10%胎牛血清的改良型1640培养基培养2 d。然后以2.5×105~3×105个/mL的细胞密度接种于96孔板,100 μL/孔培养24 h。分别用25 μL的含4种不同浓度胎牛血清(分别为0%、10%、20%和30%)的改良型1640培养基稀释按正交实验结果所得最佳的PNA和脂质体浓度组合,3 min后将稀释的PNA和脂质体混合并孵育25 min,然后将50 μL的PNA脂质体混合物加入96孔板中,5 h后每孔加入50 μL胎牛血清。转染48 h后测定其转染效率和细胞毒性,筛选出转染效率高且细胞毒性低的稀释用培养基血清浓度。
1.8 统计学处理 正交表采用极差分析法计算分析,总结各因素对细胞转染效率及细胞毒性的影响,筛选出转染效率高且细胞毒性在20%以内的组合。
2 结 果
2.1 PNA和脂质体浓度及比例 PNA加入量越多,细胞转染效率越高,但细胞毒性也随之增大,转染48 h的转染效率最高(表2)。根据转染效率和细胞毒性进行综合判断,最佳的条件组合为F5 (A2B2C3),即PNA加入量为6.25 pmol/孔(PNA母液浓度为0.05 nmoL/μL),脂质体量为0.437 5 μL,PNA与脂质体的体积比为1∶3.5,转染时间为48 h。这一条件所得转染效率为57.8%,细胞抑制率为19.7%。

表2 正交实验结果
2.2 稀释用培养基血清浓度的优化结果 以正交试验所得最佳条件(A2B2C3)为基础,不同血清浓度的培养基稀释脂质体和PNA的细胞转染结果见表3。由表3可以看出,4种稀释脂质体和PNA的培养基中,不含胎牛血清的转染效率最高且毒性最小,转染效率为87.2%,细胞毒性5.9%,即RGR=94.1%。这一转染条件的荧光显微镜下细胞见图1。

表3 稀释用培养基血清浓度优化结果
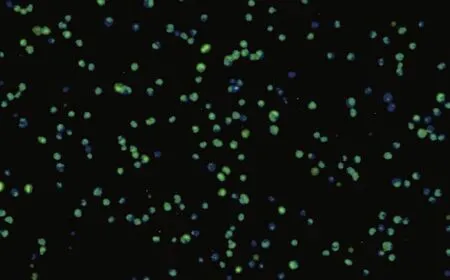
注:蓝色细胞加绿色荧光细胞为总细胞数,蓝色细胞为未转染成功细胞,绿色荧光细胞为转染成功细胞。图1 荧光显微镜转染细胞(10×15)
3 讨 论
细胞转染技术是研究特定的基因表达调控及基因治疗的重要技术之一, 选择合适的细胞转染方法对提高细胞转染率至关重要。阳离子脂质体属于无反应活性的立体稳定脂质体,能够转运DNA、RNA、核糖体及其它大电荷分子和大分子等物质进入细胞,而且转染效率也较高,因此被广泛应用于各种细胞的转染[4]。阳离子脂质体作为基因转染载体的特点是载体与目的基因以静电作用相结合,携带的外源基因容量较大,不含抗原成分,细胞毒性低,可被机体降解,可进行多次反复转染,因此是一种有临床应用潜力的基因转染载体[5]。
肽核酸(PNA)是以肽骨架取代DNA中脱氧核糖磷酸酯骨架的DNA类似物,其主链骨架是由重复的N-(2-氨基乙基)甘氨酸残基通过酰胺键连接而成,而碱基是通过亚甲基羰基连接到PNA分子的主链骨架上[6]。由于PNA生物性质稳定,不被核酸酶和蛋白酶消化降解,能以极高的序列特异性与DNA、RNA和PNA杂交形成极其稳定的二聚体或三聚体,已在基因诊断、基因治疗、癌基因研究以及反义药物等分子生物学领域有着广泛的应用[7]。介导PNA进行细胞转染的常见方法有磷酸钙沉淀法、脂质体转染法、电穿孔法、超声靶向转染法等,脂质体转染由于其高转染效率及低细胞毒性、易于优化操作等优点而在细胞转染中得到广泛应用[8-9]。基因转染过程中影响因素很多,不同细胞类型或不同细胞系所需要考虑的因素也不一样 ,在不同培养条件下的转染方法也有一定的差异[5]。本研究通过正交实验的方法探寻了转染K562细胞时肽核酸、脂质体的用量、比例和转染时间等因素。结果表明随着PNA用量增多,转染效率升高,但是细胞毒性也会随之增大;PNA和脂质体体积比为1∶3.5时转染效率和细胞毒性的综合结果最好。
考虑到稀释孵育PNA和脂质体过程中,用于稀释的培养基血清浓度会影响到PNA脂质体复合物的形成[10],为进一步提高转染效率降低细胞毒性,本研究对转染过程中的稀释用的培养基血清浓度进行了优化,最后得出用不含胎牛血清的培养基稀释孵育脂质体和PNA,在转染5 h后再加入血清(此时加入血清并加大其用量的目的是为了给转染细胞提供充足的营养,以降低其细胞毒性),最终得到较为理想的转染效率和细胞存活率(RGR),转染效率达到88.2%,RGR为94.1%,根据美国药典细胞毒性分级:RGR在80%~100%为Ⅰ级细胞,能够满足下一步的科学研究。本研究经转染条件的优化,与同类型文献报道相比,本研究所得转染效率要更高而细胞毒性则更小,所得转染效率和RGR能够满足进一步研究PNA对γ-珠蛋白基因表达影响的实验要求。
[1] 黄艳环,陆泠羽,苏国生,等. β-地中海贫血临床诊治研究进展[J].慢性性病学杂志,2014,15(8):619-622.
[2] Bank A. Regulation of human fetal hemoglobin: new players, new complexities[J].Blood,2006,107(2):435-443.
[3] Lopez RA, Schoetz S, DeAngelis K, et al. Multiple hematopoietic defects and delayed globin switching in ikaros null mice[J].Proc Natl Acad Sci USA, 2002,99(2):602-607.
[4] 杨云廷,付崇罗. 阳离子脂质体lipofectamine2000对PC12细胞转染效率的研究[J].生物技术通报,2011(5):231-235.
[5] 孙瑞琳,金发光,吾道澄,等. 多聚胺阳离子脂质体转染效率及细胞毒性的评价[J].解放军医学杂志,2006,31(4):327.
[6] 季军,潘一峰,何霞,等. 超声靶向转染c-myc基因的反义肽核酸抑制兔髂动脉平滑肌细胞增生的实验研究[J].中国现代医学杂志,2015,25(2):33.
[7] 王建华,郭泽琴. 肽核酸在分子生物学技术中的应用[J].中国生物工程杂志,2013,33(1):90-94.
[8] 张禾璇,单可人,何燕,等. 脂质体法与电穿孔法转染两种细胞效率的比较[J].重庆医学,2014,43(33):4432-4433.
[9] 段艳,王冰,崔韶辉,等. 阳离子脂质体转染 Hela 细胞的实验[J].中国组织工程研究与临床康复, 2009,13(11):2119.
[10]刘思汝,李林鲜,吴国球. 新型阳离子核酸载体的细胞转染效率研究[J].安徽医学,2014,35(12):1635.
Experimental study on peptide nucleic acid transfection into K562 cells mediated by cationic liposome
WangSiying1,LinJing2,HanYuanyuan1,ZhangHua1,HuangShengwen1.
1.DepartmentofClinicalLaboratory,AffiliatedGuizhouProvincialPeople'sHospital,GuizhouMedicialUniversity,Guiyang550002,China. 2.DepartmentofBloodTransfusion,AffiliatedGuizhouProvincialPeople'sHospital,GuizhouMedicalUniversity,Guiyang550002,China.
Objective Abstract Objective To optimize the transfection conditions for peptide nucleic acid (PNA) into K562 cells mediated by cationic liposome. Methods With the cationic liposome lipofectamine 2000 used as vector, PNAs marked by FITC fluorophore were transfected into K562 cells. Transfection efficiency was calculated according to the observation of cells under fluorescence microscope, and cytotoxicity was examined using Cell Counting Kit (CCK-8). In order to achieve the best transfection results, the dose and proportion of PNA and liposomes were optimized by orthogonal experiment, as well as the serum concentration in medium used as dilution was optimized. Results When the cells with the density of 2.5×105/mL-3×105/mL were cultured, the optimized transfection conditions were as follow: each 100 μl medium added with 6.25pmol PNA, the volume proportion of PNA to liposomes was 1∶3.5, and the medium used as dilution had no fetal bovine serum. Under these conditions, the best transfection results were achieved, with a transfection efficiency of 87.2% and a relative growth rate (RGR) of 94.1%. Conclusion PNA could be transfected into K562 cells mediated by cationic liposome. The cells transfection efficiency and RGR achieved under the optimized transfection conditions could satisfy the requirement of gene expression research.
K562 cell; Peptide nucleic acid; Liposome transfection; Cytotoxicity
贵州省优秀科技教育人才省长专项资金(黔省专合字201088号)
R394.3
A
1000-744X(2016)04-0341-03
2015-09-25)
△通信作者,E-mial:hsw713@sina.com

