基于ICC探索半夏厚朴汤加减对腰椎骨折后大鼠胃肠动力的影响及作用机制*
马朋杰刘 魏,黄杰烽,△陈伟燕郑 杨汪丽佩童培建
(1.浙江中医药大学,浙江 杭州 310053;2.浙江中医药大学附属第一医院,浙江 杭州310006)
·研究报告·
基于ICC探索半夏厚朴汤加减对腰椎骨折后大鼠胃肠动力的影响及作用机制*
马朋杰1刘 魏1,2黄杰烽1,2△陈伟燕1郑 杨2汪丽佩1童培建2
(1.浙江中医药大学,浙江 杭州 310053;2.浙江中医药大学附属第一医院,浙江 杭州310006)
目的观察半夏厚朴汤加减对腰椎骨折后大鼠胃肠动力的影响,并基于ICC探讨该方对腰椎骨折后大鼠胃肠动力影响的作用机制。方法 60只雄性SD大鼠随机分为空白组,模型组,半夏厚朴汤高、中、低剂量组以及莫沙必利组(为避免实验过程中动物死亡对实验结果的影响,每组增加2只SD大鼠,故实际操作中每组12只雄性SD大鼠,共72只SD大鼠),造模后第2天给予相对应药物灌胃(空白组、模型组予0.9%氯化钠注射液灌服),连续灌胃10 d。处死动物前予自制半固体营养糊检测大鼠胃残留率和小肠推进率,取大鼠空肠组织按免疫组化要求染色并观察其空肠的病理结构及c-kit蛋白表达。结果与空白组比较,模型组大鼠胃残留率明显升高、小肠推进率显著降低,差异具有统计学意义(P<0.05);与模型组比较,半夏厚朴汤低、中、高浓度、西药组大鼠胃残留率均明显降低、小肠推进率显著升高(P<0.05);与西药组比较,半夏厚朴汤低、中浓度组大鼠胃排空、小肠推进率差异无统计学意义(P>0.05),半夏厚朴汤高浓度组差异性显著(P<0.05)。病理切片HE染色后显示,与空白组比较,模型组大鼠空肠黏膜上皮大量坏死脱落,并伴有炎细胞浸润,而半夏厚朴汤组低、中、高3个剂量组的病理变化逐渐减轻;免疫组化结果显示,与模型组比较,空白组、西药组空肠腺体细胞高表达c-kit蛋白,半夏厚朴汤组c-kit蛋白表达亦明显增高,且呈剂量依赖性。结论半夏厚朴汤加减能促进腰椎骨折后大鼠的胃肠动力,同时促进其空肠组织恢复表达c-kit蛋白,这可能是该方调节大鼠胃肠动力的机制之一。
半夏厚朴汤加减 腰椎骨折 胃肠动力 胃残留率 小肠推进率 c-kit蛋白 SD大鼠
腰椎骨折常伴有严重的腹胀、便秘甚至恶心、呕吐等胃肠动力障碍症状,延长患者住院时间,增加患者住院费用。研究显示胃肠动力障碍可能与平滑肌网络-Caja间质细胞-胃肠神经系统的功能失调有关[1]。半夏厚朴汤原为治疗痰气郁结型“梅核气”的经典名方。《金匮·妇人杂病脉证并治》“妇人咽中如有炙脔,半夏厚朴汤主之”。近年来研究发现,半夏厚朴汤具有抗抑郁、抗焦虑等功效[2],临床上应用半夏厚朴汤治疗胃肠动力障碍获得了良好的疗效,陈少鹏等运用半夏厚朴汤加减治疗腰椎术后胃肠功能紊乱46例,其总有效率为95.6%[3];刘魏等运用半夏厚朴汤加减治疗腰椎骨折术后胃肠功能障碍30例,其总有效率达90%,显效率为70%[4]。现将半夏厚朴汤加减应用于腰椎骨折大鼠模型来进一步研究其对腰椎骨折大鼠的胃肠动力影响,并通过比较各组大鼠空肠c-kit蛋白表达探讨该方的作用机制。现报告如下。
1 材料与方法
1.1 实验动物 雄性SD大鼠72只,体质量200~250 g,由浙江中医药大学动物实验中心提供,动物许可证号SYXK(浙)2016-0009,动物观察室温度(25± 1)℃,相对湿度(60±10)%。适应性喂养驯化1周后进行实验。
1.2 试药与仪器 半夏厚朴汤加减由浙江中医药大学中医门诊部提供药材。半夏厚朴汤加减由半夏∶厚朴∶茯苓∶干姜∶苏梗∶枳壳∶炒白术∶生军∶炙甘草=2∶2∶2∶2∶3∶2∶2∶1∶1组成,将中药饮片置煎煮容器中,加相当药材量5倍冷水浸2 h,强火煮沸后文火煎 30 min,过滤。药渣加2倍量水继续煎煮,煮沸20 min过滤。合并2次滤液,浓缩成30 g/L(低浓度),60 g/L(中浓度),100 g/L(高浓度)的浓度。枸橼酸莫沙必利片(由山西亚宝药业太原制药有限公司生产,国药准字H20090158)。半固体营养糊标记物(取羧甲基纤维素5 g溶于125 mL蒸馏水中,后分别加入奶粉8 g,白糖、淀粉各4 g,活性炭末 2 g,搅拌均匀后配制成约150 mL(约1 g/mL)黑色半固体糊状物)。采用RM2128型切片机(德国Leica公司);XSP-300型双目显微镜 (上海蔡康光学仪器有限公司)。
1.3 分组与造模 为避免给药时刺激所致的应激影响,于实验前3 d始,每日用灌胃针驯化处理2次,造模前12 h开始禁食,2 h前禁水。用10%水合氯醛,以3 mL/kg行腹腔内注射麻醉,待麻醉起效后,于右侧腹部及腰背部剪毛备皮3 cm×6 cm。实验大鼠取左侧卧位,通过大鼠脊柱下段两侧可触及的一对钝形突起髋结节,其正对腰6椎体,上数一节椎体定位大鼠腰5椎体的位置,依次往上标记笔标记L5,L4,L3椎体,碘伏消毒3遍,铺巾。取右腹后外侧纵行切口长约2 cm,腹外斜肌与背肌之间切开,钝性分离椎前软组织,腹膜外入路到达椎体右前外侧方,注意不要损伤到腹膜及腹腔组织,暴露L4、L5椎体。咬除该两腰椎的右侧横突,并用自制限深克氏针分别多点穿刺破坏L4、L5椎体及克氏针倾斜45°经L4/5间盘钻入L4椎体下终板,破坏L4/ 5髓核及椎间盘组织,穿刺深度约2.3 mm,不要损伤到脊髓。术毕,逐层缝合肌肉层、皮下、皮肤。电烤灯正对麻醉状态中的大鼠照射,保温待其完全苏醒,放回鼠笼子饲养。72只SD雄性大鼠进行随机化分组:即正常组、模型组、枸橼酸莫沙比利组、半夏厚朴汤低、中、高剂量组,每组12只(为避免实验过程中动物死亡对试验结果的影响,相对于试验设计每组实际操作中增加了2只SD大鼠)。造模后第2日开始给予灌胃,正常组和模型组给予灌服生理盐水,低剂量组给予灌服30 g/L的半夏厚朴汤加减,中剂量组给予灌服60 g/L的半夏厚朴汤加减,高剂量组给予灌服100 g/L的半夏厚朴汤加减,西药组给予莫沙必利0.15 g/L,各组灌服剂量均为20 mL/kg,每日灌服2次 (早晨10∶00及16∶00),连续灌胃10 d。
1.4 观察指标 1)大鼠胃内残留率、小肠推进率的测定,最后1次灌胃给药后,所有大鼠禁食不禁水24 h。随后给予半固体营养糊标记物2 mL灌服。30 min后每组选取10只SD大鼠脱颈椎处死,迅速剖开腹腔,将大鼠的胃贲门和幽门部两端分别结扎,清除胃表面的血渍并称取胃的质量,将胃体剪开(沿胃大弯),将胃内残留物洗净,滤纸拭干称质量,此即胃净质量,用胃全质量减去胃净质量即得胃内残留物的质量,计算胃内残留率。胃残留率(%)=[(胃全质量-胃净质量)/半固体营养糊标记物质量]×100%。然后将幽门至回盲部的肠管一段取出,用直尺测量其长度,此即小肠的总长度(cm),然后测出半固体营养糊标记物推进长度,即幽门部到半固体营养糊标记物前沿的长度(cm),计算出小肠推进率。小肠推进率(%)=[营养糊推进长度(cm)/小肠总长度(cm)]×100%。2)大鼠空肠组织病理学观察大鼠胃内残留率、小肠推进率的测定完成后,剪取大鼠一段空肠组织放入10%中性甲醛溶液中预固定组织,HE染色观察大鼠空肠组织病理学改变情况。3)大鼠空肠组织c-kit蛋白表达的比较大鼠胃内残留率、小肠推进率的测定完成后,剪取大鼠空肠组织一小块,免疫组化法比较c-kit蛋白的表达。
1.5 统计学处理 应用SPSS17.0统计软件处理。计量资料以(s)表示,采用配对t检验。P<0.05为差异有统计学意义。
2 结 果
实验过程中西药组SD大鼠,死亡2只;中浓度组死亡1只;(灌胃过程中导致大鼠肺水肿死亡)由于各组实验中大鼠数量相对于实验设计额外增加2只,故对实验结果无影响。
2.1 半夏厚朴汤加减对SD大鼠胃排空、小肠推进率的影响 见表1。与空白组比较,模型组大鼠胃残留率明显升高、小肠推进率显著降低(P<0.05);与模型组比较,半夏厚朴汤低、中、高浓度、西药组大鼠胃残留率均明显降低、小肠推进率显著升高(P<0.05);与西药组比较,半夏厚朴汤低、中组大鼠胃排空、小肠推进率差异无统计学意义,高浓度组差异有统计学意义(P< 0.05)。
表1 各组大鼠胃排空、小肠推进率比较(%,s)
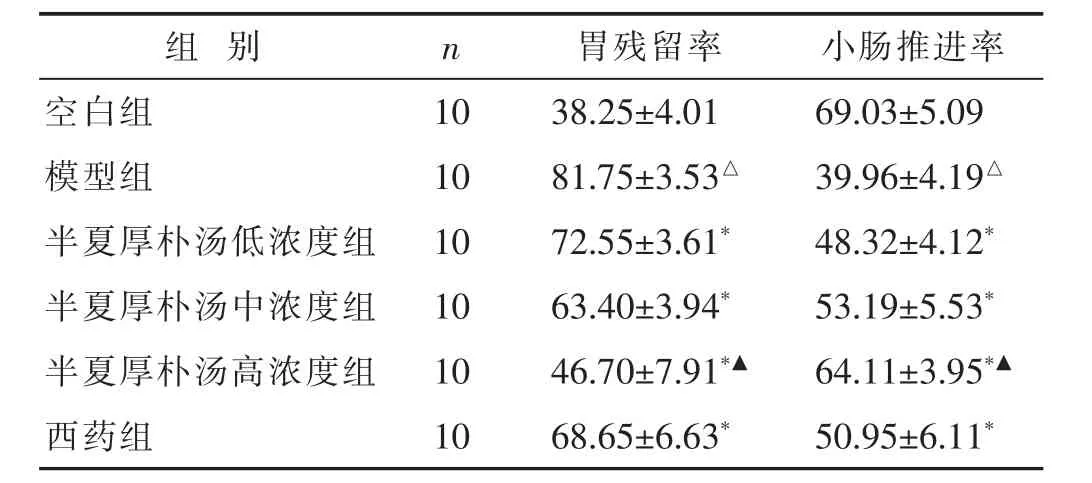
表1 各组大鼠胃排空、小肠推进率比较(%,s)
与空白组比较,△P<0.05,△△P<0.01;与模型组比较,,*P<0.05,**P<0.01;与西药组比较,▲P<0.05,▲P<0.01。
组别 n 胃残留率 小肠推进率空白组 10 38.25±4.01 69.03±5.09模型组 10 81.75±3.53△39.96±4.19△半夏厚朴汤低浓度组 10 72.55±3.61*48.32±4.12*半夏厚朴汤中浓度组 10 63.40±3.94*53.19±5.53*半夏厚朴汤高浓度组 10 46.70±7.91*▲64.11±3.95*▲西药组 10 68.65±6.63*50.95±6.11*
2.2 大鼠空肠组织的病理学观察 见图1。病理HE染色结果显示,空白组空肠组织黏膜上皮完整,无炎细胞浸润;模型组大鼠空肠黏膜上皮出现大量变性坏死脱落,并伴有大量炎细胞浸润;而经西药组治疗后,肠黏膜上皮坏死脱落现象减轻,炎细胞浸润减少;经半夏厚朴汤组低、中、高剂量组治疗后的空肠黏膜上皮变性坏死脱落及炎细胞浸润现象亦逐渐减轻,并随剂量增加,改善愈明显,呈剂量依赖性。

图1 半夏厚朴汤对空肠的作用(HE染色,100倍)
2.3 大鼠空肠组织c-kit蛋白表达的比较 见图2。免疫组化结果显示,空白组大鼠空肠组织腺体胞浆内出现大量棕黄色颗粒,提示其高表达c-kit蛋白;模型组大鼠空肠组织未见或少见棕黄色颗粒样物质,提示其几乎不表达c-kit蛋白;经西药组治疗后的大鼠空肠组织腺体细胞亦表达大量棕黄色颗粒,提示西药组高表达c-kit蛋白;而经半夏厚朴汤低、中、高剂量组治疗后的大鼠空肠组织重新出现棕黄色颗粒样物质,且随着剂量增加,表达逐渐增加,提示半夏厚朴汤可恢复空肠组织中c-kit蛋白的表达,且呈剂量依赖性。

图2 半夏厚朴汤对空肠中c-kit蛋白表达的影响(HE染色,100倍)
3 讨 论
腰椎骨折后,围手术期前后常伴有胃肠动力障碍,其临床常表现为严重的腹胀、便秘甚至恶心、呕吐等症状,增加医疗负担。其发病机制可能是创伤激活抑制性交感神经反射系统,使胃肠交感神经系统活动增强,并通过抑制胃肠神经丛的兴奋性神经元抑制胃肠动[5];创伤后应激反应导致血糖升高,高血糖高对胃肠动力有抑制作用,且呈正相关[6];创伤后长期卧床以及患者的焦虑紧张情绪皆会对胃肠动力产生不利的影响[7],术中麻醉会对患者的胃肠动力产生抑制作用,研究表明影响麻醉对胃肠动力抑制的因素包括麻醉方式和药物的选择[8]。
Cajal间质细胞(ICC)是西班牙神经解剖学家Cajal于1893年首先发现的存在于胃肠道的一种特殊间质细胞,分布于整个胃肠道。其后大量研究证实ICC是胃肠道的起搏细胞,具有产生自发电信号、传导慢波电位、调节神经递质等功能[9]。许多研究证实了ICC数量的减少、形态和网状结构改变与胃肠动力障碍密切相关[10-11],同时大量研究表明ICC可以成为许多胃肠动力性疾病治疗的靶向目标[12-13]。一些以ICC为靶向的药物已应用于临床,以中药牵牛种子和延胡索块茎合成的促胃动力剂DA-9701,可以通过激活ICC的起搏活性加速胃排空速率,且其促进胃肠动力的效果强于莫沙必利和西沙必利[14-15]。
c-kit是胃肠道ICC表面的一种特异性受体蛋白[16],现在常用c-kit免疫组织化学法特异性地检测ICC[17]。本实验以ICC为基础,重在探讨半夏厚朴汤加减对腰椎骨折后大鼠胃肠动力的影响及其作用机制。
实验结果显示半夏厚朴汤加减能降低腰椎骨折后大鼠胃残留率,提高其小肠推进率,且半夏厚朴汤高浓度组较西药组更具有优越性;该方可恢复腰椎骨折后大鼠空肠组织中c-kit蛋白的表达,且呈剂量依赖性。综上所述,本实验证实了半夏厚朴加减能促进腰椎骨折后大鼠胃肠运动,增强胃肠排空能力;同时实验表明半夏厚朴汤加减能恢复腰椎骨折后大鼠空肠组织ckit蛋白表达,即该方能恢复腰椎骨折后大鼠ICC的活性,这是该方促进胃肠动力的作用机制之一。
[1] Chen ZW,Ding ZQ,Zhai WL,et al.Anterior versus posterior approach in the treatment of chronic thoracolumbar fractures[J].Orthopedics,2012,35(2):219-224.
[2] YI Li-Tao,WANG Xing,WANG Yu,et al.Antidepressantlike effects of monarch drug compatibility in banxiaHoupu decoction[J].Chinese Journalof Natural Medicines,2010,8(5):362-369.
[3] 陈少鹏,赵凯,郑扬.半夏厚朴汤加减治疗腰椎手术后胃肠功能紊乱46例临床观察[J].甘肃中医学院学报,2014,31(4):41-42.
[4] 刘魏,黄杰烽,郑杨,等.半夏厚朴汤加减治疗腰椎骨折术后胃肠功能障碍30例的疗效观察[J].中国中医骨伤科杂志,2016,24(8):37-39.
[5] Barnatan M,Larson GM,Stephens G,et al.Delayed gastric emptying after gastricsurgery[J].Am J Surg,1996,172(1):24-28.
[6] Lshiguchi T,Tada H,Nakagawa K,et al.Hyperglycemia impairs antro-pyloric coordination and delays gastric emptying inconscious rats[J].Auton Neurosci,2002,95(1-2):112-121.
[7] 李勇,贺丹军,魏睦新.功能性消化不良与精神心理因素的相关性及中药的干预作用[J].世界华人消化杂志,2012,20(32):3081-3086.
[8] Rawlinson A,Kitchingham N,Hart C,et al.Mechanisms of reducing postoperative pain,nausea and vomiting:a systematic review of current techniques[J].Evidence-based medicine,2012,17(3):75-80.
[9] 李泽培,邱野,彭燕.Cajal间质细胞与胃肠动力关系的研究进展[J].胃肠病学和肝病学杂志,2014,23(9):983-986.
[10]Lammers WJ,Al-Bloushi HM,Al-Eisaei SA.Slow wave propagation and plasticity of interstitial cells of Cajal in the small intestine of diabetic rats[J].Exp Physiol,2011,96(10):1039-1048.
[11]Gfroerer S,Rolle U.Interstitial cells of Cajal in the normal human gut and in hirschsprungdisease[J].Pediatr Surg Int,2013,29(9):889-897.
[12]Farrugia G.Interstitial cells of Cajal in health and disease[J]. Neu-rogastroenterol Motil,2008,20 Suppl 1:54-63.
[13]Huizinga JD,Thuneberg L,Vanderwinden JM,et al.Interstitial cells of Cajal as targets for pharmacological intervention in gastrointestinal motor disorders[J].Trends Pharmacol Sci,1997,18(10):393-403.
[14]Choi S,Choi JJ,Jun JY,et al.Induction of pacemaker currents by DA-9701,a prokinetic agent,in interstitial cells of Cajal from murine small intestine[J].Mol Cells,2009,27(3):307-312.
[15]Lee TH,Choi JJ,Kim DH,et al.Gastroprokinetic effects of DA-9701,a new prokinetic agent formulated with pharbitis semen and corydalis tuber[J].Phytomedicine,2008,15(10):836-843.
[16]Wu B,Liu L,Gao HY,et al.Distribution of interstitial cells of Cajal in merionesunguiculatus and alterations in the development of incomplete intestinal obstruction[J].Histol Histopathol,2013,28(12):1557-1575.
[17]Sanders KM,Ward SM.Interstitial cells of Cajal:a new perpective on smooth muscle function[J].J Physiol,2006,576(pt3):721-726.
ICC-based Exploration on the Effect of Banxia Houpu Decoction on Gastrointestinal Motility in Rats af-ter Lumbar Fracture and Its Mechanism
MA Pengjie,LIU Wei,HUANG Jiefeng,et al. Zhejiang Chinese Medical University,Zhejiang,Hangzhou 310053,China.
Objective:To observe the impact of Banxia Houpu decoction on gastrointestinal motility in rats after vertebral fracture through animal experiments and to make ICC-based investigation into the mechanism of action of the dynamic effects of Banxia Houpu decoction on gastrointestinal motility in rats after vertebral fracture.Methods:60 male SD rats were randomly divided into control group,model group,Banxia Houpu decoction high,medium and low dose group and mosapride group(to avoid the effect of SD rats dying on the test results,two more SD rats were put into each group,so in the actual operation,there were 12 male SD rats in each group and the total was 72 SD rats).On the next day after model establishment,corresponding drugs were given orally(control group,model group were fed with normal saline),the gavage lasted for continuous 10 days.The animals were sacrificed after self-made semi-solid nutritional paste was used to detect rats’gastric residual rate and intestinal propulsive rate.Tissues from rat jejunum were extracted and stained by immunohistochemical staining.The pathological structure of jejunum and its c-kit protein expression were observed.Results:Compared with the control group,rats’gastric residual rate was significantly higher,intestinal propulsive rate was significantly lower in the model group and the difference was statistically significant(P<0.05).Compared with the model group,low density,medium density,high density,western medicine group rats’gastric residual rate decreased and intestinalpropulsion rate increased significantly,with a significant difference(P<0.05).There was no significant difference on gastric emptying and intestinal propulsive rate of low concentration group and medium concentration group compared with western medicine group,the difference was not statistically significant(P>0.05).The difference with the high concentration group was significant(P<0.05).Pathological HE staining showed that compared with the control group,lots of necrosis happened to rats’jejunal mucosal epithelia in the model group,accompanied by inflammatory cell infiltration.Among the low dose,medium dose and high dose Banxia Houpu groups,the pathological changes gradually reduced.IHC results showed that compared with the model group,the jejunum gland cell protein expression of c-kit increased in the control group and western medicine group.The histone expression of c-kit had also significantly increased in a dose-dependent manner in the Banxia Houpu groups.Conclusion:Banxia Houpu decoction can promote gastrointestinal motility of rats after fracture,while promoting the expression of c-kit in its jejunal tissue,which may be one of the mechanisms that regulate gastrointestinal motility in rats.
Banxia Houpu decoction;Lumbar fracture;Gastrointestinal motility;Gastric residual rate;Intestinal propulsive rate;C-kit protein;SD rats
R285
A
1004-745X(2016)12-2209-04
10.3969/j.issn.1004-745X.2016.12.001
2016-08-17)
国家自然科学基金资助项目(No.81403223);浙江省自然科学基金项目(No.LQ14H290003);浙江省中医药科技计划科研基金项目(No.2016ZA078)
△通信作者(电子邮箱:40983285@qq.com)

