抑制性Smads在肝纤维化发生发展中的表达变化
李建勋 李艳 何阳
(1. 武警贵州省总队离职干部休养所,贵州 贵阳 550002;2.贵阳市公共卫生救治中心,贵州 贵阳 550002;3.贵阳市第一人民医院,贵州 贵阳 550001)
·论 著·
抑制性Smads在肝纤维化发生发展中的表达变化
李建勋1李艳2何阳3
(1. 武警贵州省总队离职干部休养所,贵州 贵阳 550002;2.贵阳市公共卫生救治中心,贵州 贵阳 550002;3.贵阳市第一人民医院,贵州 贵阳 550001)
目的 观察抑制性Smads(Smad 6, Smad 7)在肝纤维化大鼠肝脏中的表达变化并探讨它们在肝纤维化发生发展中可能的作用。 方法 选取Wistar大鼠20只,随机分为正常组和肝纤维化模型组,每组各10只。通过皮下注射40% CCl4植物油溶液制备肝纤维化动物模型,注射剂量为0.4 mL/100 g体质量,每周注射2次,造模时间总计为12周。采用Western Blot检测肝脏中Smad 6及Smad 7蛋白的表达变化;采用PCR技术检测肝脏中Smad 6及Smad 7 mRNA的改变。结果 Western Blot检测显示,与正常组大鼠比较,模型组大鼠肝脏中Smad 6及Smad 7蛋白的表达显著减少;同时PCR检测发现模型组大鼠肝脏中Smad 6及Smad 7 mRNA的表达也较正常组大鼠明显降低。结论 肝纤维化过程中抑制性Smads在基因及蛋白水平表达下调可能是促进肝纤维化发生发展的一个重要因素。
肝纤维化; Smad 6; Smad 7; 大鼠
肝纤维化是众多慢性肝病患者共有的病理变化,在各种病因所致慢性肝损伤的过程中,可通过激活肝星状细胞产生大量以Ⅰ、Ⅲ型胶原为主的细胞外基质,从而形成肝纤维化[1]。Smads蛋白家族属于细胞内信号转导蛋白,在哺乳类动物组织中共发现10 种不同的Smads蛋白[2],这些Smads蛋白可根据其功能不同分为3 个亚族,分别是R-Smad、Co-Smad 和I-Smad,其中Smad 6 及Smad 7 属于I-Smad[3]。本研究拟用CCl4复制大鼠肝纤维化动物模型,观察各组大鼠肝组织中抑制性Smads(Smad 6,Smad 7)的表达变化,并探讨它们在肝纤维化发生发展中可能的作用。
1 材料和方法
1.1 实验试剂 (1)大鼠多克隆Smad 6,Smad 7抗体购自武汉博士德公司;(2)甘氨酸、丙烯酰胺、三羟甲基氨基甲烷、过硫酸铵、十二烷基硫酸钠购自北京鼎国公司;(3)ECL化学发光试剂由碧云天生物技术有限公司提供;(4)PVDF膜购自美国Millipore公司;(5)SYBR Green及逆转录试剂盒购自美国Invitrogen公司;(6)引物委托大连宝生物公司设计合成。引物序列如下:Smad 6:上游引物5’-AAAGACGCACTTTTGGCTTA 3’,下游引物5’-CGAATACTTTTATTATCGAGTGACTG 3’;Smad 7:上游引物5’-TGTCCACAGGCTTCTGAG 3’,下游引物5’-TCTCTCAAAGCACTACAATGC 3’。
1.2 动物模型 雄性Wistar大鼠20只,体质量150~160 g,实验动物随机分为两组:正常组及肝纤维化模型组(模型组),每组各10只。经皮下注射40% CCl4花生油溶液制备肝纤维化大鼠模型,注射剂量为0.4 mL/100 g,每周注射2次;正常组大鼠则注射等量花生油溶液。于12周末处死大鼠,取每只大鼠相同部位的肝组织固定于4%中性甲醛溶液中,剩余肝组织保存于-80 ℃低温冰箱中以备进行Western Blot及PCR检测。
1.3 实验指标检测 肝脏切片经HE染色后在光学显微镜下观察病理学变化。Western blot 检测肝脏中Smad 6,Smad 7蛋白表达,提取肝脏总蛋白并进行蛋白定量,经聚丙烯酰胺凝胶电泳分离蛋白质,随后将蛋白质转印到PVDF膜上,之后将PVDF膜置于封闭缓冲液中室温下封闭1 h。封闭完成后将PVDF膜与一抗稀释液(Smad 6按1∶500稀释,Smad 7按1∶1 000稀释)4 ℃封闭过夜。次日早上将PVDF膜与二抗稀释液(1∶2 000)在室温下孵育2 h,洗膜缓冲液洗膜3次后加入化学发光试剂,室温反应1 min后暗室中进行曝光。Real-time PCR 检测肝脏中Smad 6,Smad 7 mRNA表达 提取肝组织总RNA并定量,逆转录合成cDNA,以cDNA为模板进行PCR 反应,反应条件为95 ℃ 30 s,95 ℃ 5 s,60 ℃ 1 min,最后两步重复40个循环。
2 结 果
2.1 肝脏病理改变 正常大鼠肝脏结构正常,肝小叶结构清晰,无炎症细胞浸润及胶原纤维增生;模型组大鼠肝脏内胶原纤维增生明显增多,增多的胶原纤维重新包绕、分割肝组织,有假小叶形成。各组大鼠肝脏病理改变见图1。
2.2 肝脏中Smad 6,Smad 7蛋白表达 正常大鼠肝脏内可见Smad 6,Smad 7蛋白表达;模型组大鼠肝脏中Smad 6,Smad 7蛋白的表达较正常组大鼠显著减少,差异具有显著性。大鼠肝脏中Smad 6,Smad 7蛋白表达见表1、图2。
2.3 肝脏中Smad 6,Smad 7 mRNA表达 与正常组大鼠比较,模型组大鼠肝脏中Smad 6,Smad 7 mRNA的表达较正常组大鼠显著减少,差异具有显著性。各组大鼠肝脏中Smad 6,Smad 7 mRNA表达见表1。
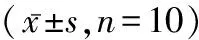
表1 大鼠肝脏中Smad 6,Smad 7蛋白及 mRNA表达
注: 与正常组比较,▲P<0.01;与正常组比较,△P<0.05。
3 讨 论
肝纤维化是在持续存在的肝损伤病因作用下,肝组织发生修复时细胞外基质合成与降解失衡而引起的一种病理改变[4]。大量研究证实TGF-β表达持续增高与肝纤维化发生发展密切相关[5-6],而Smads蛋白家族是TGF-β细胞内信号转导过程中极为重要的信号分子[7-8]。研究证实,TGF-β的二聚配体与细胞膜表面的Ⅰ型受体结合使其活化,活化后的Ⅰ型受体进一步使Smads家族中的受体型Smads(Smad 2/3)发生磷酸化,并与胞浆内的Smad 4形成复合体,该复合体可从细胞浆转移到细胞核,从而调节下游靶基因的转录[9]。而研究发现Smads家族中的抑制性Smads(Smad 6, Smad 7)可抑制Smad 2/3/4复合体转移至细胞核,从而阻断TGF-β的信号转导,发挥抗纤维化的作用[10]。而抑制性Smads在肝纤维化大鼠肝脏中的表达变化及作用目前尚不十分清楚。
本次研究发现,模型组大鼠肝小叶结构破坏,肝组织内纤维结缔组织大量增生,纤维化程度较正常组大鼠显著增加。同时,本研究还观察到模型组大鼠肝脏中Smad 6及Smad 7 mRNA表达较正常组大鼠显著减少;此外,肝纤维化大鼠肝脏中Smad 6及Smad 7蛋白的表达也较正常大鼠显著降低,这一变化趋势与Smad 6及Smad 7基因的变化趋势一致。由于Smad 6及Smad 7属于Smads家族中的抑制性Smads,正常情况下它们可拮抗受体激活的Smads蛋白(Smad 2/3)介导的信号转导,从而形成控制TGF-β致纤维化效应的负反馈机制。而肝纤维化时尤其是肝纤维化晚期,由于Smad 6及Smad 7在基因及蛋白水平的表达均显著下调,使得其对TGF-β/Smad 2/3信号转导通路的抑制作用减弱,因此肝组织细胞在TGF-β/Smad2 /3信号转导通路的调控下,导致下游促纤维化的细胞因子及细胞外基质成分如Ⅰ/Ⅲ型胶原等基因大量转录合成,从而进一步促进了肝纤维化的发生和发展。
(本文图1,图2见封三)
[1] 李娜,祝聪聪,肖永红,等. PI3K抑制剂对四氯化碳刺激的肝星状细胞增殖和Ⅰ型胶原表达的影响[J]. 西安交通大学学报(医学版),2013,34(2):164-167.
[2] 唐静,戴立里,呙琳琳,等. 肝纤维化中丹参素对TGFβ1/Smads/ERK信号通路的影响及其相互关系[J]. 第三军医大学学报,2011,33(11):1159-1164.
[3] 庞莉,王晶,蒋延文.Smad蛋白研究进展[J]. 中国医学创新,2013,10(12):155-159.
[4] Huang XP, Wang X, Lv YH, et al. Protection effect of Kallistatin on carbon tetrachloride-induced liver fibrosis in rats via antioxidative stress[J]. Plos One,2014, 9(2): e88498.
[5] 郭锐芳,杨少奇.以TGF-β为靶点的抗肝纤维化治疗[J]. 实用肝脏病杂志,2008,11(5):341-343.
[6] 周明玉,程明亮.TGFβ1刺激肝星状细胞的活化与肝纤维化的研究进展[J]. 贵州医药,2008,32(8):751-753.
[7] 陈桂敏,梁振钰,高湲芪,等. 芪蚣抗纤方对免疫损伤性肝纤维化大鼠TGF-β1/Smads信号通路影响[J]. 中华中医药杂志,2011,18(8):1865-1867.
[8] 陈桂敏,王少贤.肝纤维化TGF-β1/smad信号通路中医药研究进展[J]. 海南医学院学报,2010,16(6):810-812.
[9] 郑素军,邢欣悦,武聚山,等. Smad3 shRNA抑制TGFβ1对HSC-T6细胞活化的抗肝纤维化作用[J]. 临床肝胆病杂志,2012,28(4):289-295.
[10] 严晓华,章隽宇,陈晔光.抑制性Smad蛋白对TGF-β超家族信号转导的调控及其生理意义[J]. 中国细胞生物学学报,2009,31(2):135-144.
Expression change for the occurrence and development of inhibitory Smads in hepatic fibrosis
LiJianxun1,LiYan2,HeYang3.
1.CadreRetreatSanatoriumofGuizhouProvincialArmedPoliceCorps,Guiyang550002,China. 2.GuiyangCityPublicHealthCenter,Guiyang550002,China. 3.TheFirstPeople'sHospitalofGuiyangCity,Guiyang550002,China
Objective To observe the change of inhibitory Smads(Smad 6, Smad 7)during liver fibrosis and to explore their effects on hepatic fibrosis. Methods Twenty Wistar rats were randomly divided into normal control group and 12 weeks liver fibrosis group. Liver fibrosis model was induced by hypodermic injection of 40% CCl4,the dosage of CCl4 is 0.3ml/100g body weight. Protein of Smad 6 and Smad 7 were detected by western blot (WB), and mRNA of Smad 6 and Smad 7 were detected by real-time PCR. Results Compared with normal control group, the levels of Smad 6 and Smad 7 protein in 12 weeks liver fibrosis group were decreased. Meanwhile, the levels of Smad 6, Smad 7 mRNA in 12 weeks liver fibrosis groups were decreased. Conclusion Down regulation of inhibitory Smads at gene and protein level may promote the development of liver fibrosis.
Hepatic fibrosis; Smad 6; Smad 7; Rat
R363
A
1000-744X(2016)05-0451-02
2015-12-18)

