邻苯二胺/β-环糊精/银-碳纳米管修饰电极测定玛卡中腺嘌呤的含量
申 远,张书娟,李 洲,丁坤飞,何香香,申贵隽,*
(1. 大连大学 人才建设办公室,辽宁 大连 116622;2. 大连大学 医学院,辽宁 大连 116622;3. 大连大学 环境与化学工程学院,辽宁 大连 116622)
玛卡(Maca)属于十字花科植物玛卡独行菜(Lepi-diummeyeniiWalp),是一年生草本植物,地上部分平铺在地面,地下部分为萝卜状块茎,长约10~14 cm,宽约3~5 cm[1]。玛卡是一种非常独特的高原农作物,含有丰富的营养成分,研究认为玛卡有改善性功能、提高生育力、增强体力、抗疲劳、调节内分泌、延缓衰老、减轻压力、缓解焦虑、抑制癌变、抗肿瘤等功效。在我国,玛卡没有被归为药类,也没有相关依据批准其作为药品使用,仅有卫生部2011年第13号公号批准玛卡粉可作为新资源食品。目前在国内,玛卡是以玛卡粉和玛卡提取物的形式较为广泛地应用于食品、保健食品等领域,由于营养成分丰富而且无任何毒副作用,近年来以玛卡为主要原料生产的各类保健品已得到越来越多消费者的青睐[2-8]。
玛咖的生理活性与其化学组成有着密切的关系,其中蛋白质和生物碱被认为是玛咖的主要功效成分。其中腺嘌呤等生物碱基是其抗疲劳、抗衰老活性的主要成分之一。腺嘌呤也是生命体中构成DNA和RNA的几种基本碱基之一,在生命过程中发挥着重要作用,与各种生物体有紧密的关系[9]。其与磷酸的结合物有刺激白细胞增生的作用,目前常用于腺嘌呤测定的有色谱法、光度法、质谱法等方法[10-12]。然而这些方法有的设备价格高、操作过程复杂、耗时长,有的精确度低不能满足检测的要求。电化学方法用于物质的检测具有操作简便、灵敏度高、选择性好、成本低廉等优点[13-14]。可以为玛卡中腺嘌呤的含量测定提供一种新的途径。
本研究旨在采用多种修饰材料对玻碳电极进行处理,以期获得电信号响应强,稳定性好的修饰电极,并运用修饰后的电极对腺嘌呤的电化学行为进行研究。探讨合适的实验条件,以建立一种测定腺嘌呤含量的电化学方法,使其能用于玛卡中腺嘌呤含量的测定,并为玛卡的质量检测和开发利用提供参考。
1 实验部分
1.1 仪器与试剂
CS300电化学工作站(武汉科思特仪器有限公司);QT2060超声波清洗仪(天津市瑞普电子有限公司);Sartorius数字式酸度计(北京赛多利斯仪器公司);离心沉淀机 80-1型(上海机械手术厂);三电极系统:玻碳电极(GCE)(天津艾达恒晟科技发展有限公司),参比电极为Ag/AgCl电极(上海纳锘实业有限公司),对电极为铂电极(天津艾达恒晟科技发展有限公司)。
多壁碳纳米管(MWNT)(中科院成都有机所)、β-环糊精(β-CD)、邻苯二胺(o-PD)(天津市科密欧化学试剂开发中心);腺嘌呤(国药集团化学试剂有限公司);西藏玛卡(由大连大学弓晓杰教授提供并鉴定);磷酸盐缓冲溶液(PBS)。所有试剂均为分析纯;实验用水为二次蒸馏水。
1.2 溶液的配制
1.2.1 缓冲溶液
取35.8 g Na2HPO4,15.6 g NaH2PO4分别溶于1 L水中,取Na2HPO4620 mL,NaH2PO4380 mL混合,用NaOH调节pH,Sartorius数字式酸度计测定,调至pH=7.0,即得0.1 mol/L,pH=7.0的PBS缓冲溶液,转移到容量瓶中,冷藏备用。
1.2.2 对照品标准溶液
腺嘌呤标准溶液,称取0.014 g腺嘌呤标准品于烧杯中,用pH=7.0的PBS溶解,转移到容量瓶中定容至50 mL,贴上标签备用。
1.2.3 样品溶液
取玛卡原生植物样品,粉碎,过筛(40目),得到玛卡粉末。取5 g玛卡粉末,用150 mL丙酮在90℃条件下索氏提取,得到30 mL提取液。经旋转蒸发仪浓缩到10 mL左右,过0.45 um微孔滤膜,用pH=7的PBS缓冲溶液配成50 mL,冷藏备用。
1.2.4 邻苯二胺溶液
称取0.060 g邻苯二胺于温水中溶解,待全部溶解后,转移到50 mL容量瓶中定容,贴上标签备用。
1.2.5 β-环糊精溶液
取一定量的β-环糊精固体,于室温下达到饱和状态,贴上标签备用。
1.3 玻碳电极的活化处理
将GCE在金相砂纸(3000#)上打磨,然后在麂皮上依次用1.0、0.3、0.05 um的α-氧化铝粉末抛光,最后依次用无水乙醇和水各超声清洗3 min。将处理后的GCE置0.5 mol/L的H2SO4溶液中,以100 mV/s扫描速度,在-0.2~+0.6V电位区间用循环伏安法(CV)扫描至稳定[15]。将电极取出用水冲洗干净后,保存在水中,备用[16-17]。
1.4 邻苯二胺/β-环糊精/Ag-碳纳米管修饰电极的制备
将处理后的 GCE置于 10 mL铁氰化钾(5 mmol/L)中,以100 mV/s的扫描速度,在-0.2~+0.6 V电位区间用循环伏安法(CV)扫描至稳定。将电极取出用水冲洗干净后,在红外灯下干燥。然后以该GCE为基体电极,依次在 10 mL邻苯二胺(1.00 mol/L),10 mLβ-环糊精(5 mmol/L)中,溶液静置条件下。在上述电化学条件下,通过CV扫描20圈至CV曲线稳定,然后取出电极,在红外灯下干燥。
采用 V(HNO3):V(HCl)=1:3回流 12 h的方法将MWNTs羧基化,用NaOH(0.01 mol/L)洗至pH至接近中性时为止,离心后干燥。称取5.0 mg预处理过的MWNTs于5.0 mLDMF(N,N-二甲基甲酰胺)中超声分散30 min,最后得到稳定的黑色分散液[18]。称取7 mgMWNT于10 mLAgNO3(0.1 mg/mL)中混合,将上述修饰后的GCE放入此混合溶液中,超声5~10 min,在上述电化学环境下扫描10圈,然后取出电极,在红外灯下烘干即得 o-PD/β-CD/Ag-MWNTs/GCE,放在PBS缓冲溶液中保存,备用[19]。
1.5 电化学测试方法
电化学测试都是在三电极体系下完成,工作电极是 o-PD/β-CD/Ag-MWNTs/GCE电极,参比电极为Ag/AgCl电极,辅助电极是铂电极。
循环伏安(CV)测量的相关参数设置:扫速100 mV/s,在-0.2~+0.6 V电位区间。
2 结果与讨论
2.1 电聚合膜的循环伏安法表征
依次用裸玻碳电极、o-PD/β-CD/GCE、o-PD/β-CD/Ag-MWNTs/GCE 5 mmol/L 的K3[Fe(CN)6]溶液中用 CV 法扫描(电位范围-0.2~+0.6V,扫描速度100 mV/s),结果如图1所示。图中 K3[Fe(CN)6]探针分子在裸玻碳电极上的氧化峰与还原峰对称性较好(曲线 a),具有良好的可逆性。在o-PD/β-CD/GCE上的氧化峰正移,峰型变宽,峰电流显著减小(曲线 b)。可能是由于修饰电极表面具有交联作用的邻苯二胺与 β-CD 牢固地键合[20],β-CD具有特殊的空腔结构,在电极表面形成一定覆盖率的膜层,具弱导电性[21],从而阻碍了K3[Fe(CN)6]在电极表面的电子传递。而在 o-PD/β-CD/Ag-MWNTs/GCE上,氧化还原峰电流远大于上述两种电极(曲线 c),这可能是因为银离子的优良导电性,促进了电子在电极表面的传递速度;碳纳米管具有大的比表面积以及较多的活性位点,能够提高电极检测的灵敏度[22]。由此表明电极修饰效果良好,当邻苯二胺、β-环糊精、Ag-MWNTs共同修饰于玻碳电极表面时,既可达到防止干扰,延长使用寿命的效果,又能高效传递电子。
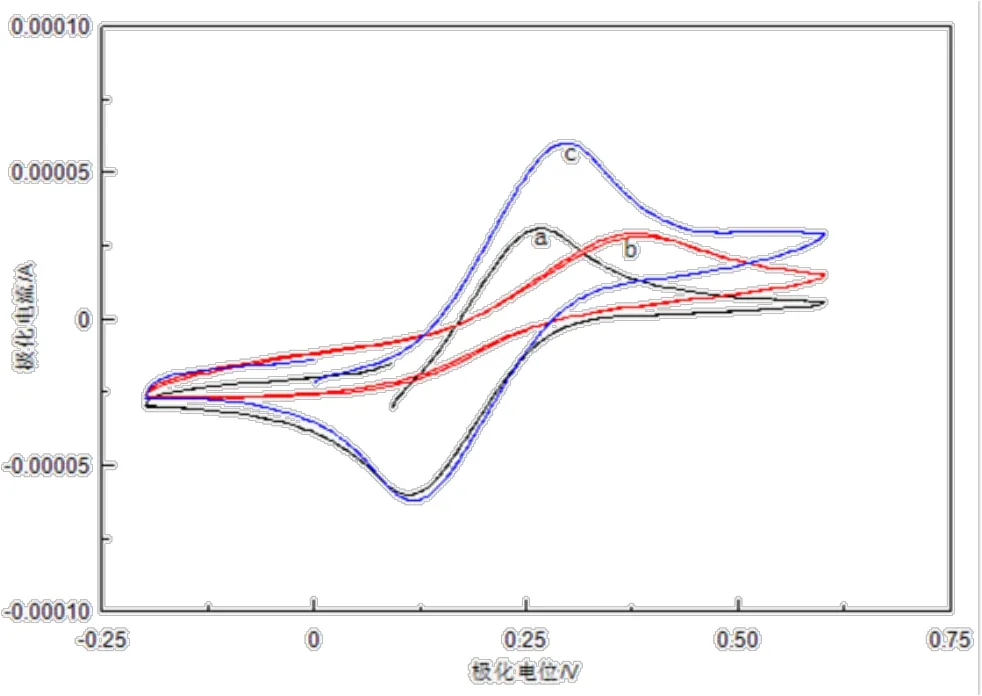
图1 不同修饰电极的循环伏安表征
2.2 腺嘌呤在 o-PD/β-CD/Ag-MWNTs/GCE 的电化学响应
将不同修饰电极以 100 mV/s的扫描速度,在-0.2~+0.6 V电位范围之间,用循环伏安扫描 0.01 mg/mL的腺嘌呤标准液,结果如图2所示。由图可见,裸玻碳电极对腺嘌呤几乎没有响应(曲线 a);腺嘌呤在o-PD/β-CD/GCE上的电信号响应比裸玻碳电极稍强,表明这些修饰材料对腺嘌呤起到了一定的催化富集的作用(曲线b),可能是由于交联剂o-PD与β-CD相互键合,使该修饰电极对腺嘌呤的吸附作用相对增强;而在 o-PD/β-CD/Ag-MWNTs/GCE上,峰电流显著增大,与上述两种修饰电极相比,该修饰电极对腺嘌呤的电化学响应最强(曲线 c),可能是因为银离子有很好的导电性能,MWNTs具有多活性位点,大的比表面积,因此该电极的电催化活性更加明显。说明在o-PD/β-CD/Ag-MWNTs修饰电极上由于各修饰层的共同作用,使得腺嘌呤的氧化作用速度加快。
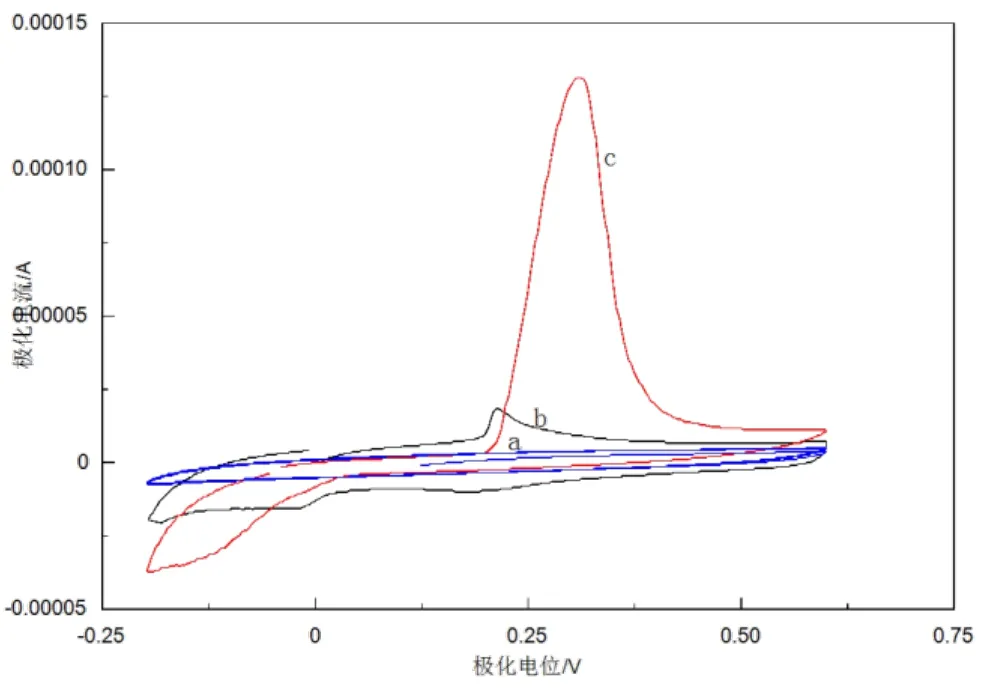
图2 腺嘌呤在不同修饰电极上的循环伏安表现
由图 2可以看出,腺嘌呤在 o-PD/β-CD/Ag-MWNTs修饰电极上发生的电氧化是不可逆的过程。在腺嘌呤的结构当中,其C-8和C-2位上碳原子与氮原子之间存在着碳碳双键,π电子云将会向氮原子上转移,从而碳原子上的电子云密度减小;同时在碳原子相邻的位置上,还存在电负性比较强的氮原子;二者共同作用导致C-H键的极性增强,使C-H键容易断开,氢原子脱去,因此可以推测这一步的反应是涉及两个电子的氧化过程[23],如图3所示。
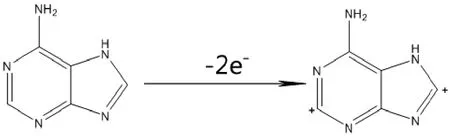
图3 腺嘌呤氧化过程示意图
2.3 实验条件优化
2.3.1 碳纳米管用量的选择
分别以碳纳米管用量为4、7、10、13和16 mg制备 o-PD/β-CD/Ag-MWNTs/GCE,在上述电化学条件下于腺嘌呤标准液中进行对比实验。结果如图 4所示,当碳纳米管用量为7 mg时,电化学响应最强,峰电流最大,峰型最佳,故使用7 mg碳纳米管修饰电极。

图4 腺嘌呤在不同碳纳米管用量的修饰电极上的循环伏安表现
2.3.2 硝酸银修饰液浓度的选择
分别以硝酸银浓度为0.05、0.1、0.15、0.2、0.25 mg/mL制备o-PD/β-CD/Ag-MWNTs/GCE,在上述电化学条件下于腺嘌呤标准液中进行对比实验。结果如图5所示,当硝酸银浓度为0.1 mg/mL时,其峰电流最大且峰型最好,故选用0.1 mg/mL AgNO3修饰电极。
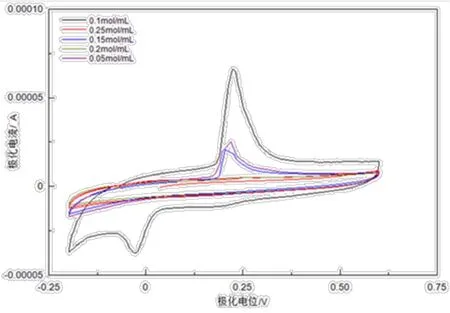
图5 腺嘌呤在不同硝酸银浓度的修饰电极上的循环伏安表现
2.3.3 扫描速率的影响
在10~150 mV/s的扫描速率范围内改变扫描速度进行实验,100 mV/s时峰电流最大,所以选择100 mV/s的扫描速度。
2.3.4 底液的选择
按如上所述的电化学方法,在TISAB(曲线a)、乙酸乙酸钠和PBS(曲线c)这三种底液条件下分别对腺嘌呤进行对比实验。结果如图6所示,在乙酸乙酸钠溶液中出现氧化还原峰,且峰电流极大(曲线b),可以认为乙酸乙酸钠溶液对腺嘌呤的检测有干扰;在TISAB中出现的峰较比PBS缓冲溶液中出现的峰电流大,因此认为PBS缓冲溶液更适合本实验条件下对腺嘌呤进行测定。
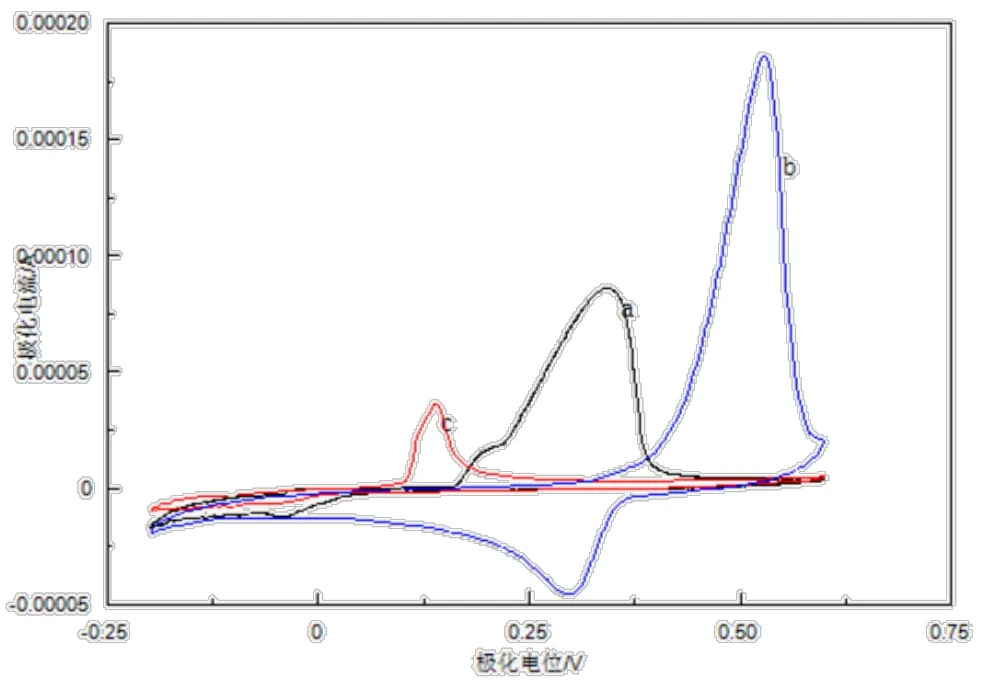
图6 腺嘌呤在不同底液中的循环伏安表现
2.3.5 底液pH值对极化电流的影响
在pH=2.0~11.0范围内改变底液的pH值,用上述电化学方法测定 o-PD/β-CD/Ag-MWNTs/GCE上1.0 mg/mL腺嘌呤的峰电流,腺嘌呤的峰电流在pH=2.0~5.0范围内随pH增大而增大;在pH=5.0~7.0范围内随pH增大,峰电流减小;在pH=7.0~11.0范围内随pH增大而增大。故选择pH=7.0的PBS为最佳底液。
2.4 干扰实验
考察了一些常见的有机化合物和金属离子对腺嘌呤测定的干扰。实验结果显示:500倍的K+、Ca2+、Zn2+、Cu2+、Al3+、Fe3+、Fe2+、Hg2+;100 倍的维生素 E、尿酸;25倍的鸟嘌呤、胸腺嘧啶几乎不会对腺嘌呤的测定产生干扰。这说明自制的修饰电极对腺嘌呤测定时的选择性很好。
2.5 重现性和稳定性
用 o-PD/β-CD/Ag-MWNTs/GCE 对 0.01 mg/mL的腺嘌呤标准溶液连续测量8次,测定结果的相对标准偏差(RSD)为0.2%,说明该修饰电极重现性好。
o-PD/β-CD/Ag-MWNTs/GCE在室温、空气流通的条件下保存18d,对腺嘌呤标准溶液响应电流基本不变,说明该电极稳定性良好。
2.6 线性范围与检出限
在最佳测试条件下,用循环伏安法研究了腺嘌呤的氧化峰电流与其浓度的关系(图 7),发现腺嘌呤的氧化峰电流与其浓度在0.2~1.0 mg/mL之间有良好的线性关系,线性方程为:y=-0.0558x+0.2935(I:mA,c:mg/mL,R2=0.9419),最低检出限为 0.06 mg/mL。
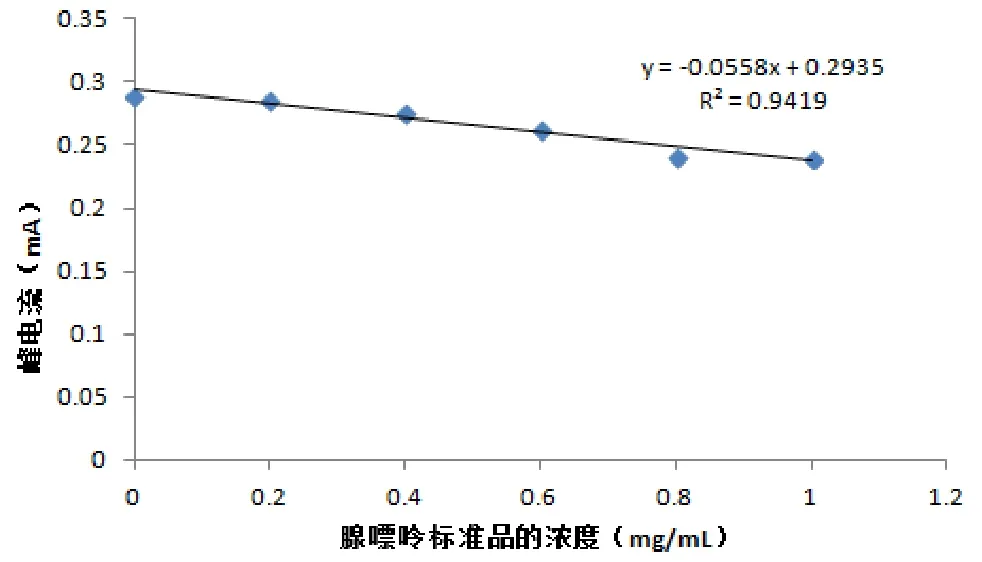
图7 腺嘌呤氧化峰电流与浓度的关系曲线
2.7 回收率实验
取玛卡原生植物样品,粉碎,过筛(40目),得到玛卡粉末。取5 g玛卡粉末,用150 mL丙酮在90℃条件下索氏提取,得到30 mL提取液。经旋转蒸发仪浓缩到10 mL左右,过0.45 um微孔滤膜,用pH=7的PBS缓冲溶液定容成50 mL,摇匀,即制成待测样品溶液。取适量待测样品,在最佳实验条件下用循环伏安法扫描,得到峰高和电流值,通过线性方程y=-0.0558x+0.2935,计算得到1 g玛卡中腺嘌呤含量为0.037 mg。待测样品取3份20 V/mL玛卡样品溶液,用上述修饰好的电极进行检测,并在样品中加入0.01 mg/mL的腺嘌呤标准溶液进行回收率实验,结果见表1。实验结果表明,该修饰电极对腺嘌呤的测定,具有较好的准确度和精密度。

表1 玛卡中腺嘌呤含量回收率测定结果
3 结论
由于邻苯二胺的交联作用使具有特殊空腔结构的β-环糊精牢固的附着在表面,并且会使银离子填充其中与之形成包络物。在电化学条件下形成惰化层,增强了电极抗干扰能力、耐用性;而且碳纳米管具有较大的比表面积以及较多的活性位点,能够提高腺嘌呤检测的灵敏度[23],使得腺嘌呤在o-PD/β-CD+Ag-MWNTs/GCE电极上显示良好的氧化还原活性。条件优化结果表明,在 pH=7的 PBS缓冲液中,用碳纳米管用量为7 mg、银离子浓度为0.1 mg/mL修饰过的玻碳电极,在-0.2~+0.6 V电位范围之间,100 mV/s的扫描速度的条件下,可以测定玛卡中腺嘌呤的含量。该方法具有操作简便、灵敏高的优点,且该修饰电极重现性和稳定性较好,具有一定的应用价值。
[1]Chacon G. La maca (Lepid ium Peruvianum) Chacon, sp. nov Ysu habitat [J]. Revista peruanade Biologia, 1961(3): 171-272.
[2]姜立科, 董浩, 张仁堂, 等. 玛卡功能作用及开发利用研究进展[J]. 中国食物与营养, 2015(05): 69-71.
[3]WANG Yali, WANG Yuchun, Mc NEIL B, et al. Maca: an andean cropwith multi-pharmacological functions [J]. Food Research International, 2007, 40: 783-792.
[4]肖培根, 刘勇, 肖伟, 等. 玛卡——全球瞩目的保健食品[J]. 国外医药: 植物药分册, 2001(06): 236-237.
[5]余龙江, 金文闻, 吴元喜, 等. 玛咖的植物学及其药理作用研究概况[J]. 天然产物研究与开发, 2002(05): 71-74.
[6]肖伟, 彭勇, 许利嘉, 等. 秘鲁特产药用植物玛卡研究的新进展[J]. 世界科学技术—中医药现代化, 2007(03): 102-106.
[7]ZHENG B L, HE K, KIM C H, et al. Effect of a lipidic extract from Lepidium meyenii on sexual behavior in mice and rats [J]. Urology, 2000, 55(4): 598-602.
[8]田万平, 王霄, 张良明, 等. 不同品种玛卡粉和不同提取方式提取物营养成分分析[J]. 食品科技, 2016(05): 229-233.
[9]张敏, 赵虎, 吕庆銮, 等. 核酸水解产物中腺嘌呤的荧光猝灭法测定及机理研究[J]. 分析测试学报, 2008(03): 263-265, 269.
[10]Gill B D, Indyk H E. Development and application of a liquid chromatographic method for analysis of nucleotides and nucleosides in milkand infant formulas [J]. International Dairy Journal, 2007, 17(6): 596-605.
[11]Heisler I, Keller J, Tauber R, et al. A colorimetric assay for the quantitation of free adenine applied to determine the enzymatic activity ofribosome-inactivating protein[J].Analytical Biochemistry, 2002, 302(1): 114-122.
[12]Yeh C F, Jiang S J. Determination of monophosphate nucleotides by capillary electrophoresis inductively coupled plasma massspectrometry[J]. Analyst, 2002, 127(10): 1324-1327.
[13]卢杰山. 某些中药成分和农药的电化学分析研究[D]. 福州大学, 2006.
[14]Wei Y, Huang Q A, Li M G, et al. Ce O2 nanoparticles decorated multi-walled carbon nanotubes for electrochemical determination of guanine and adenine [J]. Electrochimica Acta, 2011,56(24): 8571-8575.
[15]吕江维, 曲有鹏, 田家宇, 等. 循环伏安法测定电极电催化活性的实验设计[J]. 实验室研究与探索, 2015(11): 30-33+37.
[16]赵志伟, 申贵隽, 谷灵燕. DL-赖氨酸-β-环糊精/碳纳米管修饰电极的制备与应用研究[J]. 中国无机分析化学,2015(01): 70-74.
[17]杨秋霞, 李国宝, 张颖, 等. 维生素B_1自组装膜修饰金电极对多巴胺、尿酸的电催化作用[J]. 分析化学, 2009(07):1004-1008.
[18]侯晓兰, 申贵隽, 刘倩, 等. β-环糊精/碳纳米管修饰电极上盐酸异丙嗪的电化学行为研究[J]. 分析科学学报, 2011(05): 603-606.
[19]杨平华, 陈小艳, 万谦, 等. 纳米银/碳纳米管修饰玻碳电极直接电化学测定甲基对硫磷[J]. 分析试验室, 2011(04): 81-85.
[20]吴启辉, 肖晓银, 杨毅芸, 等. 邻苯二胺的电聚合及膜氧化还原过程的研究[J]. 应用化学, 1999(05): 5-8.
[21]刘淑娟, 马建国. 基于 β-环糊精交联聚合物修饰电极的电化学行为的研究[C]//重庆仪器材料研究所、中国仪器仪表学会仪表材料分会、国家仪表功能材料工程技术研究中心. 第六届中国功能材料及其应用学术会议论文集(2),2007: 3.
[22]朱华. 碳纳米管的制备方法研究进展[J]. 江苏陶瓷, 2008(04): 20-22.
[23]李晓宏. 稳态电极过程阻抗谱的研究及腺嘌呤电氧化的信息分析[D]. 河北师范大学, 2001.

