酵母培养物高活性菌株的分离及发酵条件优化
高绪娜,陈玉春,赵 倩,郭婷婷,徐海燕
(山东宝来利来生物工程股份有限公司,山东泰安271000)
酵母培养物高活性菌株的分离及发酵条件优化
高绪娜*,陈玉春,赵 倩,郭婷婷,徐海燕
(山东宝来利来生物工程股份有限公司,山东泰安271000)
酵母培养物是一种集营养和保健为一体的饲料添加剂,在畜牧生产中应用广泛。从土壤样品中分离纯化得到1株生物量较高的酵母菌BLNJ03,经16S rDNA鉴定为一株酿酒酵母。采用单因素和正交试验确定菌株BLNJ03的最佳发酵条件为:以液体深层发酵20 h菌株作种子液,固体发酵培养基为麸皮90%、玉米面3%、豆粕7%,料水比1∶0.7,初始pH值7.0,接种量6%,30℃有氧发酵48 h后厌氧发酵96 h。液体深层发酵与固体发酵相结合的两步两态法,好氧发酵与厌氧发酵相继进行,得到高活菌数、高营养成分及高消化率的酵母培养物。
酵母培养物;分离;酿酒酵母;发酵;高活性
饲料酵母一般由酵母及其培养物构成,而酵母培养物通常指固体培养基经发酵后含培养物和酵母菌的混合物,其营养丰富,含矿物质、维生素、消化酶、促生长因子及较丰富的氨基酸等 (王秋菊,2006;王丽娟和孙满吉,2000)。酵母及其培养物作为饲料添加剂,能促进动物胃肠道微生态平衡,维护肠道健康,提高生产性能,调节免疫功能,提高机体抗病能力(廖灿青等,2015;郭伶和储科军,2014;Zhang等,2008)。随着人们对食品安全的重视和对绿色食品的追求,酵母培养物因具有无毒副作用、无残留污染、不产生耐药性且可部分替代抗生素等优点,在畜牧生产中得到广泛应用(谭斌,2008)。但目前酵母培养物产品存在质量参差不齐、使用效果不稳定等问题,亟需开发质优价廉的品牌性产品。本文采用液体深层发酵与固体发酵相结合的两步两态法制备酵母培养物,并进一步对其发酵条件进行优化,以筛选高生物量、代谢丰富的酵母菌株。这对新型酵母培养物产品的开发具有十分重要的意义。
1 材料与方法
1.1 试验材料 分别从平度大泽山向阳山坡的两处葡萄架下采集土壤样品。
1.2 培养基
1.2.1 分离培养基 马铃薯葡萄糖琼脂培养基(PDA培养基):蔗糖20 g,马铃薯200 g,链霉素20mg,琼脂粉20 g,水1000 mL,pH 7.0,121℃灭菌20min。
1.2.2 纯化培养基 酵母浸出粉蛋白胨葡萄糖培养基(YEPD液体培养基):葡萄糖4 g,蛋白胨4 g,酵母膏2 g,蒸馏水100mL,pH 4.5,115℃灭菌20min。
1.2.3 液体发酵培养基 葡萄糖20 g,蛋白胨10 g,酵母膏2 g,磷酸二氢钾1 g,水1000mL,pH 7.0,121℃灭菌20min。
1.2.4 液体深层发酵培养基 按质量百分比计,葡萄糖2%,蛋白胨1%,酵母膏0.5%,磷酸氢二钾0.2%,泡敌0.05%,pH 7.0。
1.2.5 固体发酵培养基 按质量百分比计,麸皮83%,玉米面10%,豆粕7%,料水比1g∶0.7 mL,pH 7.0。
1.3 试验方法
1.3.1 菌株的分离 采用富集培养法进行酵母菌的分离。在超净工作台中,用灭菌药匙称量样品10 g,放入盛有40mL无菌水的带玻璃珠的锥形瓶中,30℃摇床震荡30min,将样品充分打散、混匀;吸取1 mL此液体加到含链霉素的PDA液体培养基中,30℃摇床培养24 h,此步骤重复一次;然后用接种针蘸取培养液在含链霉素的PDA固体培养基上划线。30℃培养箱中倒置培养48~72 h,挑取形态不同的酵母菌菌落,在YEPD固体培养基上进行划线纯化,并将纯化好的菌株接入斜面备用。
1.3.2 菌株的筛选 挑选菌落生长迅速、革兰氏染色符合酵母菌特征的纯化菌株,转接于液体发酵培养基中,30℃、200 r/min摇床培养20 h,进行菌株生物量的测定,筛选出生物量高且遗传稳定的菌株。
1.3.3 发酵方法 液体深层发酵方法:(1)采用5000mL三角瓶,培养基装量1000mL,121℃灭菌30min,冷却后接种,在30℃、200 r/min摇床培养20 h,即为一级种子菌液。(2)50 L种子罐,培养基装量30 L;实消温度121℃,时间30min;待培养基温度降为30℃时接种一级种子菌液,培养温度28~30℃,罐压0.05 MPa,搅拌转速80 r/min,培养16 h即可转入发酵罐培养。(3)500 L发酵罐培养基装量为350 L;实消温度121℃,时间30min;待培养基温度降为30℃时接种,培养温度28~30℃,罐压0.05MPa,20 h放罐。
固体发酵培养方法:将液体深层发酵得到的菌液作为种子液,按4%~6%的接种量接种于固体发酵培养基中,发酵温度为28~30℃,有氧发酵时间为36~60 h,厌氧发酵时间为72~96 h。
1.3.4 分析方法
1.3.4.1 菌株生物量的测定 将菌株发酵后得到的发酵液3500 g离心10 min,收集菌体,并以0.9%生理盐水洗涤3次,去上清收集菌体,冷冻干燥后称重。以100mL发酵液得到的菌粉重量为菌株生物量,以g/100mL表示。
1.3.4.2 活菌数的测定 准确称取1 g样品,装入盛有100mL、0.90%灭菌生理盐水的锥形瓶内,在摇床上振荡30min,制成1∶100的样品溶液,将此溶液作梯度稀释后,分别吸取1.0mL稀释菌悬液放入无菌平板中,加入适量固体培养基,充分混匀。每个梯度2个重复,室温下静置5~10min后,将平板倒置于30℃恒温培养箱中培养24~48 h,选取30~300个菌落之间的平板进行计数。
1.3.4.3 酵母培养物营养成分的检测 将发酵得到酵母培养物低温烘干、粉碎,进行营养成分的检测。粗蛋白质采用凯氏定氮法(GB/T5009.5),粗纤维采用过滤法(GB/T6364)、粗脂肪采用索氏抽提法(GB/T5009.6),以离子色谱法测定氨基酸、核苷酸、有机酸等营养成分含量,并测定蛋白质消化率(GB/T17811)。
1.3.5 发酵条件优化方法 采用单因素试验和正交试验优化发酵条件。
1.3.6 菌株的鉴定 鉴定方法:菌种鉴定采用chromosome XIIsequence的PCR鉴定法。酵母菌chromosome XIIsequence基因片段扩增的引物序列为 CXS1:5’-CACAGAAATCTCTCACCG-3’,CXS2:5’-TTATGATATGCTTAAGTTC-3’,序列由上海生物工程技术服务有限公司合成。PCR反应体系为:dNTP Mixture 4μL,5×Prime STAR Buffer 10μL,上下游引物各0.6μL,基因组模板0.8μL,Prime STAR HSDNA Polymerase 0.6μL,无菌去离子水33.4μL。PCR循环参数为:95℃5 min;94℃1 min,52℃15 s,72℃2 min,30个循环;72℃10min。将PCR反应产物进行测序,测序结果登陆Genbank blast在线对比。
2 结果与分析
2.1 菌株筛选 由表1可知,不同菌株的生物量有一定差别,生物量较大的菌株编号为2、3、10号菌株,分别命名为BLNJ02、BLNJ03、BLNJ10。将这3株酵母菌分别传接5代,并分别进行液体发酵培养,再测定其生物量。由表2可知,3株酵母菌生物量稳定,表明筛选到的3株酵母菌均具有良好的遗传稳定性,且BLNJ03菌株的生物量最高,故选择BLNJ03菌株进行发酵条件优化及酵母培养物营养成分的检测。

表1 高生物量酵母菌株筛选结果g/100mL
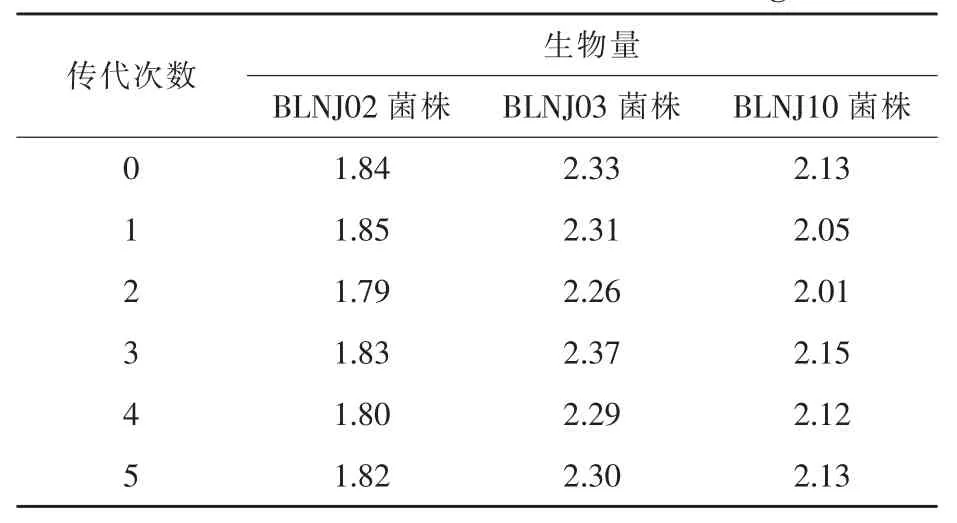
表2 酵母菌遗传稳定性试验结果g/100mL
2.2 菌株BLNJ03液体深层发酵 发酵期间2 h取样一次,镜检并计酵母活菌数。BLNJ03菌株在发酵罐中培养的生长曲线如图1所示。

图1 BLNJ03菌株在发酵罐中培养的生长曲线
由图1可知,BLNJ03菌株在18 h左右活菌数达到最大,约24亿cfu/mL,之后稳定。因此,确定BLNJ03菌株发酵罐培养18~20 h放罐,作为液体种子用于下一步的固体发酵。
2.3 菌株BLNJ03固体发酵条件的优化
2.3.1 接种量对固体发酵的影响 接种量分别为2%、4%、6%、8%、10%(体积分数),30℃培养48 h,室温下晾干,测定活菌数及绝干活菌数,结果见图2。
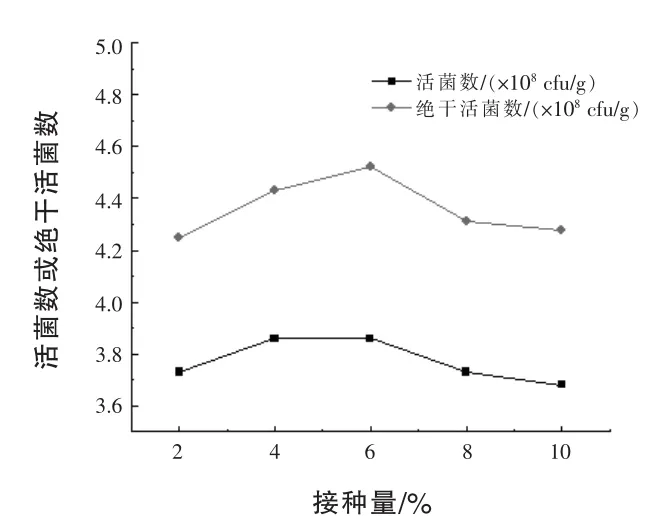
图2 接种量对菌株BLNJ03固体发酵的影响
由图2可知,接种量在2%~10%时,菌株发酵后活菌数差异不大,但接种量为6%时绝干活菌数最高。因此,菌株BLNJ03固体发酵的接种量确定为6%。
2.3.2 培养基初始pH对固体发酵的影响 将酵母菌固体发酵培养基的初始pH分别调为5.0、5.5、6.0、6.5、7.0、7.5、8.0,121℃灭菌30 min,接种后30℃培养48 h,测定活菌数,结果见图3。
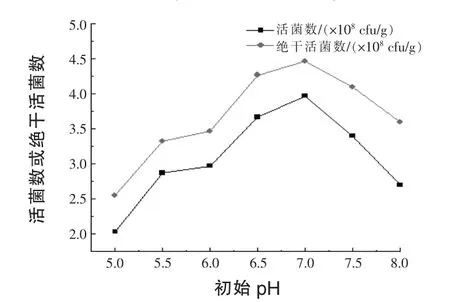
图3 培养基初始pH对菌株BLNJ03固体发酵的影响
由图3可知,培养基初始pH对菌株发酵活菌数影响很大,初始pH为7.0时活菌数最高,为pH 5.0时活菌数的1.9倍。因此,菌株BLNJ03固体发酵培养基的初始pH确定为7.0。
2.3.3 豆粕含量对固体发酵的影响 在酵母菌固体发酵中,豆粕是非常重要的氮源,其含量的高低与酵母培养物的粗蛋白质含量密切相关。配制不同豆粕含量的固体发酵培养基,30℃有氧发酵48 h,测定培养物中活菌数及粗蛋白质含量,结果见图4。

图4 豆粕含量对菌株BLNJ03固体发酵的影响
由图4可知,酵母培养物的粗蛋白质含量随豆粕含量的提高而上升,但活菌数在豆粕含量达20%之前变化不大,豆粕含量超过20%后活菌数迅速下降。分析可能的原因为,随豆粕含量增大,培养基黏度增大,通气量下降,导致酵母菌生长缓慢。综合考虑实际生产、成本等因素,选择7%为最佳豆粕添加量。
2.3.4 正交试验设计优化发酵培养基 将固体培养基中麸皮、玉米面、豆粕分别设置不同水平,进行L9(33)正交试验设计。正交试验设计及结果分析见表3。

表3 L9(33)正交试验设计及结果分析
由表3可知,各成分对菌株BLNJ03培养物中活菌数的影响顺序为:玉米面>麸皮>豆粕,极差分析的最优组合为A2B2C3,即麸皮90%、玉米面3%、豆粕7%。
2.3.5 料水比对固体发酵活菌数的影响 将发酵培养基料水比分别调为1∶0.3、1∶0.4、1∶0.5、1∶0.6、1∶ 0.7、1∶0.8、1∶0.9、1∶1(g∶mL),500 mL三角瓶装量20 g,接种量为6%,30℃培养48 h,晾干,测定培养物中活菌数,结果见图5。
由图5可知,过高或过低的料水比均不利于酵母菌的生长,料水比为1∶0.5~1∶0.7时培养物的活菌数较高。因此,建议生产中将料水比定为1∶0.7。
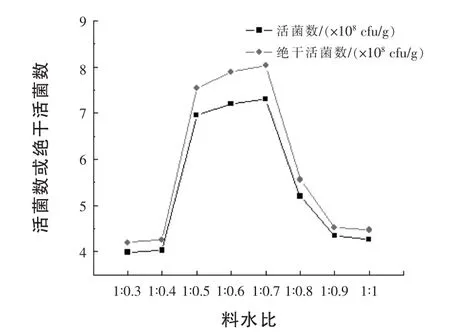
图5 料水比对菌株BLNJ03固体发酵的影响
2.3.6 需氧发酵时间对活菌数的影响 将菌株BLNJ03种子液接种于固体发酵培养基中,堆积进行好氧发酵,每12 h取样1次,测定培养物中活菌数,结果见图6。
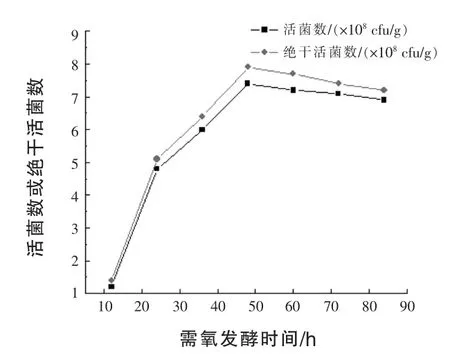
图6 需氧发酵时间对菌株BLNJ03固体发酵的影响
由图6可知,随着发酵时间延长,培养物中酵母活菌数逐渐增加,到48 h活菌数达到最高,为7.4×108cfu/g。之后活菌数趋于稳定。因此,菌株BLNJ03最优需氧发酵时间确定为48 h。
2.3.7 厌氧发酵时间对营养成分及消化率的影响将菌株BLNJ03种子液接种于固体发酵培养基中,有氧发酵48 h后压实密封进行厌氧发酵,每24 h取样1次,测定培养物中氨基酸、核苷酸含量及消化率等,结果见图7。
由图7可知,随厌氧发酵时间延长,酵母培养物中氨基酸、核苷酸含量及消化率均逐渐升高,到96 h达到最高值,分别为11.33%、28.31 mg/g和89.05%。综合考虑生产成本及发酵过程延长易污染霉菌等因素,最佳厌氧发酵时间确定为96 h。

图7 厌氧发酵时间对菌株BLNJ03固体发酵的影响
综上,优化后菌株BLNJ03酵母培养物培养条件为:液体深层发酵20 h后放罐做种子液,固体发酵培养基配方为麸皮90%、玉米面3%、豆粕7%、初始pH值7.0、料水比1∶0.7、接种量6%、有氧发酵48 h后厌氧发酵96 h。
2.4 酵母培养物营养成分的检测 将酵母BLNJ03、产朊假丝酵母,分别按相同培养基配方及发酵工艺进行固体发酵,结束后分别将酵母培养物低温烘干、粉碎。并购买市场同类酿酒酵母固体培养物产品,测定其活菌数、营养成分含量及蛋白质消化率,结果见表4。

表4 酵母固体培养物活菌数、营养成分含量及蛋白质消化率比较
由表4可知,酵母BLNJ03固体培养物与产朊假丝酵母培养物、市售酿酒酵母培养物相比,蛋白质含量较高,此现象可能与菌体蛋白有关。3种培养物的粗纤维、粗脂肪含量相差不大。酵母BLNJ03培养物的氨基酸含量比市售酿酒酵母培养物、产朊假丝酵母培养物高30%左右,有机酸含量是市售酿酒酵母培养物、产朊假丝酵母培养物的1.5~2倍。这些表明,酵母BLNJ03菌种更加优良,在固体发酵代谢产物方面更具有优势。
2.5 菌株BLNJ03的鉴定
2.5.1 菌落及菌体形态 该菌株在分离培养基上培养24~48 h,其菌落呈乳白色,表面光滑湿润,有光泽或无光泽,边缘整齐或菌丝状,显微镜下观察菌体呈圆形或椭圆形。该菌株以多边出芽方式进行无性繁殖,革兰氏染色呈阳性。
2.5.2 16S rDNA序列和系统发育分析 图8为该菌株的PCR产物电泳图,条带在1000 bp处,与预期结果一致。
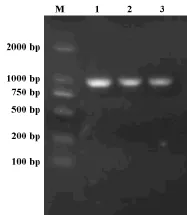
图8 菌株BLNJ03扩增产物琼脂凝胶电泳图
将菌株BLNJ03的16S rDNA序列在NCBI中进行BLAST比对分析,结果显示菌株BLNJ03 与 Saccharomyces cerevisiae的序列同源性达到100%。鉴定该菌株属于酿酒酵母(Saccharomyces cerevisiae)。
从Genebank中调取并下载与菌株BLNJ03同源性较高的和该属内其他相关菌株的16S rDNA,利用MEGA5.2软件的Neighboring-joining方法,构建系统进化树(图9)。

图9 菌株BLNJ03与相关菌株的系统进化关系
3 小结
从土壤样品中分离纯化得到1株用于固体发酵的酿酒酵母BLNJ03,该菌株具有高生物量、传代稳定等优点。通过单因素和正交试验对培养基和发酵条件进行优化,确定菌株BLNJ03最优培养基组合和发酵条件为:液体深层发酵20 h后放罐作种子液,固体发酵培养基配方为麸皮90%、玉米面3%、豆粕7%、初始pH值7.0、料水比1∶0.7、接种量6%,有氧发酵48 h后厌氧发酵96 h,得到高活菌数、高营养成分及高消化率的酵母培养物。通过16S rDNA鉴定,菌株BLNJ03为一株酿酒酵母。
[1]郭伶,储科军.酵母培养物对南美白对虾生长性能的影响[J].饲料研究,2014,15:53~55.
[2]廖灿青,陈中平,王健林,等.活性酵母及其培养物对仔猪生产性能和免疫功能的影响[J].中国饲料,2015,13:42~43.
[3]谭斌.饲用高活性干酵母的研发:[硕士学位论文][D].武汉:华中农业大学,2008.
[4]王丽娟,孙满吉.饲料酵母及其培养物的作用机制研究进展[J].中国饲料,2000,18:10~12.
[5]王秋菊.酵母培养物发酵工艺的优化及对体外培养的影响:[硕士学位论文][D].哈尔滨:东北农业大学,2006.
[6]Zhang A Z,Lu D X,Liu D C.Effects of yeast culture on immune indices of cashmere goats[J].Chinese Journal of Animal Nutrition,2008,20(2):163~169.
Yeast culture is a kind of feed additive,which combines nutrition and health care,and is widely used in animal production.A yeast strain BLNJ03 with high biomasswas isolated from soil samples.BLNJ03 was identified as Saccharomyces cerevisiae by its cultural characteristics,morphological characteristics and 16S rDNA sequence.The optimal fermentationmedium composition by single factor and orthogonal test showed as follows:the strain submerged fermentation 20 h was used as seed liquid;solid fermentation medium was wheat bran 90%,corn flour 3%,soybean meal 7%,and ratio ofmaterial to water 1∶0.7.The better fermentation conditions were as follows:initial pH 7.0,inoculation amount 6%,temperature 30℃,aerobic fermentation of 48 h and anaerobic fermentation 96 h then.The two-step two-statemethod for the combination of liquid submerged fermentation and solid fermentation,aerobic fermentation and anaerobic fermentation were carried out successively.Finally,the yeast culture with high viable count,high nutrient composition and high digestibility was obtained.
yeast culture;isolation;Saccharomyces cerevisiae;fermentation;high activities
S816.7
A
1004-3314(2017)01-0013-05
10.15906/j.cnki.cn11-2975/s.20170103
*通讯作者

