浮游植物中一氧化氮的生理作用研究进展
程 龙张甬元何 燕刘碧云田 云吴振斌
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
浮游植物中一氧化氮的生理作用研究进展
程 龙1,2张甬元1何 燕1,2刘碧云1田 云1,2吴振斌1
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
一氧化氮(NO)作为一种具有生物活性的气体自由基分子, 它的功能代表了生物学系统中信号传递的新途径。大量证据表明, NO在浮游植物细胞中的功能和在高等动植物中类似, 具有调节生长和参与抗逆性的作用, NO和ROS可能作为信号分子参与介导浮游植物程序性死亡(PCD)过程。文章较全面地介绍了NO在浮游植物中的产生途径、测定方法、生理功能和PCD的关系及作为信号分子的作用, 并对该领域今后的研究进行了展望。
一氧化氮; 浮游植物; 程序性死亡; 信号分子
20世纪80年代以前, 一氧化氮(NO)被单纯的认为是一种对环境和人体有害的气态污染物, 随着科学技术的发展和研究的深入, 证明一些生物能内源产生NO并将其作为信号分子在多种生理生化过程中扮演重要角色。随着NO生物体内源合成机制和生理特性的发现[1,2], 关于NO的研究呈现井喷式发展。1992年, NO被Science评为“年度分子”, 1998年, Furchgott、Murad和Ignarr三位科学家由于发现NO是心血管系统内皮舒张相关的信号分子而获得当年的诺贝尔生理或医学奖。NO作为信号分子在生物生理生化方面的重要作用使其在动物、高等植物、浮游植物中的作用受到越来越多的关注。浮游植物作为水生态系统中初级生产者和食物链的第一环节, NO在其体内的功能和合成机制引发研究者越来越多的兴趣, 研究内容主要集中在(i)NO的产生途径、(ii)NO的测定方法、(iii)NO的生理功能、(iv)NO与程序性死亡、(v)NO的信号转导等几个方面, 目前已有一些新发现和新观点。
1 NO在浮游植物中的产生途径
在浮游植物中, 一般认为NO有3条合成路径(图 1)[3]: (1)硝酸还原酶(NR)或亚硝酸还原酶(NiR): NR催化还原为的同时产生NO; NiR催化
外源NO不仅在对浮游植物的生长上起着重要的作用, 其本身也能产生大量的内源性NO来抵御外界环境压力。有研究表明在一些浮游植物中NO是通过NR/NiR途径产生。Tischner等[4]发现, 只有在硝酸盐或亚硝酸盐的参与下, 绿藻Chlorella sorokiniana才能在细胞中通过NR/NiR途径和线粒体的电子传递途径合成NO, 而不存在其他NOS和NOS-like途径。同样, 在富含硝酸盐的培养基中,蓝藻Anabaena doliolum、绿藻Scenedesmus obliquus和Synechoccocus leopoliensis都能不同程度地产生NO; 莱茵河中分离的刚毛藻Cladophora在含硝酸盐培养基中能在自然光照条件下会产生NO, 通过一段时间的黑暗胁迫其体内还会出现一个NO的峰值,但是当把培养基中硝酸盐氮换成氨氮时, Cladophora在光照和黑暗条件下都不会产生NO。为了进一步验证NO的产生途径, 有研究揭示蓝藻A. doliolum产生NO的底物是亚硝酸盐而不是精氨酸, 从而排除了NOS途径的可能[5]。这和Tang等[6]得到的结果类似, 蓝藻Microcystis aerugrinosa在正常生长过程中会产生NO, 在30d的培养周期里, NO和的浓度逐渐增大, 而的浓度逐渐减小, 实验过程中通过外源添加硝酸盐或L-精氨酸, 而只有在添加硝酸盐的时候会导致NO的大量产生, 这些结果都说明M. aerugrinosa细胞内NO的产生可能是通过NR/NiR途径。
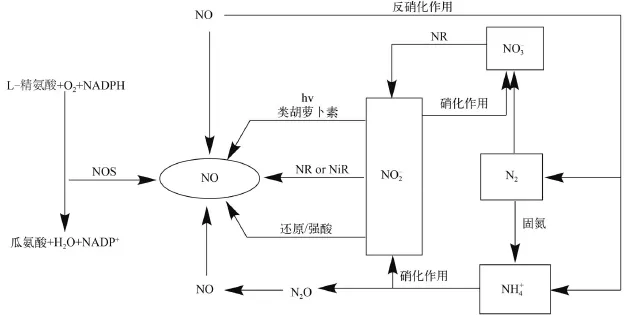
图 1 浮游植物中NO的产生途径Fig. 1 The sources of nitric oxide production in phytoplankton
研究显示哺乳动物细胞中NO可以通过一氧化氮合成酶(NOS)途径产生, 即NOS催化L-精氨酸分解产生L-瓜氨酸和NO[7]。在植物细胞中, 除了类似于动物细胞中通过转化L-精氨酸的NOS-like途径, NR途径被认为是高等植物合成NO的主要途径[8]。而NOS途径是否存在于浮游植物中还存在争议[9]。对三株硅藻Pseudonitzschia arenysensis、Pseudonitzschia delicatissima和Pseudonitzschia multistriata的转录组研究中发现只有P. multistriata存在NOS的同源序列[10]。Kim等[11]在对Chattonella marina的研究中发现, C. marina能在自然生长条件下产生NO, 通过分别添加NOS-like途径的底物L-精氨酸和抑制剂L-NAME, NO的量分别表现出增大和减小的现象, 当外源添加NiR途径底物亚硝酸盐时,对NO的产生量没有影响, 因此证明NOS-like途径才可能是C. marina细胞中积累NO的来源。但也有研究相反的指出, 为了验证绿藻Chlamydomonas reinhardtii中NO的产生是否涉及到NOS或NOS-like过程, 向藻液中加入NOS途径的底物和抑制剂,发现对NO的产生并没有影响, 因此认为在C. reinhardtii中并不存在类似于动物细胞中的NOS酶促机制[12]。
NO合成方式的差异性究竟是物种与物种之间的区别还是几种合成方式协调起作用以及如何协调来调控内源NO的产生机制尚不清楚, 揭示这些机制对认识NO在浮游植物中的信号转导途径有重要意义。目前对NO的产生机制的研究主要是根据NOS或NR/NiR途径底物的差别来判断, 如果采用生化分析和巧妙的筛选策略分离相关突变体研究浮游植物NO产生, 这对揭示NO产生途径具有重要意义。
另外, 生物体内NO也可以通过在酸性条件下亚硝酸盐自发还原的非酶促途径产生[13]。不过NO的这种产生途径需要的条件严苛, 必须在酸性或强还原性环境中进行, 浮游植物中这种适合非酶促途径的条件很少, 所以浮游植物中NO在此方面的研究还未开展。
2 浮游植物中NO的测定
2.1 血红蛋白法
此法是根据NO比O2对Hb有更强的亲和力, NO可以与HbO2反应生成高铁血红蛋白(MetHb), 其最大吸收波长会从421 nm变为401 nm, 两者的区别可作为NO检测的依据。
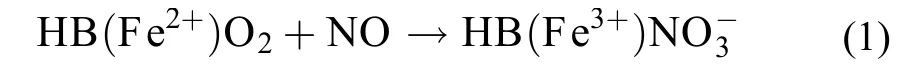
此方法的检测限达到1.3—2.8 nmol/L[14]。但是有由于其存在的一些局限性而逐渐失去了研究者的兴趣。第一, 新产生的HbO2有一些技术要求, 它需要用色谱法将其分离。第二, ROS也能氧化HbO2使得实验出现误差, 细胞内一般存在着ROS和抗氧化系统之间的动态平衡, 所以Delledonne等[15]在用此方法测量NO时先加入CAT和SOD排除ROS的干扰, 尽管如此, 残留的H2O2仍然有可能对测量产生影响。第三, pH的改变也能影响测量, 然而在植物应激反应中, pH也经常会改变。
2.2 Griess法
2.3 DAF荧光染料法
Kojima等[19]首次报道了DAF-2DA可以和NO氧化的副产物N2O3反应而产生较强的荧光, DAF-2DA可以穿过细胞膜, 进入细胞后可以被细胞内的酯酶水解形成不能穿过细胞膜的DAF-2。DAF-2本身的荧光很弱, 但在和N2O3反应后生成的DAF-2T, 可以发出强荧光[20]。环境中有、ONOO-等存在的情况下对其检测也没有影响, 其检测限可以达到5 nmol/L, 因而得到广泛应用[21]。但是随着研究的深入, 却发现抗氧化剂如抗坏血酸可以降低N2O3的水平和DAF-2T的荧光强度[22], 在无氧条件下NO不能被氧化成N2O3, 另外, 它不能被NO抑制剂cPTIO抑制而限制了其使用[20]。
DAF-FM DA是在DAF-2 DA的基础上改进用于NO定量检测的新型荧光探针, 与DAF-2 DA相比, DAF-FM和NO反应形成的荧光产物受pH值的影响小, 在pH大于5.5时不受pH的影响。其次, DAF-FM DA和DAF-2 DA相比, 前者产生的荧光更加稳定,不容易淬灭, 这样更加便于检测。另外, DAF-FM DA和DAF-2 DA相比, 前者对一氧化氮的检测灵敏度更高, 相同条件下检测灵敏度可以提高接近2倍,最低检测浓度可以达到3 nmol/L[23]。因此DAF-FM DA在测定细胞内的NO中有广泛的应用。
2.4 电子顺磁共振法
电子顺磁共振(Electron paramagnetic resonance, EPR)是由不配对电子的磁矩发源的一种磁共振技术, 可用于从定性和定量方面检测物质原子或分子中所含的不配对电子。因为NO特殊的分子结构, 它有未成对的电子, 带有自由基, 具有顺磁性,因此可以用EPR稳定的测量。由于NO较短的半衰期, 所以需要特异性的捕获剂捕获使其稳定, 最常见的捕获NO的捕获剂是二硫代氨基甲酸盐(铜试剂)[24], 其检测限一般在皮摩尔级别[25]。值得注意的是, Gao等[26]联合两种不同的捕获剂同时测定了大豆细胞和老鼠细胞中同时产生的ROS和NO。但是由于EPR高昂的费用限制了其使用。
2.5 NO电极法
在临床医学研究中, NO的电极法测量由于其相对低廉的价格和简单的操作而得到广泛的应用。同样, 在植物科学研究中, 由于NO的电极法测量不需要对样品进行预处理, 可以实时在线监测细胞产生的NO, 同时可以定量NO的绝度浓度, 所以逐渐成为具有发展前景NO测量方法[27]。Zhang等[28]通过一个装配有ISO-NO MarkⅡ电极的NO测量仪的电化学法测定实验室培养的海洋微藻和大亚湾的藻类海洋生态系统中的NO。其灵敏度高, 测定的浓度为1—10 nmol/L。在绿藻C. reinhardtii和蓝藻M. aeruginosa中同样用NO电极法测到由细胞内自由扩散到培养基中的NO[6,12]。
关于浮游植物中NO的各种测定方法比较见表 1。NO的测定是研究NO在有机体中功能的基础, 其发展推动了NO的研究, 然而随着对NO研究的深入, 还发现NO可以自由进出浮游植物细胞, 单个细胞可以通过NO把环境因子的改变传递给周围细胞, 从而可以引起浮游植物的群体对环境因子变化的响应[29]。现有的测定技术也亟待改进, 例如,现在被大量使用的测定技术包括DAF-FM DA荧光探针法和NO电极法随着研究内容的深入也需要改进, DAF-FM DA在测定细胞内产生的NO有明显的优势, 但是其对NO的测定并没有得到NO的绝对浓度; 由于高等动物或高等植物相对较大的细胞个体, 选择不同的NO电极材料可以测定细胞内或培养液中NO的绝对浓度, 对于一些单细胞的藻类由于其细胞很小, NO电极材料在技术上很难直接测定细胞内的NO, 但是浮游植物细胞培养液中NO的测定结果也间接证明了NO可以在细胞内自由进出。因此, 高精度、绝对测定浮游植物细胞内外NO的浓度的技术急需实现, 并且很有希望在改进NO电极技术的基础上实现。
3 浮游植物体内NO的作用
3.1 调控浮游植物的生长
NO对海洋微藻生长的影响研究发现[28], 低浓度的NO促进生长而高浓度的NO抑制生长, 所以提出了“NO阈”的概念。这和在动物和高等植物中得到的结果类似, 体现了NO在对细胞作用上的一些共性。
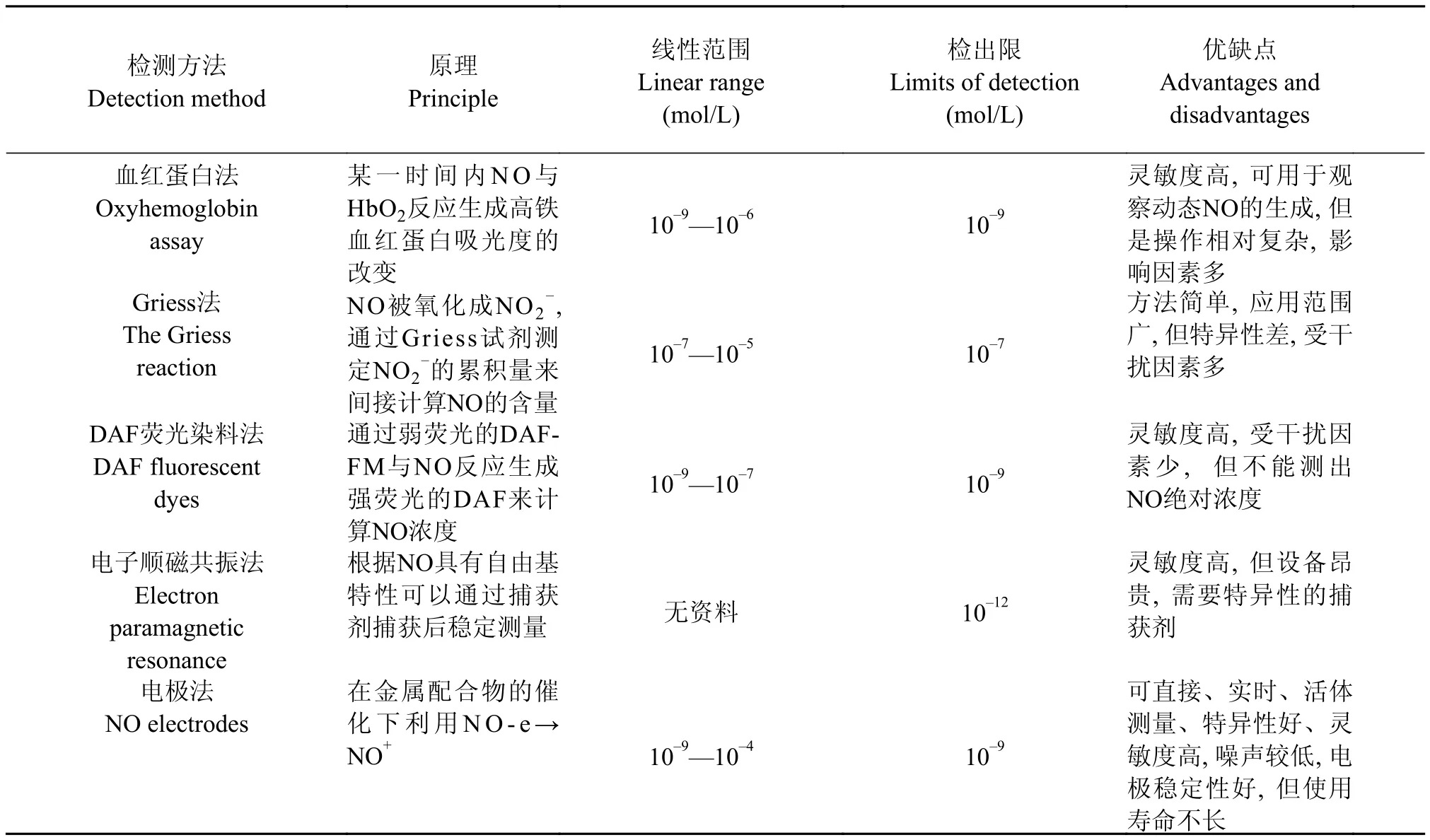
表 1 浮游植物中NO的各种测定方法Tab. 1 The methods of determining nitric oxide (NO) in phytoplankton
外源NO供体SNP对蓝藻M. aerugrinosa的生长有一定的促进作用, 促进其生长的最适浓度为0.1 mg/L, 而M. aerugrinosa的过度生长会导致水华的爆发, 因而NO对于蓝藻水华爆发在一定程度上具有相关性[6]。在对3种海洋微藻Platymonas subcordiformis、Skeletonema costatum和Gymnodinium sp.生长过程中NO的积累研究来看, 起始阶段NO浓度随着细胞密度的升高而升高, 随后在细胞密度出现峰值的前2—3天NO出现一个峰值, 通过观察海洋浮游植物中一些赤潮种C. marina、C. ovata、H. akashiwo与非赤潮种C. polykrikoides、A. taylori、A. tamarense、G. impudicum、N. oculata的差别, 发现赤潮藻种细胞内有NO产生, 而非赤潮藻种细胞内没有NO的产生[30], 因此认为对NO的监测可作为赤潮的爆发的预警因子之一[31]。总而言之, NO对于浮游植物的作用, 特别是对于湖泊水华优势种和海洋赤潮优势种的影响, 可能对水华和赤潮的监测和消亡机理提供新的思路。
3.2 参与浮游植物抗逆性作用
浮游植物在受到重金属、紫外线、有机污染物等环境胁迫时, 会引起浮游植物细胞的损伤, 已有证据表明浮游植物细胞会产生内源性的NO作为信号分子调控和响应环境胁迫, 而当通过外源添加NO到受环境胁迫的浮游植物体系中时, 能降低环境胁迫对浮游植物造成的损伤。Li等[32]发现, NO能缓解十六烷基三甲基氯化铵(表面活性剂)和荧蒽(多环芳烃)对绿藻Chlorella vulgaris的氧化毒性作用, 在十六烷基三甲基氯化铵或荧蒽处理绿藻C. vulgaris体系中接入外源NO供体SNP后, 绿藻的生物量、叶绿素含量、可溶性蛋白的含量, SOD、POD、CAT的活性比不加NO供体对照组要高, 并且随之ROS和MDA含量下降。对2种海洋浮游植物P. subcordiforms和S. costatum的研究发现, 在受到非金属、金属、杀虫剂、紫外线的胁迫时其生长受到明显抑制, 当向藻的培养液中每天两次添加不同低浓度的NO(0.1—10 nmol/L)时, 两种海洋藻的生长明显受到促进, 说明NO对于这两种海洋藻在受到非生物胁迫时具有保护功能[33]。
NO的这种保护功能, 可能是NO与活性氧(ROS)之间的复杂关系有关, 一种说法是NO作为抗氧化剂通过上调超氧化物歧化酶(SOD)、愈创木酚过氧化物酶(GPX)、过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)来猝灭由重金属、盐度、紫外线、除草剂等引起的ROS产生, 进而减少由氧化胁迫带来的细胞损伤。另外, NO在清除ROS起到的保护作用还跟在环境胁迫下NO和ROS的浓度比有关, 在低浓度时通过清除和脂质自由基来终止脂质过氧化和引起抗氧化酶的表达。在高浓度时与形成毒性更强的过氧亚硝基(ONOO-), 而过氧亚硝基可以破坏生物大分子的结构和功能[34]。在除草剂莠去津、草铵膦引起的绿藻C. vulgaris细胞死亡中, 外源添加NO供体表现出双重作用, 低浓度的SNP可以增强SOD、CAT、POD等抗氧化酶以降低由除草剂引来的ROS、MDA的升高, 上调光合作用基因(psbC、psaB、chlB和rbcL)的表达以维持正常的光合作用; 而高浓度的SNP(100 μmol/L)通过增强ROS、MDA和减少叶绿素含量、抗氧化性酶、光合作用基因转录加剧除草剂的毒性[35]。NO的这种双重性, 可能是通过NO的信号分子功能来减少环境胁迫对浮游植物的毒性作用, 或者当NO浓度过高时, 从种群演替的意义来说是去清除受损或者破坏了的浮游植物, 从而让资源能让健康的细胞利用。
4 NO与程序性死亡
程序性死亡(PCD)是一种由遗传决定的且受代谢指导的细胞自杀事件, 大量研究结果表明, 在浮游植物中也存在类似于细胞凋亡、类凋亡、自噬等途径的PCD[36], 而PCD是有机体适应外界环境条件, 主动调整自身代谢的重要手段。NO参与了细胞的程序性死亡过程在很多研究中都得到验证, 目前有几种观点, 一种是NO直接引起程序性死亡[37],另一种是和其他物质作用引起程序性死亡, 例如ROS[15]、C2H4[38]等。研究发现虫黄藻Symbiodiniummicroadriaticum的培养温度从27℃升高到32℃时会导致细胞死亡率增高、caspase-3酶活性增强, NO浓度增大, 并且NO的产生与casepase-3活性具有紧密的相关性[39]。Lehner等[40]对单细胞绿藻Micrasterias denticulata的研究发现, 用外源的NO供体SNP、SNAP处理藻细胞, 细胞的生长受到抑制, 与对照相比, 处理组细胞出现如次生壁缺失、高尔基体的功能受到损伤等典型的PCD特征。海洋硅藻分泌的活性物质反式-2, 4癸二烯醛对硅藻T. pseudona和Phaeodactylum tricornutum的研究发现,两种藻发生PCD的过程中, 没有监测到ROS的产生,但处理5min后NO的水平显著增加[29]。
对于浮游植物来说, PCD的重要功能是从种群中移除受损或者破坏了的细胞, 让资源可以被健康的细胞生长所利用, 或在不利的环境条件下, 淘汰大部分群体, 保留少数强健个体, 以便在合适环境下继续繁衍其种群, 从另一个角度讲是实现种群利益的最大化, 浮游植物PCD的这种特点, 为我们控制藻类异常增殖的工程应用提供新的思路, 可以通过人为诱导水华藻类PCD发生的环境条件来降低水华藻类生物量, 因此研究浮游植物中NO和PCD关系对控制富营养化水体藻类水华爆发具有重要意义。实验室沉水植物Myriophyllum spicatum和M. aeruginosa共培养的研究发现, 水生植物能够通过化感作用诱导藻类产生NO从而引起PCD[41], 更重要的一点是NO可以向水体中扩散, 可以作为一种刺激引起临近的细胞产生NO[29], 进而诱导其PCD的产生, 其意义在于可能引起浮游植物细胞群落的PCD。
5 NO对浮游植物的信号转导作用
NO作为一种结构简单的气体活性分子, 是自然界中继乙烯之后的第二种气体信号分子, 代表了生物学系统中信号转导的一种新途径。在高等植物中NO参与种子萌发、侧根和根毛发育、气孔运动、开花和防御反应等许多重要的生理过程[42]。在植物抗逆性反应中, NO主要依赖环磷酸鸟苷(cGMP)和不依赖cGMP这两条途径介导信号转导,但作为初级生产者的浮游植物, NO的研究还处于初级阶段, 其研究与在高等植物细胞中类似, 如NO可以与Ca2+相互交叉影响硅藻的多种生理功能,在浮游植物多种胁迫信号转导过程中, 细胞内Ca2+的浓度变化总是伴随着细胞内NO浓度的变化,并且和高等植物中类似, NO信号位于Ca2+信号的上游[29]。
环境胁迫的刺激下能导致细胞内NO和ROS的产生, 在多种生理过程中, NO和ROS作为信号分子表现出类似的生物学效应, 暗示它们可能存在着复杂的相互关系[42]。NO和ROS作为信号分子触发浮游植物的死亡已经被证实, 对硅藻S. costatum的研究表明, NO可以作为二级信使, 调节死亡特异性蛋白ScDSP-1的表达[43], 盐藻Dunaliella viridis在受到环境胁迫时, 细胞死亡早期ROS可能起着开关的作用[44]。在高等植物细胞中, Delledonne等[15,45]的两篇经典文献揭示了NO和ROS的相互作用关系, 证实NO和ROS之间的相互作用决定高等植物细胞PCD的发生, NO和ROS本身不能引起大豆细胞发生PCD, NO和H2O2的比例决定PCD的发生, 但是为什么只有NO和H2O2才能引起PCD, 以及高等植物中这种NO和ROS的相互作用关系决定PCD的发生在浮游植物中是否适用还鲜有研究, 是值得重点关注的方向之一。
6 展望
NO在有机体内复杂的反应和生理功能都值得研究, NO在浮游植物(低等植物)中的作用极有可能与在高等植物中类似, NO参与植物的许多生理过程已经被实验证实, 但是同NO在高等植物和动物中的研究相比, NO在浮游植物中的研究还处于初级阶段。
总结NO在高等植物、动物和浮游植物中现有的研究进展, NO的功能还未有定论, 还有许多工作需要展开: (1)NO在浮游植物中便捷、准确、定量的监测技术, 目前主要通过荧光探针和电极的方法测定浮游植物细胞内产生的NO, 前者的结果检测NO的产生部位, 但是NO的浓度只能用相对荧光值表示, 电极法能直接定量测定浮游植物培养液中NO的绝对浓度, 但是对于单细胞的藻类不能测定细胞内产生的NO, 随着现代科学技术的发展, 一些定量、便捷测定浮游植物细胞内外NO绝对浓度的方法亟待开发, 这必将大大促进NO在浮游植物中的研究; (2)NO在浮游植物中产生途径有NR/NiR和NOS途径已经被确定, 但是由哪些因素造成这种差异还有待研究; (3)关于NO在浮游植物中的功能大都是通过NO供体、清除剂来验证, 但是细胞内的生理功能和化学药物处理还是存在差异, 因此实验方法和技术还有待改进; (4)NO引起的程序性死亡在浮游植物群演替及进化中起着重要作用, 其可能为控制藻类水华的发生提供新的思路, 而NO作为信号分子通过细胞内级联反应过程, 如何引起的细胞死亡值得思考, 这种死亡信号分子无疑为解决淡水和海洋藻类环境污染提供新的理论和技术指导。
[1]Palmer R M J, Ferrige A G, Moncada S. Nitric oxide release accounts for the biological activity of endotheliumderived relaxing factor [J]. Nature, 1987, 327(6122): 524—526
[2]Ignarro L J, Buga G M, Wood K S, et al. Endotheliumderived relaxing factor produced and released from artery and vein is nitric oxide [J]. Proceedings of the National Academy of Sciences, 1987, 84(24): 9265—9269
[3]Wojtaszek P. Nitric oxide in plants: to NO or not to NO [J]. Phytochemistry, 2000, 54(1): 1—4
[4]Tischner R, Planchet E, Kaiser W M. Mitochondrial electron transport as a source for nitric oxide in the unicellular green alga Chlorella sorokiniana [J]. FEBS Letters, 2004, 576(1): 151—155
[5]Mallick N, Rai L C, Mohn F H, et al. Studies on nitric oxide (NO) formation by the green alga Scenedesmus obliquus and the diazotrophic cyanobacterium Anabaena doliolum [J]. Chemosphere, 1999, 39(10): 1601—1610
[6]Tang X, Chen J, Wang W H, et al. The changes of nitric oxide production during the growth of Microcystis aerugrinosa [J]. Environmental Pollution, 2011, 159(12): 3784—3792
[7]Andreakis N, D'Aniello S, Albalat R, et al. Evolution of the nitric oxide synthase family in metazoans [J]. Molecular Biology and Evolution, 2011, 28(1): 163—179
[8]Foresi N, Mayta M L, Lodeyro A F, et al. Expression of the tetrahydrofolate-dependent nitric oxide synthase from the green alga Ostreococcus tauri increases tolerance to abiotic stresses and influences stomatal development in Arabidopsis [J]. The Plant Journal, 2015, 82(5): 806—821
[9]Correa-Aragunde N, Foresi N, Lamattina L. Structure diversity of nitric oxide synthases (NOS): the emergence of new forms in photosynthetic organisms [J]. Frontiers in Plant Science, 2013, 4: 232
[10]Di Dato V, Musacchia F, Petrosino G, et al. Transcriptome sequencing of three Pseudo-nitzschia species reveals comparable gene sets and the presence of Nitric Oxide Synthase genes in diatoms [J]. Scientific Reports, 2015, 5: 12329
[11]Kim D, Yamaguchi K, Oda T. Nitric oxide synthase-like enzyme mediated nitric oxide generation by harmful red tide phytoplankton, Chattonella marina [J]. Journal of Plankton Research, 2006, 28(6): 613—620
[12]Sakihama Y, Nakamura S, Yamasaki H. Nitric oxide production mediated by nitrate reductase in the green alga Chlamydomonas reinhardtii: an alternative NO production pathway in photosynthetic organisms [J]. Plant and Cell Physiology, 2002, 43(3): 290—297
[13]Bethke P C, Badger M R, Jones R L. Apoplastic synthesis of nitric oxide by plant tissues [J]. The Plant Cell, 2004, 16(2): 332—341
[14]Murphy M E, Noack E. Nitric oxide assay using hemoglobin method [J]. Methods in Enzymology, 1994, 233: 240—250
[15]Delledonne M, Xia Y, Dixon R A, et al. Nitric oxide functions as a signal in plant disease resistance [J]. Nature, 1998, 394(6693): 585—588
[16]Beligni M V, Lamattina L. Nitric oxide interferes with plant photo-oxidative stress by detoxifying reactive oxygen species [J]. Plant, Cell & Environment, 2002, 25(6): 737—748
[17]Sokolovski S, Hills A, Gay R, et al. Protein phosphorylation is a prerequisite for intracellular Ca2+release and ion channel control by nitric oxide and abscisic acid in guard cells [J]. The Plant Journal, 2005, 43(4): 520—529
[18]Hetrick E M, Schoenfisch M H. Analytical chemistry of nitric oxide [J]. Annual Review of Analytical Chemistry (Palo Alto, Calif.), 2009, 2: 409
[19]Kojima H, Nakatsubo N, Kikuchi K, et al. Detection and imaging of nitric oxide with novel fluorescent indicators: diaminofluoresceins [J]. Analytical chemistry, 1998, 70(13): 2446—2453
[20]Planchet E, Kaiser W M. Nitric oxide (NO) detection byDAF fluorescence and chemiluminescence: a comparison using abiotic and biotic NO sources [J]. Journal of Experimental Botany, 2006, 57(12): 3043—3055
[21]Kojima H, Sakurai K, Kikuchi K, et al. Development of a fluorescent indicator for nitric oxide based on the fluorescein chromophore [J]. Chemical and Pharmaceutical Bulletin, 1998, 46(2): 373—375
[22]Zhang X, Kim W S, Hatcher N, et al. Interfering with nitric oxide measurements 4, 5-diaminofluorescein reacts with dehydroascorbic acid and ascorbic acid [J]. Journal of Biological Chemistry, 2002, 277(50): 48472—48478
[23]Murad F. Discovery of some of the biological effects of nitric oxide and its role in cell signaling [J]. Bioscience Reports, 2004, 24(4—5): 452—474
[24]Van Doorslaer S, Desmet F. The power of using continuous-wave and pulsed electron paramagnetic resonance methods for the structure analysis of ferric forms and nitric oxide-ligated ferrous forms of globins [J]. Methods in Enzymology, 2008, 437: 287—310
[25]Weaver J, Porasuphatana S, Tsai P, et al. Spin trapping nitric oxide from neuronal nitric oxide synthase: a look at several iron-dithiocarbamate complexes [J]. Free Radical Research, 2005, 39(10): 1027—1033
[26]Cao Y, Guo P, Xu Y, et al. Simultaneous detection of NO and ROS by ESR in biological systems [J]. Methods in Enzymology, 2005, 396: 77—83
[27]Davies I R, Zhang X. Chapter five-nitric oxide selective Electrodes [J]. Methods in Enzymology, 2008, 436: 63—95
[28]Zhang Z, Xing L, Wu Z, et al. Discovery of nitric oxide in marine ecological system and the chemical characteristics of nitric oxide [J]. Science in China Series B: Chemistry, 2006, 49(5): 475—480
[29]Vardi A, Formiggini F, Casotti R, et al. A stress surveillance system based on calcium and nitric oxide in marine diatoms [J]. PLoS Biology, 2006, 4(3): 411—419
[30]Kim D, Kang Y S, Lee Y, et al. Detection of nitric oxide (NO) in marine phytoplankters [J]. Journal of Bioscience and Bioengineering, 2008, 105(4): 414—417
[31]Zhang Z B, Liu C Y, Wu Z Z, et al. Detection of nitric oxide in culture media and studies on nitric oxide formation by marine microalgae [J]. Medical Science Monitor, 2006, 12(2): BR75—BR85
[32]Li Q, Liang Z, Ge F, et al. Alleviating CTAC and Flu combined pollution damage in Chlorella vulgaris by exogenous nitric oxide [J]. Chemosphere, 2014, 96: 39—45
[33]Li P, Liu C Y, Liu H, et al. Protective function of nitric oxide on marine phytoplankton under abiotic stresses [J]. Nitric Oxide, 2013, 33: 88—96
[34]Neill S J, Desikan R, Hancock J T. Nitric oxide signalling in plants [J]. New Phytologist, 2003, 159(1): 11—35
[35]Qian H, Chen W, Li J, et al. The effect of exogenous nitric oxide on alleviating herbicide damage in Chlorella vulgaris [J]. Aquatic Toxicology, 2009, 92(4): 250—257
[36]Li J, Ding Y, Xiang R. Programmed cell death in phytoplankton [J]. Ecology & Environmental Sciences, 2010, 11: 41 [李杰, 丁奕, 项荣, 等. 浮游植物程序性细胞死亡研究进展. 生态环境学报, 2010, 11: 41]
[37]Clarke A, Desikan R, Hurst R D, et al. NO way back: nitric oxide and programmed cell death in Arabidopsis thaliana suspension cultures [J]. The Plant Journal, 2000, 24(5): 667—677
[38]Yordanova Z P, Iakimova E T, Cristescu S M, et al. Involvement of ethylene and nitric oxide in cell death in mastoparan-treated unicellular alga Chlamydomonas reinhardtii [J]. Cell Biology International, 2010, 34(3): 301—308
[39]Bouchard J N, Yamasaki H. Implication of nitric oxide in the heat-stress-induced cell death of the symbiotic alga Symbiodinium microadriaticum [J]. Marine Biology, 2009, 156(11): 2209—2220
[40]Lehner C, Kerschbaum H H, Lütz-Meindl U. Nitric oxide suppresses growth and development in the unicellular green alga Micrasterias denticulata [J]. Journal of Plant Physiology, 2009, 166(2): 117—127
[41]He Y, Zhou Q H, Liu B Y, et al. Programmed cell death in the cyanobacterium Microcystis aeruginosa induced by allelopathic effect of submerged macrophyte Myriophyllum spicatum in co-culture system [J]. Journal of Applied Phycology, 2016: 1—10
[42]Wang P C, Du Y Y, Song C P. Research progress on nitric oxide signaling in plant cells [J]. Chinese Bulletin of Botany, 2009, 44(5): 517—525 [王鹏程, 杜艳艳, 宋纯鹏. 植物细胞一氧化氮信号转导研究进展. 植物学报, 2009, 44(5): 517—525]
[43]Chung C C, Hwang S P L, Chang J. Nitric oxide as a signaling factor to upregulate the death-specific protein in a marine diatom, Skeletonema costatum, during blockage of electron flow in photosynthesis [J]. Applied and Environmental Microbiology, 2008, 74(21): 6521—6527
[44]Jiménez C, Capasso J M, Edelstein C L, et al. Different ways to die: cell death modes of the unicellular chlorophyte Dunaliella viridis exposed to various environmental stresses are mediated by the caspase-like activity DEVDase [J]. Journal of Experimental Botany, 2009, 60(3): 815—828
[45]Delledonne M, Zeier J, Marocco A, et al. Signal interactions between nitric oxide and reactive oxygen intermediates in the plant hypersensitive disease resistance response [J]. Proceedings of the National Academy of Sciences, 2001, 98(23): 13454—13459
PROGRESS OF PHYSIOLOGICAL EFFECT OF NITRIC OXIDE ON PHYTOPLANKTON
CHENGLong1,2,ZHANGYong-Yuan1,HEYan1,2,LIUBi-Yun1,TIANYun1,2andWUZhen-Bin1
(1.State Key Laboratory of Freshwater Ecology and Biotechnology,Institute of Hydrobiology,Chinese Academy of Sciences,Wuhan 430072,China;2.University of Chinese Academy of Sciences,Beijing100049,China)
Nitricoxide(NO)isfreeradicalgaswithbiologicalactivityinsignaltransmission.NOmediatedvariousresponsestobioticorabioticstressandplayedanimportantroleinphytoplanktongrowthandstress-resistance,whichare similartohigheranimalsandplants.Additionally,NOandreactiveoxygenspecies(ROS)functionasasignaltoinitiateprogrammedcelldeath(PCD)inphytoplankton.ThereviewsummarizedtheNOpathway,themethodsmeasuring NOanditsapplication,theadvantagesanddisadvantagesofdifferentmeasurements,thephysiologicalfunctionofNO, therelationshipbetweenNOandPCD,andthefunctionofNOasasignalmoleculeinphytoplankton.Finally,some ideasconcerningnitricoxideresearchinorganismswereputforward.
Nitricoxide;Phytoplankton;Programmedcelldeath;Signalmolecule
Q178.1
A
1000-3207(2017)01-0257-08
10.7541/2017.32
2016-01-12;
2016-05-18
国家自然科学基金(51178452); 国家“十二五”水专项(2012ZX07101007-005); 国家“十二五”科技支撑项目(2012BAJ21B03-04);湖北省环保厅科研项目(2015HB08)资助 [Supported by the National Natural Science Foundation of China (51178452); the Major
Science and Technology Program for Water Pollution Control and Treatment of China 12th Five-Year Plan (2012ZX07101007-005); National Key Technology R&D Program of China 12th Five-Year Plan (2012BAJ21B03-04); Environmental Science Research Project of Hubei Province (2015HB08)]
程龙(1992—), 男, 湖北孝感人; 硕士研究生; 主要从事藻类生理生态研究。E-mail: edgarmail@qq.com
刘碧云, 副研究员; 主要从事植物化感及水生态修复研究。E-mail: liuby@ihb.ac.cn

