斑马鱼IRF11基因的鉴定、亚细胞定位及表达特征
熊亚玮张义兵桂建芳
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
斑马鱼IRF11基因的鉴定、亚细胞定位及表达特征
熊亚玮1,2张义兵1桂建芳1
(1. 中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049)
早期的研究表明IRF11是鱼类特有的IRF家族成员。查询最近解析的斑马鱼第九版基因组时, 发现斑马鱼IRF1和IRF11命名出现了混乱。通过对脊椎动物IRF1和IRF11基因位点进行同线型分析表明, IRF11与IRF1是两个不同的基因, 不宜命名为IRF1b和IRF1a。系统进化树分析发现, 在脊椎动物中IRF11基因比IRF1起源更早; 两栖类以后的脊椎动物基因组只有IRF1, 没有IRF11, 其中原因可能是因为基因丢失。斑马鱼IRF11与脊椎动物IRF1一样, 其表达蛋白定位在细胞核中。缺失分析揭示斑马鱼IRF11的DBD有一个能引导蛋白定位进入细胞核的序列。表达分析发现poly (I:C)能诱导斑马鱼IRF11的表达, 但其表达水平低于IRF1。
斑马鱼; IRF11; 亚细胞定位; 表达
干扰素调节因子(Interferon regulatory factor, IRF)是一种转录因子[1]。脊椎动物有一个保守的IRF家族, 功能研究证实部分家族成员能直接调控干扰素基因的表达[2]。哺乳类IRF家族有9个成员(IRF1-9), 系统进化树分析可以分为4个亚家族: IRF1亚家族(IRF1和IRF2)、IRF3亚家族(IRF3和IRF7)、IRF4亚家族(IRF4、IRF8、IRF9), 还有IRF5亚家族(IRF5和IRF6)[2]。所有的IRF蛋白都有两个保守的结构域, N端的DBD(DNA-binding domain)和C端的IAD (IRF association domain)[3—6]。鱼类基因组解析发现鱼类不仅有保守的IRF1-9, 而且还有IRF10和IRF11[7]。IRF10在鸟类中也有发现, IRF11仅在鱼类基因组中存在, 因此是鱼类特有的IRF家族成员[7]。IRF蛋白定位与其功能有关[5,6]。如鱼类IRF3/7与病毒诱导干扰素表达有关, 在正常细胞中, IRF3/7位于细胞质, 但是病毒感染能激活IRF3/7导致其从细胞质转移到细胞核发挥转录因子功能[5]。鱼类IRF1位于细胞核[4,6], 斑马鱼IRF1差异诱导不同干扰素基因的表达[6]。鉴于IRF1/3/7的功能, 鱼类IRF1/3/7都是病毒或干扰素诱导表达基因[3—5]。然而, 斑马鱼基因组数据库(version 9)显示斑马鱼有两个IRF1基因, 分别命名为IRF1a (ENSDARG000 00043492)和IRF1b (ENSDARG00000032768)。本文通过基因线性分析和系统进化树分析证实斑马鱼IRF1a应该是IRF11, 而IRF1b则是IRF1。随后研究了斑马鱼IRF11的亚细胞定位和表达特征。
1 材料与方法
1.1 细胞
斑马鱼肝脏细胞(Zebrafish liver cells, ZFL)和鲤上皮瘤细胞(Epithelioma papulosum cyprinid, EPC)分别用含有10%胎牛血清的F12培养基和含有10%胎牛血清的199培养基传代培养[8,9]。
1.2 质粒构建
利用PCR方法扩增编码不同长度斑马鱼IRF11氨基酸的cDNA, 插入到pEGFP-N3载体的多克隆位点(KpnⅠ/EcoR Ⅰ), 构建了6个融合GFP (Green fluorescent protein)蛋白的表达质粒: IRF11-GFP (包括IRF11全长氨基酸1-251)、N1-138、N1-114、N1-69、C115-251、M1-114。其中质粒M1-114的制备方法是通过序列突变质粒N1-114的氨基酸片段97RSIKK101(AGAAGCATCAAGAAA)中的R (Arginine)和两个K (Lysine)成为A (Alanine)(GCCAGCATCGCAG CA)[4]。测序正确后提取质粒备用。
1.3 生物信息学分析
在Ensemble中查询具有代表性物种的IRF1和IRF11基因, 并对IRF1和IRF11基因座位的上下游基因进行同线性分析。在NCBI和Ensemble中查找代表性物种的IRF蛋白氨基酸序列, 利用ClustalX进行多重序列比对分析。利用MEGA6软件中的N-J法构建系统进化树(表 1)。
1.4 细胞定位分析
细胞定位分析根据我们实验室建立的方法进行[4,5]。EPC细胞在6孔板中的盖玻片上培养过夜,然后利用转染试剂lipofectamine 2000 (Invitrogen)转染2 μg融合GFP报告基因的各种IRF11质粒。在转染24h后, 细胞去除转染液进行如下操作: PBS清洗3次后用多聚甲醛固定20min; 再次用PBS清洗3次, 然后用0.2% Triton X-100处理15min; 同样在经PBS洗3次后, 用50 μg/mL DAPI染色10min, 最后在激光共聚焦显微镜下检测照相(NOL-LSM 710)。
1.5 RNA提取和RT-PCR检测
根据本实验室建立的方法进行[5]。ZFL细胞传代于一组25 cm2培养瓶中, 铺满单层过夜。在去除原培养基后, 细胞利用转染试剂lipofectamine 2000 (Invitrogen)转染2 μg的poly (I:C), 然后在不同转染时间点收集细胞, 利用Trizol法提取细胞总RNA, 用M-MLV逆转录酶(Gibco BRL)反转录合成第一链cDNA。通过荧光定量RT-PCR方法分析斑马鱼IRF1、IRF3、IRF7、IRF11、IFN1、IFN2、IFN3、IFN4基因的表达水平, 采用2-∆∆Ct法计算基因的表达水平, 每组设3个重复。本研究所用引物见表 2。
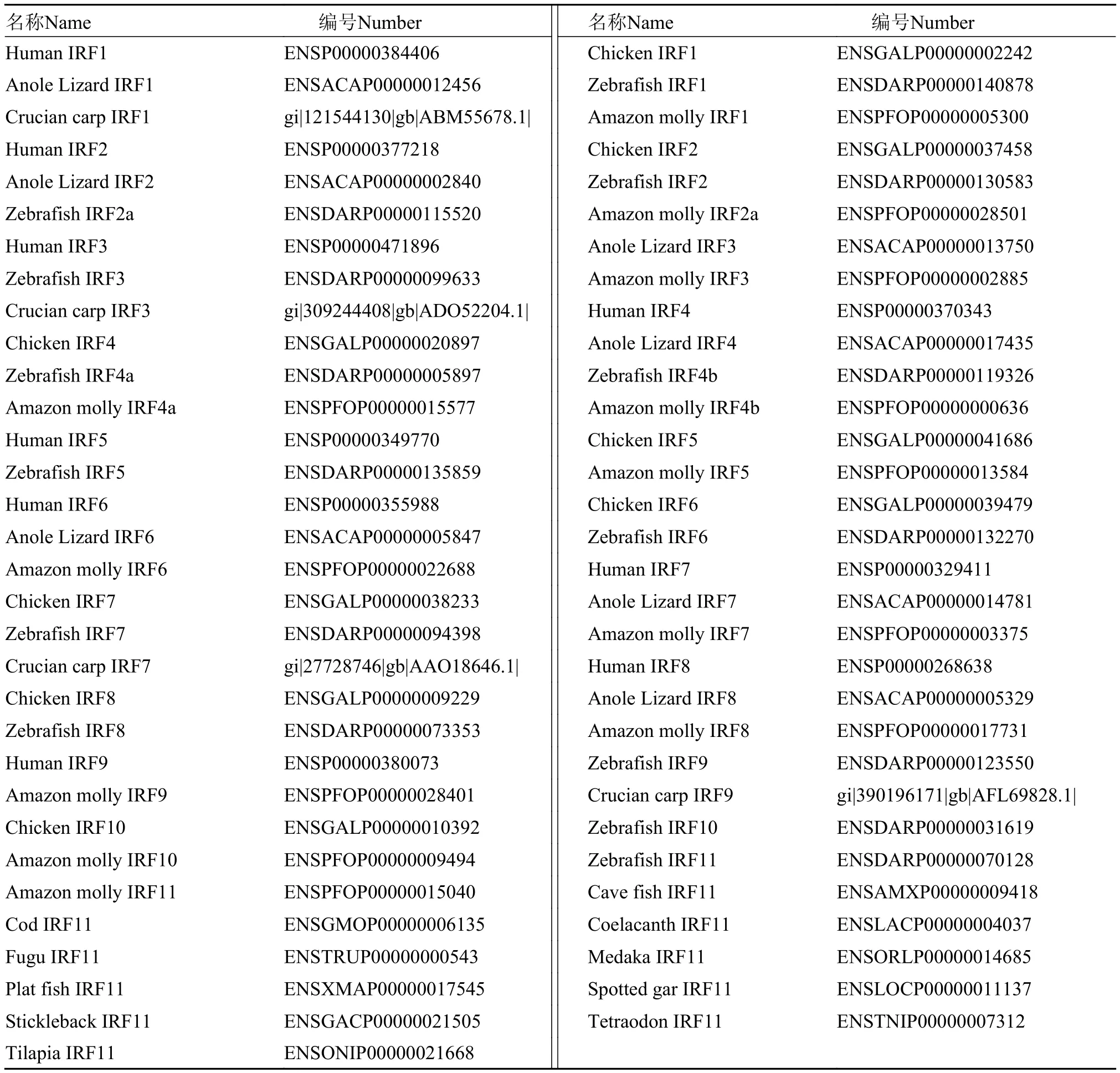
表 1 用于蛋白序列比较和系统进化树分析的IRF信息Tab. 1 The accession numbers of IRFs used in this study
2 结果
2.1 IRF1和IRF11基因位点的同线型分析
通过分析3种哺乳动物(人H. sapiens、小鼠M. musculus、狗C. familiaris)、一种鸟类(鸡G. gallus)、一种爬行类(安乐蜥A. carolinensis)以及12种鱼类(斑马鱼D. rerio、亚马逊花鳉P. Formosa、墨西哥丽脂鲤A. mexicanus、矛尾鱼L. chalumnae、大西洋鳕G. morhua、红鳍东方豚T. rubripes、青鳉O. latipes、眼斑雀鳝L. oculatus、三刺鱼G.aculeatus、绿河豚T. nigroviridis、罗非鱼O. niloticus、花斑剑尾鱼X. maculates)的基因组数据发现,它们都具有IRF1基因。12种鱼类基因组不仅有IRF1基因, 而且还有IRF11基因, 它们分别位于不同的染色体上(图 1)。进一步分析IRF1基因位点的上下游基因发现: 在3种哺乳类物种中, IRF1的上下游基因相同, 而且排列位置一致; 鸟类和爬行类IRF1基因位点的上下游基因完全一致, 但排列位置稍有变化。鱼类基因组数据不太完整, 就目前收集的数据可以看出, 已经鉴定的鱼类IRF1基因位点的上下游基因与其他物种完全一致, 但是排列位置变化较大 (图 1A)。利用同样的分析方法, 发现鱼类IRF11的基因位点同样具有相对保守的同线型 (图1B)。

表 2 本研究所用引物Tab. 2 Primers used in the study
2.2 脊椎动物IRF家族的进化树分析
选取代表性物种的IRF家族成员进行系统进化树分析。结果表明: 所有脊椎动物IRF1聚为一簇,表明所有脊椎动物IRF1为直向同源基因(Orthologous gene)。IRF2-10都具有与IRF1同样的结果。IRF11只存在于鱼类基因组中, 单独聚为一簇。所有IRF成员可以分为明显的4个亚家族, 其中IRF1、IRF11和IRF2同属一个亚家族。从系统进化树可以看出, IRF11与IRF1和IRF2二者具有相似的进化距离, 表明IRF11基因比IRF1和IRF2起源于更早时期(图 2)。
2.3 鱼类IRF1和IRF11的序列比较
鉴于斑马鱼IRF1和IRF11的命名混乱, 选择12种鱼类IRF1和IRF11蛋白序列进行了比较。鲫IRF1是我们早期在鲫培养细胞中鉴定的鱼类IRF1[4], 也用于序列比对分析。结果如图 3, IRF1和IRF11都具有保守的DBD结构域, 但是C端的IAD结构域的序列保守性较低。与IRF11蛋白相比较, IRF1蛋白的C端具有较高保守性。例如, 鲫IRF1和斑马鱼IRF1紧邻DBD结构域即IAD的N端有一个与核定位信号相关的序列[4,6], 其他鱼类IRF1对应区域也存在一个相对保守的富含R和L的序列(图 3)。
2.4 斑马鱼IRF11的亚细胞定位
为了研究斑马鱼IRF11的亚细胞定位, 首先制备了融合GFP蛋白的各种斑马鱼IRF11质粒(图 4A)。EPC细胞转染野生型斑马鱼IRF11质粒(wtIRF11),利用激光共聚焦显微镜观察, 发现绿色荧光信号全部位于细胞核(图 4B)。当转染对照GFP质粒时, 绿色信号均匀分布于整个细胞中。以上结果表明斑马鱼IRF11蛋白定位于细胞核。转染包括N端DBD的质粒N1-138和N1-114时, 与转染wtIRF11质粒的结果相同, 绿色荧光信号全部位于细胞核; 而转染包括部分DBD的质粒N1-69时, 绿色信号均匀分布于整个细胞中, 与转染对照GFP质粒的结果一致(图4C)。因此, DBD的N70-115应该有一个核定位信号(Nuclear localization signal, NLS), 该NLS足以引导斑马鱼IRF11蛋白定位在细胞核中。
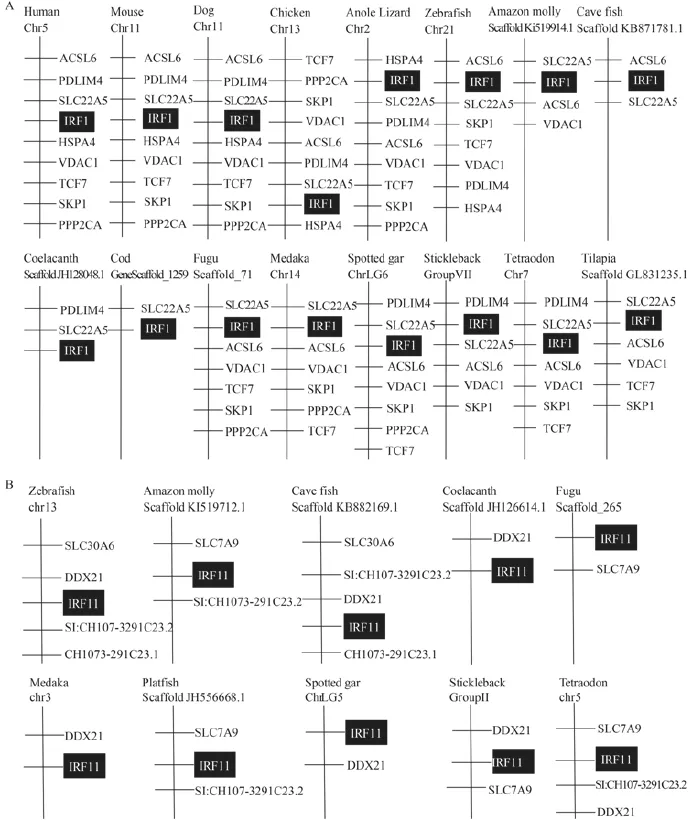
图 1 不同物种IRF1 (A)和IRF11 (B)基因位点的同线型分析Fig. 1 Synteny analysis of IRF1 (A) and IRF11 (B) gene locus from different species查询3种哺乳动物(人、小鼠、狗), 1种鸟类(鸡), 1种爬行类(安乐蜥)以及12种鱼类(斑马鱼、亚马逊花鳉、墨西哥丽脂鲤、矛尾鱼、大西洋鳕、红鳍东方豚、青鳉、眼斑雀鳝、三刺鱼、绿河豚、罗非鱼、花斑剑尾鱼)的基因组, 分析IRF1 (A)和IRF11 (B)基因及其上下游基因的组成。由于缺少上下游基因信息, 花斑剑尾鱼IRF1、大西洋鳕和罗非鱼IRF11所在基因组片段在图 1A和图 1B中没有显示By searching the genome data from human H. sapiens, mouse M. musculus, dog C. familiaris, chicken G. gallus, anole Lizard A. carolinensis, zebrafish D. rerio, amazon molly P. Formosa, cave fish A. mexicanus, Coelacanth L. chalumnae, cod G. morhua, fugu T. rubripes, medaka O. latipes, spotted gar L. oculatus, stickleback G. aculeatus, tetraodon T. nigroviridis, tilapia O. niloticus, and platfish X. maculates, the arrangement of genes upstream and downstream of IRF1 and IRF11 were analyzed. IRF1 of plat fish (scaffold JH559106.1) and IRF11s of cod (GeneScaffold_3537) and tilapia (scaffold GL831287.1) were not included in Fig. 1A or Fig. 1B due to lack of downstream or upstream genes in the current genome data
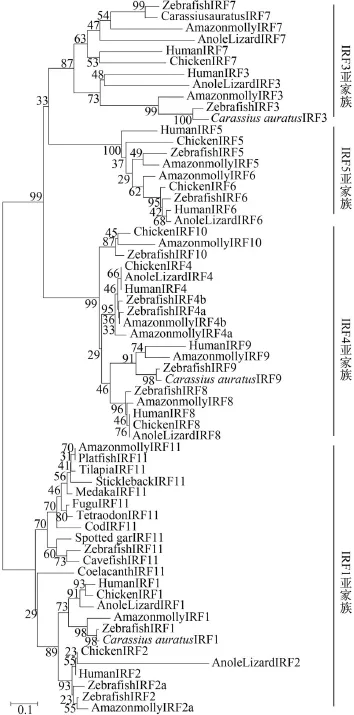
图 2 脊椎动物IRF家族的进化树分析Fig. 2 Phylogenetic tree of IRF family利用Mega6.0软件对17种代表性物种的IRF家族成员运用NJ法构建系统进化树; IRF序列信息来源请见表 1Phylogenetic tree was made with IRF family members from 17 representative species, by using neighbor-joining method within Mega6.0 program. The accession numbers of IRF genes are shown in Tab. 1
NLS是由富含精氨酸(R)和赖氨酸(K)组成的氨基酸片段[10]。序列分析发现N70-115之间共有9个R或K, 其中97RSIKK101集中有1个R和2个K。为了分析97RSIKK101是否具有NLS的功能, 将N1-114质粒中氨基酸片段97RSIKK101的R和K突变成中性氨基酸A, 即突变成97ASIAA101(质粒M1-114)(图4A)。在接下来的实验中, 转染该质粒发现表达蛋白大部分位于细胞核, 少部分位于细胞质中(图 4C),表明97RSIKK101在斑马鱼IRF11蛋白定位在细胞核中发挥作用。然而当表达缺失DBD的IRF11质粒(C115-251)时, 该质粒表达蛋白大部分仍位于细胞核, 只有少部分位于细胞质中(图 4C)。因此, C端IAD中也有序列在引导斑马鱼IRF11蛋白的亚细胞定位中发挥功能。
2.5 斑马鱼IRF11的诱导表达分析
利用Real-time PCR方法检测poly (I:C)诱导ZFL细胞IRF11基因的转录表达。结果显示, poly (I:C)能诱导IRF11基因的表达, 但是低于同时间点斑马鱼IRF1、IRF3及IRF7的表达上调水平。如在转染poly (I:C) 3h后, IRF1就被显著诱导表达, 而IRF11在转染12h才有明显的诱导表达。与此同时,斑马鱼IRF家族的IRF3和IRF7也被显著诱导表达。斑马鱼有4个IFN基因, poly (I:C)能显著诱导IFN1的表达, 其次是IFN2和IFN3, IFN4只有微弱表达(图5)。
3 讨论
从斑马鱼第九版的基因组数据库中可以查到两个IRF1, 分别命名为IRF1a (ENSDARG000000 43492)和IRF1b (ENSDARG00000032768)。我们最近的研究发现IRF1b (ENSDARG00000032768)实际上是IRF1[6]。本文通过基因组同线性分析进一步证实, 只有鱼类基因组中才有IRF11, 其上下游的相邻基因与IRF1完全不同。系统进化树分析进一步发现, 作为IRF1亚家族的一个分支, 鱼类IRF11在进化上相对保守, 起源早于脊椎动物的IRF1和IRF2, 且IRF11与IRF1和IRF2的进化距离相似。由此可以推测, 在鱼类和哺乳类共同祖先物种的基因组中, 不仅有IRF1和IRF2基因, 而且有IRF11基因。在进化过程中当物种分化进化产生两栖类时, IRF11基因在两栖类基因组中丢失, 由此导致两栖类、以及后来的爬行类、鸟类和哺乳类的基因组都没有IRF11基因, 只保留了IRF1等其他IRF家族基因。但是鱼类祖先保留了IRF11基因, 因此现存鱼类都具有IRF11基因。
表达分析发现polyI:C不仅能诱导斑马鱼IRF1/3/7的表达, 而且还能诱导斑马鱼IRF11的表达, 特别是在polyI:C诱导的细胞中, 4种斑马鱼IFN基因都有不同程度的表达。考虑到斑马鱼IRF1/3/7能显著诱导IFN基因表达[5,6], IRF11的这种表达特性表明其可能也在鱼类IFN抗病毒免疫中发挥某种功能。
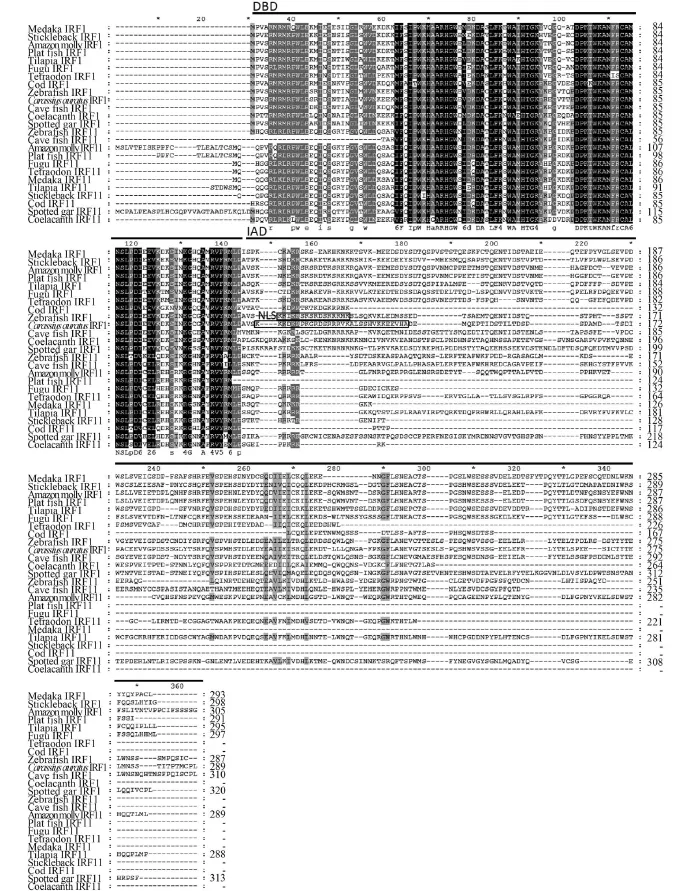
图 3 鱼类IRF1和IRF11蛋白序列比较Fig. 3 Multiple alignments of fish IRF1 and IRF11DBD区域和IAD区域用横线标出, 保守的氨基酸序列用星号标出; IAD区域的核定位信号NLS用方框标出; IRF序列信息来源请见表 1The DNA-binding domain (DBD) and IRF association domain (IAD) are indicated by lines above the aligned sequences. Identical amino acid residues are highlighted with black shading. The accession numbers of IRF genes are shown in Tab. 1
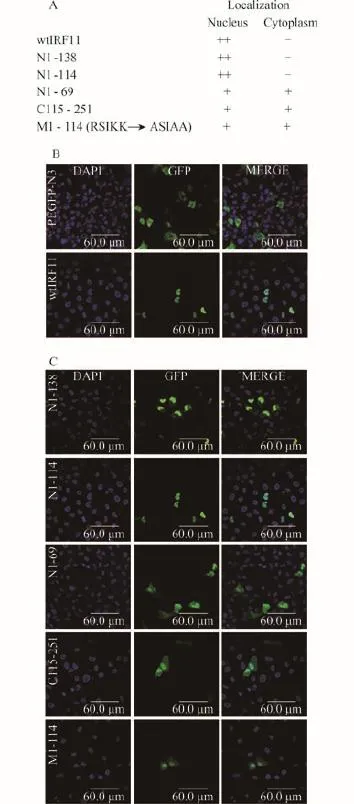
图 4 斑马鱼IRF11的亚细胞定位Fig. 4 Subcellular distribution of zebrafish IRF11 and different truncatesA.与GFP融合各种长度的IRF11质粒及亚细胞定位; B和C. 各种融合GFP的斑马鱼IRF11转染EPC细胞, 24h后用激光共聚焦显微镜检测A. Schematic diagram of zebrafish IRF11-GFP fusion proteins and their respective subcellular localization. B and C. EPC cells were transiently transfected with control GFP plasmid or different kinds of IRF11 plasmids that fused with GFP for 24h, and examined using confocal laser scanning microscope
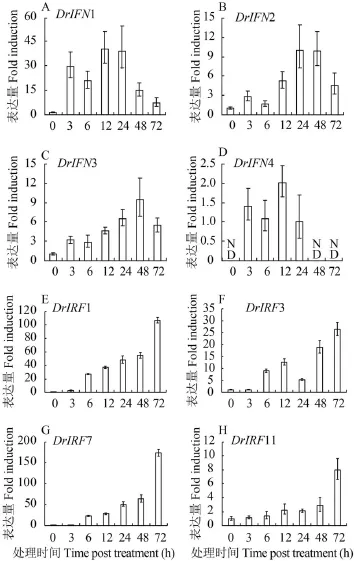
图 5 poly (I:C)诱导斑马鱼IRF11及其他相关基因表达分析Fig. 5 Inducible expression of zebrafish IRF11 and other related genes in poly (I:C)-transfected ZFL cellspoly I:C (2 mg/mL) 转染ZFL细胞, 获得不同时序细胞总RNA样, real-time PCR方法检测斑马鱼IFN1 (A)、IFN2 (B)、IFN3 (C)、IFN4 (D)、IRF1 (E)、IRF3 (F)、IRF7 (G)、IRF11 (H)的表达; ND. 未检测到ZFL cells were transfected with poly (I:C) and were sampled for mRNA at 0, 3h, 6h, 12h, 24h, 48h, 72h. Real-time PCR was used to detect the expression of zebrafish IFN1 (A), IFN2 (B), IFN3 (C), IFN4 (D), IRF1 (E), IRF3 (F), IRF7 (G), IRF11 (H); ND. Not detected
IRF11与IRF1一样, 其表达蛋白定位在细胞核。人IRF1的核定位信号紧邻DBD结构域[1,11]。我们前期研究发现, 与人IRF1核定位信号区域相对应的鲫和斑马鱼IRF1蛋白的氨基酸片段也富含R和K, 能发挥引导IRF1蛋白进入细胞核的功能[4,6]。研究结果还表明, 除了紧邻DBD结构域的核定位信号外, 鲫IRF1和斑马鱼IRF1的DBD结构域也有富含R、K的氨基酸片段, 缺失和突变研究发现它们也具有引导IRF1蛋白定位细胞核的作用[4,6]。本结果显示, 斑马鱼IRF11的N端DBD具有核定位信号, 该核定位信号足以引导蛋白的核定位。序列缺失研究发现核定位信号应该位于斑马鱼IRF11氨基酸70—114, 进一步的氨基酸突变证实97RSIKK101在IRF11蛋白的核定位中发挥作用。但是当在细胞中过量表达用斑马鱼IRF11的C端部分构建的表达质粒时, 表达蛋白大部分位于细胞核, 少部分位于细胞质, 表明斑马鱼IRF的C端IAD也有核定位信号存在。由于DBD编码蛋白全部位于细胞核, 因此与DBD中的核定位信号相比, C端IAD中的核定位信号可能仅在斑马鱼IRF11的核定位中发挥辅助定位功能。
[1]Miyamoto M, Fujita T, Kimura Y, et al. Regulated expression of a gene encoding a nuclear factor, IRF-1, that specifically binds to IFN-beta gene regulatory elements [J]. Cell, 1988, 54: 903—913
[2]Tamura T, Yanai H, Savitsky D, et al. The IRF family transcription factors in immunity and oncogenesis [J]. Annual Review Immunology, 2008, 26: 535—584
[3]Zhang Y, Hu C, Zhang J, et al. Molecular cloning and characterization of crucian carp (Carassius auratus L.) interferon regulatory factor 7 [J]. Fish Shellfish Immunology, 2003, 15: 453—466
[4]Shi Y, Zhang YB, Zhao Z, et al. Molecular characterization and subcellular localization of Carassius auratus interferon regulatory factor-1 [J]. Developmental and Comparative Immunology, 2008, 32: 134—146
[5]Sun F, Zhang YB, Liu TK, et al. Characterization of fish IRF3 as an IFN-inducible protein reveals evolving regulation of IFN response in vertebrates [J]. The Journal of Immunology, 2010, 185: 7573—7582
[6]Feng H, Zhang YB, Zhang QM, et al. Zebrafish IRF1 regulates IFN antiviral response through binding to IFN-varphi1 and IFNvarphi3 promoters downstream of MyD88 signaling [J]. The Journal of Immunology, 2015, 194: 1225—1238
[7]Stein C, Caccamo M, Laird G, et al. Conservation and divergence of gene families encoding components of innate immune response systems in zebrafish [J]. Genome Biology, 2007, 8: R251
[8]Liu Y, Zhang YB, Liu TK, et al. Lineage-specific expansion of IFIT gene family: an insight into coevolution with IFN gene family [J]. PLoS One, 2013, 8: e66859
[9]Liu T K, Zhang Y B, Liu Y, et al. Cooperative roles of fish protein kinase containing Z-DNA binding domains and double-stranded RNA-dependent protein kinase in interferon-mediated antiviral response [J]. Journal of Virology, 2011, 85: 12769—12780
[10]Barnes B J, Kellum M J, Field AE, et al. Multiple regulatory domains of IRF-5 control activation, cellular localization, and induction of chemokines that mediate recruitment of T lymphocytes [J]. Molecular and Cellular Biology, 2002, 22: 5721—5740
[11]Fujita T, Reis L F, Watanabe N, et al. Induction of the transcription factor IRF-1 and interferon-beta mRNAs by cytokines and activators of second-messenger pathways [J]. Proceedings of the National Academy Science USA, 1989, 86: 9936—9940
IDENTIFICATION, SUBCELLULAR LOCALIZATION AND EXPRESSION CHARACTERIZATION OF ZEBRAFISH IRF11
XIONG Ya-Wei1,2, ZHANG Yi-Bing1and GUI Jian-Fang1
(1. State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China)
Previous studies have shown that IRF11 is a fish-specific gene. There is confusion in nomenclature of IRF1 and IRF11 in the version 9 of the zebrafish genome. Herein, gene synteny of IRF1 and IRF11 was analyzed in some vertebrates, suggesting that IRF11 and IRF1 are two different genes and are not appropriate to name IRF1b and IRF1a, respectively. Phylogenetic tree analysis showed that fish IRF11 shows similar evolution distance to either IRF1 or IRF2, and that fish IRF11 occurred earlier in a vertebrate ancestor than did fish IRF1 and IRF2 likely due to gene loss in nonfish vertebrates during evolution. Like vertebrate IRF1, zebrafish IRF11 resided in nucleus, which was sufficiently directed by a nuclear localization sequence in N-terminal DNA binding domain. Expression analysis revealed that zebrafish IRF11 was transcriptionally induced by poly (I:C), although at a lower level than zebrafish IRF1.
Zebrafish; IRF11; Subcellular localization; Inducible expression
Q344+.1
A
1000-3207(2017)01-0001-08
10.7541/2017.1
2016-03-02;
2016-07-16
国家自然科学基金(31272690、31572646)资助 [Supported by the National Natural Science Foundation of China (31272690, 31572646)]
熊亚玮(1990—), 女, 湖北襄阳人; 硕士研究生; 研究方向为鱼类免疫遗传学。E-mail: xiongyw1@126.com
张义兵, 博士, 研究员; E-mail: ybzhang@ihb.ac.cn

