氨基端前B型钠尿肽单克隆抗体的制备及其鉴定
谌海兰 陈 特 毕小云
(重庆医科大学附属第一医院检验科,重庆 400016)
氨基端前B型钠尿肽单克隆抗体的制备及其鉴定
谌海兰 陈 特 毕小云
(重庆医科大学附属第一医院检验科,重庆 400016)
目的 通过经典单克隆抗体制备技术制备氨基端前B型钠尿肽(NT-proBNP)单克隆抗体,将单克隆抗体进行特异性和亲和力鉴定,并用于免疫学检测试剂盒的开发。方法 用带His-Trx-标签蛋白的NT-proBNP免疫Balb/C小鼠制备单克隆抗体。使用PEG1500化学融合法将小鼠脾细胞与骨髓瘤细胞SP2/0进行融合。用不带标签的NT-proBNP对获取的杂交瘤细胞进行反复多次克隆筛选,将稳定分泌抗体的杂交瘤细胞株经腹腔注射Balb/C小鼠诱导产生腹水,经蛋白G亲和纯化后获得NT-proBNP单克隆抗体并对其进行亲和力和特异性进行鉴定。结果 成功进行细胞融合并获得4株稳定分泌单克隆抗体的杂交瘤细胞株,抗体分泌亚型为IgG1,可特异性识别NT-proBNP。经腹腔体内诱生法和蛋白G亲和纯化,获得高质量NT-proBNP单克隆抗体,经ELISA检测抗体效价在1∶105以上。结论 通过传统经典单克隆抗体制备技术成功制备NT-proBNP单克隆抗体,为NT-proBNP检测试剂盒的研发奠定了基础。
氨基端前B型钠尿肽;单克隆抗体;亲和纯化;心力衰竭
氨基端前B型钠尿肽(NT-proBNP)与B型钠尿肽(BNP)相比,具有半衰期更长、分子量更大、无生物学活性等特性,临床上将其用于心力衰竭、心肌梗死、急性冠脉综合征等心血管疾病的早期诊断和鉴别诊断,也用于呼吸困难的鉴别诊断。目前NT-proBNP主要采用进口罗氏公司的化学发光法检测,由于其试剂价格昂贵,临床广泛应用受到极大的限制,开发具有自主产权的国内NT-proBNP检测产品具有很高的经济价值和社会前景。单克隆抗体由于其优异的特异性,被广泛地应用于免疫学检测当中〔1〕。本实验前期通过分子克隆技术制备了带Trx-His标签的NT-proBNP蛋白,用该蛋白免疫小鼠,并用获取的高纯度无标签的NT-proBNP〔2〕蛋白筛选杂交瘤细胞制备单克隆抗体,经染色体计数分析,获得多株可稳定分泌抗体的单克隆细胞株,通过腹水诱生和亲和纯化获得了高质量的单克隆抗体,为NT-proBNP免疫学检测试剂盒的研发奠定基础。
1 材料与方法
1.1 试剂与仪器 胎牛血清(Hyclone 公司);RPMI1640培养基(Hyclone 公司);福氏佐剂、PEG1500(Roche公司);8-AG、次黄嘌呤-氨基蝶呤-胸腺嘧啶核苷(HAT)、次黄嘌呤-胸腺嘧啶核苷(HT,Sigma公司);单克隆抗体亚型鉴定试剂盒(Santa Cruz公司);Sulfo-NHS-LC-Biotin(Sigma Aldrich 公司);1 kD透析袋(生工生物);HRP标记的链霉亲和素(博士德公司);恒温CO2孵箱(Thermo scientific 公司);水平离心机(Thermo scentific 公司 );普通光学显微镜、电子显微镜(Olympus 公司);蛋白G亲和纯化柱、蛋白纯化仪(KTA purifier)(GE公司),Bradford蛋白浓度测定试剂盒(碧云天公司),酶标仪(SUNRISE公司)。
1.2 实验动物和细胞 Balb/C 雌性小鼠,SPF级别,6周龄(免疫)和4周龄(制备饲养细胞),购自重庆医科大学实验动物中心并于动物中心处代养。SP2/0小鼠骨髓瘤细胞购自上海生命科学研究所,由实验室传代培养并经返祖试验筛选获得。
1.3 方法
1.3.1 NT-proBNP免疫小鼠 Balb/C雌性小鼠于免疫前采尾血测本底效价,选取无本底效价的小鼠进行免疫。首次免疫:pet32a(+)-NT-proBNP重组带标签的蛋白按150 μg/只免疫,蛋白与等体积完全福氏佐剂混合后,于4℃磁珠搅拌乳化至油包水样,于SPF实验室中皮下多点免疫注射小鼠背部、腋窝、四肢、腹股沟。首次免疫后2 w进行第二次免疫,剂量为100 μg/只,蛋白与不完全福氏佐剂乳化后于小鼠背部、腋窝、四肢、腹股沟,多点免疫。二次免疫后2 w进行第三次免疫,方法、剂量同第二次。第三次免疫7 d后采小鼠尾血测效价。选取效价在106以上小鼠取脾融合。于融合前3 d对小鼠进行冲击免疫:选择尾静脉注射,100 μg/只。
1.3.2 SP2/0骨髓瘤细胞和饲养细胞的制备 SP2/0骨髓瘤细胞于融合前两周用8-氮鸟嘌呤饲养3~7 d,观察是否有返祖现象。融合后的杂交瘤细胞生长所需生长因子,选择同品系2~4周龄Balb/C小鼠腹腔巨噬细胞提供。每只Balb/C 小鼠可铺制2~4块96孔板。方法:Balb/C 小鼠处死后,于75%酒精浸泡10 min彻底消毒,用大头钉固定于解剖板,10 ml注射器吸取5~10 ml RPMI1640,缓慢注入小鼠腹腔,反复缓慢抽打几次后吸出,注入10 ml离心管中,用RPMI1640,1 000 r/min,10 min洗涤2次,弃上清,用完全培养基重悬后细胞计数,调整细胞浓度4×105/ml,巴氏吸管滴加入96孔培养板中,每孔150 μl。
1.3.3 SP2/0骨髓瘤细胞与脾细胞的融合 收集SP2/0骨髓瘤细胞,用RPMI1640,1 000 r/min,5 min洗涤两次。将冲击免疫过的小鼠从SPF动物实验中心取出,取眼眶血离心分离血清作为以后筛选融合细胞的阳性对照。将含1×108个脾细胞的细胞悬液和2×107个骨髓瘤细胞的细胞悬液(细胞数之比为5∶1)移至50 ml离心管中,补加不含血清RPMI1640培养基30 ml,1 200 r/min,10 min,弃上清,吸弃残留液体,以免影响PEG1500浓度。食指轻弹离心管底使细胞沉淀松散。将离心管浸在预温至37℃水的烧杯中,用1 ml刻度吸管吸取1 ml预温至37℃的50% PEG1500溶液,在1 min之内沿离心管壁慢慢加入,边加边轻轻搅拌均匀,37℃水浴中作用30 s。1 min内加入1 ml 37℃预温的RPIM1640不完全培养基终止PEG1500作用,在3 min内加入3 ml不含血清的RPIM1640不完全培养基,10 min内缓慢加入10 ml RPIM1640不完全培养基。最后补加RPIM1640不完全培养基至30 ml,以水平离心机960 r/min,5 min离心,弃上清,加入HAT完全培养基重悬杂交瘤细胞。将融合杂交瘤细胞接种至10块已铺有饲养细胞的96孔细胞培养板,50 μl/孔,37℃,5%CO2细胞培养箱中培养〔3〕。
1.3.4 杂交瘤细胞的筛选、克隆和亚克隆 融合后第3天开始可以观察细胞状态,以后隔日观察一次,到第5天可半量换液,以后每3~5 d用HAT选择培养基半量换液。2 w后开始用HT选择培养基半量换液,4 w后用完全培养基培养。当杂交瘤细胞铺满96孔板的1/3时,用不带标签的NT-proBNP包被96孔酶标板,ELISA筛选获得阳性融合杂交瘤细胞株并进行克隆。当96孔板中单克隆细胞长至孔底1/3时继续进行ELISA筛选并进行阳性细胞株亚克隆,反复筛选得到持续分泌抗体的杂交瘤细胞株。将持续分泌抗体的细胞株存入液氮,以后每3个月进行复苏-冻存循环,检测抗体分泌情况,反复3次,最终确定稳定分泌抗体的细胞株。
1.3.5 杂交瘤细胞染色体计数 阳性克隆杂交瘤细胞,采用染色体计数可确定融合是否成功〔4〕。Balb/C 小鼠有40条染色体,SP2/0骨髓瘤细胞有62~68条,融合成功的杂交瘤细胞有染色体共102~108条。
1.3.6 杂交瘤细胞诱生小鼠腹水 选取2~3个月龄同品系Balb/C雌性小鼠制备腹水。注射细胞前7 d采用不完全福氏佐剂300 μl/只腹腔注射,以激发小鼠处于反应状态。调整8E8杂交瘤细胞浓度至1×106/ml,500 μl/只进行注射。注射后7 d左右开始产生腹水,用5 ml注射器针头收集腹水。腹水离心:3 000 r/min,10 min,留取上清,弃去沉淀和脂质成分,离心2次,-20℃保存。
1.3.7 单克隆抗体的纯化 4℃解冻8E8细胞株腹水,0.22 μm滤膜过滤,用无菌PBS将腹水稀释5~10倍,蛋白G亲和纯化柱用PBS平衡至基线后,以1 ml/min缓慢上样稀释后的腹水,单克隆抗体特异性结合于亲和纯化柱上,上样完后以PBS平衡亲和纯化柱至基线,再用pH2.7的100 mmol/L甘氨酸洗脱结合于亲和柱上的抗体,在收集到的抗体洗脱液中加入适量pH9.0的1 mol/L Tris平衡液体,以防止抗体蛋白沉淀,用分子量5 000的超滤膜浓缩洗脱抗体后用Bradford测抗体浓度,分装后-20℃保存。
1.3.8 单克隆抗体效价测定及亚型鉴定 ELISA反应板中包被无标签的NT-proBNP,加入纯化后的单克隆抗体共同孵育,洗涤后再加入辣根过氧化物酶标记的羊抗鼠二抗,二抗IgG亚型分别有IgG1、IgG2a、IgG2b、 IgG3,鉴定单克隆抗体的亚型。将纯化并浓缩后得到的抗体用PBS倍比稀释测定抗体效价。
1.3.9 单克隆抗体的Western印迹鉴定 将纯化后的8E8单克隆抗体用Western印迹检测抗体特异性,分别与pet32a(+)Trx-His蛋白、pet32a(+)-NT-proBNP、NT-proBNP反应,结果显示:纯化后的8E8单克隆抗体与Trx-His标签蛋白不结合,与pet32a(+)NT-proBNP和NT-proBNP均为阳性反应,证明8E8单克隆抗体具有较好的特异性。
1.3.10 单克隆抗体的方法学验证 将蛋白G亲和纯化后的8E8 NT-proBNP单克隆抗体用生物素进行标记,用NT-proBNP多克隆抗体包被96孔酶标板,进行双抗体夹心反应,以HRP标记的链霉亲和素进行显色,对免疫学检测方法的建立进行初步摸索,寻找最适多抗包被浓度和最优单抗反应浓度。同时寻找其他影响双抗夹心反应的最适反应条件。多克隆抗体使用前用PBS充分透析,分装后-40℃保存。单克隆抗体生物素标记前应将纯化后的单克隆抗体用pH9.5的碳酸盐透析液充分透析以去除纯化过程中带入的Tris和甘氨酸等物质,生物素标记单抗的方法详见Sigma Aldrich (H1759)说明书。标记后的生物素化单克隆抗体需用1 kD孔径的生物透析袋4℃对PBS磁珠搅拌透析,每3~4 h换一次透析液,直至将游离的生物素完全透析除去为止,以Bradford测标记后的抗体-生物素蛋白浓度,分装后-40℃保存。
2 结 果
2.1 免疫小鼠效价测定 Balb/C小鼠免疫前经ELISA检测未检测到本底效价,经三次皮下免疫及一次尾静脉加强免疫后做细胞融合,融合时取眼眶血测效价,两只小鼠融合时抗体效价分别为1号:4.8×106,2号:2.4×106,均达到细胞融合要求。

图1 杂交瘤细胞染色体计数(×40)
2.2 杂交瘤细胞染色体计数 融合成功的细胞经纯蛋白筛选后获得4株稳定分泌抗体的细胞株分别为:1F7、1B11、5E5和8E8。取亚克隆三次的单克隆细胞株染色体计数,在油镜下观察1F7、1B11、5E5和8E8并计数(图1),可见四株细胞染色体计数都在100条以上(骨髓瘤细胞染色体为62~68条,Balb/C小鼠脾细胞染色体为40条),证明细胞融合成功。
2.3 杂交瘤细胞抗体亚型鉴定 反复克隆多次的杂交瘤细胞株经ELISA鉴定抗体亚型,450 nm测吸光度,可见四株细胞亚型均为IgG1,见表1,证明细胞已达到较好的单克隆状态,成功获得NT-proBNP单克隆细胞株。

表1 单克隆抗体亚型鉴定
2.4 单克隆抗体的纯化 将8E8单克隆细胞株杂交瘤细胞腹腔注射Balb/C小鼠,获取的腹水经蛋白G亲和纯化法纯化单克隆抗体,在GE AKTA Purifier,UV 280 nm监测下可见一个明显的单克隆抗体蛋白峰,见图2。获得的单克隆抗体经SDS-PAGE鉴定,可见κ链位于55 kD,λ链位于25 kD处,纯度可达95%以上,见图3。

A:穿透峰;B:单克隆抗体洗脱峰图2 单克隆抗体亲和纯化图

图3 单克隆抗体SDS-PAGE鉴定
2.5 免疫印迹鉴定单克隆抗体特异性 经蛋白G亲和纯化后的8E8单克隆抗体以1∶100稀释用于单克隆抗体的特异性鉴定,可见,8E8单克隆抗体与pet32a(+)NT-proBNP和NT-proBNP蛋白有特异性反应,与pet32a(+)Trx-His标签蛋白无反应,表明单克隆抗体具有较好的特异性,见图4。经ELISA检测亲和纯化后的单克隆抗体亲和力,效价在1∶105以上。
2.6 单克隆抗体的方法学验证 建立免疫学检测方法,首先对封闭液的封闭效果进行了优化,分别采用了2%BSA,5%BSA,10%BSA,2.5%BSA+100 μg/ml salmon DNA,5%BSA+100 μg/ml salmon DNA,结果显示在2.5%BSA+100 μg/ml salmon DNA时封闭效果最好,背景本底最低。
多克隆抗体以不同浓度梯度(10、5.0、2.5、1.25、1.0、0.625 μg/ml)以磷酸盐缓冲液100 μl/孔,在4℃包被过夜,以不同浓度的生物素标记的8E8单克隆抗体浓度(10、5.0、2.5、1.25、0.625、0.312 5、0.156 μg/ml),以棋盘法寻找最优生物素标记单克隆抗体与多克隆抗体的反应浓度,由表2可见,最适多克隆抗体包被浓度为1.25 μg/ml,最适生物素标记单克隆抗体浓度为0.312 5 μg/ml。通过不同浓度的HRP标记的亲和素,以及不同浓度的TMB显色剂,也是通过棋盘法来寻找最优的反应浓度,结果显示在设定显色反应时间为25 min时:在亲和素-HRP稀释浓度为1∶8 000,TMB使用浓度为1∶400时,二者反应比例最好,显色最深。
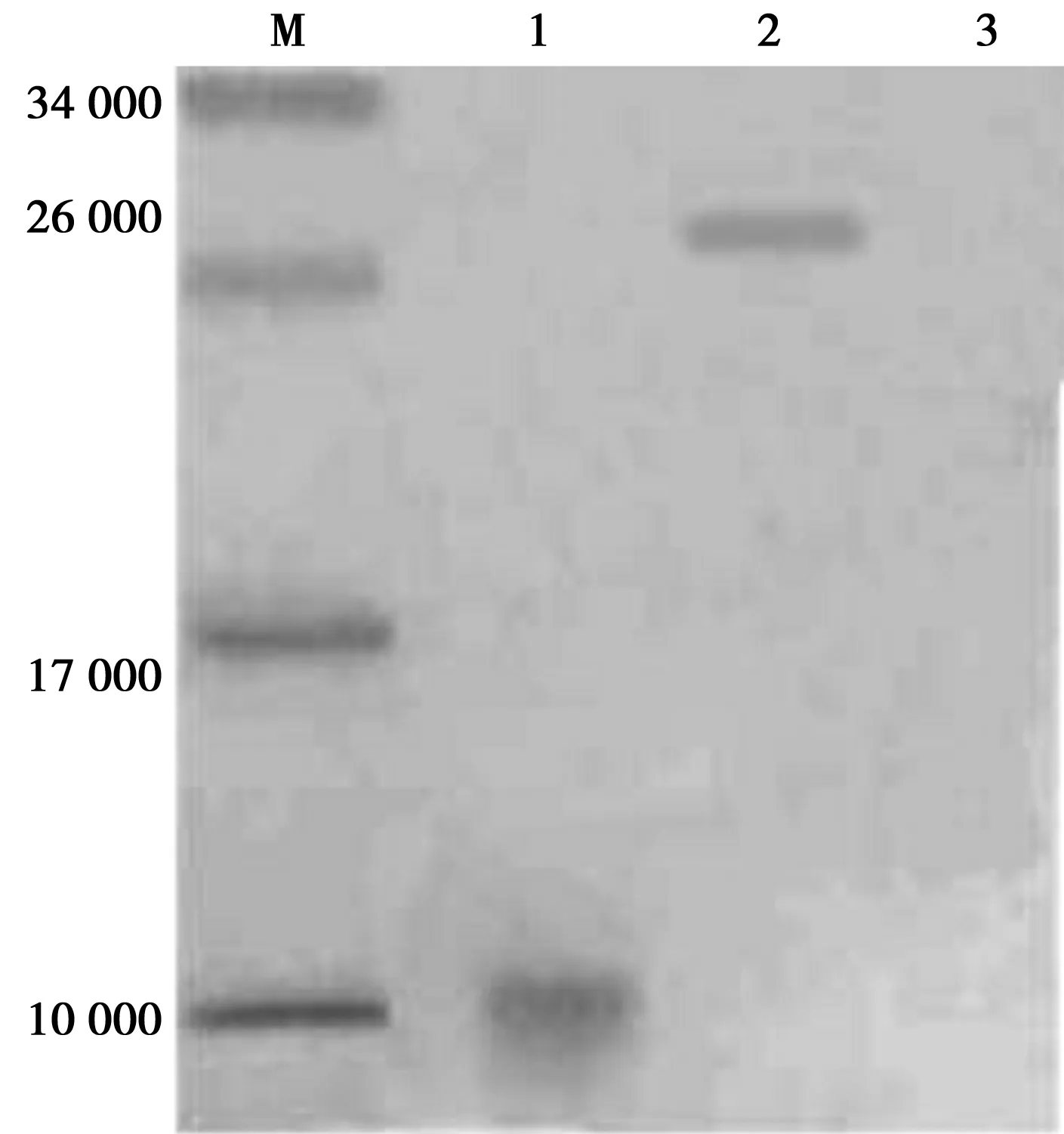
1:NT-proBNP;2:pet32a(+)NT-proBNP;3:pet32a(+) 标签蛋白;M:Marker图4 单克隆抗体免疫印迹鉴定抗体特异性表2 多克隆抗体浓度和生物素标记单克隆抗体 浓度的优化(μg/ml)

包被多克隆抗体(μg/ml)52.51.250.6250.31250.16551.7621.8371.7291.391.1681.2812.51.9362.141.9861.8641.8961.8361.252.0361.982.0511.8442.1511.8341.02.0661.9461.9851.8781.891.8320.50.4660.6010.3880.2320.1770.179
3 讨 论
本研究前期构建了质粒pet32a(+)NT-proBNP,获得了带Trx-His标签的NT-proBNP,由于NT-proBNP分子量小,为提高其免疫原性,本实验用带Trx-His标签的NT-proBNP蛋白作为免疫原免疫小鼠,为了排除针对标签抗体的单克隆抗体,筛选时用无标签NT-proBNP筛选单克隆细胞株。本研究通过经典杂交瘤技术获得了NT-proBNP杂交瘤细胞并对其进行了亚型分析,通过腹水诱生法制备了NT-proBNP单克隆抗体,使用蛋白柱亲和层析纯化的方法得到了高纯度的单克隆抗体,鉴定了单克隆抗体的特异性。一株好的单克隆抗体不仅需要具有高的特异性还要求具有高的亲和力,本研究获得的单克隆抗体效价在105左右,可以满足科研检测的需要,需要获得更高效价的单克隆抗体,可以通过低温超滤浓缩,或通过提高抗体纯化技术得到更高效价的单克隆抗体。本研究成功获得NT-proBNP的优质抗原、高质量多克隆抗体和优质单克隆抗体,通过初步试验证明该抗原、多克隆抗体、单克隆抗体可以有效结合反应,为下一步研发NT-proBNP的免疫学检测试剂盒奠定了基础。NT-proBNP作为公认有效的诊断心力衰竭,以及鉴别诊断心衰的指标,应用越来越受到推崇,但是,目前NT-proBNP电化学发光检测试剂盒仍然需要从国外进口,价格非常昂贵〔5~9〕。国内市场开发出了一些试剂盒,但其检测方法多为金标法,其灵敏度还较低,不能满足临床医生对诊断的需求。NT-proBNP的电化学发光检测最核心的技术是其单克隆抗体的获得,其效价、纯度的优劣直接关系到产品的质量,国内市场要在这方面取得突破,还需加大研发力度以获得高质量的单抗。
1 曹雪涛.免疫学研究的发展趋势及我国免疫学研究的现状与展望〔J〕.中国免疫学杂志,2009;25(1):10-23.
2 谌海兰,陈 曦,徐绣宇,等.无标签NT-proBNP重组蛋白的获得及多克隆抗体的制备〔J〕.临床检验杂志,2012;30(11):902-5.
3 Chinen J,Shearer WT.Advances in basic and clinical immunology in 2010〔J〕.Allerg Clin Immunol,2011;127(2):336-41.
4 Januzzi JL Jr,Chen-Tournoux AA,Moe G.Amino-terminal pro-B-type natriuretic peptide testing for the diagnosis or exclusion of heart failure in patients with acute symptoms〔J〕.Am J Cardiol,2008;101(3A):29-38.
5 Gaggin HK,Januzzi Jr JL.Biomarkers and diagnostics in heart failure〔J〕.Biochim Biophys Acta,2013;1832(12):2442-50.
6 Popcel JM,Bielsa S.Comparison of pleural N-terminal pro-B-type natriuretic peptide,midregion pro-atrial natriuretic peptide and mid-region pro-adrenomedullin for the diagnosis of pleural effusions associated with cardiac failure〔J〕.Respirology,2013;18(3):540-5.
7 Zhou Q,Ye ZJ,Su Y.Diagnostic value of N-terminal pro-brain natriuretic peptide for pleural effusion due to heart failure:a meta-analysis〔J〕.Heart,2010;96(15):1207-11.
8 Alehagen U,Dahlstr U,Rehfeld JF,etal.ProeA-type natriuretic peptide,proadrenomedullin and N-Terminal proeB-type natriuretic peptide used in a multimarker strategy in primary health care in risk assessment of patients with symptoms of heart failure〔J〕.J Cardiac Fail,2013;19(1):31-9.
9 Huntley BK,Sandberg SM,Heublein DM.ProBNP1-108 processing and degradation in human heart failure〔J〕.Circ Heart Fail,2014;8(1):17-9.
〔2015-08-11修回〕
(编辑 苑云杰/曹梦园)
Preparation and identification of monoclonal antibody against NT-proBNP
CHEN Hai-Lan, CHEN Te, BI Xiao-Yun.
Department of Laboratory, the First Affiliated Hospital of Chongqing Medical University, Chongqing 400016, China
Objective To make monoclonal antibody of N-terminal pro-B-type natriuretic peptide (NT-proBNP) with traditional chemical fusion and cloning screens technique, identify the specificity and affinity, provide a foothold for constructing immunological test kit with this acquired antibodies for NT-proBNP.Methods Chemical fusion technique was used to get hybridoma of NT-proBNP. Hybridomas were identified with chromosome dyeing counting. Monoclonal antibodies of NT-proBNP were acquired by peritoneal injection hybridomas in Balb/C mouses. Monoclonal antibodies of 8E8 were purified by protein G affinity purification in GE AKTA Purifier. SDS-PAGE identified the purity quotient of it. The affinity was identified with ELISA, and Western blot was used to identify the specificity of this antibodies.Results Chromosome dyeing counting proved that hybridomas were prepared successfully. Four hybridomas (1F7,1B11,5E5 and 8E8)steadily secreting NT-proBNP monoclonal antibody were screened out. The isotype of all the four hybridomas was IgG1. The titer of the 8E8 monoclonal antibody after purified with protein G affinity was above 105 with a good purity quotient up to 95%. Western blot showed that this antibody had a good conjugation with NT-proBNP.Conclusions The hybridomas persistent secreting monoclonal antibody against NT-proBNP are successfully prepared. This would be an outstanding experimental basis for NT-proBNP immunological kit construction.
NT-proBNP;Monoclonal antibody;Affinity purification;Heart failure
国家自然科学基金项目(31270984)
谌海兰(1984-),女,硕士,检验技师,主要从事病原微生物学致病机制及体外诊断试剂研发研究。
R541.6
A
1005-9202(2017)03-0525-04;
10.3969/j.issn.1005-9202.2017.03.002

