烟草的TMV侵染耐受性与谷胱甘肽代谢途径的关系
王 静,周 祁,李丽华,郝风声,魏远方,杨立均,刘卫群*
(1.河南农业大学 烟草学院,河南 郑州 450002; 2.河南农业大学 生命科学学院,河南 郑州 450002;3.河南省农业科学院 粮食作物研究所,河南 郑州 450002; 4.河南省烟草公司 驻马店市公司,河南 驻马店463000)
烟草的TMV侵染耐受性与谷胱甘肽代谢途径的关系
王 静1,周 祁2,李丽华3,郝风声2,魏远方2,杨立均4,刘卫群2*
(1.河南农业大学 烟草学院,河南 郑州 450002; 2.河南农业大学 生命科学学院,河南 郑州 450002;3.河南省农业科学院 粮食作物研究所,河南 郑州 450002; 4.河南省烟草公司 驻马店市公司,河南 驻马店463000)
为了深入了解烟草对烟草花叶病毒(TMV)的抗性机制,以耐受TMV感染品种豫烟8号和具有相同遗传背景对花叶病敏感的品种NC89为材料,通过对高通量测序获得的转录组数据进行生物信息学分析发现,二者接种TMV后的差异表达基因富集通路中共同存在谷胱甘肽代谢途径,且耐受性品种豫烟8号中该途径有增强的趋势。采用荧光定量PCR和分光光度法检测了两品种接种TMV前后谷胱甘肽代谢途径中关键酶谷胱甘肽S转移酶(GST)基因表达水平、酶活性以及谷胱甘肽(GSH)含量的变化。结果表明,接种TMV后两品种中GST基因表达水平升高,GST酶活性增强,GSH含量升高,耐受性品种豫烟8号增幅更明显。通过硫元素的丰缺试验研究了接种TMV对GST基因及与TMV侵染耐受性相关基因表达水平的影响,结果显示,+S和-S处理中两品种接种病毒后这些基因的表达趋势一致,-S处理的表达量低于+S处理。GST、PR1-a、HSP90和Catalase-3这些抗病相关基因都呈上调表达,其中豫烟8号接种后的表达量均高于NC89;而PsbA和PhotosystemⅡ 10kDapolypeptide2个涉及光合作用的基因均呈现下调表达,但是接种后豫烟8号的下调幅度小于NC89。以上表明,在耐受TMV感染的品种中,谷胱甘肽代谢增强对细胞环境的氧化还原平衡有一定的促进作用,使光系统Ⅱ中的关键成分D1蛋白基因PsbA的表达相对稳定,从而减轻光合系统的破坏程度。
烟草花叶病毒; 耐受性; 谷胱甘肽; 谷胱甘肽S转移酶
烟草花叶病毒(tobacco mosaic virus,TMV)是世界上最先被分离、鉴定的病毒[1],也是烟草栽培生产上普遍发生且危害严重的侵染性病原[2],其寄主范围非常广泛,可侵染茄科、葫芦科、十字花科、藜科、苋科、豆科和商陆科等36科350种植物[3]。自Mayer[4]首次发现感染TMV烟草的叶片通过汁液传播可以使健康烟株感病至今,国内外针对抗TMV的研究主要集中在TMV的发生条件、防治措施和筛选抗TMV烟草品种等领域。但由于该病毒的寄主范围广,且与寄主的寄生关系复杂,使得花叶病的研究和防治还未达到理想的效果。随着植物病毒抗药性的增加和人们对生态环境的重视,化学药剂防治的发展受到限制。同时,由于远缘烟草品种在杂交育种时存在生殖隔离,抗性基因在品种间很难转移。这一系列问题导致烟草花叶病仍是现阶段烟叶生产中的主要病害,许多研究工作尚需进一步深入开展。
近年来,功能基因组学的发展,尤其是转录组和蛋白质组的深入研究,在探讨特定时期基因转录水平的表达丰度及大规模分析基因的表达模式等方面起着重要的作用[5-7]。为了更深入地了解烟草对花叶病的抗性机制,杨立均等[8]从TMV高发病的NC89烟田中筛选出无病健壮变异单株,经过几代选育而成豫烟8号品系,将其作为一个耐受病毒侵染的材料,以对花叶病敏感的NC89作为参照材料,通过高通量测序技术进行转录组和蛋白质组分析发现,2个品种在响应TMV的差异表达基因富集通路中共同存在谷胱甘肽代谢途径,而且在耐受性品种豫烟8号的特异表达基因富集通路中也存在该途径,表明耐受性品种感染TMV后该途径的某些物质发生了特异性变化(未发表)。因此,本研究采用荧光定量PCR和分光光度法对该通路中的关键酶谷胱甘肽S转移酶(glutathione S-transferase,GST)基因表达水平和由该基因编码的GST酶活性以及谷胱甘肽(glutathione,GSH)含量进行检测,探讨谷胱甘肽代谢途径增强对提高TMV侵染耐受性的作用,为进一步阐明TMV与植物互作机制奠定基础。
1 材料和方法
1.1 试剂和材料
Trizol试剂购自Invitrogen生物技术有限公司;反转录试剂盒、荧光定量试剂均购自TaKaRa公司;还原型谷胱甘肽试剂盒和谷胱甘肽S转移酶试剂盒均购自苏州科铭生物技术有限公司;其他常规试剂均为国产分析纯。供试材料豫烟8号和NC89均由驻马店市烟草公司提供。
1.2 病毒源提取、接种与取样
TMV病毒源提取与接种参照杨立均等[9]的方法。两品种接种病毒后分别在0 h和24 h取接种叶片上部叶,立即用液氮冷冻处理。
1.3 总 RNA 提取与cDNA第一链合成
总RNA提取采用Trizol试剂按操作手册进行;cDNA第一链合成按照TaKaRa公司的PrimeScriptTMRT Reagent Kit说明书进行操作。
1.4 差异表达基因的筛选和实时荧光定量PCR验证
对前期转录组数据在京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)中进行富集分析发现,谷胱甘肽代谢途径处于高水平。为了验证转录组分析所获得的差异表达基因的可靠性,对GST基因的表达水平变化进行验证,根据基因序列设计特异性引物(表 1),选用烟草Actin基因为内参基因。实时荧光定量PCR的反应体系(总体系10 μL)为:SYBR GREEN 5 μL、正向引物(F) 0.1 μL、反向引物(R) 0.1 μL、cDNA 1.25 μL、DEPC水 3.55 μL。每个样品做3组重复,反应条件为:95 ℃预变性2 min;95 ℃变性20 s,60 ℃退火20 s,72 ℃延伸20 s,40个循环。反应在BioRad IQ5 荧光定量PCR仪上进行,结果采用 2-ΔΔCT法分析,其中,CT是循环阈值,ΔCT是目的基因与内参基因CT值的差值,ΔΔCT是不同时间处理与对照ΔCT值的差值。

表1 差异表达基因的荧光定量PCR引物序列
1.5 两品种接种TMV前后GSH含量和GST活性的测定
将组织在液氮中磨碎,分别采用还原型谷胱甘肽试剂盒和谷胱甘肽S转移酶试剂盒测定GSH含量和GST活性。
1.6 通过硫元素的丰缺试验验证两品种对TMV耐受性的差异
试验按照Höller等[10]的方法进行。首先,将豫烟8号和NC89分别在石英砂上催芽;3周后将幼苗转移至石英砂与蛭石比例为1∶3的基质中,其中一部分用+S营养液[+S营养液配方:5 mmol/L KNO3、1 mmol/L KH2PO4、 2 mmol/L Mg(NO3)2、2.5 mmol/L CaSO4、1 mmol/L MgSO4、70 μmol/L EDTA-FeNa、4 mmol/L Ca(NO3)2、0.9 μmol/L ZnCl2、30 μmol/L H3BO3、0.9 μmol/L CuCl2、0.5 μmol/L MoO3、20 μmol/L MnCl2]给予充足的硫培养,另一部分一次性加5 mL+S营养液,之后采用不含硫配方的营养液(-S营养液,配方是将+S 配方中2.5 mmol/L CaSO4换成0.86 mmol/L CaCl2,去掉 1 mmol/L MgSO4);温度保持在18~22 ℃,湿度70%,光周期12 h。4周后接种TMV,提取RNA后分别对GST、PR1-a、HSP90、Catalase-3、PhotosystemⅡ 10kDapolypeptide和PsbA基因进行荧光定量PCR检测,其引物序列见表1。
2 结果与分析
2.1 两品种接种TMV前后谷胱甘肽代谢途径差异表达基因的筛选
已有研究表明,GST是植物体中广泛存在的一种具有多种功能的超家族酶,它不仅参与初生代谢、次生代谢、除草剂解毒[11-12],还具有保护植物免受氧化损伤及异源物质隔离等作用[13-15]。两品种接种TMV前后谷胱甘肽代谢途径中共有29个差异表达的unigene,其中,有20个为编码GST的unigene。相对NC89品种,豫烟8号接种TMV后有17个GST unigene高表达(表2),推测GST的高表达对抵抗TMV侵染具有重要意义。

表2 两品种接种TMV前后谷胱甘肽代谢途径的差异表达基因
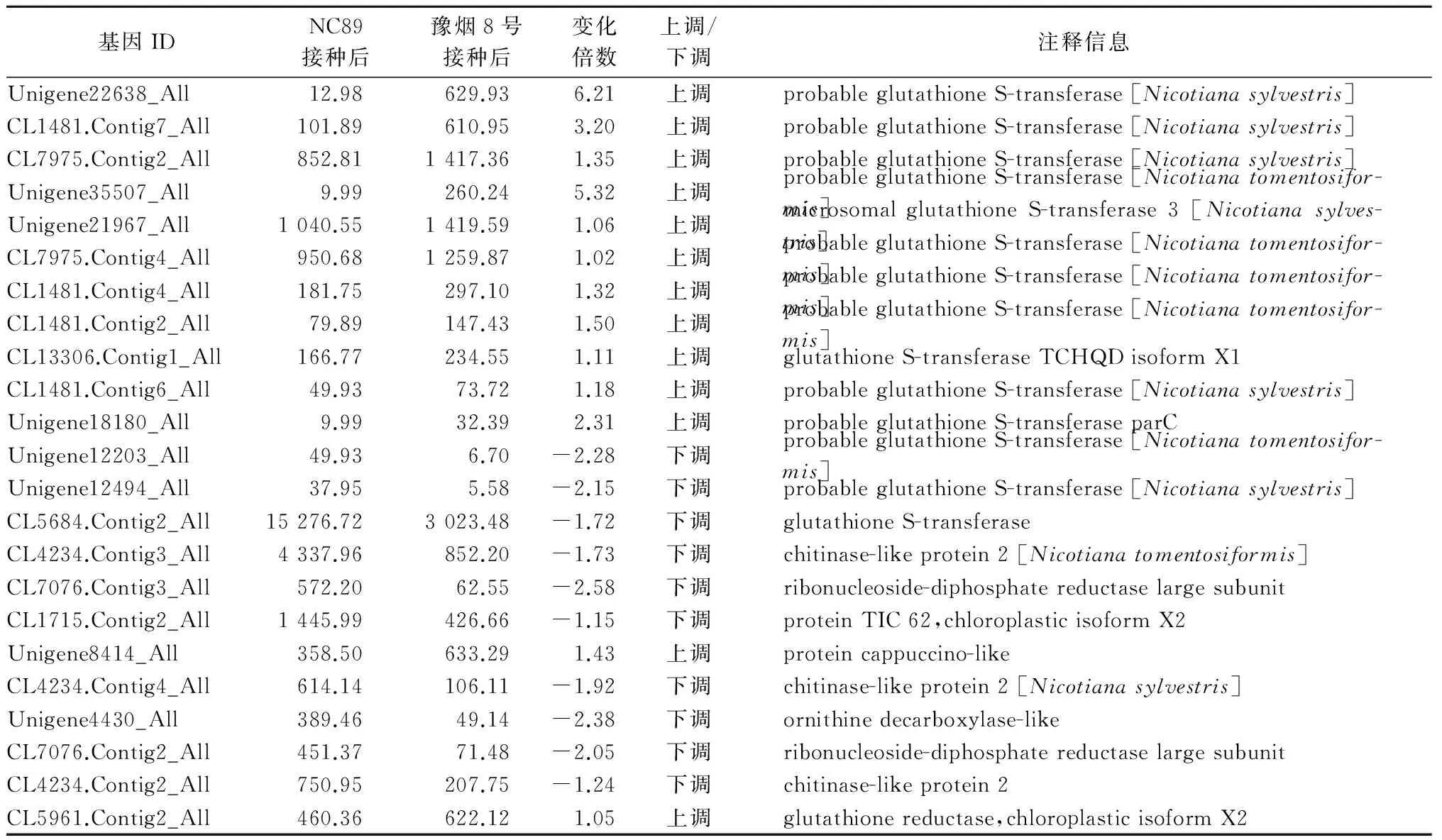
续表2 两品种接种TMV前后谷胱甘肽代谢途径的差异表达基因
2.2 荧光定量PCR验证转录组数据
为了验证上述筛选的差异表达基因,采用荧光定量PCR对两品种接种TMV前后的样品进行检测。结果显示,两品种在接种TMV 24 h后GST均上调表达(图1),且豫烟8号急速上调,表达量是NC89的2倍,这与转录组分析的上调趋势吻合。
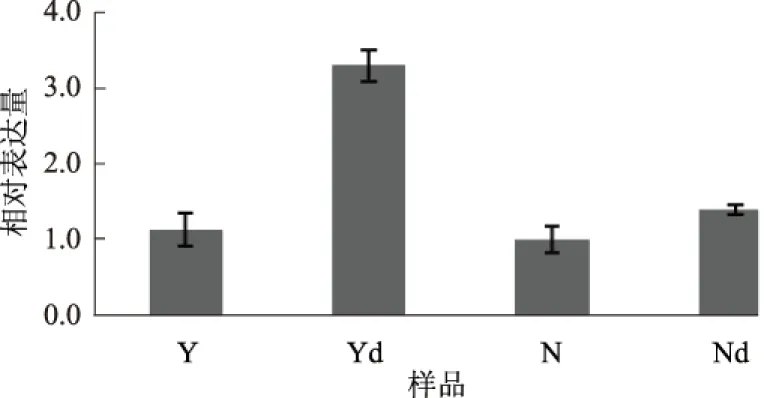
Y、N分别代表豫烟8号、NC89,Yd、Nd分别代表接种TMV 24 h后的豫烟8号、NC89,下同图1 荧光定量PCR验证GST基因的表达趋势
2.3 两品种接种TMV前后GSH含量和GST活性的变化
为了探明谷胱甘肽代谢途径与TMV耐受性的关系,检测了两品种接种TMV前(CK)和接种TMV 24 h后的GSH含量和GST活性。结果显示,两品种接种TMV后GSH含量以及GST活性都升高,其中,豫烟8号接种后上升幅度更为明显,GSH含量升高将近1倍(图2),GST活性是接种前的1.7倍(图3),表明谷胱甘肽代谢途径在烟草防御TMV侵染过程中起了重要的作用。

图2 接种TMV对GSH含量的影响

图3 接种TMV对GST活性的影响
2.4 不同硫元素浓度下接种TMV对GST及与TMV侵染耐受性相关基因表达的影响
许多文献已经报道,提供充足的硫元素能诱导植物产生对TMV的抗性,这种诱导抗性与谷胱甘肽代谢增强有关,因此,将这种抗性称为硫诱导抗性或增强抗性(SIR/SED)[16-17]。为了评估GST及与TMV侵染耐受性相关基因的功能,对豫烟8号和NC89分别进行了缺硫(-S)和富硫(+S)处理并接种TMV,采用荧光定量PCR技术对这8个样品的GST基因及其他5个与TMV抗性相关(PR1-a、HSP90和Catalase-3)或涉及光合作用(PsbA、PhotosystemⅡ 10kDapolypeptide)的基因进行检测。结果显示(图4),2个品种接种TMV前后,-S处理中这6个基因的表达趋势与+S处理一致,表达量稍低于后者。NC89和豫烟8号2个品种接种TMV后,GST、PR1-a、HSP90和Catalase-3这些抗病相关基因都呈上调表达,其中,豫烟8号接种后的表达量均高于NC89;2个涉及光合作用的基因均呈现下调表达,但是接种后豫烟8号的下调幅度小于NC89,尤其是-S处理中NC89接种后PsbA的表达量下调幅度明显大于豫烟8号,其表达量仅为豫烟8号表达量的一半。以上表明,供应充足的硫元素能提高植物的TMV耐受性,并且在耐受TMV感染的品种中,由于谷胱甘肽代谢增强,对细胞环境的氧化还原平衡有一定的促进作用,使光系统Ⅱ中的关键成分D1蛋白基因PsbA的表达相对稳定,从而减轻光合系统的破坏程度。

图4 GST及与TMV侵染耐受性相关基因的定量检测结果
3 结论与讨论
GST是植物体内普遍存在的小分子抗氧化物质,它在还原态硫的储存和转运、蛋白质和核酸的合成、酶活性的调节、组织抗氧化特性的维持以及对氧化还原敏感信号传导的调节中起着重要作用[18-19]。大量研究表明,植物防御能力的强弱与抗氧化系统水平的高低具有相关性,如Ball等[20]在拟南芥中发现,对镉敏感的GSH1突变体rax1-1改变了谷胱甘肽代谢,推测野生型植株中,谷胱甘肽代谢可能在信号转导和控制防御基因的表达中发挥了关键作用。本研究发现,谷胱甘肽代谢途径是2个烟草品种接种TMV后的差异表达基因富集通路中共同存在的代谢途径之一,且在豫烟8号接种后特异表达基因富集通路中该途径增强,尤其是该通路中的关键酶GST在豫烟8号接种TMV后高表达。研究表明,GST是谷胱甘肽代谢中重要的酶之一,除具有结合细胞内有毒物质转运外排的生理解毒功能和谷胱甘肽还原酶的功能外,还可以保护细胞免受氧化损伤,在植物修复中起着重要的作用[21-22]。目前,GST表达的增强已经被认为是植物对胁迫响应的重要标志之一[23]。本试验也发现,接种TMV后,抗性品种豫烟8号中的GST表达水平和GST酶活性均高于NC89品种;且无论在+S处理还是-S处理中,豫烟8号接种前后GST的表达量以及抗病相关基因PR1-a、HSP90和Catalase-3的表达量均高于NC89,同时豫烟8号中光系统Ⅱ的关键成分D1蛋白基因PsbA的表达相对稳定。由此推测,豫烟8号活跃的谷胱甘肽代谢维持了体内氧化还原平衡,从而减轻光合系统的破坏程度,这与Lim等[24]的研究结果一致。Lim等[24]发现,在瞿麦(DianthussuperbusL.)中过量表达烟草GST基因能够增强其在干旱及不同光照条件下的光合作用。因此,增强谷胱甘肽代谢途径有利于提高植物对TMV感染的耐受性。
[1] Bawden F C,Pirie N W,Bernal J D,etal.Liquid crystalline substances from virus-infected plants[J].Nature,1936,138:1051-1052.
[2] 马国胜,何博如.烟草病毒研究现状与展望[J].中国生态农业学报,2006,14(2):150-153.
[3] 雷彩燕,王振跃,张振臣,等.烟草花叶病毒株系研究进展[J].河南农业科学,2005(12):14-16.
[4] Mayer A.Concerning the mosaic disease of tobacco [J].Landivertschaftlichen Versuchs-Stationen,1886,32:451-467.
[5] Xu L,Zhu L,Tu L,etal.Lignin metabolism has a central role in the resistance of cotton to the wilt fungusVerticilliumdahliaeas revealed by RNA-seq-dependent transcriptional analysis and histochemistry[J].Journal of Experimental Botany,2011,62(15):5607-5621.
[6] Kawahara Y,Oono Y,Kanamori H,etal.Simultaneous RNA-seq analysis of a mixed transcriptome of rice and blast fungus interaction[J].PLoS One,2012,7(11):e49423.DOI:10.13718/j.cnki.zwys.2014.05.027.
[7] 苏亚春.甘蔗应答黑穗病菌侵染的转录组与蛋白组研究及抗性相关基因挖掘[D].福州:福建农林大学,2014.
[8] 杨立均,翟文汇,吴宁,等.豫烟8号的选育及其特征特性[J].河南农业科学,2012,41(9):59-62.
[9] 杨立均,赵钰泽,王静,等.烟草对烟草花叶病毒耐受性的早期防御反应[J].河南农业科学,2016,45(3):82-86.
[10] Höller K,Kiràly L,Künstler A,etal.Enhanced glutathione metabolism is correlated with sulfur-induced resistance in tobacco mosaic virus-infected genetically susceptibleNicotianatabacumplants[J].MPMI,2010,23(11):1448-1459.
[11] 陈秀华,王臻昱,李先平,等.谷胱甘肽S-转移酶的研究进展[J].东北农业大学学报,2013,44(1):149-153.
[12] Jablonkai I,Hatzios K K.Invitroconjugation of chloroacetanilide herbicides and atrazine with thiols and contribution of nonenzymatic conjugation to their glutathione-mediated metabolism in corn[J].Journal of Agricultural and Food Chemistry,1993,41(10):1736-1742.
[13] Kampranis S C,Damianova R,Atallah M,etal.A novel plant glutathione S-transferase-peroxidase suppresses bax lethality in yeast[J].Journal of Biological Chemistry,2000,275(38):29207-29216.
[14] Marrs K A,Alfenito M R,Lloyd A M,etal.A glutathione S-transferase involved in vacuolar transfer encoded by the maize geneBronze-2[J].Nature,1995,375(6530):397-400.
[15] Bartling D,Radzio R,Steiner U,etal.A glutathione S-transferase with glutathione-peroxidase activity fromArabidopsisthaliana[J].European Journal of Biochemistry,1993,216(2):579-586.
[16] Wang J,Wang X,Zhou Q,etal.iTRAQ protein profile analysis provides integrated insight into mechanisms of tolerance to TMV in tobacco (Nicotianatabacum)[J].Journal of Proteomics,2016,132(2):21-30.
[17] Terry N.Effects of sulfur on the photosythesis of intact leaves and isolated chloroplasts of sugar beets[J].Plant Physiol,1976,57(4):477-479.
[18] 王敏杰,徐延驰.硫元素对作物生长发育的影响研究进展[J].辽宁农业职业技术学院学报,2001,13(1):13-15.
[19] 陈坤明,宫海军,王锁民.植物谷胱甘肽代谢与环境胁迫[J].西北植物学报,2004,24(6):1119-1130.
[20] Ball L,Accotto G P,Bechtold U,etal.Evidence for a direct link between glutathione biosynthesis and stress defense gene expression inArabidopsis[J].Plant Cell,2004,16(9):2448-2462.
[21] Moons A.Osgstu3 andosgtu4,encoding tau class glutathione S-transferases,are heavy metal-and hypoxic stress-induced and differentially salt stress-responsive in rice roots[J].FEBS Letters,2003,553(3):427-432.
[22] George S,Venkataraman G,Parida A.A chloroplast-localized and auxin-induced glutathione S-transferase from phreatophyteProsopisjulifloraconfer drought tolerance on tobacco[J].Journal of Plant Physiology,2010,167(4):311-318.
[23] Edwards R,Dixon D P,Walbot V.Plant glutathione S-transferases:Enzymes with multiple functions in sickness and in health[J].Trends in Plant Science,2000,5(5):193-198.
[24] Lim J D,Hahn S J,Yu C Y,etal.Expression of the glutathione S-transferase gene(NT107) in transgenicDianthussuperbus[J].Plant Cell Tissue & Organ Culture,2005,80(3):277-286.
Relationship of Tolerance to TMV and Glutathione Metabolic Pathway in Tobacco
WANG Jing1,ZHOU Qi2,LI Lihua3,HAO Fengsheng2,WEI Yuanfang2,YANG Lijun4,LIU Weiqun2*
(1.College of Tobacco Science,Henan Agricultural University,Zhengzhou 450002,China; 2.College of Life Sciences,Henan Agricultural University,Zhengzhou 450002,China; 3.Cereal Crop Research Institute,Henan Academy of Agricultural Sciences,Zhengzhou 450002,China; 4.Zhumadian Branch of Henan Province Tobacco Company,Zhumadian 463000,China)
In order to further explore the resistance mechanism of tobacco to tobacco mosaic virus(TMV),two tobacco varieties,NC89 and Yuyan 8 which is tolerant to TMV and has the same genetic background as NC89,were used as materials,and bioinformatics analysis using transcriptome data obtained by high-throughput sequencing found that there was common response to glutathione metabolism after inoculation with TMV in the two varieties,and the response of Yuyan 8 was enhanced.We detected the change of transcription of glutathione S-transferase(GST)gene in glutathione metabolic pathway with quantitative PCR,the enzyme activity of GST and glutathione(GSH)content with spectrophotometry in the two varieties after inoculated by TMV.The results showed that the transcription level ofGSTgene,the enzyme activity of GST and the GSH content were increased,and the increase rate in Yuyan 8 was higher.The influence of TMV infection on the expression level ofGSTand other genes related to TMV tolerance was studied by the sulfur concentration experiment.The result showed that whether +S or -S,the expression trend of these genes in the two varieties was same,but the expression level in -S treatment was less than in the +S treatment.The expression of the genes related with disease resistance(GST,PR1-a,HSP90,Catalase-3)was increased after infection by TMV,and the expression level of Yuyan 8 was higher than NC89.The two genes involved in photosynthesis,PsbAandPhotosystemⅡ 10kDapolypeptideshowed reduced expression,but the reduced rate in Yuyan 8 was less than NC89.The results above indicated that in the varieties resistant to TMV infection,enhancement of glutathione metabolic pathway was beneficial to cellular redox balance,which stabilized the expression ofPsbAthat encodes the key D1 protein in photosystem Ⅱ,and decreased the damage degree of TMV to photosynthetic system.
TMV; tolerance; glutathione; glutathione S-transferase
2016-10-04
驻马店市烟草公司科技计划项目
王 静(1985-),女,山西长治人,讲师,博士,主要从事植物逆境分子生物学研究。 E-mail:wangjing040922@126.com
*通讯作者:刘卫群(1956-),女,河北临城人,教授,博士,主要从事植物逆境分子生物学研究。 E-mail:liuweiqun2004@126.com
S435.72
A
1004-3268(2017)02-0049-06

