拮抗细菌W-7的鉴定及其对致病疫霉的抑制作用
万安琪,蒋继志,沙海天,李 颖,王蓓蓓,金 鑫,张亚辉
(河北大学 生命科学学院,河北 保定 071002)
拮抗细菌W-7的鉴定及其对致病疫霉的抑制作用
万安琪,蒋继志*,沙海天,李 颖,王蓓蓓,金 鑫,张亚辉
(河北大学 生命科学学院,河北 保定 071002)
为明确分离纯化自马铃薯晚疫病病叶上的一株对致病疫霉菌丝生长有明显抑制作用的细菌W-7的分类地位、抑菌作用及其防病潜力,采用传统方法和16S rDNA序列分析相结合对该菌株进行鉴定,以平板对峙法和打孔法分别测定细菌活体、菌液和无菌体发酵液以及不同浓度菌液的抑菌作用,显微镜观察该菌株对病菌菌体形态的影响,并采用块茎切片法评价菌液的离体防病效果。结果表明,综合菌落特征、生理生化特性以及16S rDNA序列分析结果,初步确定W-7菌株为短小芽孢杆菌(Bacilluspumilus);该菌株菌液的抑菌作用最强,抑菌率达到94.44%,菌液能使致病疫霉菌丝变形;将菌液稀释至原液浓度的25%后,抑菌率仍能达到87.65%,其在马铃薯块茎切片上对晚疫病的预防效果为73.40%。拮抗细菌W-7在防治马铃薯晚疫病方面具有一定潜力。
致病疫霉; 拮抗细菌; 短小芽孢杆菌; 鉴定; 抑制作用
马铃薯是世界四大粮食作物之一,其种植面积和产量均在逐年增加。随着近年我国马铃薯主粮化战略的确立,马铃薯将成为我国继水稻和小麦之外的又一主粮。预计到2020年,我国50%以上的马铃薯将作为主粮消耗[1]。此外,马铃薯淀粉及其衍生物广泛应用于造纸、纺织、医药、化工等多个领域,具有很高的经济价值。但随着全球马铃薯种植面积的不断扩大,特别是在其生长季节降水充沛的马铃薯主产区,马铃薯病害逐年加重,其中由致病疫霉(Phytophthorainfestans)引起的晚疫病已被公认为世界第一大作物病害[2]。致病疫霉属于卵菌中水生与陆生群体的过渡类型,寄生性很强又可人工培养,生理分化与变异频繁,加之A2交配型在世界各地相继出现[3],有性生殖概率大幅度上升,导致生理小种类型已由单一基因型转变为复合基因型,且已经出现了能克服生产中现有11个抗晚疫病基因(R1—R11)的超级生理小种(1.2.3.4.5.6.7.8.9.10.11)[4],同时抗药性也在不断增强[5]。这给当前生产中主要依靠化学农药防治该病带来了巨大挑战。因此,探讨防治该病的新途径或新措施迫在眉睫,其中筛选和利用拮抗微生物抑制致病疫霉进而防治马铃薯晚疫病,或者将生防菌或生防制剂与农业栽培、化学农药等构建成集成化防病措施正在受到许多学者的关注[6]。已报道的致病疫霉拮抗菌主要分离自蔬菜地或马铃薯根际土壤[7-8],笔者所在的河北大学微生物系统学与生物多样性研究实验室在前期研究中也筛选出了多株显著抑制致病疫霉生长的拮抗菌[7-9],但这些菌株的抑菌作用不够稳定,尤其是不易在马铃薯植株中定殖,限制了对这些菌株的进一步研究和利用。迄今,从马铃薯植株分离致病疫霉拮抗菌的报道还比较少[8]。W-7菌株是河北大学微生物系统学与生物多样性研究实验室从马铃薯晚疫病病叶上分离纯化致病疫霉菌株过程中获得的一株细菌,其对致病疫霉菌丝生长有很强的抑制作用,本试验对该菌株进行初步鉴定,并测定其活体菌株、菌液及无菌体发酵液对致病疫霉的抑制作用和离体防病效果,为揭示该菌株的抑菌特性和防病潜力提供依据。
1 材料和方法
1.1 供试菌株
致病疫霉W101菌株为河北大学微生物系统学与生物多样性研究实验室分离鉴定并保存的菌株,细菌W-7菌株为河北大学微生物系统学与生物多样性研究实验室前期从内蒙古自治区克山农场马铃薯晚疫病病叶上分离纯化保存的菌株。
1.2 菌株培养特性、革兰氏染色及形态特征的观察
在LB培养基、高氏1号培养基、KMB培养基和PDA培养基上对W-7进行划线培养,37 ℃培养72 h后观察其生长及培养特性;挑取在LB培养基上活化培养24 h的W-7菌落进行革兰氏染色,镜检观察形态;同时,将W-7接种于LB液体培养基中,摇床培养12 h后稀释并涂布于LB固体培养基上,37 ℃培养72 h,观察其菌落形态。
1.3 菌株生理生化试验
参照文献[10-11]测定W-7菌株的主要生理生化特性,包括触酶反应、淀粉水解、硝酸盐还原、吲哚产生、V-P反应、马尿酸盐水解、明胶水解、葡萄糖产酸、葡萄糖产气、木糖产酸、甘露醇产酸、柠檬酸盐利用等。
1.4 菌株16S rDNA鉴定及系统发育分析
将W-7菌株送上海生工生物工程技术服务有限公司进行16S rDNA序列测定,序列提交至NCBI网站,获取该序列的登录号。将测序结果进行BLAST比对,下载与W-7菌株相似性达到95%以上菌株的16S rDNA序列。采用ClustalX软件进行序列比对,将比对结果导入Mega 5.0软件,用Neighbor-Joining方法构建系统发育树。
1.5 活体菌株、菌液及无菌体发酵液对致病疫霉抑菌活性的测定
参照文献[8-9]的方法制备W-7菌株的活体、菌液及无菌体发酵液。采用对峙培养法测定活体菌株对致病疫霉的抑制作用,在致病疫霉菌饼(直径9 mm)两侧20 mm处分别接一环W-7菌株,以单独培养致病疫霉为对照;采用打孔法分别测定菌液和无菌体发酵液的抑菌活性[8],在致病疫霉菌饼两侧20 mm处打孔,孔中加入50 μL菌液或无菌体发酵液,以加入等体积LB液体培养基为对照。试验重复3次,20 ℃培养7~10 d后,采用十字交叉法测量菌落直径,统计抑菌率。
抑菌率=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100%。
1.6 不同浓度W-7菌液对致病疫霉的抑制作用测定
W-7菌株的菌液(原液)用液体LB培养基稀释,两者体积比分别设为0∶1、1∶3、1∶1、3∶1、1∶0,稀释后的浓度分别为原液浓度的0、25%、50%、75%、100%,以打孔法测定不同浓度菌液的抑菌作用[9]。试验重复3次,20 ℃培养7~10 d后统计抑菌率。
1.7 菌液在离体块茎上的防病作用测定
参照蒋继志等[8]的方法在马铃薯块茎表面滴加20 μL 25%的W-7菌株菌液,对照组滴加等体积液体LB培养基,20 ℃培养2 d后接种致病疫霉菌饼(9 mm),20 ℃培养5~7 d,根据文献[12]统计病情指数,计算其病害预防效果。
1.8 菌液对致病疫霉菌丝形态的影响观察
用已灭菌的牙签挑取与25%的W-7菌株菌液对峙培养后受抑制的致病疫霉菌落边缘的菌丝体,显微镜观察菌丝形态,并与正常致病疫霉菌丝进行对比。
2 结果与分析
2.1 W-7菌株培养特性、菌落特征及革兰氏染色结果
将W-7分别在KMB、PDA、高氏1号以及LB培养基上划线培养,观察发现,在KMB培养基上,菌落边缘不整齐,正面黄白相间,反面乳黄色(图1A、B);在PDA培养基上,正面黄色,反面淡黄色(图1C、D);在高氏1号培养基上,菌落边缘较整齐,正反面均为乳黄色,且生长速率较前两者慢(图1E、F);在LB培养基上,正面乳白色,反面乳黄色,生长速率居中(图1G、H)。将W-7菌株稀释涂布培养,发现有不透明菌落和半透明菌落2种形态;不透明菌落乳白色、圆形,边缘比较整齐,表面湿滑有黏性,菌落向外突出生长;半透明菌落乳黄色、光滑、湿润;此外,随培养时间延长,不透明菌落边缘开始皱缩,表面形成褶皱(图1I)。该菌革兰氏染色呈阳性,镜检发现,菌体呈短杆状,大部分单独存在,少部分成链排列(图1J),有芽孢生成但不易观察到。依据这些特征发现,W-7菌株与文献[13]描述的芽孢杆菌科芽孢杆菌属(Bacillus)较为接近,尤其是菌体短小,且具有不透明菌落和半透明菌落2种菌落特征,与其中的短小芽孢杆菌(Bacilluspumilus)更接近。
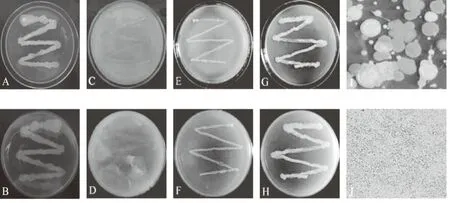
A、B为KMB培养基,C、D为PDA培养基,E、F为高氏1号培养基,G、H为LB培养基,其中,A、C、E、G为正面,B、D、F、H为背面; I为2种菌落形态; J为革兰氏染色 图1 W-7菌株的培养特性、菌落特征及革兰氏染色
2.2 W-7菌株生理生化试验鉴定结果
依据2.1的结果可知,W-7菌株与芽孢杆菌属的短小芽孢杆菌较为接近,根据参考文献[10-11]的描述,对W-7菌株的主要生理生化特性进行了测定,并与其近似的枯草芽孢杆菌(Bacilllussubtilis)和地衣芽孢杆菌(Bacilluslincheniformis)的特性进行了比较(表1)。结果显示,W-7菌株的淀粉水解、硝酸盐还原以及马尿酸盐水解反应均与短小芽孢杆菌完全一致,而这3项正是区分短小芽孢杆菌与枯草芽孢杆菌和地衣芽孢杆菌的主要特征。据此,可初步推测W-7菌株属于短小芽孢杆菌。
2.3 W-7菌株16S rDNA序列分析及其系统发育树构建
序列分析结果显示,W-7菌株的16S rDNA序列为1 436 bp,提交至NCBI网站所获得的登录号为KX056277。将该序列通过BLAST与GenBank中已有菌株的16S rDNA序列进行比对,并从中选择了9株相似性高于95%的菌株,以Escherichiacolistrain AE 1-2作为外群,采用ClustalX软件进行序列比对,使用Neighbor-Joining法(Mega 5.0软件)构建系统发育树,结果如图2所示。W-7菌株与B.pumilusstrain ATCC 7061和B.pumilusstrain NBRC 12092位于同一分支,其相似性达到99%,说明W-7菌株与短小芽孢杆菌高度相似。因此,结合W-7菌株的培养特征、菌落特征、革兰氏染色结果以及生理生化特性等,初步确定W-7菌株为短小芽孢杆菌。
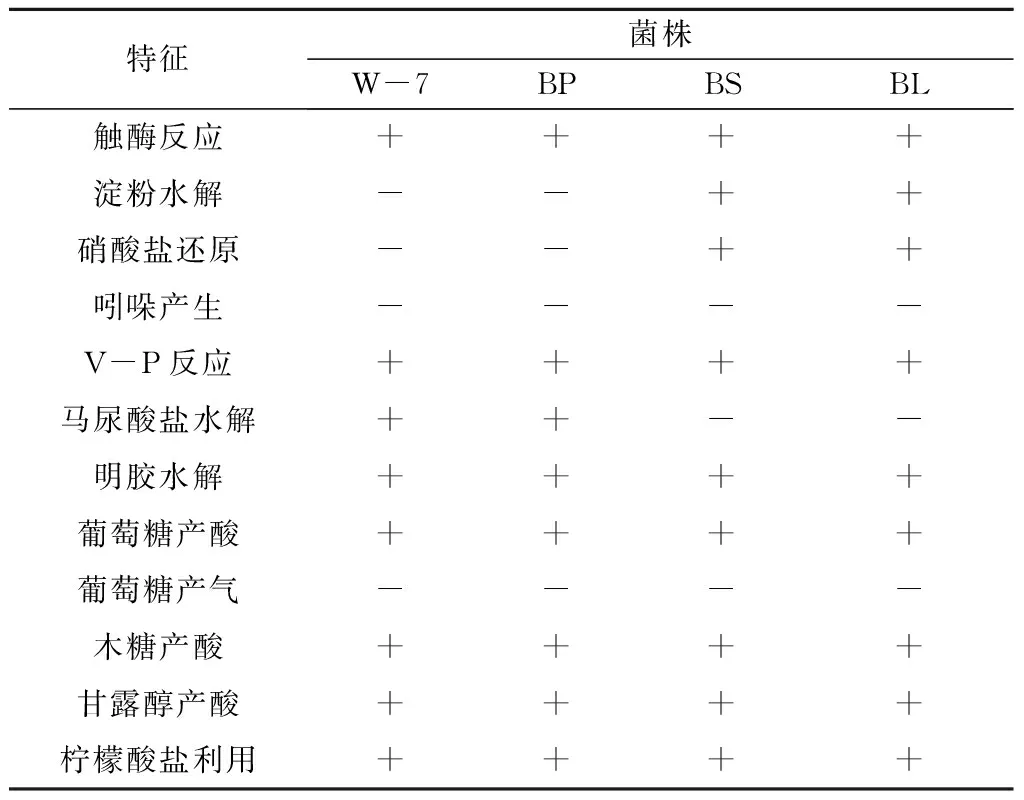
表1 W-7菌株的部分生理生化特性
注: BP—短小芽孢杆菌(B.pumilus),BS—枯草芽孢杆菌(B.subtilis), BL—地衣芽孢杆菌(B.lincheniformis);+表示阳性,-表示阴性。
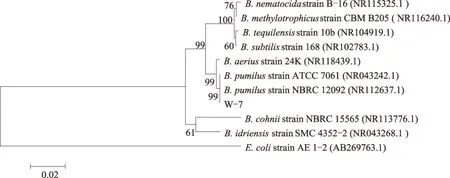
图2 根据16S rDNA序列构建的W-7及相关菌株的系统发育树
2.4 W-7菌株活体、菌液和无菌体发酵液对致病疫霉菌丝生长的影响
采用对峙法和打孔法测定的结果表明,W-7菌株的活体、在一定条件下培养的菌液和无菌体发酵液对致病疫霉菌丝生长均有显著的抑制作用(图3),其中,以菌液(图3B)的抑制作用最强,抑菌率达到94.44%,与活体菌株(图3A,抑菌率为83.33%)的抑制作用有显著差异(P<0.05),与无菌体发酵液(图3C,66.67%)有极显著差异(P<0.01)。
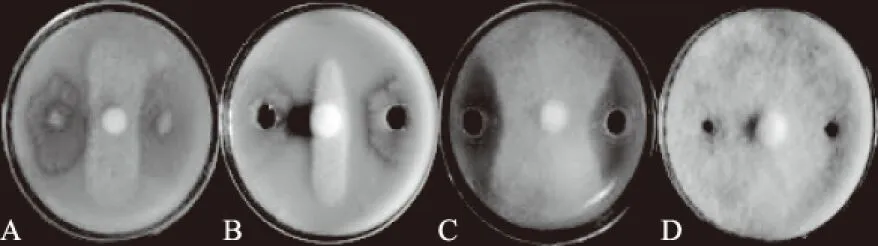
A、B、C分别为活体菌株、菌液、发酵液对致病疫霉的抑制作用,D为对照图3 W-7活体菌株、菌液及无菌体发酵液对致病疫霉的抑制作用
2.5 不同浓度菌液对致病疫霉菌丝生长的抑制作用
进一步将菌液稀释后测定发现,不同浓度的菌液对致病疫霉菌丝生长均有很强的抑制作用,其中,菌液原液的抑菌作用最强,抑菌率为93.82%,虽然随菌液浓度降低抑菌强度也逐渐减弱,但当菌液原液稀释3倍体积后,即浓度为原液的25%时,抑菌率仍能达到87.65%(图4);统计分析显示,菌液原液的抑菌作用与稀释后不同浓度菌液之间均有显著差异(P<0.05)。
2.6 菌液在离体块茎上的防病作用
经W-7菌株25%的菌液预防处理的马铃薯块茎正反面均无变软现象,块茎表面菌丝体十分稀疏,甚至没有菌丝体;而对照组块茎表面遍布菌丝体,有变软腐烂现象(图5)。用菌液进行预防处理后病情指数为25,对照病情指数为94,其预防效果达到73.40%,表明该菌株菌液有明显的病害预防效果。
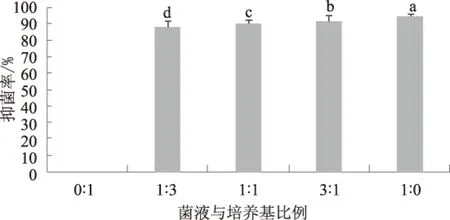
不同字母表示差异显著(P<0.05)图4 不同浓度菌液对致病疫霉的抑制作用
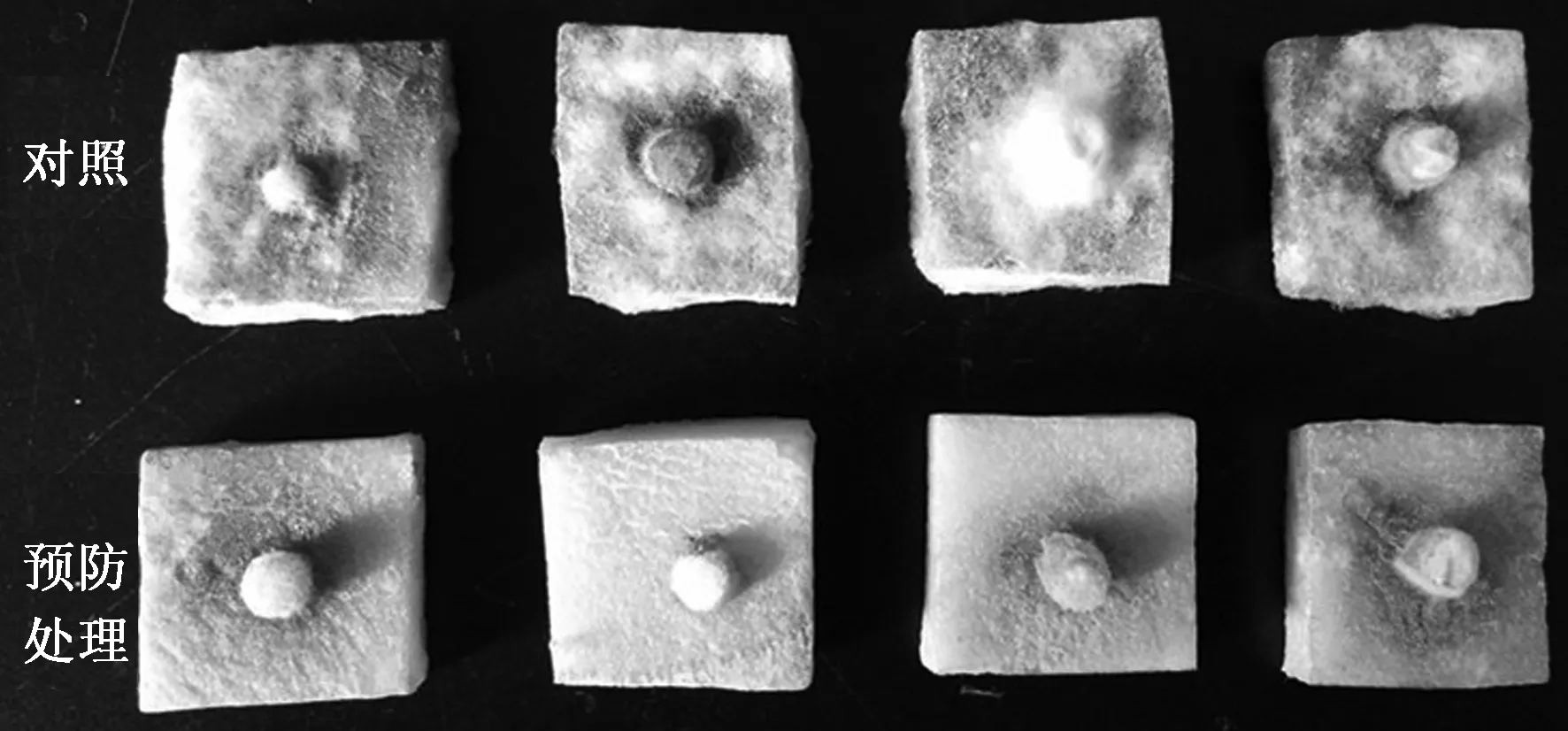
图5 菌液在离体块茎上的防病作用
2.7 菌液对致病疫霉菌体形态的影响
挑取受W-7菌株25%的菌液抑制的致病疫霉菌丝在显微镜下观察发现,大部分菌丝都表现出不同程度的畸变。与菌丝无隔、粗细比较均匀、外壁光滑、内容物分布均匀的正常菌丝体(图6A)相比,受抑制的菌丝体弯曲折叠、粗细不均(图6B),外壁粗糙、内含物分布不均、有大量隔膜产生等(图6C)。
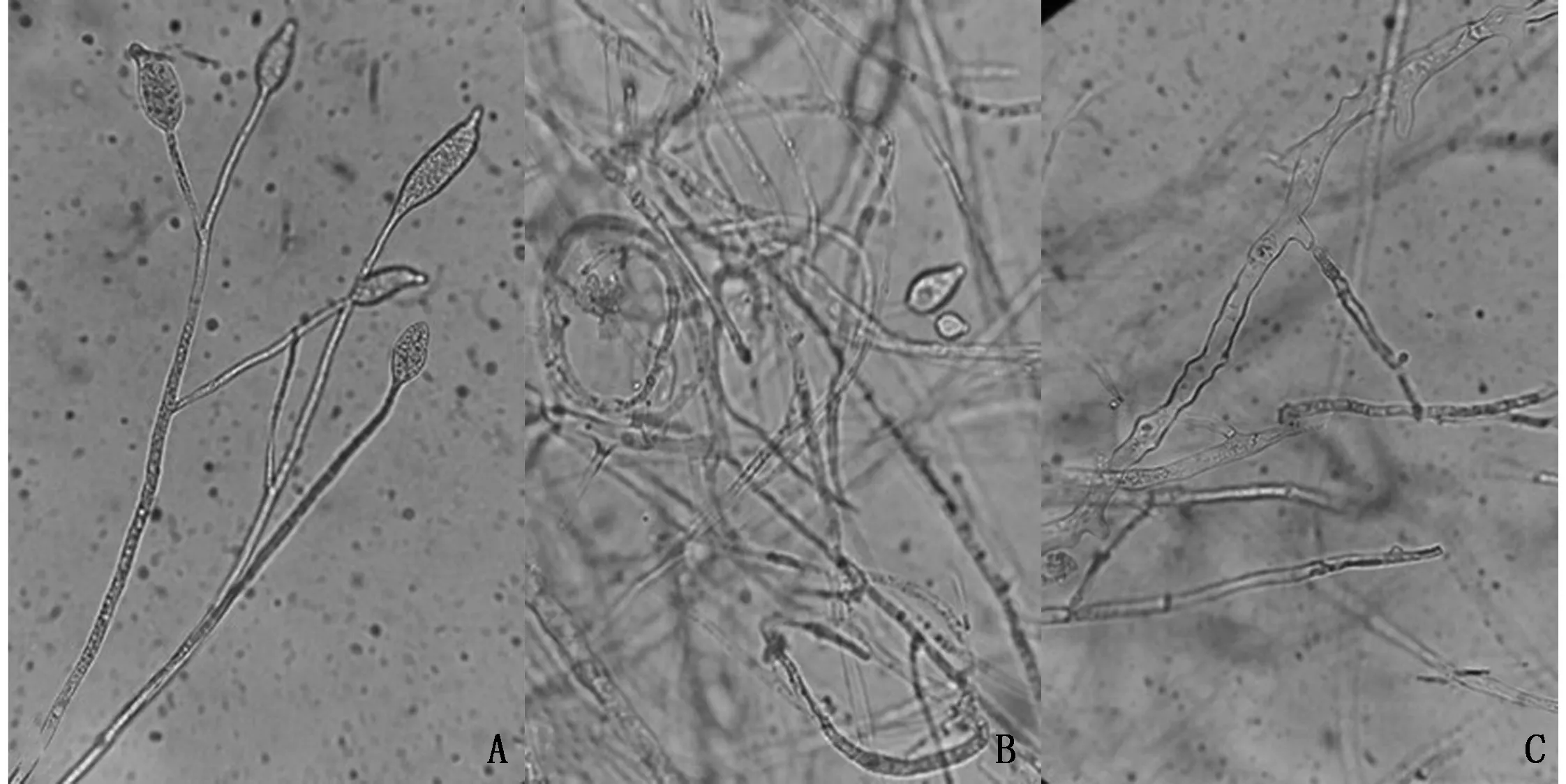
A为正常菌丝,B、C均为受抑制菌丝图6 受W-7菌液抑制的致病疫霉菌丝体(10×40)
3 结论与讨论
当前在马铃薯生产中,除培育推广抗病品种外,多种化学农药联合施用[3]是防治马铃薯晚疫病的主要方法,但是由于A2交配型在世界范围内的广泛迁移、生理小种变异迅速、化学农药广泛使用引起菌株抗药性增强[3],使得晚疫病的防治面临着更大的挑战。鉴于拮抗细菌在生物防治方面的巨大优势[6],利用拮抗细菌及其代谢产物抑制致病疫霉已引起了广泛关注[5]。Bengtsson等[5]发现,荧光假单胞菌(Pseudomonasfluorescens)2.74菌株产生的表面活性剂(1 mg/mL)可抑制致病疫霉菌丝生长,并能使60%的游动孢子裂解,预先处理马铃薯植株后对晚疫病的保护率在75%以上;Lamsal等[14]分离筛选出7株番茄根际细菌,其对致病疫霉菌丝生长均有较强的抑制作用,其中,AB15菌株的抑菌率最高(80%),预处理番茄植株后晚疫病的发病率比对照下降了74%;Zegeye等[15]研究表明,荧光假单胞菌Bak150菌株能强烈抑制致病疫霉菌丝生长,抑制率为88%,温室中该菌株处理叶片后病情曲线下面积(AUDPC=765.1)显著低于未做任何防病处理的对照(AUDPC=1 045)(P<0.05)。吴艳清等[9]从狗尾草中分离的细菌Y-1和Y-3菌株对致病疫霉有明显抑制作用,抑菌率在80%以上,从Y-3菌株提取的脂肽粗提物抑制率高达90%以上;蒋继志等[8]从马铃薯根际土壤中分离的一株荧光假单胞菌M15菌株对致病疫霉有显著的抑制作用,其菌液抑菌率达到88.23%,在马铃薯块茎切片上对晚疫病的预防效果为65.06%。本试验对分离自马铃薯晚疫病病叶的W-7菌株进行了初步鉴定,将其归属于短小芽孢杆菌(Bacilluspumilus),该菌株活体、菌液以及发酵液对致病疫霉菌丝生长均有很强的抑制作用,其中,以菌液的抑制率最高,达到94.44%,菌液浓度稀释至25%后在马铃薯块茎切片上对晚疫病的预防效果为73.40%。有文献报道,短小芽孢杆菌中的一些菌株已被应用于生物农药、肥料、饲料、酶制剂、医学中的抗凝溶栓、环保等多个领域[16-18],尤其是作为生防菌在抑制植物病原菌和防治病害方面已有许多应用成果,其中,王会军等[19]从油菜根内分离的短小芽孢杆菌YN201305对十字花科根肿病菌有明显裂解和抑制作用,盆栽试验中对大白菜根肿病的防治效果达到65.12%。以上表明,短小芽孢杆菌应用范围广泛且潜力巨大。本试验中的W-7菌株分离自马铃薯叶片,其菌液对致病疫霉菌丝生长以及菌丝形态表现出非常强的抑制作用和影响,并且在马铃薯块茎上具有较好的防病作用,暗示该菌株在防治马铃薯晚疫病方面有很大潜力,下一步拟对其实际防病效果开展研究,为尽快开发利用W-7菌株防治马铃薯晚疫病提供依据。
[1] 农业部新闻办公室.以科技创新引领马铃薯主粮化发展[EB/OL].(2015-01-06)[2015-06-01].http://www.moa.gov.cn/zwllm/ tpxw/201501/ t20150106_4323476.htm.
[2] Han M,Liu G,Li J P,etal.Phytophthorainfestansfield isolates from Gansu province,China are genetically highly diverse and show a high frequency of self fertility[J].Journal of Eukaryotic Microbiology,2013,60(1):79-88.
[3] Céspedes M C,Cárdenas M E,Vargas A M,etal.Physiological and molecular characterization ofPhytophthorainfestansisolates from the central Colombian Andean region[J].Revista Iberoamericana de Micología,2013,30(2):81-87.
[4] Arora R K,Sharma S,Singh B P.Late blight disease of potato and its management[J].Potato Journal,2014,41(1):16-40.
[5] Bengtsson T,Holefors A,Liljeroth E,etal.Biosurfactants have the potential to induce defence againstPhytophthorainfestansin potato[J].Potato Research,2015,58(1): 83-90.
[6] 黄英菊,蒋继志,冯丽娜,等.致病疫霉颉颃细菌研究进展[J].中国植保导刊,2013,33(8):18-22.
[7] 冯丽娜,蒋继志,赵偲,等.内生真菌DC-11的分离筛选及对致病疫霉的抑制作用[J].河北农业大学学报,2015,38(2):76-81.
[8] 蒋继志,梁廷银,王怀远,等.致病疫霉拮抗菌荧光假单胞菌的筛选及离体防病作用[J].河北农业大学学报,2013,36(3):72-76.
[9] 吴艳清,蒋继志,梁廷银.致病疫霉拮抗芽孢杆菌的筛选及脂肽类物质分离的研究[J].安徽农业科学,2012,40(14):8111-8112,8135.
[10] 希坎南R E,吉本斯N E.伯杰氏细菌鉴定手册[M].北京: 科学出版社,1984: 734-735.
[11] 东秀珠,蔡妙英,王宝玲,等.常见细菌鉴定手册[M].北京: 科学出版社,2001: 62-64.
[12] Mucharromah,Kuc' J.The effect of sterols on the compatibilityor incompatibility of potato tuber discs and foliage to Phytophthora infestans and Helminthosporium carbonum,and the induction of resistance by arachidonic acid[J]. Physiological and Molecular Plant Pathology,1995,47(1) : 1-12.
[13] 陈晓明,魏宝丽,张建国.短小芽孢杆菌E601 传代和中子辐照后的菌落形态变化[J].核农学报,2008,22(3) : 291-295.
[14] Lamsal K,Kim S W,Kim Y S,et al. Biocontrol of late blight and plant growth promotion in tomato using rhizobacteria isolates[J]. Journal of Microbiol & Biotechnology,2013,23(7) : 897-904.
[15] Zegeye E D,Santhanam A,Gorfu D,et al.Biological activity of Trichoderma viride and Pseudomonas fluorescens against Phytophthora infestans under greenhouse conditions[J].International Journal of Agricultural Technology,2011,7(6) : 1589-1602.
[16] 李云龙.芽孢杆菌发展史综述及用途[J].农业开发与装备,2015(5) : 37.
[17] 孙冰冰,李伟,魏军,等.生防芽孢杆菌的研究进展[J].天津农业科学,2015,21(12) : 102-107.
[18] 杨丽丽,尹宝华,侯文菊,等.芽孢杆菌诱变育种研究进展[J].山西农业科学,2012,40(7) : 804-806.
[19]王会军,陈卓君,吴毅歆,等.防治十字花科作物根肿病的油菜内生细菌分离与鉴定[J].中国油料作物学报,2014,36(1) : 92-97
Identification of Antagonistic Bacterium W-7 Strain and Its Inhibition on Phytophthora infestans
WAN Anqi,JIANG Jizhi*,SHA Haitian,LI Ying,WANG Beibei,JIN Xin,ZHANG Yahui
(College of Life Sciences,Hebei University,Baoding 071002,China)
The bacterium W-7 strain was isolated from diseased leaf of potato late blight,and showed obvious suppression on mycelia growth ofPhytophthorainfestansin lab.The purpose of this paper was to clear its classification status,inhibitory characteristics onP.infestansand the potential in control potato late blight.The traditional method combined with 16S rDNA sequence analysis were used for identification of W-7 strain,and dual culture method and punch method were applied for testing the inhibition effect of living strain,bacterial fluid and free-cell fermentation liquid of W-7 strain onP.infestans.And potato tuber slices method was employed for evaluating the prevention effect of bacterial fluid against late blightinvitro.The W-7 strain was identified asBacilluspumilusbased on colony feature,partial physiology and biochemistry characteristics,and 16S rDNA sequence analysis.Its fluid had the strongest inhibition effect(94.44%) on pathogen mycelia growth compared with living strain and fermentation liquid.Especially,the inhibition rate and prevention effect on disease still reached 87.65%and 73.40%,respectively,after the bacterial fluid was diluted to 25% of initial concentration.It was observed that the bacterial fluid could cause deformation ofP.infestanshyphae.W-7 strain,which belongs toBacilluspumilus,has a great potential in controlling potato late blight in future.
Phytophthorainfestans; antagonistic bacteria;Bacilluspumilus; identification; inhibition effect
2016-08-11
河北省自然科学基金项目(C2015201231);河北省科技支撑计划项目(13226502D);河北省生物学强势特色学科建设专项
万安琪(1992-),女,湖北荆州人,在读硕士研究生,研究方向:生物化学与分子生物学。 E-mail:wananqiwananqi@126.com
*通讯作者:蒋继志(1960-),男,宁夏中宁人,教授,主要从事植物病害生物防治研究。E-mail:jizhijiang909@163.com
S435.32;S476.1
A
1004-3268(2017)02-0055-06

