MicroRNA-222对肺腺癌细胞增殖、迁移和侵袭的影响
卢滨,贾金广,李利华,姚菲菲
(河南省郑州人民医院 呼吸内科,河南 郑州 450003)
MicroRNA-222对肺腺癌细胞增殖、迁移和侵袭的影响
卢滨,贾金广,李利华,姚菲菲
(河南省郑州人民医院 呼吸内科,河南 郑州 450003)
D O I:10.3969/j.i s s n.1005-8982.2017.03.007
目的探讨m i croR N A-222(m i R-222)对肺腺癌细胞增殖、迁移和侵袭的影响。方法将m i R-222和对照分别转染入肺腺癌细胞系A549进行活细胞计数法试剂盒(C C K-8)增殖实验、Trans w el l迁移及M at ri gel侵袭实验,观察m i R-222对肺腺癌细胞增殖、迁移和侵袭的影响。运用荧光素酶报告实验、实时荧光定量聚合酶链反应(qR T-PC R)及W es t ern bl ot验证m i R-222靶向下调ETS1的过程。结果C C K-8增殖实验,Trans w el l迁移及M at ri gel侵袭实验发现,与对照组相比m i R-222能够促进肺腺癌细胞增殖、迁移和侵袭。荧光素酶报告实验、qR T-PC R及W es t ern bl ot实验发现,m i R-222可以靶向下调ETS1的表达,且ETS1参与调节上述过程。结论m i R-222通过靶向下调ETS1,促进肺腺癌细胞增殖、迁移和侵袭。
m i croR N A-222;ETS1;增殖;迁移;侵袭
肺腺癌为肺癌的一种,属于病理分型中非小细胞肺癌。在全世界范围内有很高的发病率,其中包括中国,且肺腺癌恶性程度高,5年生存率约为15%[1-2]。腺癌初发时多位于肺周边部,界限清楚,但具有高度浸润和破坏性生长特征,容易侵犯血管和淋巴管壁,而出现较多的血行及淋巴转移[3]。肺腺癌的发生、发展是一个复杂的过程,包括细胞的异常增殖、表观遗传学的改变、癌细胞的转移等过程[4-5]。最近关于m icroRNAs(m i RNAs)在肺腺癌发生过程中发挥的作用受到广泛关注,尤其在细胞增殖、转移和对化疗药物的抵抗方面发挥的作用研究较多。许多m i RNAs在肺癌组织、患者血清中表达水平发生改变,但关于其在肺腺癌中的作用研究得较少[6]。先前文献报告m i R-222在许多肿瘤中高表达,比如胶质细胞瘤、非小细胞肺癌、前列腺癌、乳腺癌、结直肠癌、膀胱癌等[7-11]。功能学研究发现,m i R-222通过靶向10号染色体上张力蛋白同源物缺失活化PI3K/AKT信号通路,促进肿瘤细胞的增殖、迁移和微管形成[7]。另外,m i R-222可以作用于ETS1,间接促进内皮细胞一氧化氮合酶的表达水平[12],而在黑色素瘤中m i R-222通过下调ETS1的表达促进肿瘤的转移[13]。为探索m i R-222在肺腺癌的发生过程中发挥的作用,本文通过过表达m i R-222,观察该m i RNA对肺腺癌细胞增殖、迁移和侵袭的影响,并寻找参与该过程m i R-222的靶基因。
1 材料与方法
1.1 细胞与质粒
人肺腺癌细胞A549[14-15]和人胚肾上皮细胞293T细胞购自中国科学院上海细胞库,其中A549生长于含10%灭活胎牛血清(f et alcal fserum,FBS)、2m m ol/L L-谷氨酰胺、青霉素(100 U/m L)和链霉素(100 μg/m L)的RPM I 1640培养基中。293T细胞生长于10%FBS改良伊格尔培养基(dul becco's m odi f i ed eagl e m edi um,DM EM)中。
表达海肾荧光素酶的质粒pRL-TK购自美国Prom ega公司。pGL3-cont rol报告质粒为本实验所有,在pGL3-cont rol虫荧光素酶序列下游插入ETS1 3’-UTR序列的质粒为本实验构建,经测序验证正确并命名为pGL3-ETS1 3’-UTR。
1.2 实验试剂
Tri zol试剂、蛋白分子量M arker及转染试剂Li pof ect am i neTM2000购自美国Invi t rogene公司,蛋白酶抑制剂、磷酸酶抑制剂及苯甲基磺酰氟购自上海康成生物公司,抗ETS1单克隆抗体、抗α-t ubul i n单克隆抗体及辣根过氧化物酶标记的山羊抗小鼠免疫球蛋白G购自美国Sant a Cruz公司,活细胞计数法试剂盒(cel l count i ng ki t-8,CCK-8)购自日本同仁化学研究所,Transwel l小室(8μm)购于德国M i ll i pore公司,基质胶购自美国BD Bi osci ences公司,M i R-222 m i m i c和阴性对照(negat i ve cont rol,NC)由上海吉玛生物公司合成,定量引物由上海申能博彩生物公司合成。
1.3 荧光素酶报告实验
将293T按2×104个/孔接种于48孔板中,加入0.2 m l DM EM培养基。次日将m i R-222和阴性对照分别与pGL3-Cont rol或pGL3-ETS1 3’-UTR及pRL-TK质粒共转染入细胞。48 h后收集细胞,运用GLOM AX多功能酶标仪进行荧光素酶报告分析。
1.4 实时荧光定量聚合酶链反应检测ETS1 mRNA的表达
于实验前1天将5×104A549铺入6孔板中,次日细胞贴壁,细胞汇合度达60%~70%,按照Li pof ect am i neTM2000说明书操作,将m i R-222和阴性对照分别转染入A549细胞,48 h后用Tri zol试剂收取细胞,提取RNA,进行反转录,按SYBRRPrem i x Ex TaqT(MTl i RNaseH Pl us)说明书建立反应体系,运用ABI7300进行实时荧光定量聚合酶链反应(quant i t at i ve real-t i m e pol ym erase chai n react i on,qRT-PCR)实验。反应条件:95℃预变性30 s,95℃变性5s,60℃退火31 s,共40次循环,获得Ct值。获得的Ct值按美国Appl i ed Bi osyst em公司ABI PRISM 7700 Sequence Det ect i on Syst em User Bul l et i n#2推荐方法进行计算,并比较各样本中目的基因的表达水平。引物序列:ETS1正向引物:5'-GTGGTGAGGC AAGGACCTAG-3',反向引物:5'-TGAGTTGCCATCT CATCCCA-3';β-act i n正向引物:5'-TTGCCGACAG GATGCAGAAGGA-3',反向引物:5'-AGGTGGACAG CGAGGCCAGGAT-3'。
1.5 Western blot检测
将m i R-222和NC分别转染入A549细胞,48 h收取细胞蛋白进行W est ern bl ot检测。每孔加样20μl,先恒压60 V电泳30 m i n,待蛋白样品进入分离胶后再110V电泳90m i n,然后恒流80m A、100m i n将蛋白转移至聚偏(二)氟乙烯膜,转膜结束后用5%脱脂牛奶37℃封闭1 h,三羟基甲胺-盐酸缓冲盐溶液(Tri s-H Clbuf f er sal i ne,TBS)-T洗3次,5m i n/次,加入以抗体稀释液1∶1 000配制的抗ETS1抗体4℃过夜,TBS-T洗3次,10 m i n/次,加入抗体稀释液1∶4 000配制的辣根过氧化物酶(horseradi shperoxi dase,H RP)标记山羊抗小鼠免疫球蛋白,37℃作用1 h,TBS-T洗3次,10 m i n/次,以化学发光法检测。同时以抗体稀释液1∶1 000配制的抗αt ubul i n为一抗,以抗体稀释液1∶4 000配制的H RP标记的山羊抗小鼠抗体为二抗,检测α-Tubul i n作为参照。
1.6 CCK-8增殖实验
于实验前1天分别将m i R-222和NC分别转染入A549细胞,次日用胰酶消化细胞以3 000个/孔细胞数接种于96孔板中,37℃、5%二氧化碳CO2培养箱中培养,分别在培养1、2、3、4和5 d后,每孔加入10 μl CCK-8,继续培养1h,以空白孔调零,波长450 nm下,用Bi ot eck DR-3506全自动酶标读数仪上测出每孔光密度(opt i cal densi t y,OD)值。
1.7 Transwell迁移实验
于实验前1天,将m i R-222和NC分别转染入A549细胞,第2天进行Transwel l迁移实验。首先于24孔板中加入500μl 10%FBS 1640培养基,将Tran-swel l小室置于孔上,放入细胞培养箱平衡30 m i n。然后将转染有m i R-222和NC的细胞消化用纯1640培养基配制成5×105个/m l的细胞悬液。每个小室加入200 μl细胞悬液,即每孔细胞约为1×105个。每组设置3个复孔,将24孔板放入细胞培养箱,分别于培养6和12 h后取出小室染色固定,显微镜下拍照计数,观察进入下室的细胞数量以判断细胞迁移情况。
1.8 Matrigel侵袭实验
将基质胶和1640培养基按2∶1配成基质胶-1640混合液,置于冰上备用。将Transwel l小室置于24孔板中,下室加入500μl10%FBS 1640培养基,每个小室加入60 μl基质胶-1640混合液,于37℃、5%CO2细胞培养箱中培养5 h。然后将转染有m i R-222和NC的细胞消化用纯1640培养基配制成5× 105个/m l的细胞悬液。每个小室加入200 μl细胞悬液,即每孔细胞约为1×105个,每组设置3个复孔。将24孔板放入细胞培养箱,分别于6和12 h取出小室染色固定,显微镜下拍照计数,观察进入下室的细胞数量以判断细胞侵袭情况。
1.9 统计学方法
数据分析采用SPSS 15.0统计软件,计量资料以均数±标准差(±s)表示,用重复测量设计的方差分析,任意两组间比较用LSD-t检验,偏态数据则为秩和检验,P<0.05为差异有统计学意义。
2 结果
2.1 过表达miR-222促进肺腺癌细胞的增殖
将m i R-222和NC分别转染入A549细胞后1、2、3、4和5 d进行CCK-8增殖实验,采用重复测量数据的方差分析,结果:①转染不同时间点间的细胞增殖比较,差异有统计学意义(F=7.782,P=0.000);②转染m i R-222组和对照组的细胞增殖情况比较,差异有统计学意义(F=8.128,P=0.000);③转染m i R-222组和对照组的细胞增殖的变化趋势比较,差异有统计学意义(F=5.781,P=0.000)。见表1和图1。
表1 两组过表达miR-222促进肺腺癌细胞增殖的OD值(±s)

表1 两组过表达miR-222促进肺腺癌细胞增殖的OD值(±s)
组别5 d NC组 1.33±0.32 1.98±0.41 2.31±0.42 3.31±0.44 3.82±0.49 m i R-222组 1.41±0.41 2.21±0.39 2.89±0.40 4.25±0.47 5.01±0.53 4 d 1 d2 d 3 d

图1 转染入A549细胞后,过表达miR-222促进肺腺癌细胞的增殖 (±s)
2.2 过表达miR-222促进肺腺癌细胞的迁移和侵袭
对转染有m i R-222和NC的A549细胞分别进行Transwel l迁移实验。NC组6和12 h迁移细胞数分别为(98±5)和(190±38)个;m i R-222组6和12 h迁移细胞数分别为(160±17)和(282±18)个,采用重复测量数据的方差分析,结果:①转染不同时间点的细胞迁移比较,差异有统计学意义(F=4.182,P= 0.000);②转染m i R-222组和对照组的细胞迁移情况比较,差异有统计学意义(F=4.122,P=0.000);③转染m i R-222组和对照组的细胞迁移变化趋势比较,差异有统计学意义(F=3.981,P=0.000)。见图2A。
对转染有m i R-222和NC的A549细胞分别进行M at ri gel侵袭实验。NC组6和12 h侵袭细胞数分别为(58±4)和(110±12)个;m i R-222组6和12 h侵袭细胞数分别为(104±11)和(176±10)个,采用重复测量数据的方差分析,结果:①转染不同时间点的细胞侵袭比较,差异有统计学意义(F=4.467, P=0.000);②转染m i R-222组和对照组的细胞侵袭情况比较,差异有统计学意义(F=5.162,P=0.000);③转染m i R-222组和对照组的细胞侵袭变化趋势比较,差异有统计学意义(F=4.512,P=0.000)。提示过表达m i R-222促进A549细胞的迁移和侵袭能力。见图2B。
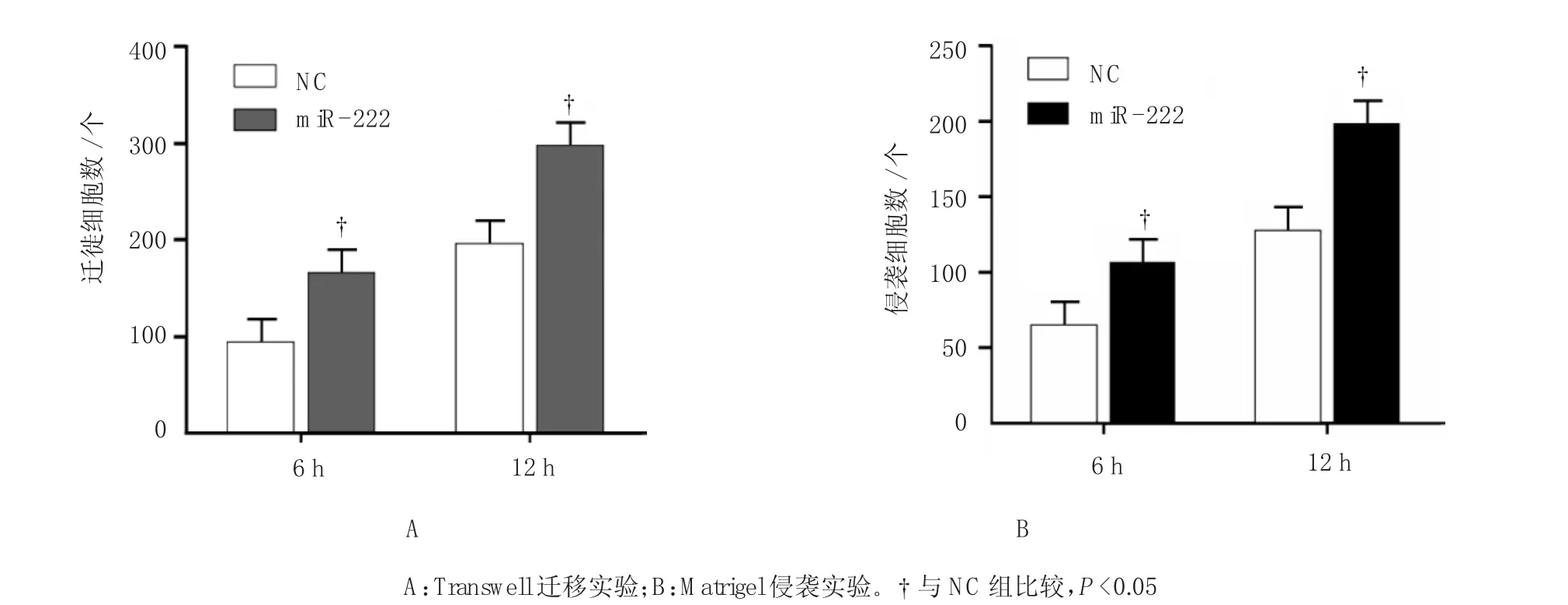
图2 过表达miR-222促进肺腺癌细胞的迁移和侵袭 (±s)
2.3 miR-222靶向作用于ETS1
荧光素酶双报告实验结果显示,NC组转染前和转染48 h后荧光素梅活性分别为(1.15±0.14)%和(1.13±0.07)%;m i R-222组分别为(1.14±0.16)%和(0.66±0.10)%。采用重复测量数据的方差分析,结果:①转染不同时间点的细胞表达ETS1比较,差异有统计学意义(F=3.131,P=0.007);②转染m i R-222组和对照组的细胞表达ETS1水平比较,差异有统计学意义(F=3.012,P=0.003);③转染m i R-222组和对照组的细胞表达ETS1变化趋势比较,差异有统计学意义(F=3.631,P=0.010)。见图3A。

图3 miR-222靶向作用于ETS1(±s)
M i croRNA作用于靶基因的结果是抑制靶基因的表达水平,本实验将m i R-222、NC分别转染入A549细胞,利用qRT-PCR反应和W est ern bl ot检测ETS1的表达水平,结果显示,过表达m i R-222后ETS1 m RNA表达水平较对照下降,差异有统计学意义(t= 2.417,P=0.007)。W est ern bl ot检测显示,转染m i R-222后与NC比较,ETS1的表达水平下调。见图3B、4。

图4 Western blot检测ETS1蛋白表达水平
2.4 过表达ETS1抑制肺腺癌细胞的增殖过程
为说明ETS1是否参与m i R-222促进肺腺癌细胞的增殖过程,笔者将ETS1质粒及对照分别转染入过表达NC和m i R-222的细胞中进行CCK-8增殖实验,采用重复测量数据的方差分析,结果:①过表达不同时间点的细胞增殖比较,差异有统计学意义(F=3.411,P=0.012);②转染不同组的细胞增殖水平比较,差异无统计学意义(F=3.578,P=0.006);③转染不同组的细胞增殖变化趋势比较,差异有统计学意义(F=3.821,P=0.005)。见表2和图5。
2.5 过表达ETS1抑制肺腺癌细胞的迁移和侵袭过程
为说明ETS1是否参与m i R-222促进肺腺癌细胞的迁移和侵袭过程,笔者将ETS1质粒及对照分别转染入过表达NC和m i R-222的细胞中进行Transwel l迁移实验,并采用重复测量数据的方差分析,结果:①过表达不同时间点的细胞迁移比较,差异有统计学意义(F=7.424,P=0.000);②转染不同组的细胞迁移水平比较,差异有统计学意义(F=7.524,P= 0.000);③转染不同组的细胞迁移变化趋势比较,差异有统计学意义(F=7.831,P=0.000)。见表3和图6A。
同样进行M at ri gel侵袭实验,采用重复测量数据的方差分析,结果:①过表达不同时间点的细胞侵袭比较,差异有统计学意义(F=8.411,P=0.000);②转染不同组的细胞侵袭水平比较,差异有统计学意义(F= 7.783,P=0.000);③转染不同组的细胞侵袭变化趋势比较,差异有统计学意义(F=7.812,P=0.000)。该结果提示m i R-222通过靶向ETS1促进A549细胞的迁移和侵袭能力。见表4和图6B。
表2 过表达ETS1抑制肺腺癌细胞增殖的OD值 (±s)

表2 过表达ETS1抑制肺腺癌细胞增殖的OD值 (±s)
组别5 d NC+对照组 1.27±0.21 1.57±0.40 1.91±0.42 2.11±0.44 2.82±0.43 NC+STS1组 1.30±0.22 1.37±0.31 1.34±0.33 1.72±0.31 2.11±0.481 d2 d3 d4 dm i R-222+对照组 1.31±0.20 1.62±0.39 2.21±0.45 3.21±0.38 4.17±0.38 m i R-222+ STS1组 1.32±0.35 1.36±0.30 1.36±0.51 1.92±0.41 2.11±0.48
表3 过表达ETS1抑制肺腺癌细胞的迁移 (个±s)

表3 过表达ETS1抑制肺腺癌细胞的迁移 (个±s)
组别12 h NC+对照组 97±12 191±21 NC+STS1组 76±8 97±16 m i R-222+对照组 135±12 289±18 m i R-222+STS1组 81±4 99±106 h
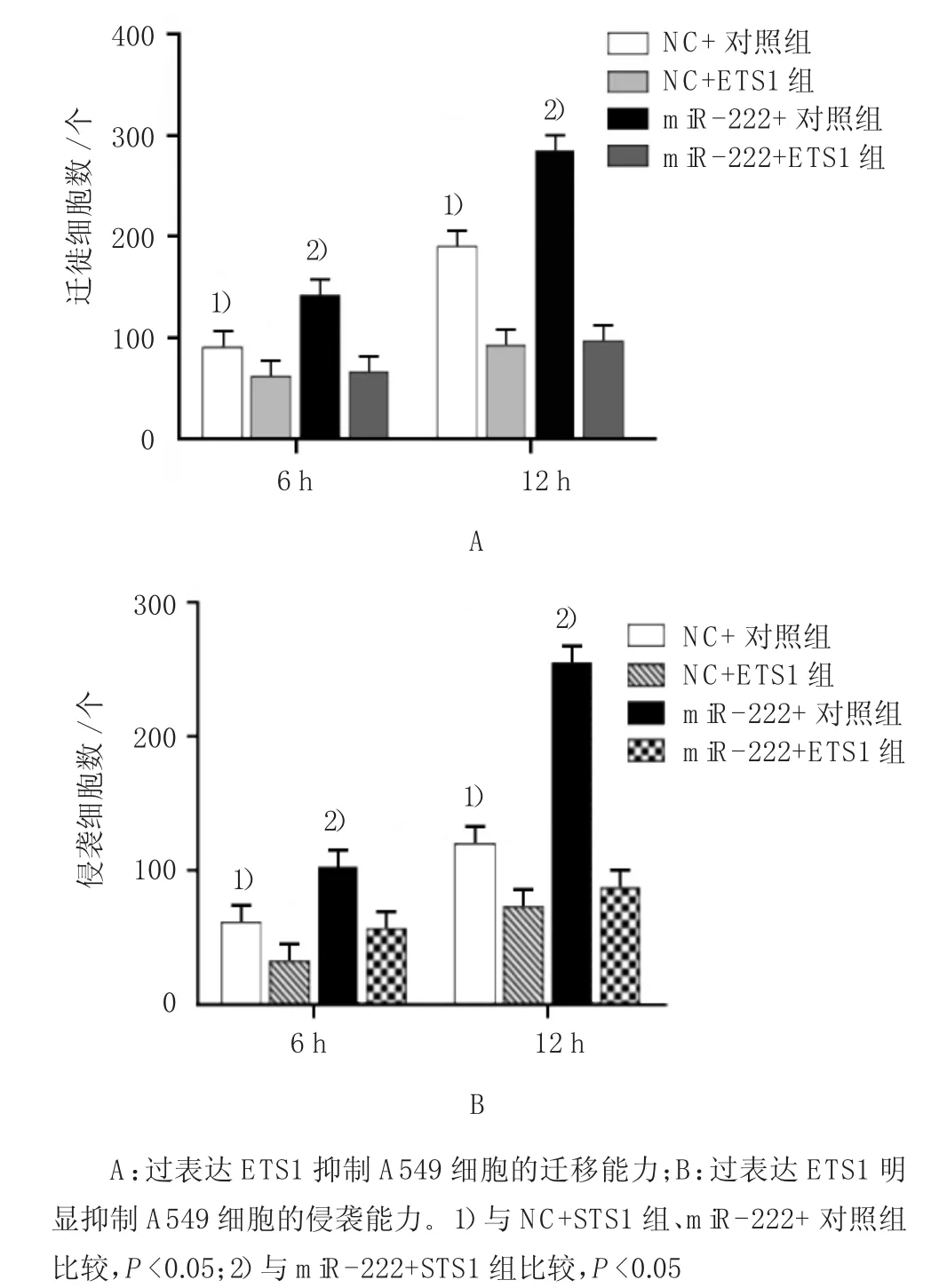
图6 过表达ETS1抑制肺腺癌细胞的迁移和侵袭过程
表4 过表达ETS1抑制肺腺癌细胞的侵袭 (个±s)

表4 过表达ETS1抑制肺腺癌细胞的侵袭 (个±s)
组别12 h NC+对照组 61±17 112±21 NC+STS1组 37±10 67±11 m i R-222+对照组 100±21 232±21 m i R-222+STS1组 71±11 85±176 h
3 讨论
肺癌是最常见的恶性肿瘤,具有较高的死亡率,全世界每年约有130万人死于肺癌,其中非小细胞肺癌占全部肺癌的85%,且40%非小细胞肺癌为肺腺癌。尽管现在诊断与治疗方式不断革新,但是肺腺癌的预后仍较差,很多患者会发生转移,5年生存率仅为15%[1]。因此关于肺腺癌发生的机制,尤其关于转移方面仍需更多的研究,为进一步治疗提供理论基础。
m i R-222属于m i R-221/m i R-222家族,在许多肿瘤中高表达,被认为是肿瘤相关m i croRNAs,参与许多肿瘤细胞的增殖和转移过程。M AO等[16]对非小细胞肺癌组织和邻近正常组织进行比较发现,m i R-222在癌组织中有较高的表达水平,且高表达的m i R-222与临床分期和淋巴结转移明显相关,且m i R-222表达水平较高的患者生存周期较短,这提示m i R-222可能参与非小细胞肺癌的发生和转移过程。且另一课题组研究发现,过表达m i R-222可以明显促进非小细胞肺癌细胞系H 460的增殖[17],但是关于m i R-222在肺腺癌细胞系A549中的研究尚未有报道。因此,本文研究m i R-222对肺腺癌的影响。在肺腺癌细胞系A549中分别过表达m i R-222进行功能学实验后,通过重复测量数据的方差分析发现,m i R-222促进肺腺癌细胞的增殖、迁移和侵袭能力。已知m i croRNA通过下调其靶基因的表达水平发挥生物学功能,且m i R-222被报道可靶向p27促进非小细胞肺癌的增殖[17]。而事实上1个m i croRNA可以作用于较多靶基因,因此笔者预寻找参与该过程的m i R-222靶基因。m i R-222可以靶向结合ETS1,但关于m i R-222与ETS1在肺癌中的相互作用尚未有报道,因此本研究通过荧光素酶报告实验和W est ern bl ot检测证实,ETS1确实为m i R-222的靶基因,该结果与EVANGELISTA等[12]的研究一致。接着,本文通过过表达ETS1再次进行功能学实验发现,过表达ETS1后,A549细胞的增殖、迁移和侵袭能力明显下降。以上结果说明m i R-222确实通过抑制ETS1的表达促进A549细胞的增殖、迁移和侵袭能力。ETS1为转录因子家族成员,参与调节许多基因的转录过程,且ETS1在疾病发生过程中发挥多重作用[18],而低水平的ETS1被报道参与非小细胞肺癌化疗的耐药过程[19]。本研究推测m i R-222通过下调ETS1的表达,从而抑制其下游多种基因的转录,有利于肺腺癌细胞发生增殖、迁移和侵袭过程,但详细的机制有待进一步研究。
综上所述,本文通过在肺腺癌细胞A549中过表达m i R-222进行实验发现,m i R-222通过靶向下调转录因子ETS1的表达,从而促进A549细胞的增殖、迁移和侵袭能力,再次证明m i R-222在肺癌中发挥作用,为m i R-222作为肺癌尤其是肺腺癌的生物诊断标记物和新的治疗靶点提供更多理论基础。
[1]SIEGEL R,M A J,ZOU Z,et al.Cancer st at i st i cs,2014[J].CA:a cancer j ournal f or cl i ni ci ans,2014,64(1):9-29.
[2]黄霞,陈亮,刘景丽,等.紫杉醇联合卡培他滨治疗Ⅳ期肺腺癌临床疗效及毒理研究[J].现代生物医学进展,2015,15(17):3276-3279.
[3]M ORALES-OYARVIDE V,M INO-KENUDSON M.Tum or i sl ands and spread t hrough ai r spaces:di st i nct pat t erns of i nvasi on i n l ung adenocarci nom a[J].Pat hol ogy Int ernat i onal,2016,66(1):1-7.
[4]DEVARAKONDA S,M ORGENSZTERN D,GOVINDAN R.Genom i c al t erat i ons i n l ung adenocarci nom a[J].The Lancet Oncol ogy,2015,16(7):e342-e351.
[5]KIM H,CH UNG J H.Overvi ew of cl i ni copat hol ogi c f eat ures of ALK-rearranged l ung adenocarci nom a and current di agnost i c t esti ng f or ALK rearrangem ent[J].Transl at i onal Lung Cancer Research,2015,4(2):149-155.
[6]RANI S,GATELY K,CROW N J,et al.Gl obal anal ysi s of serum m i croRNAs as pot ent i al bi om arkers f or l ung adenocarci nom a[J]. Cancer Bi ol ogy Therapy,2013,14(12):1104-1112.
[7]ZH ANG C Z,H AN L,ZH ANG A L,et al.M i croRNA-221 and m i croRNA-222 regul at e gast ri c carci nom a cel l prol i f erat i on and radi oresi st ance by t arget i ng PTEN[J].BM C Cancer,2010,10:367.
[8]H W ANG M S,YU N,STINSON S Y,et al.m i R-221/222 t arget s adi ponect i n recept or 1 t o prom ot e t he epi t hel i al-t o-m esenchym al t ransi t i on i n breast cancer[J].PLoS One,2013,8(6):DOI:10.1371/ j ournal.pone.0066502.
[9]XU K,LIANG X,SH EN K,et al.M i R-222 m odul at es m ul t i drug resi st ance i n hum an col orect al carci nom a by down-regul at i ng ADAM-17[J].Experi m ent al Cel l Research,2012,318(17):2168-2177.
[10]LEE C,H E H,JIANG Y,et al.El evat ed expressi on of t um or m i R-222 i n pancreat i c cancer i s associ at ed wi t h Ki 67 and poor prognosi s[J].M ed Oncol,2013,30(4):700.
[11]PUERTA-GIL P,GARCIA-BAQUERO R,JIA A Y,et al. m i R-143,m i R-222,and m i R-452 are usef ul as t um or st rat i f icat i on and noni nvasi ve di agnost i c bi om arkers f or bl adder cancer[J]. The Am eri can Journal of Pat hol ogy,2012,180(5):1808-1815.
[12]EVANGELISTA A M,DESCH AM PS A M,LIU D,et al. m i R-222 cont ri but es t o sex-di m orphi c cardi ac eNOS expressi on vi a et s-1[J].Physi ol ogi cal Genom i cs,2013,45(12):493-498.
[13]M ATTIA G,ERRICO M C,FELICETTI F,et al.Const i t ut i ve act i vat i on of t he ETS-1-m i R-222 ci rcui t ry i n m et ast at i cm el anom a[J].Pi gm ent Cel l M el anom a Research,2011,24(5):953-965.
[14]H UANG Q M,ZENG Y M,ZH ANG H P,et al.4-Ni t roqui nol i ne-1-oxi de ef f ect s hum an l ung adenocarci nom a A549 cel l s by regul at i ng t he expressi on of POLD4[J].Bi om edi cal Report s, 2016,4(3):345-348.
[15]ZH ANG B,DENG S M,GUO L C,et al.Ef f ect of gem ci t abi ne on t he upt ake of(18)F-f l uorodeoxygl ucose and(18)F-f l uorot hym idi ne i n l ung adenocarci nom a A549 cel l s and t he ani m al t um or m odel[J].Journal of Cancer Research and Therapeut i cs,2016, 12(1):271-276.
[16]M AO K P,ZH ANG W N,LIANG X M,et al.M i croRNA-222 expressi on and i t s prognost i c pot ent i al i n non-sm al l cel l l ung cancer[J].The Sci ent i f i c W orl d Journal,2014:DOI:10.1155/2014/ 908326.
[17]ZH ONG C,DING S,XU Y,et al.M i croRNA-222 prom ot es hum an non-sm al l cel l l ung cancer H 460 growt h by t arget i ng p27[J].Int ernat i onalJournalofCl i ni caland Experi m ent alM edi ci ne, 2015,8(4):5534-5540.
[18]DITTM ER J.The rol e of t he t ranscri pt i on f act or Et s1 i n carcinom a[J].Sem i nars i n Cancer Bi ol ogy,2015,35:20-38.
[19]PH UCH AREON J,M CCORM ICK F,EISELE D W,et al.EGFR i nhi bi t i on evokes i nnat e drug resi st ance i n l ung cancer cel l s by prevent i ng Akt act i vi t y and t hus i nact i vat i ng Et s-1 f unct i on[J]. Proceedi ngs of t he Nat i onal Academ y of Sci ences of t he Uni t ed St at es of Am eri ca,2015,112(29):E3855-E3863.
(童颖丹 编辑)
MicroRNA-222 promotes proliferation,migration and invasion of human lung adenocarcinoma cells by directly targetingETS1
Bin Lu,Jin-guang Jia,Li-hua Li,Fei-fei Yao
(Department of Respiratory Medicine,Zhengzhou People's Hospital,Zhengzhou, Henan 450003,China)
ObjectiveTo investigate the role of microRNA-22 (miR-222)in the proliferation,migration and invasion of human lung adenocarcinoma cells.MethodsFirstly,miR-222 and negative control were transfected into lung adenocarcinoma cells,and the CCK-8 assay,Transwell migration and Matrigel invasion assays were performed to detect the effect of miR-222 on cell proliferation,migration and invasion respectively.Then the luciferase reporter assay,quantitative real-time polymerase chain reaction (qRT-PCR)and Western blot were performed to validate the putative target of miR-222.Subsequently,loss-of-function assay was applied to determine the target involved in the regulation of proliferation,migration and invasion of lung adenocarcinoma cells.ResultsThe results of CCK-8 assay,Transwell migration and Matrigel invasion assays indicated that miR-222 could promote the proliferation,migration and invasion of lung adenocarcinoma cells.The luciferase reporter assay,qRT-PCR and Western blot showed that miR-222 directly targeted the 3'UTR ofETS1.And overexpression ofETS1significantly inhibited the miR-222-induced proliferation,migration and invasion of lung adenocarcinoma cells.ConclusionsmiR-222 facilitates proliferation,migration and invasion of lung adenocarcinoma cells by repressingETS1.
miR-222;ETS1;proliferation;migration;invasion
1005-8982(2017)03-0034-07
R 734.2
A
2016-05-09
图5 过表达ETS1抑制肺腺癌细胞的增殖过程 (±s)

