小鼠巨噬细胞系RAW 264.7向破骨细胞分化的诱导条件
耿 欢,林 琛,邢更彦
小鼠巨噬细胞系RAW 264.7向破骨细胞分化的诱导条件
耿 欢,林 琛,邢更彦
目的探讨RAW 264.7细胞与向破骨细胞分化的诱导条件,以期提高破骨细胞的数量与活性。方法 采用不同浓度核因子κB受体活化因子配体(receptor activator of nuclear factor κB ligand,RANKL)诱导RAW 264.7细胞4 d后形成破骨细胞,并通过抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色和鬼笔环肽染色鉴定破骨细胞,骨板吸收实验检测破骨细胞的骨吸收活性,反转录酶-聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR)检测破骨细胞功能基因TRAP、破骨细胞相关受体(osteoclast-associated receptor,OSCAR)、c-Fos、核转录因子激活的T细胞1(nuclear factor of activated T-cells 1,NFATc1)的表达。结果RAW 264.7细胞经RANKL诱导4 d后可出现大量TRAP呈阳性和纤维肌动蛋白环形成的多核破骨细胞,骨板上形成较多的骨吸收瘢痕,RT-PCR检测到破骨细胞特殊功能基因信使核糖核酸(message ribonucleic acid,mRNA)高表达。结论RAW 264.7诱导4 d可产生大量噬骨能力较强的破骨细胞。
RAW 264.7;破骨细胞;抗酒石酸酸性磷酸酶;核因子κB受体活化因子配体
骨的生理平衡是通过成骨细胞的骨形成与破骨细胞的骨吸收维持的[1]。破骨细胞的过度激活与功能增强会打破这种平衡,导致骨量减少,增加骨折的风险,如类风湿性关节炎、多发性骨髓瘤等疾病,因此破骨细胞的研究非常重要与有意义。破骨细胞的获取是研究的前提,但其在骨组织中含量少,较难分离,体外诱导是获取破骨细胞的主要方法。破骨细胞是在骨组织中由单核巨噬细胞分化来的特殊的具有吞噬骨组织功能的多核巨细胞。由于成骨细胞与破骨细胞之间OPG/ RANKL/RANK信号轴的发现[2],使在体外诱导单核巨噬细胞融合成破骨细胞成为简单有效的方法。RAW 264.7细胞是小鼠源性单核细胞,获取简单,纯度较高,可以无限传代,成为诱导破骨细胞的主流[3]。然而,RAW 264.7细胞生长较快,且容易分化,用RAW 264.7细胞诱导破骨细胞依然有很大的难度,国内外文献对其培养与诱导的条件有很大差异,笔者主要研究RAW 264.7细胞向破骨细胞诱导分化的适宜条件,为后续研究破骨细胞的功能奠定基础。
1 材料与方法
1.1 试剂与材料 DMEM高糖培养基、胎牛血清(Gibco公司,美国);抗酒石酸酸性磷酸酶(tartrateresistant acid phosphatase,TRAP)染色试剂盒(Sigma,美国);核因子κB受体活化因子配体(receptor activator of nuclear factor κB ligand,RANKL)(R&D,美国);24孔破骨活性测定板(Coning,美国);鬼笔环肽染色液(Invitrogen,美国);RAW 264.7小鼠单核巨噬细胞系购自北京协和细胞库;荧光倒置显微镜(奥林巴斯,日本);聚合酶链式反应(polymerase chain reaction,PCR)仪(Bio-rad,美国)。
1.2 方法
1.2.1 RAW 264.7细胞培养与接种的密度梯度 RAW 264.7细胞生长迅速且容易分化,而状态较好的RAW 264.7细胞是诱导破骨细胞的关键,RAW 264.7细胞的培养血清56 ℃灭活30 min[4],吹打传代,用于诱导的RAW 264.7细胞要为未分化的圆形。因为RAW 264.7细胞生长较快,且诱导需要4 d,诱导前密度梯度培养4 d,将RAW 264.7细胞按(0.25、0.50、0.75、1.00、1.25、1.50)×104/cm2的密度接种到24孔板中,培养4 d后用1%的甲苯胺蓝染色观察细胞生长状态,找出RAW 264.7细胞的最佳诱导密度。
1.2.2 破骨细胞诱导与TRAP染色 根据密度梯度培养结果将RAW 264.7细胞以5×103/cm2的密度接种到48孔板中,加用50 ng/ml的高浓度RANKL诱导破骨细胞,并于24、48、72、96 h分别进行TRAP染色,观察破骨细胞形态变化。同样密度将RAW 264.7细胞接种到48孔板中,设置对照组与不同RANKL浓度诱导组,过夜贴壁后,对照组正常培养,未加任何处理,诱导组分别加用5、10、20、50 ng/ml的RANKL诱导破骨细胞,每2 d换液。4 d后镜下观察到融合的破骨细胞取出48孔板,去除培养液,按照Sigma试剂盒说明书进行TRAP染色。
1.2.3 破骨细胞纤维肌动蛋白环的鬼笔环肽染色 将RAW 264.7细胞以5×103/cm2的密度接种到48孔板中,设置对照组与诱导组,对照组正常培养,未加任何处理,诱导组加20 ng/ml的RANKL,诱导4 d后,镜下观察到融合的破骨细胞后取出48孔板,去除培养液,磷酸缓冲盐溶液(phosphate buffer saline,PBS)漂洗2遍,4%多聚甲醛固定20 min后,PBS漂洗2遍,0.1%的Triton-100穿孔10 min,PBS漂洗1遍,用鬼笔环肽工作液染色30 min,回收鬼笔环肽染色液,PBS漂洗2遍,用Hoechst染色20 min,PBS漂洗1遍后于荧光显微镜下观察拍照。
1.2.4 破骨细胞吸收功能检测实验 RAW 264.7细胞以5×103/cm2的密度接种于24孔骨细胞培养板中,设立对照组与诱导组,对照组正常培养,未加任何处理,诱导组加20 ng/ml的RANKL诱导破骨细胞,换液2 d/次,诱导4 d后拿出骨细胞培养板,移除培养液,ddH2O洗1遍,加入4%的次氯酸钠漂洗5 min,移除次氯酸钠,用ddH2O洗2遍,加入1%的甲苯胺蓝染色10 min后,ddH2O洗3遍,室温晾干,光镜下进行观察拍照。
1.2.5 破骨细胞的标志与功能基因检测 将RAW 264.7细胞以5×103/cm2的密度接种于6孔板中,设置对照组与诱导组,对照组正常培养,未加任何处理,诱导组加用20 ng/ml的RANKL干预。48 h后提取总信使核糖核酸(message ribonucleic acid,mRNA),接着逆转成与mRNA链呈互补的碱基序列的单链DNA(complementary deoxyribonucleic acid,cDNA),通过实时聚合酶链式反应(realtime-polymerase chain reaction,RT-PCR)检 测TRAP、OSCAR、c-Fos、NFATc1基因的表达。目的基因引物序列见图1。

表1 荧光定量PCR的引物
1.3 统计学处理 应用SPSS 16.0统计学软件分析本研究数据,计量资料采用表示,组间比较采用独立样本t检验。误差棒表示(平均值)的标准误,以P<0.05为差异有统计学意义。
2 结 果
2.1 RAW 264.7细胞的形态与接种密度梯度培养结果状态较好的RAW 264.7细胞为未分化的小圆形,生长迅速,进行密度梯度培养4 d后发现细胞接种密度为5×103/cm2时细胞重叠生长较少且基本铺平板底,小于此密度细胞集落之间距离较大,大于此密度细胞重叠严重且部分细胞脱落均影响破骨细胞的诱导,因此将RAW 264.7细胞以5×103/cm2的密度接种到相应的培养板中诱导破骨细胞(图1)。

图1 RAW 264.7细胞不同接种密度培养4 d后甲苯胺蓝染色(标尺=200μm)
2.2 RAW 264.7细胞诱导分化为破骨细胞的TRAP染色结果RAW 264.7细胞经50 ng/ml的RANKL诱导1 d后,出现少量单核的TRAP阳性细胞,诱导2 d后几乎所有的细胞都是TRAP阳性,但未出现多核细胞,第3天开始出现多核的破骨细胞,但体积相对较小且数量较少,4 d后可见大量圆形、椭圆形的体积巨大的细胞,胞质丰富,进行TRAP染色可见为酒红色的多核巨细胞,有的核可达上百个。RAW 264.7细胞经不同浓度的RANKL诱导4 d后,未加RANKL组未见到TRAP阳性的多核巨细胞,5 ng/ml组与10 ng/ml组出现少量小的破骨细胞,而20 ng/ml组与50 ng/ml组均出现大量的TRAP阳性的破骨细胞,因此实验可以较低浓度的RANKL(20 ng/ml)诱导破骨细胞来提高经济效益(图2)。
2.3 RAW 264.7细胞诱导分化为破骨细胞的纤维肌动蛋白环染色结果RAW 264.7细胞经RANKL诱导4 d后经红色鬼笔环肽染色可见成熟的破骨细胞纤维肌动蛋白环被染成红色,复染Hoechst可见细胞内有大量的蓝色细胞核,对照组未出现红色的肌动蛋白环与多核细胞(图3)。
2.4 RAW 264.7细胞诱导分化为破骨细胞的骨板吸收结果骨吸收实验发现RAW 264.7细胞经诱导4 d后骨细胞培养板上出现大量的圆形、椭圆形、不规则形状的白色吸收瘢痕,对照组未见吸收瘢痕(图4)。
2.5 RAW 264.7细胞分化为破骨细胞相关基因表达结果RT-PCR结果显示RAW 264.7细胞经RANKL诱导48 h后,经过Image J软件灰度分析,SPSS 16.0软件统计,发现破骨细胞分化的相关基因TRAP、OSCAR、c-Fos、NFATc1的表达均明显高于对照组(P<0.05,图5)。

图2 RAW 264.7细胞经50 ng/ml的RANKL诱导不同时间与经不同浓度的RANKL诱导4 d后的TRAP染色结果(标尺=100μm)
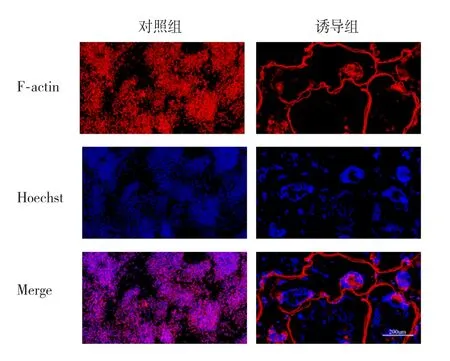
图3 RAW 264.7细胞分化为破骨细胞的鬼笔环肽染色(标尺=200 μm)

图4 破骨细胞的骨吸收活性检测(标尺=100 μm)
3 讨 论
破骨细胞是由单核巨噬细胞融合而成[5],巨噬细胞集落刺激因子(macrophage colony-stimulating factor,M-CSF)与RANKL是破骨细胞分化过程中的两个重要细胞因子[6]。M-CSF与破骨细胞前体细胞上c-fms受体结合促进细胞增殖与细胞骨架的形成[7];RANKL是促进破骨细胞前体细胞向破骨细胞分化的关键细胞因子[8],RANKL与破骨细胞前体细胞上的RANK受体结合,RANK被激活后关键的起始阶段是肿瘤坏死因子受体相关的细胞内因子 (tumor necrosis factor, TNF)受体相关因子(receptor-associated factor, TRAF)结合到受体RANK胞内特殊的结构域[9],最终引起破骨细胞特殊基因的表达并向破骨细胞分化[10]。上述机制的发现使得体外诱导破骨细胞变得相对简单,现在RANKL与 M-CSF联合成为诱导破骨细胞的主要方法。
RAW 264.7细胞是小鼠单核巨噬细胞系并可以融合为破骨细胞[11],且RAW 264.7细胞能表达破骨细胞表型标志物。Xu等[12]研究认为RAW 264.7细胞是晚期分化阶段的破骨前体细胞,仅需要RANKL就可以诱导出破骨细胞。但文献报道用RAW 264.7细胞诱导破骨细胞的方法差异较大,本研究主要探索用RAW 264.7细胞诱导破骨细胞的适宜条件。
RAW 264.7细胞生长迅速,诱导的密度采取密度梯度法直观摸索条件,发现接种密度为5×103/cm2时4 d后细胞生长状态良好,多数实验者根据文献确定细胞密度,建议诱导前进行密度梯度摸索,同时RAW 264.7细胞的状态对诱导破骨细胞也至关重要,状态良好的RAW 264.7细胞更易诱导出破骨细胞。经过高剂量RANKL多次诱导发现,RAW 264.7细胞经诱导24 h后出现少量有融合能力的TRAP阳性细胞,48 h后几乎所有的RAW 264.7细胞均为TRAP阳性且开始发生融合[13],并开始出现TRAP阳性的多核破骨细胞,96 h后出现大量的TRAP阳性的破骨细胞。随后进行RANKL浓度梯度诱导发现20 ng/ml时即出现大量的TRAP阳性细胞,随着RANKL浓度的增加破骨细胞的数量并无显著的增加[14],这可能与RANKL和RAW 264.7细胞上的RANK受体结合达到饱和有关。因此笔者将RAW 264.7细胞以5×103/cm2的密度、20 ng/ml的RANKL浓度诱导4 d作为最佳诱导条件。按此条件诱导4 d后,成熟的破骨细胞经鬼笔环肽荧光染色可见到纤维肌动蛋白环,纤维肌动蛋白环是成熟破骨细胞在骨上形成密闭小室进行骨吸收的重要结构[15]。24孔骨细胞培养板中可以明显看到破骨细胞吸收留下的瘢痕,这是检验破骨细胞功能的直观指标。最后PCR检测发现破骨细胞分化过程的相关基因TRAP、OSCAR、c-Fos、NFATc1均高表达。

图5 RAW 264.7细胞经RANKL诱导48 h后破骨细胞相关基因的表达
综上所述,采用小鼠单核细胞系RAW 264.7诱导破骨细胞是一种高效简单的方法,可以为实验需要提供大量形态与功能良好的破骨细胞。由于实验条件的不同,诱导前应对细胞接种密度、诱导天数、RANKL的诱导浓度进行摸索,以期提高诱导效率。
[1]Hayashi M, Nakashima T, Taniguchi M, et al. Osteoprotection by semaphorin 3A [J]. Nature, 2012, 485(7396): 69-74. DOI:10.1038/nature11000 .
[2]Boyle W J, Simonet W S and Lacey D L. Osteoclast differentiation and activation [J]. Nature, 2003, 423(6937): 337-342. DOI: 10.1038/nature01658 .
[3]Xiong Q, Zhang L, Xin L, et al. Proteomic study of different culture medium serum volume fractions on RANKL-dependent RAW 264.7 cells differentiating into osteoclasts [J]. Proteome Sci, 2015, 13(5):16. DOI:10.1186/ s12953-015-0073-6.
[4]Fujiwara T, Zhou J, Ye S, et al. RNA-binding protein Musashi2 induced by RANKL is critical for osteoclast survival [J]. Cell Death Dis, 2016, 7(7):e2300. DOI: 10.1038/cddis.2016.213.
[5]Asagiri M and Takayanagi H. The molecular understanding of osteoclast differentiation [J]. Bone, 2007, 40( 2): 251-264. DOI:10.1016/j.bone.2006.09.023.
[6]Miron R J and Bosshardt D D. OsteoMacs: Key players around bone biomaterials [J]. Biomaterials, 2016, 82(3): 1-19. DOI:10.1016/j.biomaterials.2015.12.017.
[7]Dou C, Li J, Kang F, et al. Dual effect of cyanidin on RANKL-Induced differentiation and fusion of osteoclasts [J]. J Cell Physiol, 2016, 231( 3): 558-567. DOI: 10.1002/jcp.24916.
[8]Takeshita S, Namba N, Zhao J J, et al. SHIP-deficient mice are severely osteoporotic due to increased numbers of hyper-resorptive osteoclasts [J]. Nat Med, 2002, 8( 9): 943-949. DOI:10.1038/nm752.
[9]Galibert L, Tometsko M E, Anderson D M, et al. The involvement of multiple tumor necrosis factor receptor(TNFR)-associated factors in the signaling mechanisms of receptor activator of NF-kappa B, a member of the TNFR superfamily [J]. J Biol Chem, 1998, 273( 51): 34120-34127. DOI:10.1074/jbc.273.51.34120.
[10]Heo D N, Ko W K, Moon H J, et al. Inhibition of osteoclast differentiation by gold nanoparticles functionalized with cyclodextrin curcumin complexes [J]. Acs Nano, 2014, 8(12): 12049-12062. DOI:10.1021/nn504329u.
[11]Zhao N, Tsuda H, Murofushi T, et al. Chaetocin inhibits RANKL-induced osteoclast differentiation through reduction of Blimp1 in Raw264.7 cells [J]. Life Sciences, 2015, 143(12): 1-7. DOI:10.1016/j.lfs.2015.10.027.
[12]Xu J, Wang C, Han R, et al. Evidence of reciprocal regulation between the high extracellular calcium and RANKL signal transduction pathways in RAW cell derived osteoclasts [J]. J Cell Physiol, 2005, 202( 2): 554-562. DOI:10.1002/jcp.20159.
[13]Levaot N, Ottolenghi A, Mann M, et al. Osteoclast fusion is initiated by a small subset of RANKL-stimulated monocyte progenitors, which can fuse to RANKL-unstimulated progenitors [J]. Bone, 2015, 79(10):21-28.DOI: 10.1016/j.bone.2015.05.021. Epub 2015 May 22.
[14]Motiur Rahman M, Takeshita S, Matsuoka K, et al. Proliferation-coupled osteoclast differentiation by RANKL: Cell density as a determinant of osteoclast formation [J]. Bone, 2015, 81(8):392-399.DOI:10.1016/ j.bone.2015.08.008. Epub 2015 Aug 8.
[15]Takito J, Otsuka H, Yanagisawa N, et al. Regulation of osteoclast multinucleation by the actin cytoskeleton signaling network [J]. J Cell Physiol, 2015, 230( 2): 395-405. DOI:10.1002/jcp.24723.
(2016-12-16收稿2016-02-07修回)
(本文编辑 孙秀明)
Induction conditions of osteoclasts differentiation from mouse macrophage RAW 264.7 cell line
GENG Huan,LIN Chen,and XING Gengyan.
Department of Joint limbs in Orthopedics center, General Hospital of Chinese People's Armed Police Force, Beijing 100039 , China
Corresponding author: XING Gengyan, E-mail: xgy7766@263.net
ObjectiveThe study aimed to explore the induction conditions of RAW 264.7 cells differentiation into osteoclasts, with the view to improving the amount and activity of osteoclasts.MethodsThe RAW 264.7 cells were induced with different concentrations of receptor activator of nuclear factor κB ligand (RANKL) for 4 days to differentiate into osteoclasts, tartrate-resistant acid phosphatase (TRAP) staining and phalloidin staining were used to identify the osteoclasts, the Osteo Assay Surface Plate was used to measure the bone resorptive activities of osteoclasts, reverse transcription polymerase chain reaction (RT-PCR) was used to detect the expressions of osteoclast phenotypic and functional genes TRAP, osteoclast-associated receptor (OSCAR), c-Fos and nuclear factor of activated T-cells 1 (NFATc1).ResultsRAW 264.7 cells induced by RANKL 4 days, could differentiate into multinucleated cells and a large number of fibrous actin rings formed by TRAP positive 1fibers and fibrous actin ring; Bone resorption pits were found on the surface of bone plate by microscope; RT-PCR detected that high expression of message ribonucleic acid (mRNA) made by the gene messenger of osteoclasts for special function.ConclusionsThe RAW 264.7 cells induced for 4 days can differentiate into a large number of osteoclasts with strong bone resorption activity.
RAW 264.7; osteoclast; tartrate-resistant acid phosphatase;receptor activator of nuclear factor κB ligand
R329
10.13919/j.issn.2095-6274.2017.03.006
国家自然科学基金(11405185)
100039 北京,武警总医院骨科中心关节四肢科
邢更彦,E-mail:xgy7766@263.net

