三文鱼过敏原小清蛋白分离纯化及免疫结构鉴定
马涛,王一侠,金振涛,谷瑞增,鲁军
(中国食品发酵工业研究院北京市蛋白功能肽工程技术研究中心,北京100027)
三文鱼过敏原小清蛋白分离纯化及免疫结构鉴定
马涛,王一侠,金振涛,谷瑞增,鲁军*
(中国食品发酵工业研究院北京市蛋白功能肽工程技术研究中心,北京100027)
小清蛋白是鱼类的主要过敏原,三文鱼小清蛋白具有不同的亚型,分子量相近,序列基本相同,给分离纯化带来了不小的挑战。本试验采用硫酸铵盐析、Qxl-Sepharose离子交换结合凝胶过滤等方法定向纯化小清蛋白β1型,并应用免疫印迹法对纯化的小清蛋白进行过敏原性鉴定,结合激光辅助解析/飞行时间质谱进行结构鉴定。结果显示,硫酸铵盐析、离子交换层析结合凝胶过滤纯化方法可以得到纯度达90%以上的小清蛋白β1型,且蛋白具有很强的免疫反应活性。针对该蛋白的研究不仅有利于过敏原检测方法的建立,也可为低致敏性水产品的开发提供理论依据。
三文鱼;原肌球蛋白;分离纯化;免疫印迹
根据流行病学调查,全世界范围内约有2%的成年人、8%的婴幼儿对食物产生过敏反应,其中90%以上的食物过敏反应由蛋、奶、鱼、甲壳类动物、花生、大豆、坚果和小麦等八大类食物引起[1]。鱼是引起食物过敏的常见水产品之一,其主要过敏原是小清蛋白,一种水溶性钙结合蛋白,分子量大约为12 ku,等电点(pI)为3.9~5.5,能够引起人体由IgE介导的免疫反应[2-3]。相对而言,国内在水产品过敏原的研究起步较晚,目前的研究主要集中在虾、蟹等甲壳类动物,对于鱼类过敏的研究仍然很少[4-5]。
三文鱼,学名鲑鱼,是一种广泛引起人们过敏的海水鱼,可引发荨麻疹、哮喘、呕吐、腹泻、过敏性休克等症状。随着中国经济的腾飞,人民的生活水平日益改善,三文鱼以其丰富的营养含量及其独特的口感赢得了中国消费者的青睐,目前中国已成为挪威三文鱼在亚洲除日本之外最大的市场。国外研究表明,三文鱼过敏原蛋白为Sals1蛋白,与人们深入研究的鳕鱼Gad c 1蛋白仅有58%的氨基酸序列同源性。Sals1蛋白有2个亚型,均为109个氨基酸,序列基本相同,致敏活性完全不同[6-7]。但是,关于三文鱼小清蛋白活性分离及结构特征国内却乏人研究。本试验以三文鱼为研究对象,采用硫酸铵盐析、QXL-Sepharose离子交换结合凝胶过滤等方法定向纯化小清蛋白β1型,并应用免疫印迹法对纯化的小清蛋白进行免疫原性鉴定,同时通过激光辅助解析/飞行时间质谱进行质谱鉴定,为建立鱼类过敏原蛋白检测及致敏活性控制技术奠定基础。
1 材料与方法
1.1 材料与试剂
抗蛙小清蛋白单克隆抗体(PARV-19):Sigma公司;辣根过氧化酶标记的兔抗小鼠IgG:Abnova公司;0.45μm硝酸纤维素膜:Bio-Rad公司;其他试剂均为国产分析纯。
1.2 仪器与设备
ChemiDoc MP凝胶成像仪:美国Bio-Rad公司;AKTApurifier 10蛋白质快速纯化系统:瑞典GE Healthcare;Allegra X-15R高速冷冻离心机:美国Beckman公司;DYCZ-24DN电泳槽及电转移装置:北京市六一仪器厂;FE20K酸度计:瑞士梅特勒公司;恒温水浴锅等。
1.3 方法
1.3.1 肌浆蛋白的制备
三文鱼过敏原小清蛋白主要存在于鱼肉肌浆蛋白中。取三文鱼红肉60 g,切碎后置于4倍体积冰冷的缓冲液中(含有5mmol/LEDTA的20mmol/LTris-HCl pH7.5),用组织捣碎机捣碎。将悬浮液于8 000 r/min,4℃下离心30min,取上清即为肌浆蛋白[8]。
1.3.2 三文鱼小清蛋白粗级纯化
三文鱼肌浆蛋白100℃水浴加热30min,期间不断搅拌,样品冷却至室温,于12000 r/min,4℃离心10min,收集上清液。上清液进行60%(NH4)2SO4盐析,继续搅拌30min后于4℃静置1 h,离心收集淀并用适量水将其溶解,溶解液即为粗纯化的小清蛋白。
1.3.3 三文鱼小清蛋白粗级纯化
将粗纯化的三文鱼小清蛋白样品于缓冲液(pH 7.5,10mmol/L Tris-HCl)中4℃透析过夜,12 000 r/min离心20min,将上清液上样于缓冲液(20mmol/L Tris-HCl、pH7.5)平衡过的QxL-Sepharose预装柱,流速为1mL/min,用缓冲液充分洗净未吸附蛋白质。用0~ 0.5mol/LNaCl进行线性梯度洗脱,流速为1mL/min,收集各组分进行蛋白含量测定和SDS-PAGE电泳,确定目的蛋白所在组分并将其收集储存。随后上样于用缓冲液(含有0.15mol/LNaCl的20mmol/LTris-HCl、pH7.5缓冲液)平衡过的Superdex 200凝胶柱,然后用相同缓冲液洗脱,流速为0.5mL/min,收集各组分并分别测定它们在280 nm下的吸光值,确定目的蛋白所在组分并将其收集储存。
1.3.4 凝胶电泳(SDS-PAGE)
配制聚丙烯酰胺凝胶,加入SDS化的蛋白质样品,电泳,考马斯亮蓝染色,凝胶成像系统拍照。
1.3.5 免疫印迹
将SDS-PAGE分离的蛋白质样品转移到膜上,5%牛血清白蛋白封闭1 h,TBST洗涤3次,加入一抗(按1∶50体积比稀释的小鼠抗蛙小清蛋白单克隆抗体)孵育3 h,TBST洗涤,加入二抗(按1∶2000体积比稀释的HRP标记的山羊抗鼠IgG)反应1 h,TBST洗涤3次,加入DAB显色,观察并拍照。
1.3.6 肽质量指纹图谱分析
采用激光辅助解析/飞行时间质谱(MALDI-TOFMS)对三文鱼小清蛋白进行分析,得到肽质量指纹图谱(委托广东骏辉生物科技有限公司)[9]。
2 结果与分析
2.1 三文鱼小清蛋白的粗级纯化
三文鱼肌浆蛋白热提取物的SDS-PAGE电泳结果,见图1。
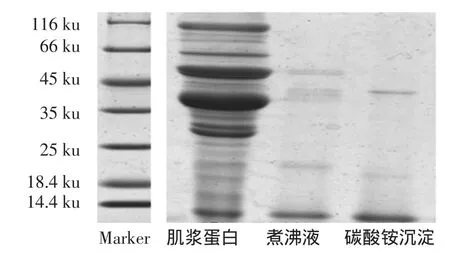
图1 三文鱼蛋白SDS-PAGE图Fig.1 SDS-PAGE analysis of Salmon protein
鱼肌肉蛋白根据其组成不同,可分为肌原纤维蛋白、肌浆蛋白、肌基质蛋白和异质组织蛋白4大部分。三文鱼肌浆蛋白组成很复杂,至少含有十多种蛋白,其中116、36、48 ku左右蛋白含量较高。三文鱼是引起食物过敏的常见水产品之一,其主要过敏原是小清蛋白,具有很高的热稳定性。由于小清蛋白具有较高的热稳定性,而大部分蛋白经过加热后会发生变性沉淀[10],因此,本研究将鱼类肌浆蛋白抽提后进行短暂的加热处理,从而获得含有较高纯度小清蛋白的提取物,有效去除肌浆抽提物中其它蛋白、脂肪等物质对后续检测的干扰。试验通过Tris缓冲液提取、热处理分离、硫酸铵盐析进行小清蛋白初级纯化。从电泳图1可以看出,粗提样品中含有至少十多种蛋白,成分复杂,经过煮沸和硫酸铵沉淀杂蛋白明显减少,蛋白纯度从13.8%提高到52.4%。
2.2 离子交换层析纯化
三文鱼粗蛋白通过硫酸铵盐析,透析后上样于QXL-Sepharose阴离子交换柱,用0~0.5mol/LNaCl进行线性梯度洗脱。小清蛋白离子交换层析图,见图2。
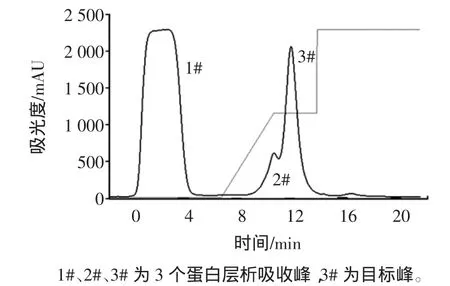
图2 小清蛋白离子交换层析图Fig.2 Iron-exchanged chromatogram of parvalbumin
从图2可以看到经过QXL-Sepharose柱层析后,在加入NaCl开始洗脱到蛋白检测值趋于平稳时,整个过程得到2个洗脱蛋白峰,其中第3#峰为目标峰,所含三文鱼小清蛋白纯度最高,通过光密度扫描检测纯度达到92%。从自动部分收集器中分别收集于锥形瓶中,经低温条件下超滤管浓缩后,用于电泳分析,离子层析谱图及电泳图谱,见图3。
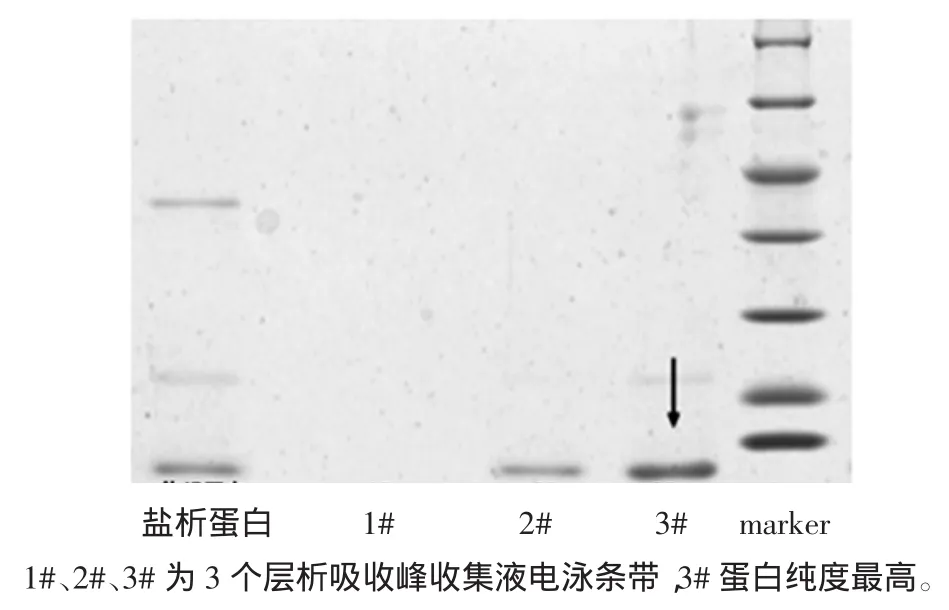
图3 小清蛋白离子层析电泳图Fig.3 SDS-PAGE analysis of parvalbumin through Ironexchanged chromatography
2.3 凝胶过滤层析纯化
小清蛋白凝胶色谱层析谱图见图4,小清蛋白凝胶层析电泳图见图5。
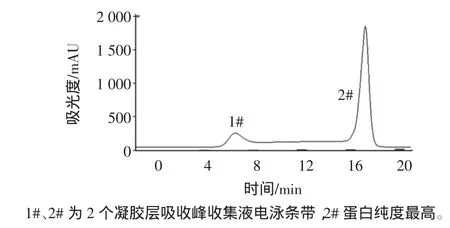
图4 小清蛋白凝胶色谱层析谱图Fig.4 Gel chromatogram of parvalbumin
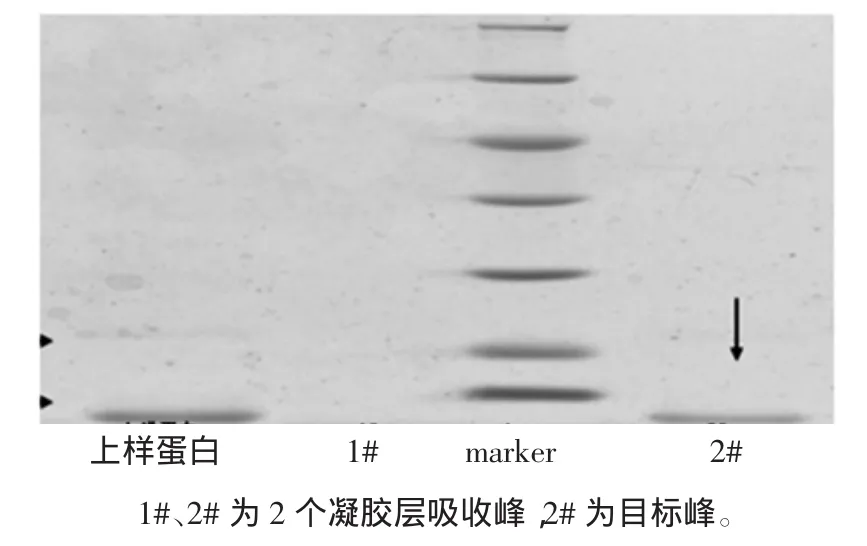
图5 小清蛋白凝胶层析电泳图Fig.5 SDS-PAGE analysis of parvalbum in through Gel chromatography
样品经Superdex 200凝胶过滤柱,收集各组分并进行紫外检测。在280 nm波长下,得到2个主要吸收峰,自动部分收集器中分别收集于锥形瓶中,经低温条件下超滤管浓缩后,用于电泳分析,从图5中可以看出,经过进一步的凝胶过滤纯化,已基本去除了所有杂蛋白,蛋白达到较高的纯度,灰度扫描显示其纯度大于99%。
2.4 电泳鉴定纯度
小清蛋白分离纯化电泳图见图6。
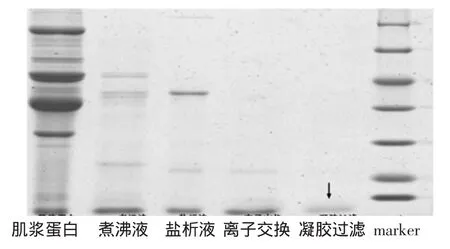
图6 小清蛋白分离纯化电泳图Fig.6 SDS-PAGE analysis of parvalbumin through separation and purification process
将粗分离、盐析、离子交换、凝胶过滤等得到的蛋白进行SDS-PAGE试验,上样分离胶经Quantity one软件分析,图6中可以看出,三文鱼小清蛋白逐步得到纯化,第5泳道只有一条条带,分子量为12 ku左右,其相对含量大于99%。而据文献报道,三文鱼小清蛋白的分子量为12 ku,结果符合文献报道。
2.5 免疫活性鉴定
分别取水溶性总蛋白及纯化小清蛋白进行SDSPAGE,以小鼠抗蛙小清蛋白单克隆抗体为一抗进行Western blotting确认分析,结果见图7。

图7 小清蛋白免疫印迹鉴定Fig.7 Western-blotting analysis of parvalbumin
由图7可见,三文鱼水溶性总蛋白及纯化小清蛋白在分子量约为12 ku处均与该单克隆抗体出现明显的特异杂交显色条带,据此进一步判定纯化的蛋白样品即为小清蛋白,且具有较强的免疫反应活性。Davis等[11]报道,在对小清蛋白热处理过程中,70℃~80℃时二硫键将断裂,80℃~90℃时会形成分子内或分子间相互作用、二硫键重新排列,90℃~100℃时会形成新的聚合物。汪宁等[4]在研究鲢骨骼肌过敏原小清蛋白热稳定活性时发现,鲢小清蛋白对高温具有较强的抗性,加热会促进该蛋白多聚物的形成。但随着加热时间的延长,,则蛋白免疫活性会降低,不能与抗蛙小清蛋白单克隆抗体有效结合。在本试验过程中,热变性时间控制在30min以内,纯化的三文鱼小清蛋白保持了较强的免疫活性。
2.6 质谱结构鉴定
小清蛋白质谱结构鉴定见图8。
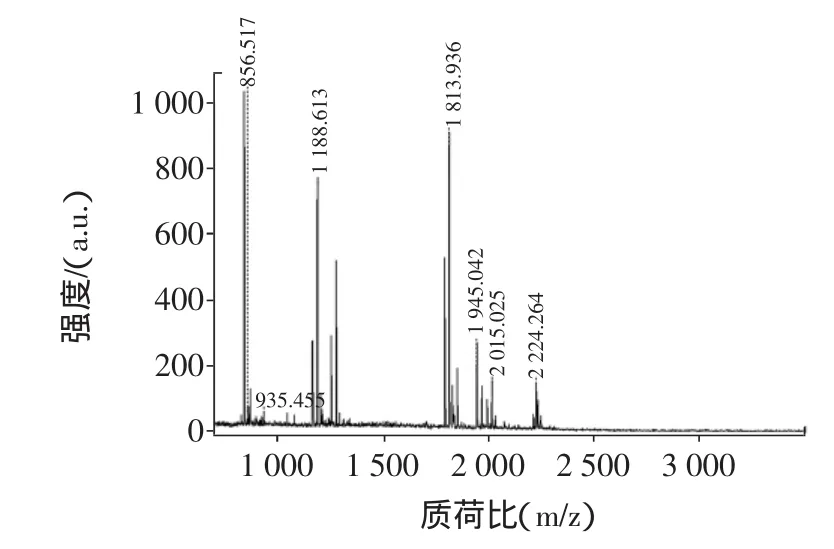
图8 小清蛋白质谱结构鉴定Fig.8 MALDI-TOF-MS spectrogram of by Parvalbumin
为了进一步确证蛋白质的种类,对蛋白质进行了质谱鉴定。待鉴定的三文鱼主要过敏原蛋白经胰蛋白酶酶切后,得到的肽段混合物经过基质辅助激光解吸电离/飞行时间质谱分析[12]。图8得到的是三文鱼过敏原蛋白12 ku主要过敏原蛋白的肽质量指纹图谱,图中每个谱峰代表1种肽段。应用MALDI-TOF-MS测定蛋白质或多肽混合物,不仅操作简单、灵敏度高、分析速度快,而且从图中可以看出它的谱峰简单,可直接分析。利用Mascot搜索引擎,根据蛋白匹配分值与匹配次数关系进行鉴定。结果显示,搜索匹配的蛋白质均为三文鱼原肌球蛋白,且匹配得分值之间差异不大,所以该蛋白得到确定鉴定。鉴定结果显示,该蛋白质确系三文鱼过敏原小清蛋白Parvalbumin beta 1 [Salmo salar]。
3 结论
鱼类是最容易引起过敏的食物之一,小清蛋白是其主要的过敏原蛋白组分。根据蛋白质一级结构的序列分析,小清蛋白可进一步分为α型和β型。α-小清蛋白的等电点大于或等于5.0,而β-小清蛋白由于含有更多的酸性氨基酸,其等电点在4.5以下[9]。三文鱼引发人体的过敏原蛋白主要为Parvalbuminβ1,其中Parvalbuminβ2型蛋白序列相差不大但致敏活性却截然不同。Marina Perez-Gordo采用肽段免疫芯片的技术针对parvalbuminβ1进行了筛选,发现MACAHLCKEADIKTALEA、KTFFHTIGFASKSADDVK、VEELKLFLQNFCPKARELTDA 3个重要的过敏原抗体结合表位肽段。本试验以海洋三文鱼作为研究对象,采用加热及硫酸铵分级盐析、离子交换结合凝胶过滤对小清蛋白进行纯化,免疫印迹及质谱检测结果显示该蛋白为三文鱼过敏原蛋白parvalbumin beta 1,且三文鱼小清蛋白耐热性强,采用100℃加热处理30min仍能稳定存在且保持较强的免疫反应活性,小清蛋白是鱼类的主要过敏原,对该蛋白的研究不仅有利于过敏原检测方法的建立,也可为低致敏性水产品的开发提供理论依据。
[1]Sampson H A.Food allergy.Immunopathogenesis and clinical disorders[J].Allergy Clin Immunol,1999,103(5):717-728
[2]KOBAYASHIA,TaANAKA H,HAMADA Y,et al.Comparison of allergenicity and allergens between fish white and dark muscles[J]. Allergy,2006,61(3):357-363
[3]VAN DT,HORDVIKD I,ENDRESENB C,et al.Characterization of parvalbumin,the major allergen in Alaska pollack,and comparison withcodfish allergen M[J].Mol Immunol,2005,42(3):345-353
[4]汪宁,蔡秋凤,刘光明,等.鲢骨骼肌过敏原小清蛋白的分离纯化及多克隆抗体制备与应用[J].水产学报,2010,34(1):41-45
[5]练玉银,刘志刚,温岸玲.鲤鱼主要过敏原的分离、鉴定与纯化[J].中国公共卫生,2006,22(8):947-949
[6]Lindstrom CD,Van Do T,Hordvik I,et al.Cloning of two distinct cDNAs encoding parvalbumin,the major allergen of Atlantic salmon (Salmo salar)[J].Scand J Immunol,1996,44(4):335-344
[7]Marina PG,Jing L,Ludmilla B,et al.Epitope Mapping of Atlantic Salmon Major Allergen by Peptide Microarray Immunoassay[J].Allergy Immunol,2012,157(1):31-40
[8]杜雪莉,周利亘,王锡昌,等.黄鳍鲷骨骼肌伴肌动蛋白的纯化及其抗体制备[J].水产学报,2008,32(3):465-469
[9]Pastor C,Cuesta-Herranz J,Cases B,et al.Identification of major allergens in watermelon[J].Int Arch Allergy Immunol,2009,149(4): 291-298
[10]Chen L,Hefle S L,Taylor SL,et al.Detecting fish parvalbum in with commercial mouse monoclonal ant-i frog parvalbum in IgG[J].J A-gric Food Chem,2006,54(15):5577-5582
[11]Davis P J,Williams S C.Protein modification by thermal processing [J].Allergy,1998,53(46):102-105
[12]Liang Y L,Cao M J,Su W J,et al.Identification and characterisation of the major allergen of Chinese mitten crab(Eriocheir sinensis)[J]. Food Chemistry,2008,111(4):998-1003
Purification and Allergenicity Identification of Salmon Parvalbumin
MA Tao,WANG Yi-xia,JIN Zhen-tao,GU Rui-zeng,LU Jun*
(Beijing Engineering Research Center of Protein and Functional Peptides,China National Research Institute of Food and Fermentation Industries,Beijing100027,China)
Parvalbumin is the major allergen of fish species.The different subtypes of salmon parvalbumin with close molecular weight and sequence bring great challenges to protein separation and purification.Parvalbuminβ1 was purified by heat treatment,(NH4)2SO4salting out method and Qxl-Sepharose chromatography combined by gel filtration.Western blotting was used to identify the allergenicity of purified Parvalbumin.MALDITOF/MS was used to further identify the characteristic of parvalbumin structure.The results revealed that the purity of the parvalbumin β1 was more than 90 percent and it had immunological reactive activity.Investigation into this protein is beneficial not only to detecting allergen,but also to producing aquatic products with low allergenicity.
salmon;parvalbumin;separation and purification;immunoblotting
10.3969/j.issn.1005-6521.2017.04.001
2016-06-12
国家高技术研究发展计划(863计划)项目(2013AA102205-02);国家十二五科技支撑项目(2012BAD33B04-02);北京市科委科技创新基地培育与发展工程项目(Z121106002812040);科技北京百名领军人才培养工程项目(Z131110000513026)
马涛(1987—),男(汉),研究生,研究方向:食物过敏原。
*通信作者

