循环肿瘤细胞对胰腺癌诊断价值的Meta分析
吴斌,陈敏捷,陈飞,吴绍汉,王晓光,钟征翔
(1.泰山医学院 研究生院,山东 泰安 271000;2.浙江省嘉兴市第二医院 肝胆外科,浙江 嘉兴 314000)
目前,胰腺癌是恶性程度最高的肿瘤之一,它的发病率在国内外均成升高趋势,其5年生存率<5%[1],且多数胰腺癌患者在有效诊断之前就发展到中晚期,仅有15%的胰腺癌患者具有手术切除指征[2]。这些问题均归咎于当前尚没有哪一种检查方法能集高敏感性、高特异性和低费用于一体而应用于临床。在胰腺癌发病的早期,淋巴结转移前,患者外周血中可以检测到胰腺来源的肿瘤细胞,其亦可种植到胰腺外的部位,这些肿瘤细胞很可能是从原发的肿瘤上脱落下来进入外周循环[3],并形成微转移灶[4]。Ashworth于1869年首次提出外周循环肿瘤细胞(circulating tumor cells,CTCs)的概念[5],亦有学者称之为“微小残存病灶”。CTCs检测被认为是一种“液体活检”[6],更因为其方便无创的特点也被称为“real-time biopsy”[7]。目前CTCs检测已运用于乳腺癌的诊断、预后判断等方面[8]。同样,若能够在胰腺癌患者中开展CTCs检测,将对胰腺癌的诊断具有重大意义。虽然目前有文献表明CTCs与胰腺癌预后相关[9-10],但是目前胰腺癌CTCs技术未完全成熟,关于CTCs检测对胰腺癌诊断的研究结果差异较大,结果难以令人完全信服。为此,为开展更多的临床应用研究提供理论依据,本研究收集国内外有关CTCs对胰腺癌诊断价值的文献并进行Meta分析。
1 资料与方法
1.1 资料检索
计算机检索PubMed、Cochrane Library、Embase、万方、中国知网、维普等中英文数据库,检索范围从其建库至2016年8月31日,文献检索策略采用主题词和自由词结合的原则,中文检索词为:循环肿瘤细胞、胰腺癌、胰腺肿瘤等;英文检索词为:CTCs、Circulating Tumor Cells、Pancreatic Cancer、Pancreatic Neoplasm等,并手工检索纳入文献的参考文献以发现潜在符合纳入标准的研究。
1.2 文献纳入与排除标准
1.2.1 纳入标准 ⑴ 试验类型:应用检测CTCs的方法诊断胰腺癌的试验研究;⑵ 研究对象:试验组为胰腺癌患者,对照组为非胰腺癌组(包括非胰腺癌胰腺疾病患者组或健康人组);⑶ 金标准设定:以病理组织学检查和病理细胞学检查结果作为诊断金标准;⑷ 已公开发表并且能获取全文文献。
1.2.2 排除标准 ⑴ 金标准设定不是病理组织学结果;⑵ 文献信息量太少,无法从文献全文获得完整的诊断四格表数据,联系文章作者未果的研究文献;⑶ 同一作者重复发表的研究。
1.3 数据提取
采用统一制定的数据收集表,提取纳入文献数据资料,主要数据信息包括:第一作者、发表时间、国家、分离富集方法、检测鉴定方法、TP(真阳性率/敏感度)、FP(假阳性率/误诊率)、FN(假阴性率/漏诊率)、TN(真异性率/特异度)、诊断标准、质量等级、胰腺癌组人数、非胰腺癌组人数等。如存在争议,通过与第三方讨论解决分。
1.4 纳入文献质量评分
根据QUADAS[11](Quality Assessment of Diagnostic Accuracy Studies)评分量表 分别对纳入文献的质量进行评价。QUADAS中14 个条目逐一评价文献质量,评价标准包含“是”、“否”、“不清楚”,其中“是”为达到此项标准,记1分;“否”为未达到或未提及,记-1分;“不清楚”为部分达到或从文献中无法得到足够信息的,记0分,总分≥7的视为文献质量较高,具体评价方法参考曾玉等[12]的研究。本次研究由2名评价者独立评价,若评价不一致者经讨论决定。
1.5 统计学处理
本次Meta分析主要参考诊断试验Meta分析手册[13],首先检验各研究间异质性大小,采用Cochran Q检验进行评价,若P<0.05提示异质性显著。此外,采用I2检验定量评估异质性大小,I2值介于0~100%,I2值越大提示异质性越明显。如果各研究不存在显著异质性,则采用固定效应模型进行合并分析;如果异质性检验P<0.05或者I2>50%则提示各研究间有显著异质性,采用随机效应模型法分析[14]。探索其异质性来源,阈值效应是诊断性试验异质性的主要来源之一,做诊断优势比(DOR)效应量的受试者工作特征曲线(ROC)散点图及Spearman相关系数判断有无阈值效应,若无阈值效应,则Meta回归初步探索非阈值效应异质性的来源,再亚组分析以探索各亚组间异质性来源,并逐一删除纳入的研究进行敏感性分析以评价单个研究对总体的影响。最后采用Deek漏斗图分析纳入文献有无存在发表偏移以评价原始文献的真实可靠性,本文运用的统计学软件:Metadisc 1.4和Stata 12.0。
2 结 果
2.1 文献基本特征
共检索到950篇中英文文献,经过阅读标题和摘要筛选得61篇文献,再阅读全文后,依照纳入和排除标准,最终有19篇[6,15-32]文献符合要求(图1),包括693例胰腺癌患者和406例非胰腺癌患者(表1)。
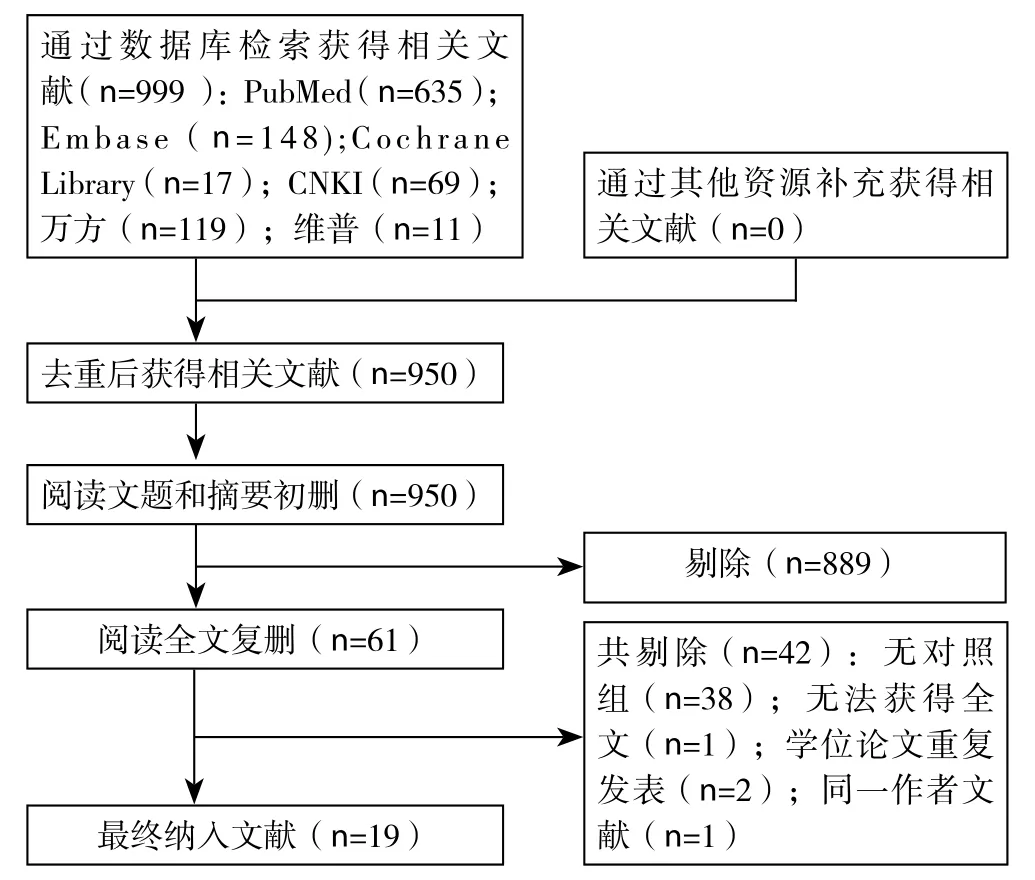
图1 文献检索流程Figure 1 Literature searching process

表1 纳入研究文献的特征Table 1 Table 1 General features of the included studies
2.2 异质性检验
对研究进行异质性检验得到DOR森林图(图2),各研究间有明显异质性(Cochran-Q=51.31,P=0.0000,I2=64.9%),故采用随机效应模型进行分析。分析其异质性的来源,阈值效应是诊断试验的异质性最基本来源之一,本研究得到ROC散点图不呈“肩臂状(shoulder arm)”样式(图3);Spearman相关分析表明研究间不存在阈值效应引起的异质性(r=0.419,P=0.074)。然后对其他来源异质性进行检验,本研究中的非阈值效应引起的异质性来源可能来自:⑴ 不同的CTCs分离、富集方法;⑵ 不同的CTCs检测、鉴定方法;⑶ 不同的对照组组成;⑷ 种族。
2.3 Meta回归分析
对于非阈值引起的异质性采用Meta回归分的组成析的方法初步探讨异质性的来源。按照P<0.1即可认为该因素可能为异质性的主要来源的标准,得出不同的对照组(P=0.0257),可能是研究间异质性的主要来源(表2)。
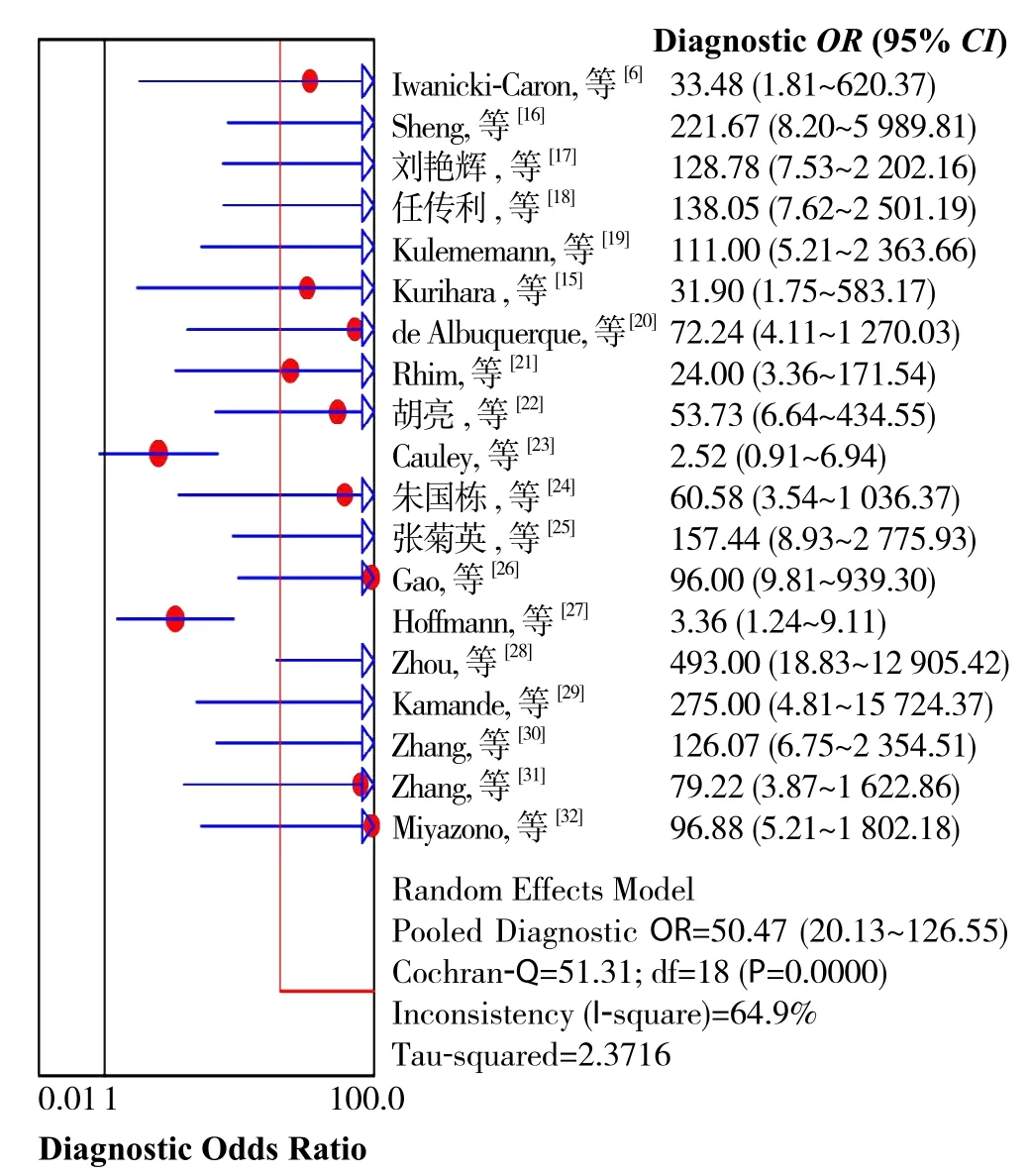
图2 DOR森林图Figure 2 Forest plot for DOR

图3 SROC曲线散点图Figure 3 Scatter plot of SROC analysis
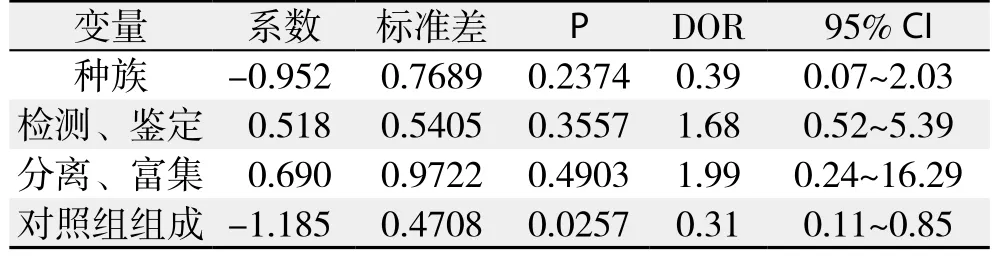
表2 Meta回归分析Table 2 Meta-regression analysis
2.4 亚组分析
2.4.1 对照组的组成 将对照组分成3组,A组:只有健康人群;B组只有非胰腺癌疾病患者;C组:包含健康人和非胰腺癌疾病。A组共纳入研究11篇,组内各个研究间不存在异质性(Cochran-Q=0.79,P=0.9999,I2=0.0%);B组共纳入文献4篇,组内各个研究间不存在异质性(Cochran-Q=2.50,P=0.4745,I2=0.0%);C组共纳入文献4篇,组内各个研究间有异质性(Cochran-Q=8.21,P=0.0419,I2=63.4%),亚组DOR森林图(图4)。结合Meta回归分析结果对照组:主要影响因素,P=0.0257<0.10,得出不同对照组的组成很可能是各研究间异质性的主要来源,但也不排除C组的组内差异造成了全部研究的异质性。该亚组分析表明CTCs检测在健康人群中和其他胰腺疾病中区分胰腺癌患者的诊断效应即DOR是存在差异的,CTCs检测在各种胰腺疾病患者中诊断出胰腺癌患者的效能比在健康对照中要低,表明存在着较大的假阳性率或者假阴性率。
2.4.2 CTCs分离、富集方法 CTCs分离、富集系统主要有两种[33],一种是基于形态学的方法,包括密度梯度离心法和膜滤过分离法,另一种是基于免疫学分离方法。纳入文献中Screencell、密度梯度离心法归为A组,CellSearch、GEM chip、GEDI chip、免疫磁珠法等归为B组。A组共纳入研究5篇,Cochran-Q=12.85,P=0.012,I2=68.9%,表明A组内异质性很大,可能由于基于膜过滤技术的CellSearch系统,可能由于循环肿瘤细胞直径差异较大,造成结果的不稳定,或者密度梯度离心法密度分层的不确定性造成。B组共纳入研究14篇,Cochran-Q=4.49,P=0.9848,I2=0%,表明B组内不存在异质性,表明这几种基于免疫学方法的各种装置分离、富集CTCs的表现差异不大、较稳定。分离、富集方法亚组DOR森林图(图5)。

图4 对照组的组成亚组分析Figure 4 Subgroup analysis of composition of control group
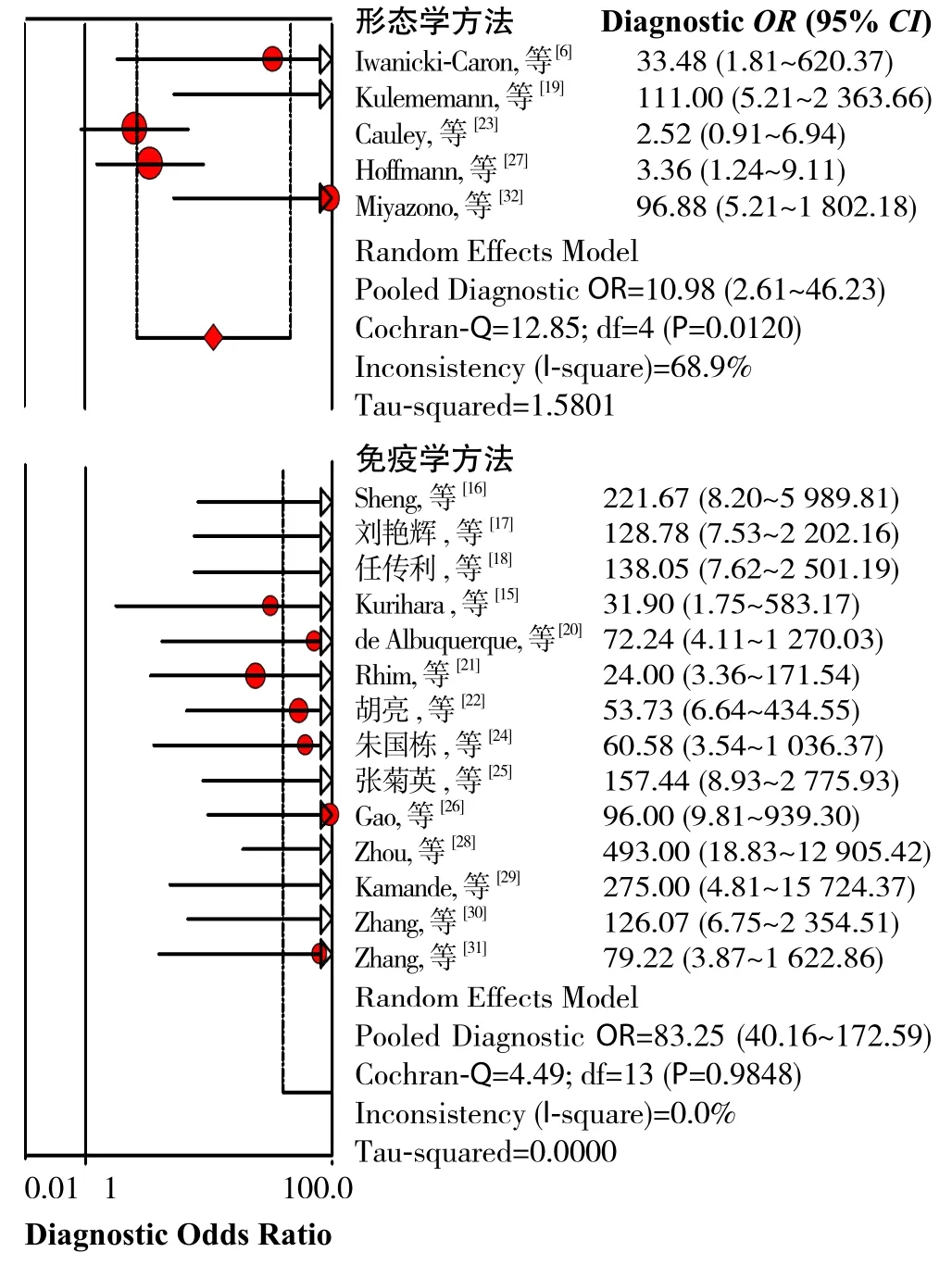
图5 分离、富集方法亚组分析Figure 5 Subgroup analysis of separation and enrichment methods
2.4.3 CTC检测、鉴定方法 常用的有核酸检测法和细胞计数法两种方法,前者有逆转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR),后者包括免疫细胞化 学 法(immunocytochemistry,ICC)、 流式细胞术、原位杂交技术(FISH)和Giemsa染色法等。A组:细胞计数法;B组:核酸检测法。A组纳入13篇文献,各研究间存在明显异质性(Cochran-Q=30.76,P=0.0021,I2=61.0%),分析原因可能为:⑴ 细胞计数法包括流式细胞仪法、免疫荧光法、Giemsa染色法等,各种方法检测效能相差较大;⑵ 免疫荧光法和Giemsa染色法等受观察者主观影响较大。B组纳入6篇文献,组内存在明显异质性(Cochran-Q=19.69,P=0.0014,I2=74.6%),可能由于各研究PCR选取的目的基因不同所造成,检测、鉴定亚组DOR森林图(图6)。
2.4.4 种族 将纳入研究分为两组:欧美人群组与亚洲人群组。欧美人群组共纳入研究8篇,欧美组不同研究间异质性较明显(Cochran-Q=22.59,P=0.0020,I2=69.5%),可能由于欧美人群较分散,且欧美人群之间遗传等存在差异所造成。亚洲人群组共纳入研究11篇,组内各个研究间无异质性(Cochran-Q=2.19,P=0.9947,I2=0%),回顾文献,发现目前胰腺癌CTCs研究主要集中在中国、日本、韩国等东北亚地区,人群种族相似度较高,几乎无种族异质性。种族亚组森林图(图7)。
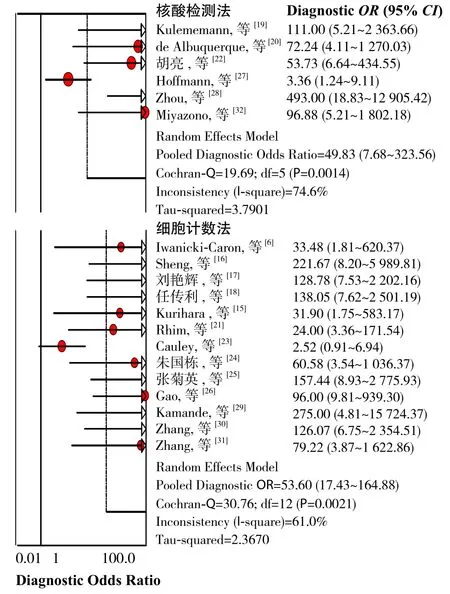
图6 检测、鉴定亚组分析Figure 6 Subgroup analysis of detection and ident ification methods

图7 种族亚组分析Figure 7 Subgroup analysis of race
2.5 敏感性分析
将每个研究逐一排除后,重新估计合并效应量,并与未排除前的Meta分析结果进行比较,探讨该研究对合并效应量影响程度及结果稳健性。若排除后加过发生大的变化,说明敏感性高,结果的稳健性较低。本文用stata 12.0软件做出敏感性分析(图8),显示分别剔除研究10、11的研究后,对结果影响较大,提示研究不稳定。究其原因:研究10采用了Screencell+Giemsa染色细胞计数的方法,有文献报道单独采用Giemsa染色进行CTCs细胞计数准确性不高,此外,该研究病例数较多,所占权重较大,对合并结果影响大。研究11研究对象的是老年胰腺癌患者,与其他研究存在差异。
2.6 合并统计量
因各纳入研究间存在由非阈值效应引起的异质性,故采用随机效应模型进行合并分析,结果CTCs诊断胰腺癌的合并敏感性为0.67(95% CI= 0.63~0.60),合并特异性为0.94(95% CI=0.91~0.96),DOR为50.47(95% CI=20.13~126.55),合并+LR(阳性似然比)为11.15(95% CI=5.42~22.95),合并-LR(阴性似然比)为0.36(95% CI=0.28~0.45),SROC曲线下面积总AUC为0.93,Q*值为0.03(图8)。
2.7 发表偏倚评价
发表偏倚主要是指有统计学意义的研究结果比无统计学意义的研究更容易被投稿和发表[34]。应用Stata 12.0软件绘诊断性试验Deek漏斗图(图9),回归直线与DOR轴的夹角偏离90°,Bias为14.122 86(P=0.240),表明纳入研究间存在发表偏倚。
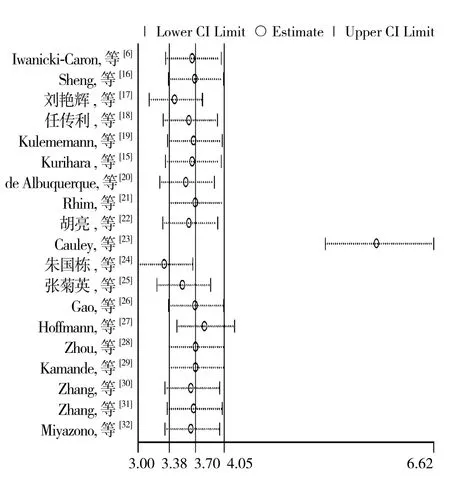
图8 敏感性分析结果Figure 8 Results of sensitivity analysis

图9 Deek's漏斗图评价表达偏倚Figure 9 Deek’s funnel plot of publication bias
3 讨 论
胰腺癌作为一种高度恶性的肿瘤,由于起病隐匿,是目前预后最差的恶性肿瘤之一[35],胰腺癌的早期发现和早期干预显得尤为重要。目前常用的诊断方法有B超、CT、MRI、EUS,血清学肿瘤标记物如CA19-9等[36]。有研究[37]将CA19-9的免疫定量分析作为胰腺癌检测的常规标准,但是CA19-9的升高在非恶性肿瘤中也会出现,如急性胰腺炎、胃肠道肿瘤、梗阻性黄疸等,假阳性率较高,所以传统的CA19-9可能不是一种最理想的肿瘤标记物。有研究表明CTCs检测在胰腺癌中的敏感度很高,如Soeth等[38]的研究中敏感性可达0.89(81/91),Nagrath等[39]的研究中敏感性可达1(15/15)。目前,CellSearch检测系统已被美国食品和药品管理局(FDA)批准应用于乳腺癌、直肠癌、前列腺癌[40]的诊治,由此看来CTCs作为一种新兴技术也有望成为胰腺癌的有效诊断方法,但是目前CTCs技术仍层次不齐,对胰腺癌的诊断效能仍未明确。
本研究经文献检索共19篇文献纳入研究,包括1 099例研究对象,693例胰腺癌患者,406例非胰腺癌患者,按QUADAS质量评价标准评价文献质量,文献质量中等。异质性检验示存在除阈值效应外的较明显异质性,Meta回归和亚组分析提示不同对照组的组成可能是异质性的主要来源,敏感性分析得出Cauley等[23]和朱国栋等[24]两个研究敏感性较大,对结果影响大。采用随机效应模型合并统计量得出外周循环肿瘤细胞检测对胰腺癌检出的敏感性为0.67(95% CI=0.63~0.60),特异性为0.94(95% CI=0.91~0.96),DOR为50.47(95% CI=20.13~126.55),+LR为11.15(95% CI=5.42~22.95),-LR为0.36(95% CI=0.28~0.45),敏感性中等,特异性较高,本研究的合并敏感度不理想,分析原因可能是研究人群的不同,检测方法不同所致,本研究敏感性分析中Cauley等[23]的研究对合并敏感性影响也较大,因为这两个研究患者例数较多,所占权重较大,剔除这个研究后合并敏感性为0.72(95% CI=0.68~0.76)。诊断性试验Deek漏斗图显示存在发表偏倚,因CTCs作为一种新兴技术运用在胰腺癌中仍不完全成熟,多种胰腺癌CTCs技术仍处于研究阶段,这造成了某些未取得进展的研究没有发表出来,从而引起发表偏倚,笔者认为本次分析得到的结果对于所有胰腺癌CTCs(包括未发表研究)研究来说仍较乐观。
由上可知,CTCs检测单独作为胰腺癌早期诊断指标尚有不足,可以作为胰腺癌早期诊断检测方法的重要补充,是胰腺癌诊断的可选检查方法,随着技术的发展,更加有效的CTCs捕获技术和检测技术出现,CTCs检测的敏感性有望大大提高,结合极高的特异度成为胰腺癌的有效早期诊断方法。
本研究存在以下局限性:⑴ 由于有对照组的关于胰腺癌CTCs的研究文献较少,病例数较少,并且个别研究权重较大,对最终合并结果的影响较大;⑵ 纳入文献中有15个研究的对照组含有招募的健康人群,可能会影响试验数据的稳定、可靠;⑶ 仅有1个研究采用了前瞻性研究,其18个研究均为回顾性研究;⑷ 各个研究试验设计、试验方法、试验试剂、试验仪器不同,可能会导致研究间的异质性。
综上所述,Meta分析提示外周CTCs检测可作为胰腺癌的诊断方法,但是受纳入研究质量和数量限制,目前尚无充足的证据证明可将CTCs检测单独作为胰腺癌早期诊断指标并应用于临床。因此,需要纳入更多高质量的随机对照试验进行更有效的评价,有理由相信,CTCs检测将成为胰腺癌诊治中的一个热点。
参考文献
[1]Thege FI,Lannin TB,Saha TN,et al.Micro fluidic immunocapture of circulating pancreatic cells using parallel EpCAM and MUC1 capture:characterization,optimization and downstream analysis[J].Lab Chip,2014,14(10):1775–1784.doi:10.1039/c4lc00041b.
[2]钟志惟,殷香保.胰腺癌的分子靶向治疗研究进展[J].中国普通外科杂志,2016,25(9):1351–1356.doi:10.3978/j.issn.1005–6947.2016.09.022.Zhong ZW,Yin XB.Research progress in molecular targeted therapy for pancreatic cancer[J].Chinese Journal of General Surgery,2016,25(9):1351–1356.doi:10.3978/j.issn.1005–6947.2016.09.022.
[3]Chang CL,Huang W,Jalal SI,et al.Circulating tumor cell detection using a parallel flow micro-aperture chip system[J].Lab Chip,2015,15(7):1677–1688.doi:10.1039/c5lc00100e.
[4]胡亮,周家华,易永祥,等.纳米免疫磁珠联合巢式PCR检测胰腺癌患者外周循环微转移的意义[J].中国普通外科杂志,2012,21(9):1097–1101.Hu L,Zhou JH,Yi YX,et al.Combination of immunomagnetic nanobeads and RT-nest-PCR for detection of micrometastases of pancreatic cancer in peripheral circulation[J].Chinese Journal of General Surgery,2012,21(9):1097–1101.
[5]Wolfgang CL,Herman JM,Laheru DA,et al.Recent progress in pancreatic cancer[J].CA Cancer J Clin,2013,63(5):318–348.doi:10.3322/caac.21190.
[6]Iwanicki-Caron I,Basile P,Toure E,et al.Usefulness of circulating tumor cell detection in pancreatic adenocarcinoma diagnosis[J].Am J Gastroenterol,2013,108(1):152–155.doi:10.1038/ajg.2012.367.
[7]Cen P,Ni X,Yang J,et al.Circulating tumor cells in the diagnosis and management of pancreatic cancer[J].Biochim Biophys Acta,2012,1826(2):350–356.doi:10.1016/j.bbcan.2012.05.007.
[8]Cristofanilli M,Budd GT,Ellis MJ,et al.Circulating tumor cells,disease progression,and survival in metastatic breast cancer[J].N Engl J Med,2004,351(8):781–791.
[9]Ma XL,Li YY,Zhang J,et al.Prognostic role of circulating tumor cells in patients with pancreatic cancer:a meta-analysis[J].Asian Pac J Cancer Prev,2014,15(15):6015–6020.
[10]Torphy RJ,Tignanelli CJ,Kamande JW,et al.Circulating tumor cells as a biomarker of response to treatment in patient-derived xenograft mouse models of pancreatic adenocarcinoma[J].PLoS One,2014,9(2):e89474.doi:10.1371/journal.pone.0089474.
[11]Oliveira MR,Gomes AC,Toscano CM.QUADAS and STARD:evaluating the quality of diagnostic accuracy studies[J].Rev Saude Publica,2011,45(2):416–422.
[12]曾玉,许鹏飞,陈辰,等.外周血循环miRNA诊断卵巢癌的Meta分析[J].实用肿瘤杂志,2016,31(1):52–59.doi:10.13267/j.cnki.syzlzz.2016.01.03.Zeng Y,Xu PF,Chen C,et al.Diagnostic value of miRNAs in peripheral blood circulation for ovarian cancer:A meta-analysis[J].Journal of Practical Oncology,2016,31(1):52–59.doi:10.13267/j.cnki.syzlzz.2016.01.03.
[13]田金徽,陈杰峰.诊断试验系统评价:Meta分析指导手册[M].北京:中国医药科技出版社,2015:102–148.Tian JH,Chen JF.Systematical evaluation of diagnostic tests:guide book of Meta-analysis[M].Beijing:China Medical Science Press,2015:102–148.
[14]Deeks JJ,Macaskill P,Irwig L.The performance of tests of publication bias and other sample size effects in systematic reviews of diagnostic test accuracy was assessed[J].J Clin Epidemiol,2005,58(9):882–893.
[15]Kurihara T,Itoi T,Sofuni A,et al.Detection of circulating tumor cells in patients with pancreatic cancer:a preliminary result[J].J Hepatobiliary Pancreat Surg,2008,15(2):189–195.doi:10.1007/s00534–007-1250–5.
[16]Sheng W,Ogunwobi OO,Chen T,et al.Capture,Release and Culture of Circulating Tumor Cells from Pancreatic Cancer Patients using an Enhanced Mixing Chip[J].Lab Chip,2014,14(1):89–98.doi:10.1039/c3lc51017d.
[17]刘艳辉,唐甜甜,孙丽丽.肿瘤外周血循环细胞对胰腺癌的诊断价值[J].解放军医学院学报,2013,34(10):1045–1047.doi:10.3969/j.issn.2095–5227.2013.10.015.Liu YH,Tang TT,Sun LL.Diagnostic value peripheral blood circulating tumor cells for pancreatic cancer[J].Academic Journal of Chinese Pla Medical School,2013,34(10):1045–1047.doi:10.3969/j.issn.2095–5227.2013.10.015.
[18]任传利,韩崇旭,王大新,等.EpCAM抗体偶联纳米磁珠阳性分离实体瘤外周血循环肿瘤细胞方法的建立[J].中华检验医学杂志,2011,34(3):218–223.doi:10.3760/cma.j.issn.1009–9158.2011.03.007.Ren CL,Han CX,Wang DX.A new isolation method for peripheral blood circulating solid tumor cells with EpCAM antibody linked nanobeads[J].Chinese Journal of Laboratory Medicine,2011,34(3):218–223.doi:10.3760/cma.j.issn.1009–9158.2011.03.007.
[19]Kulemann B,Liss AS,Warshaw AL,et al.KRAS mutations in pancreatic circulating tumor cells:a pilot study[J].Tumour Biol,2016,37(6):7547–7554.doi:10.1007/s13277–015-4589–2.
[20]de Albuquerque A,Kubisch I,Breier G,et al.Multimarker gene analysis of circulating tumor cells in pancreatic cancer patients:a feasibility study[J].Oncology,2012,82(1):3–10.doi:10.1159/000335479.
[21]Rhim AD,Thege FI,Santana SM,et al.Detection of circulating pancreas epithelial cells in patients with pancreatic cystic lesions[J].Gastroenterology,2014,146(3):647–651.doi:10.1053/j.gastro.2013.12.007.
[22]胡亮,周家华,余泽前,等.胰腺癌患者外周血循环c-Met和h-TERT表达的临床意义[J].中国肿瘤临床,2013,40(4):208–211.doi:10.3969/j.issn.1000–8179.2013.04.007.Hu L,Zhou JH,Yu ZQ,et al.Clinical signi ficance of h-TERT and c-Met expression in the peripheral blood circulation of pancreatic cancer patients[J].Chinese Journal of Clinical Oncology,2013,40(4):208–211.doi:10.3969/j.issn.1000–8179.2013.04.007.
[23]Cauley CE,Pitman MB,Zhou J,et al.Circulating Epithelial Cells in Patients with Pancreatic Lesions:Clinical and Pathologic Findings[J].J Am Coll Surg,2015,221(3):699–707.doi:10.1016/j.jamcollsurg.2015.05.014.
[24]朱国栋,刘丰,朱志刚,等.老年胰腺癌患者外周血循环肿瘤细胞对预后的影响[J].实用医学杂志,2016,32(13):2146–2149.doi:10.3969/j.issn.1006–5725.2016.13.020.Zhu GD,Liu F,Zhu ZG,et al.The clinical significance of circulating tumor cells for prognosis of pancreatic cancer patients[J].The Journal of Practical Medicine,2016,32(13):2146–2149.doi:10.3969/j.issn.1006–5725.2016.13.020.
[25]张菊英,张亚衡.免疫磁珠阳性筛选联合流式细胞术对胰腺癌外周血循环肿瘤细胞的诊断价值[J].中国实验诊断学,2016,20(4):551–554.Zhang JY,Zhang YH.The Diagnosis Value about the Peripheral Blood Circulating Tumor Cells of Pancreatic cancer by Positive-Screened Immune Magnetic Bead Combine with Flow Cytometry[J].Chinese Journal of Laboratory Diagnosis,2016,20(4):551–554.
[26]Gao Y,Zhu Y,Zhang Z,et al.Clinical significance of pancreatic circulating tumor cells using combined negative enrichment and immunostaining-fluorescence in situ hybridization[J].J Exp Clin Cancer Res,2016,35:66.doi:10.1186/s13046–016-0340–0.
[27]Hoffmann K,Kerner C,Wilfert W,et al.Detection of disseminated pancreatic cells by ampli fication of cytokeratin-19 with quantitative RT-PCR in blood,bone marrow and peritoneal lavage of pancreatic carcinoma patients[J].World J Gastroenterol,2007,13(2):257–263.
[28]Zhou J,Hu L,Yu Z,et al.Marker expression in circulating cancer cells of pancreatic cancer patients[J].J Surg Res,2011,171(2):631–666.doi:10.1016/j.jss.2010.05.007.
[29]Kamande JW,Hupert ML,Witek MA,et al.Modular microsystem for the isolation,enumeration,and phenotyping of circulating tumor cells in patients with pancreatic cancer[J].Anal Chem,2013,85(19):9092–9100.doi:10.1021/ac401720k.
[30]Zhang Y,Wang F,Ning N,et al.Patterns of circulating tumor cells identified by CEP8,CK and CD45 in pancreatic cancer[J].Int J Cancer,2015,136(5):1228–1233.doi:10.1002/ijc.29070.
[31]Zhang J,Li S,Liu F,et al.SELEX aptamer used as a probe to detect circulating tumor cells in peripheral blood of pancreatic cancer patients.[J].PLos One,2015,10(3):e0121920.DOI:10.1371/journal.pone.0121920.
[32]Miyazono F,Takao S,Natsugoe S,et al.Molecular detection of circulating cancer cells during surgery in patients with biliarypancreatic cancer[J].Am J Surg,1999,177(6):475–479.
[33]王晓光,陈飞,钟征翔.循环肿瘤细胞检测在胰腺癌患者中的研究现状及应用前景[J].中华实验外科杂志,2016,33(1):262–264.doi:10.3760/cma.j.issn.1001–9030.2016.01.085.Wang XG,Chen F,Zhong ZX.Research status and application prospects of circulating tumor cells detection in patients with pancreatic cancer[J].Chinese Journal of Experimental Surgery 2016,33(1):262–264.doi:10.3760/cma.j.issn.1001–9030.2016.01.085.
[34]刘俊平.诊断试验偏倚来源的研究进展[J].中国循证医学杂志,2011,11(7):835–840.doi:10.3969/j.issn.1672–2531.2011.07.017.Liu JP.Advances in Research on Bias Sources in Diagnostic Test[J].Chinese Journal of Evidence-Based Medicine,2011,11(7):835–840.doi:10.3969/j.issn.1672–2531.2011.07.017.
[35]黄晓曼.郑雷教授:胰腺癌的多学科综合诊疗[J].中国普通外科杂志,2016,25(3):318–320.doi:10.3978/j.issn.1005–6947.2016.03.002.Huang XM.Professor Lei Zheng:Multidisciplinary management for pancreatic cancer[J].Chinese Journal of General Surgery,2016,25(3):318–320.doi:10.3978/j.issn.1005–6947.2016.03.002.
[36]杨尹默.胰腺癌外科治疗的现状、存在问题与展望[J].中国普通外科杂志,2016,25(9):1231–1235.doi:10.3978/j.issn.1005–6947.2016.09.001.Yang YM.Surgical managements of pancreatic cancer:current status and future directions[J].Chinese Journal of General Surgery,2016,25(9):1231–1235.doi:10.3978/j.issn.1005–6947.2016.09.001.
[37]Poruk KE,Gay DZ,Brown K,et al.The clinical utility of CA 19–9 in pancreatic adenocarcinoma:diagnostic and prognostic updates[J].Curr Mol Med,2013,13(3):340–351.
[38]Soeth E,Grigoleit U,Moellmann B,et al.Detection of tumor cell dissemination in pancreatic ductal carcinoma patients by CK 20 RT-PCR indicates poor survival[J].J Cancer Res Clin Oncol,2005,131(10):669–676.
[39]Nagrath S,Sequist LV,Maheswaran S,et al.Isolation of rare circulating tumour cells in cancer patients by microchip technology[J].Nature,2007,450(7173):1235–1239.
[40]张波,荆结线.循环肿瘤细胞检测方法及临床应用的研究进展[J].中华实验外科杂志,2015,32(12):3223–3225.doi:10.3760/cma.j.issn.1001–9030.2015.12.109.Zhang B,Jing JX.Detection methods and clinical application of peripheral blood circulating tumor cells[J].Chinese Journal of Experimental Surgery,2015,32(12):3223–3225.doi:10.3760/cma.j.issn.1001–9030.2015.12.109.

