FOLFIRINOX为基础的新辅助化疗后局部进展期胰腺癌的手术疗效分析
慕春红,吕邦策,马平安
(甘肃省庆阳市人民医院 普通外科,甘肃 庆阳 745000)
胰腺癌(pancreatic cancer,PC)因其起病隐匿,进展快,预后极差,成为消化系统最致命的恶性肿瘤之一[1]。外科手术联合化疗是目前胰腺癌治疗的最佳方式,但这仅使20%的患者获益[2]。据统计[3],约有超过40%的胰腺癌患者虽无远处转移,但伴有广泛的血管及淋巴结侵犯,而不能接受及时的手术治疗,该期肿瘤也被称为局部进展期胰腺癌(locally advanced pancreatic cancer,LAPC)。LAPC之所以不建议直接手术切除的原因在于切缘阳性的患者与未接受手术治疗的患者生存期相似[4]。虽然吉西他滨单药或联合放射治疗近年来已成为LAPC患者姑息治疗的标准方案,但该方案患者应答率及是否能明确改善LAPC患者生存期仍有争议[5]。
目前,对于LAPC患者,系统的化疗是其最主要的治疗方案。FOLFIRINOX(5-氟尿嘧啶、亚叶酸钙、奥沙利铂、伊立替康)方案最初被用于转移性胰腺癌。有研究[6]结果显示,FOLFIRINOX方案与吉西他滨单药化疗相比可明显改善转移系胰腺癌患者的中位生存期(11.1个月 vs.6.8个月,P=0.001)。近年来有较多关于FOLFIRINOX方案治疗LAPC的研究发表,但受到样本量的限制,对于该方案的安全性及有效性未能得出较为一致的结论[7]。本研究旨在采用循证医学Meta分析的方法,对LAPC患者接受FOLFIRINOX为基础的化疗方案治疗后手术切除率及临床疗效进行比较,以期为临床治疗LAPC选择更优策略提供理论依据。
1 资料与方法
1.1 文献检索
计算机检索CNKI数据库、万方数据库、中国生物医学文献数据库、PubMed数据库、Cochrane图书馆及Embase数据库,均从建库开始至2016年1月。查找FOLFIRINOX方案治疗LAPC的随机对照试验、临床对照研究、队列研究等。中文检索词为:FOLFIRINOX方案、5-氟尿嘧啶、亚叶酸钙、奥沙利铂、伊立替康、局部进展期胰腺癌、胰腺恶性肿瘤、LAPC。英文检索词为:FOLFIRINOX、5-Fluorouracil、Oxaliplatin、Irinotecan、Leucovorin、Locally Advanced Pancreatic Cancer、Pancreatic Neoplasm。自由词与主题词检索相结合,语种限制为中文和英语,人群及种族不限,尽可能的追溯参考文献及灰色文献。
1.2 纳入与排除标准
纳入的研究须符合以下标准:⑴ 研究类型为随机对照试验、队列研究、临床对照研究等;⑵ 研究对象为LAPC患者,化疗前有影像学及病理学证据确诊;⑶ 干预措施为FOLFIRINOX为基础的治疗方案,包括FOLFIRINOX方案联合其他化疗药物、分子靶向药物及放疗等;⑷ 研究中明确报告了以下指标的1项或多项:手术切除率、R0切除率、生存期及化疗的不良反应等。排除标准为:⑴ 会议摘要、重复发表、细胞学或动物实验等;⑵ 研究中无可用数据或数据报道不详实者;⑶ 经追溯参考文献或联系作者未能获取全文的文献。
1.3 文献筛选及数据提取
由2名研究员严格按照纳入排除标准进行文献筛选。首先阅读题目及摘要对检索的文献进行初步评价,最后获取全文后再次对文献进行审核。过程中如有分歧可与第三方商议解决。采用Excle 2007绘制数据提取表格,数据提取内容包括:⑴ 基本资料(第一作者、文献发表年代、研究类型、样本量、化疗方案、手术方式等);⑵ 结局指标(患者生存期、R0切除率、患者应答率、不良反应等)。
1.4 质量评价
文献质量评价按照牛津循证医学中心(Oxford Centre for Evidence-Based Medicine,OCEBM)推荐的偏倚风险评估量表[8]进行评价,包括9个条目,主要内容为:⑴ 纳入排除标准是否明确;⑵ 是否存在选择偏倚;⑶ 干预措施是否标准化;⑷ 治疗方案是否标准化;⑸ 结局指标是否标准化;⑹ 混杂因素的控制;⑺ 缺失值的验证;⑻ 随访时间是否超过12个月;⑼ 失访偏倚。
1.5 统计学处理
采用Stata SE 12.0软件进行Meta分析。异质性检验采用Q检验,如果I2<50%或P>0.1,认为研究间异质性较小,选用固定效应模型(fixed effects model,FEM)Mantel-Haenszel法进行数据合并;反之则认为纳入研究间的异质性较大,分析异质性来源,进行亚组分析及敏感性分析判别,如果异质性仍存在则采用随机效应模型(randomeffects model,REM)M-Hheterogeneity法。合并的数据如为连续变量,采用标准化均数差(standardized mean difference,SMD)及其95%可信区间(confidence interval,CI)进行统计学分析,二分类变量采用比值比(odds ratio,OR)及其95% CI,显著性水平设定为α=0.05。
2 结 果
2.1 文献筛选及纳入
按照预先制定的检索策略进行文献检索,共获得546条记录。采用Endnote X6软件去重287篇后,阅读题目和摘要排除221篇,其中包括重复103篇,综述74篇,动物实验或细胞相关研究21篇,会议摘要6篇,无关文献17篇。随后对初步纳入的38篇文献调阅全文后再次进行筛选,综述9篇,重复4篇,细胞实验3篇,无可用数据5篇,剔除无关文献3篇,最终纳入14篇文献[9-22]进行Meta分析。
2.2 纳入研究的基本特征
共纳入14项研究,其中前瞻性观察研究1项(1/14,7.14%),回顾性研究13项(13/14,92.86%)。纳入研究来自美国10项(10/14,71.43%),法国2项(2/14,14.28%),澳大利亚及英国各1项(1/14,7.14%)。纳入患者年限最早为2000年,截止日期最近为2014年。纳入患者平均年龄范围为56~66岁。LAPC诊断标准多参考美国国立综合癌症网络(NCCN)指南(4/14,28.57%),其次为美国肝胆胰协会(AHPBA)诊断标准(3/14,21.43%)。纳入研究的基本特征见表1。
2.3 纳入研究质量评价
对纳入14项研究按照OCEBM推荐的偏倚风险评估标准进行质量评价,结果显示,在纳入排除标准(10/14,71.43%),选择偏倚(12/14,85.71%),干预措施(12/14,85.71%),混杂因素(10/14,71.43%),随访时间(10/14,71.43%)条目的报告中评估为低风险的研究超过了60%,而在其他条目中低分险报告虽然低于60%,但均高于50%,提示纳入的研究质量均较高(图1)。

表1 纳入研究的基本特征Table 1 The basic characteristics of included studies
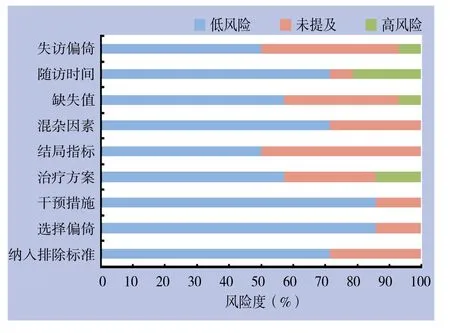
图1 纳入研究偏倚风险评估Figure 1 Bias risk assessment for the included studiers
2.4 Meta分析结果
2.4.1 手术切除率的分析 纳入的研究中10项报告[11-14,16-18,20-22]患者接受FOLFIRINOX为基础的治疗方案后手术切除率,异质性检验结果表明研究间存在统计学异质性(I2=82.3%,P=0.000),故采用随机效应模型进行数据合并。Meta分析结果显示:接受FOLFIRINOX为基础的治疗方案后LAPC患者手术切除率为59%(95% CI=0.46~0.72,P=0.0001)(图2)。
2.4.2 R0切除率的分析 纳入的研究中9项报告[9,11,13-14,16-18,20,22]患者接受FOLFIRINOX为基础的治疗方案后行手术治疗的R0切除率,异质性检验结果表明研究间存在统计学异质性(I2=70.5%,P=0.001),故采用随机效应模型进行数据合并。Meta分析结果显示:FOLFIRINOX为基础的治疗方案后接受手术治疗的LAPC患者R0切除率为70.0%(95% CI=0.51~0.88,P=0.001)(图3)。
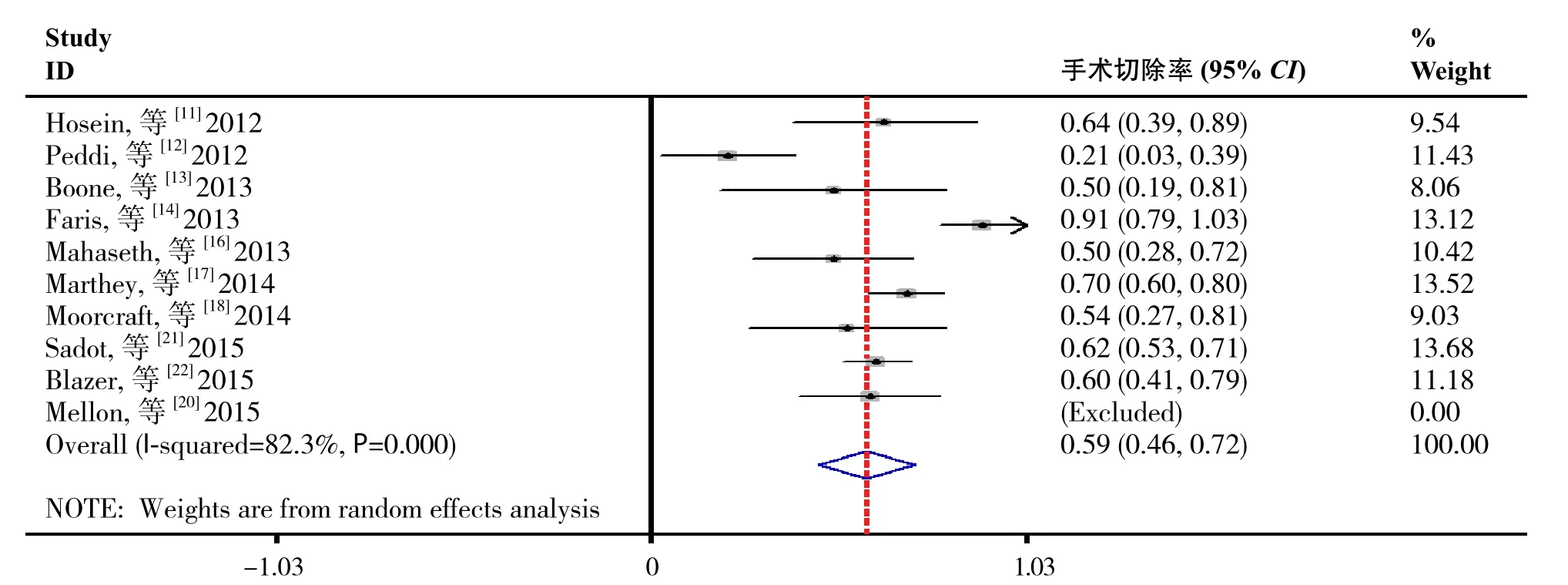
图2 LAPC患者手术切除率合并结果Figure 2 Pooled results of surgical resection rate in LAPC patients
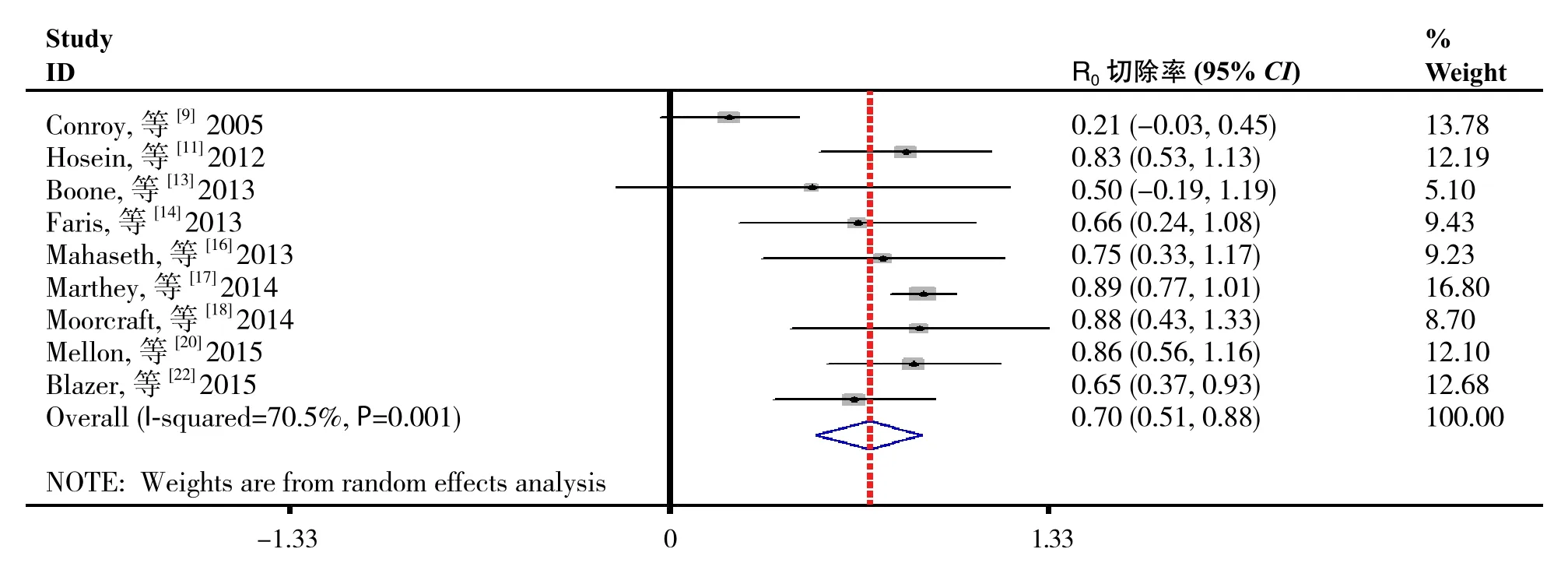
图3 LAPC患者接受手术治疗的R0切除率合并结果Figure 3 Pooled results of R0 resection rate in LAPC patients after surgery
2.4.3 中位生存期的分析 纳入的研究中10项报告[9-10,11,14-18,21-22]患者中位生存期,异质性检验结果表明研究间存在统计学异质性(I2=68.8%,P=0.001),故采用随机效应模型进行数据合并。Meta分析结果显示:接受FOLFIRINOX为基础的治疗方案后LAPC患者的中位生存期为20.63个月(95% CI=16.54~24.73,P=0.001)(图4)。
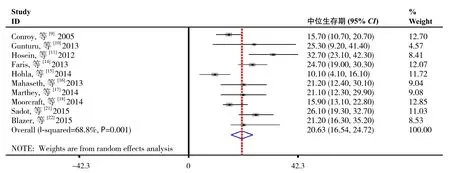
图4 LAPC患者中位生存期合并结果Figure 4 Pooled results of the median survival in LAPC patients
2.4.4 中位无疾病进展期的分析 纳入的研究中8项报告[9-12,14,16-17,20]患者的中位无疾病进展期,异质性检验结果表明研究间存在统计学异质性(I2=60.0%,P=0.015),故采用随机效应模型进行数据合并。Meta分析结果显示:接受FOLFIRINOX为基础的治疗方案后LAPC患者的中位无疾病进展期为13.54个月(95% CI=10.54~16.54,P=0.0001)(图5)。

图5 LAPC患者中位无疾病进展期合并结果Figure 5 Pooled results of the median disease-free survival in LAPC patients
2.4.5 FOLFIRINOX为基础的治疗方案治疗不良反应的分析 纳入的研究均报告了FOLFIRINOX为基础的治疗方案的不良反应,异质性检验结果表明研究间存在统计学异质性(I2=41.2%,P=0.059),故采用固定效应模型进行数据合并。Meta分析结果显示:FOLFIRINOX为基础的治疗方案后患者不良反应发生率为8%(95% CI=0.05~0.11,P=0.0001)(图6)。
2.5 发表偏倚
如图7所示,对纳入的研究进行发表偏倚分析,结果显示各个研究未能向漏斗图顶部汇集,并有3个研究游离于漏斗图之外,提示可能存在部分阴性结果未被发表的可能(图7)。

图6 LAPC患者接受FOLFIRINOX为基础的治疗不良反应发生率合并结果Figure 6 Pooled results of the incidence of adverse reactions in LAPC patients receiving FOLFIRINOX-based treatment
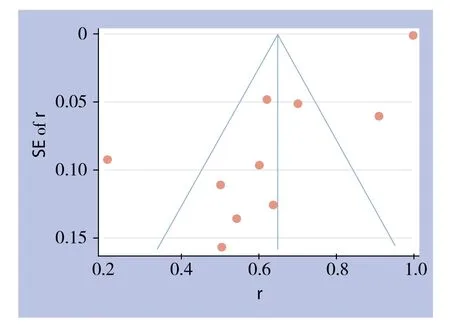
图7 漏斗图评估发表偏倚Figure 7 Funnel plots for detecting publication bias
3 讨 论
胰腺癌是一种恶性程度极高且预后较差的消化道肿瘤,近年来发病率呈逐年上升趋势,据统计其占人类全部恶性肿瘤的3%,5年生存率不超过5%[23]。目前手术治疗被认为是延长胰腺癌患者生存期最有效的策略,但由于胰腺癌起病隐匿,疾病进展快,仅有不到15%的患者在初诊时可接受根治性胰腺切除术,大部分的患者一经诊断即为LAPC或出现远处转移,因此而不能接受有效的手术干预[24]。LAPC约占全部胰腺肿瘤的30%~50%[25],其虽然没有远处转移,但往往伴有严重的血管侵犯,即使尝试手术切除也很难实现R0切除[26],因此胰腺癌的新辅助治疗已得到广大外科医师的关注。然而,由于缺乏大样本、前瞻性临床研究的支持,新辅助化疗的价值也一直存在争议[27]。已有Meta分析结果[28]提示,LAPC患者接受新辅助化疗后可使约1/3的患者降期并使既往无手术切除机会的患者得到手术治疗,甚至有些患者可实现肿瘤的R0切除。有研究[29]发现,FOLFIRINOX方案可有效的改善转移性胰腺癌的目标转移率及中位生存期,但三级及以上不良反应发生率较高。也有研究[30]报道,通过改良FOLFIRINOX方案可有效的降低LAPC患者不良反应的发生率及提高患者的转化后手术切除率。由此,FOLFIRINOX方案成为目前研究的焦点。2015年NCCN指南将FOLFIRINOX方案首次写入了胰腺癌的诊治指南,但同时也建议该方案应在大的医学中心进行,并开展相应的临床试验。本研究采用循证医学Meta分析的方法对既往接受以FOLFIRINOX方案为基础的治疗后患者手术切除率及生存资料进行了研究,希望能更加全面准确的评估该治疗策略对LAPC患者带来的临床获益,旨在为更多LAPC患者带来更优的治疗方案。
本研究共纳入14项临床研究,714例LAPC患者,Meta分析结果显示,术前接受FOLFIRINOX为基础的治疗方案的LAPC患者手术切除率为59%(95% CI=0.46~0.72,P=0.0001),其中R0切除率为70.0%(95% CI=0.51~0.88,P=0.001),同时LAPC患者中位生存期为20.63个月(95% CI=16.54~24.73,P=0.001),中位无疾病进展期为13.54个月(95% CI=10.54~16.54,P=0.0001),不良反应发生率为8%(95% CI=0.05~0.11,P=0.0001)。Rombouts等[31]对365例LAPC患者的数据资料进行了Meta分析,结果显示FOLFIRINOX方案化疗后手术切除了可达57%,其中R0切除了可为77%,数据合并结果与本研究基本相近,但国内目前仍缺乏同类相关证据。
尽管本研究采用Meta分析的方法进行数据合并,但仍存在以下局限性:⑴ 纳入的研究中多数为回顾性研究(13/14,92.86%),而随机对照试验较少,明显的降低了证据等级;⑵ 纳入的研究中对于LAPC的诊断标准不一,多数采用NCCN指南推荐意见,但部分研究采用其他确诊方法,故而对于结局指标的判定具有一定的影响;⑶ 纳入的研究多数未明确报告FOLFIRINOX为基础的治疗方案的实施细节,包括患者筛选、治疗剂量、治疗周期、疗效判定标准及质量控制等,因此不能对数据进行深层挖掘;⑷ 纳入的研究大部分来自于欧美国家,对于以国人为对象的研究缺乏,故结论的推及还需谨慎;⑸ 纳入的研究大部分为单臂研究,仅能对部分结局指标实现率的合并,未能与其他标准方案进行对比。
综上所述,FOLFIRINOX为基础的治疗可提高LAPC手术切除率,增加R0切除机会,改善患者生存期,且不良反应发生率较低,可作为LAPC降期治疗的较优方案。但值得推荐更多大样本、多中心、前瞻性研究进一步验证。
参考文献
[1]Garrido-Laguna I,Hidalgo M.Pancreatic cancer:from state-of-theart treatments to promising novel therapies[J].Nat Rev Clin Oncol,2015,12(6):319–334.doi:10.1038/nrclinonc.2015.53.
[2]Vincent A,Herman J,Schulick R,et al.Pancreatic cancer[J].Lancet,2011,378(9791):607–620.doi:10.1016/S0140–6736(10)62307–0.
[3]Miller KD,Siegel RL,Lin CC,et al.Cancer treatment and survivorship statistics,2016[J].CA Cancer J Clin,2016,66(4):271–289.doi:10.3322/caac.21349.
[4]马湘,曲林林,张明进,等.进展期胰腺癌患者姑息性旁路手术后的预后因素分析[J].中国普通外科杂志,2014,23(9):1195–1199.doi:10.7659/j.issn.1005–6947.2014.09.008.Ma X,Qu LL,Zhang MJ,et al.Prognostic factors in patients undergoing palliative bypass surgery for advanced pancreatic cancer[J].Chinese Journal of General Surgery,2014,23(9):1195–1199.doi:10.7659/j.issn.1005–6947.2014.09.008.
[5]Oettle H,Lehmann T.Gemcitabine-resistant pancreatic cancer:a second-line option[J].Lancet,2016,387(10018):507–508.doi:10.1016/S0140–6736(15)01035–1.
[6]Conroy T,Desseigne F,Ychou M,et al.FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer[J].N Engl J Med,2011,364(19):1817–1825.doi:10.1056/NEJMoa1011923.
[7]Yuan C,Rubinson DA,Qian ZR,et al.Survival among patients with pancreatic cancer and long-standing or recent-onset diabetes mellitus[J].J Clin Oncol,2015,33(1):29–35.doi:10.1200/JCO.2014.57.5688.
[8]Durieux N,Vandenput S,Pasleau F.OCEBM levels of evidence system[J].Revue Médicale De Liège,2013,68(12):644–649.
[9]Conroy T,Paillot B,François E,et al.Irinotecan plus oxaliplatin and leucovorin-modulated fluorouracil in advanced pancreatic cancer--a Groupe Tumeurs Digestives of the Federation Nationale des Centres de Lutte Contre le Cancer study[J].J Clin Oncol,2005,23(6):1228–1236.
[10]Gunturu KS,Yao X,Cong X,et al.FOLFIRINOX for locally advanced and metastatic pancreatic cancer:single institution retrospective review of ef ficacy and toxicity[J].Med Oncol,2013,30(1):361.doi:10.1007/s12032–012–0361–2.
[11]Hosein PJ,Macintyre J,Kawamura C,et al.A retrospective study of neoadjuvant FOLFIRINOX in unresectable or borderline-resectable locally advanced pancreatic adenocarcinoma[J].BMC Cancer,2012,12:199.doi:10.1186/1471–2407–12–199.
[12]Peddi PF,Lubner S,McWilliams R,et al.Multi-institutional experience with FOLFIRINOX in pancreatic adenocarcinoma[J].JOP,2012,13(5):497–501.doi:10.6092/1590–8577/913.
[13]Boone BA,Steve J,Krasinskas AM,et al.Outcomes with FOLFIRINOX for borderline resectable and locally unresectable pancreatic cancer[J].J Surg Oncol,2013,108(4):236–241.doi:10.1002/jso.23392.
[14]Faris JE,Blaszkowsky LS,McDermott S,et al.FOLFIRINOX in locally advanced pancreatic cancer:the Massachusetts General Hospital Cancer Center experience[J].Oncologist,2013,18(5):543–548.doi:10.1634/theoncologist.2012–0435.
[15]Hohla F,Hop finger G,Romeder F,et al.Female gender may predict response to FOLFIRINOX in patients with unresectable pancreatic cancer:a single institution retrospective review[J].Int J Oncol,2014,44(1):319–326.doi:10.3892/ijo.2013.2176.
[16]Mahaseth H,Brutcher E,Kauh J,et al.Modified FOLFIRINOX regimen with improved safety and maintained ef ficacy in pancreatic adenocarcinoma[J].Pancreas,2013,42(8):1311–1315.doi:10.1097/MPA.0b013e31829e2006.
[17]Marthey L,Sa-Cunha A,Blanc JF,et al.FOLFIRINOX for locally advanced pancreatic adenocarcinoma:results of an AGEOmulticenter prospective observational cohort[J].Ann Surg Oncol,2015,22(1):295–301.doi:10.1245/s10434–014–3898–9.
[18]Moorcraft SY,Khan K,Peckitt C,et al.FOLFIRINOX for locally advanced or metastatic pancreatic ductal adenocarcinoma:the Royal Marsden experience[J].Clin Colorectal Cancer,2014,13(4):232–238.doi:10.1016/j.clcc.2014.09.005.
[19]Ferrone CR,Marchegiani G,Hong TS,et al.Radiological and surgical implications of neoadjuvant treatment with FOLFIRINOX for locally advanced and borderline resectable pancreatic cancer[J].Ann Surg,2015,261(1):12–17.doi:10.1097/SLA.0000000000000867.
[20]Mellon EA,Hoffe SE,Springett GM,et al.Long-term outcomes of induction chemotherapy and neoadjuvant stereotactic body radiotherapy for borderline resectable and locally advanced pancreatic adenocarcinoma[J].Acta Oncol,2015,54(7):979–985.doi:10.3109/0284186X.2015.1004367.
[21]Sadot E,Doussot A,O'Reilly EM,et al.FOLFIRINOX Induction Therapy for Stage 3 Pancreatic Adenocarcinoma[J].Ann Surg Oncol,2015,22(11):3512–3521.doi:10.1245/s10434–015–4647–4.
[22]Blazer M,Wu C,Goldberg RM,et al.Neoadjuvant modi fied (m)FOLFIRINOX for locally advanced unresectable (LAPC) and borderline resectable (BRPC) adenocarcinoma of the pancreas[J].Ann Surg Oncol,2015,22(4):1153–1159.doi:10.1245/s10434–014–4225–1.
[23]Kaur S,Baine MJ,Jain M,et al.Early diagnosis of pancreatic cancer:challenges and new developments[J].Biomark Med,2012,6(5):597–612.doi:10.2217/bmm.12.69.
[24]陈博滔,陈梅福.交界性可切除胰腺癌的研究进展[J].中国普通外科杂志,2016,25(3):448–455.doi:10.3978/j.issn.1005–6947.2016.03.025.Chen BT,Chen MF.Research progress of borderline resectable pancreatic cancer[J].Chinese Journal of General Surgery,2016,25(3):448–455.doi:10.3978/j.issn.1005–6947.2016.03.025.
[25]黄江,白利杰,张生军,等.局部切除胰体尾联合血管切除重建治疗晚期胰腺癌的疗效分析[J].中国普通外科杂志,2016,25(9):1253–1258.doi:10.3978/j.issn.1005–6947.2016.09.005.Huang J,Bai LJ,Zhang SJ,et al.Ef ficacy analysis of local resection of the body and tail of the pancreas combined with vascular resection and reconstruction for advanced pancreatic cancer[J].Chinese Journal of General Surgery,2016,25(9):1253–1258.doi:10.3978/j.issn.1005–6947.2016.09.005.
[26]杨尹默.胰腺癌外科治疗的现状、存在问题与展望[J].中国普通外科杂志,2016,25(9):1231–1235.doi:10.3978/j.issn.1005–6947.2016.09.001.Yang YM.Surgical managements of pancreatic cancer:current status and future directions[J].Chinese Journal of General Surgery,2016,25(9):1231–1235.doi:10.3978/j.issn.1005–6947.2016.09.001.
[27]He J,Rosati L,Blair A,et al.Long-term outcome in patients with a pathological complete response after neoadjuvant chemoradiation for pancreatic cancer[J].HPB,2016,18:e115.
[28]Assi fiMM,Lu X,Eibl G,et al.Neoadjuvant therapy in pancreatic adenocarcinoma:a meta-analysis of phase II trials[J].Surgery,2011,150(3):466–473.doi:10.1016/j.surg.2011.07.006.
[29]Vaccaro V,Sperduti I,Milella M.FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer[J].N Engl J Med,2011,365(8):768–769.doi:10.1056/NEJMc1107627#SA1.
[30]Nanda RH,El-Rayes B,Maithel SK,et al.Neoadjuvant modi fied FOLFIRINOX and chemoradiation therapy for locally advanced pancreatic cancer improves resectability[J].J Surg Oncol,2015,111(8):1028–1034.doi:10.1002/jso.23921.
[31]Rombouts SJ,Walma MS,Vogel JA,et al.Systematic Review of Resection Rates and Clinical Outcomes After FOLFIRINOX-Based Treatment in Patients with Locally Advanced Pancreatic Cancer[J].Ann Surg Oncol,2016,23(13):4352–4360.

