长链非编码RNA XIST在胰腺癌中的表达及意义
魏伟,杨波,唐翎
(中南大学湘雅医院 1.普通外科 3.药剂科,湖南 长沙 410008;2.湖南省常德市第四人民医院 普通外科,湖南 常德415000)
胰腺癌是我国最常见的恶性肿瘤之一,其病因和发病的分子机制尚不明确[1-4]。近年来,癌基因或抑癌基因变异引起的相关功能因子的表达紊乱而导致胰腺癌发生发展的基因功能研究是胰腺癌病因和发病分子机制研究的重要方向[5-8]。
长链非编码RNA(long non-coding RNA,lncRNA)是一类本身不编码蛋白、转录本长度超过200 nt的长链非编码RNA分子,它可在多层面上,包括表观遗传调控、转录调控以及转录后调控等多个方面调控基因的表达[9]。近年来有研究[10-15]表明,lncRNA亦可作为原癌基因或抑癌基因参与肿瘤的增殖与侵袭转移过程,如MALAT1、HOTAIR、HNF1A-AS及XIST等。据报道[16],X染色体失活特异转录本(X-inactive specific transcript,XIST)在多种癌症中均呈高表达,且XIST的高表达往往与癌症预后不良有密切关系。Fang等[17]研究表明,在非小细胞肺癌中,XIST扮演了癌基因的角色。
本研究将检测胰腺癌组织和胰腺癌细胞系中XIST的表达水平,并通过siRNA干扰胰腺癌细胞中XIST表达后检测其增殖的变化情况。
1 材料与方法
1.1 实验材料
人正常胰腺导管上皮细胞系HPDE、人胰腺癌细胞系AsPC-3、BxPC-3、Capan-1、CFPAC-1、Hs766T、Panc-1及SW1990购自中国科学院典型培养物保藏委员会细胞库。XIST siRNA套装购自上海吉玛生物;MTT检测试剂盒和BrdU检测试剂盒购自赢润生物技术有限公司;0.25%胰蛋白酶、胎牛血清购自Gibco公司;细胞转染试剂lipo-2000购自美国Life Technology公司;总RNA提取试剂(RNA Lyz01)购自依科赛生物公司;反转录试剂盒(RT reagent Kit)购自TaKaRa公司;荧光定量PCR试剂购自Bio-Rad公司;改良Eagle培养基高糖培养基购自Hyclone公司;Ki-67、PCNA抗体购自Abcam公司;其它常用试剂均为国产分析纯。实时荧光定量PCR(real-time PCR,RT-PCR)仪为美国Bio-Rad公司产品。
1.2 组织样品收集
56对正常胰腺组织和胰腺癌组织标本由本科室2013—2015年收集,所有病例术前均未行放疗、化疗。
1.3 细胞培养
HDPE、Capan-1、Hs766T、Panc-1在含10%胎牛血清的DMEM(Gibco,Carlsbad,CA)培养基中培养;AsPC-1、BxPC-3、SW1990细胞系在含10%胎牛血清的RPMI1640培养基中培养;CFPAC-1在含10%胎牛血清的IMDM培养基中培养。所有细胞均置于37 ℃、5%CO2、饱和湿度培养箱内常规传代培养。实验用细胞均为对数生长期细胞。
1.4 细胞转染
制备终浓度为80 nmol/L的XIST siRNA脂质体复合物,实验组加入XIST siRNA,同时设置对照组。将人胰腺癌 SW1990细胞以每孔2×105个接种于6孔板,待细胞增殖至70%~80%时,更换无血清培养基,采用Lipo-2000 将XIST siRNA1、siRNA2、siRNA3分别转染细胞。
1.5 RT-PCR检测
收集各组细胞,每孔不少于1×106个细胞制备总RNA并定量;取5 μg总RNA进行反转录反应合成cDNA,然后以cDNA为模板、GAPDH作为内参照,进行RT-PCR反应。PCR扩增的反应条件为:95 ℃ 30 s 预变性;95 ℃ 5 s,60 ℃ 20 s,40个循环。反应结束后,使用BIO-RAD real-time PCR仪自带软件分析PCR过程中样本的循环阈值(cycle threshold,CT),采用2-AACT计算各组细胞中目的基因相对反应起始拷贝数。GAPDH引物序列正向:5'-TGC ACC ACC AAC TGC TTA GC-3';反向:5'-GGC ATG GAC TGT GGT CAT GAG-3'。XIST引物序列为正向:5'-ACG CTG CAT GTG TCC TTA G-3';反向:5'-GAG CCT CTT ATA GCT GTT TG-3'。
1.6 MTT检测细胞生长曲线
收集各组处于对数生长期的胰腺癌SW1990细胞,把细胞悬液浓度调节为1×105/mL。将100 μL(含1×104个细胞)的细胞悬液种入每孔中,每组设5个复孔,种5块96孔板。置于37 ℃,5%CO2培养箱孵育,把种板时间作为起始时间点0 h,在1 h取出一块96孔细胞培养板,每孔加入10 μL 0.5%MTT溶液,继续培养4 h。1 000 r/min离心10 min,小心吸掉孔内上清液,每孔均加入100 μL二甲基亚砜,将9 6孔板置摇床上,低速振荡10 min,充分溶解结晶物。在酶联免疫检测仪上波长490 nm处分别测量各孔的吸光度(A)。同时设置调零孔(MTT、培养基、二甲基亚砜)。此后每隔12 h取1块培养板检测490 nm的OD值,一共检测72 h。
1.7 BrdU检测细胞增殖能力
细胞以2×103/mL细胞数接种于96孔板中,培养1 d,用含0.4%FCS培养液同步化2 d,使绝大多数细胞处于G0期。终止细胞培养前,加入BrdU(终浓度为10 μmol/L),37 ℃,孵育24 h。去除培养基,细胞被固定30 min,过氧化物酶孵育耦合抗BrdU抗体(Sigma-Aldrich公司)孵育60 min,用PBS洗3次,加过氧化物酶底物(四甲基联苯胺)染色30 min,在490 nm处测定各组的OD值。
1.8 Western blot检测Ki-67、PCNA
收集各组细胞,每孔不少于1×106个细胞制备总蛋白,定量后按相同总量和浓度进行SDSPAGE垂直电泳(1.5~2.5 h);然后用半干转膜法将蛋白转移到PVC膜上(90 V,45~90 min),用5%的脱脂牛奶封闭;洗膜后分别孵育一抗,4 ℃孵育过夜后洗膜3次;孵育二抗,1~2 h后洗膜3次;制备化学发光试剂并滴加到含目的蛋白的膜上,暗室显影或用成像系统直接采集图像。
1.9 统计学处理
采用SPSS 17.0统计软件进行分析,数据用均数±标准差(±s)表示,两两比较采用两独立样本t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 XIST在胰腺癌组织及癌旁组织中的表达
应用RT-PCR技术分别检测56对胰腺癌组织及正常组织中XIST的表达情况,结果显示:胰腺癌组织XIST的表达量明显高于癌旁正常胰腺组织[(2.452±0.134)vs.(0.9729±0.035),P<0.001](图1)。结合临床指标进行统计分析得出:XIST的高表达与胰腺癌肿瘤分期(P=0.016)、淋巴结转移(P=0.032)有关(表1)。

图1 XIST在胰腺癌组织及癌旁正常组织的表达Figure 1 XIST expression in pancreatic cancer and normal tissues

表1 XIST的表达与胰腺癌患者临床病理的关系[n(%)]Table 1 Relations of XIST expression with clinicopathologic variables of pancreatic cancer patients [n (%)]
2.2 XIST在胰腺癌细胞系中的表达
为了确定XIST在胰腺癌中的表达情况,实验中选取人胰腺导管上皮细胞HPDE作为对照,同时选择7个胰腺癌细胞系AsPC-3、BxPC-3、Capan-1、CFPAC-1、Hs766T、Panc-1和SW1990为研究对象。应用RT-PCR技术分别检测8组细胞中XIST的表达水平,结果显示:与HPDE细胞比较,XIST在7个胰腺癌细胞系中均呈高表达(均P<0.05);其中SW1990相比较于HPDE,XIST表达水平升高(2.510±0.170)倍(图2)。

图2 XIST在胰腺导管上皮细胞与不同胰腺癌细胞系中的表达Figure 2 XIST expressions in pancreatic duct epithelial cells and diあerent pancreatic cancer cell lines
2.3 XIST有效siRNA序列筛选
实验选择XIST高表达的SW1990细胞为后续研究工具细胞,并设计在SW1990细胞中沉默XIST。将合成的3个XIST siRNA序列分别转染至SW1990细胞,根据siRNA产品使用手册推荐,在转染后48 h收集细胞,应用RT-PCR技术分别检测4组细胞中XIST mRNA的表达水平,结果显示:siRNA2对XIST的RNA表达水平抑制最明显,表达水平为0.247±0.021,抑制率达到75.3%(P<0.01)(图3),满足后续实验需求。

图3 XIST siRNA序列筛选结果Figure 3 Results of XIST siRNA screening
2.4 XIST调控胰腺癌细胞增殖
研究应用MTT法和BrdU法测定了XIST siRNA2转染胰腺癌细胞系SW1990后细胞的活力和增殖水平的变化。MTT法检测结果显示:48 h对照组及沉默组OD(490nm)分别为1.215±0.048、0.812±0.024,差异有统计学意义(P<0.001)(图4)。BrdU法检测结果显示:48 h对照组及沉默组OD(450 nm)分别为1.007±0.065、0.708±0.085,差异有统计学意义(P<0.001)(图5)。
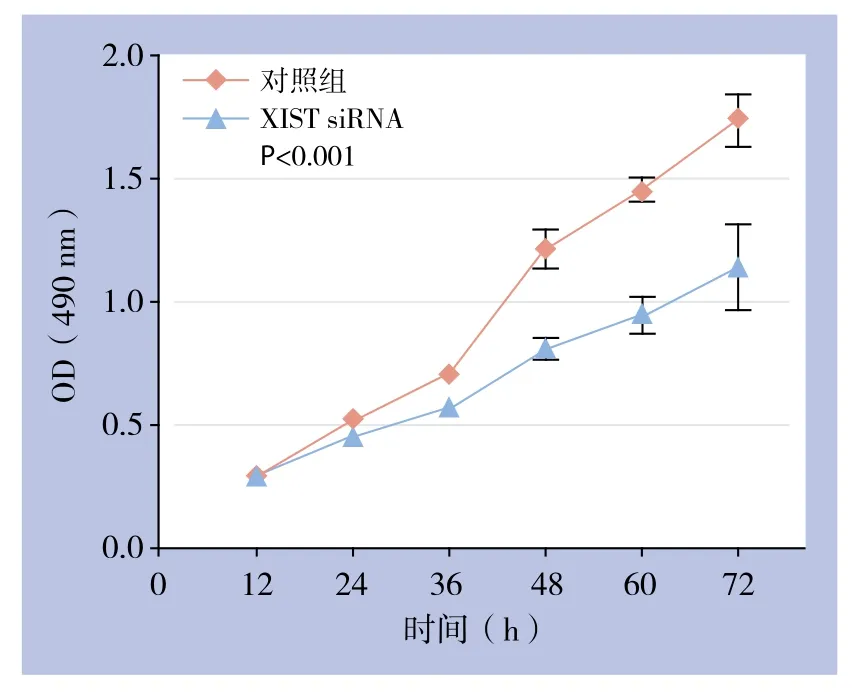
图4 MTT检测XIST沉默对胰腺癌细胞活力的影响Figure 4 In fluence of XIST silencing on viability of pancreatic cancer cells detected by MTT assay

图5 BrdU法检测XIST沉默对胰腺癌细胞增殖的影响Figure 5 Influence of XIST silencing on proliferation of pancreatic cancer cells detected by BrdU assay
2.5 XIST调控细胞增殖相关蛋白
为进一步验证XIST抑制胰腺癌细胞增殖的分子机制,实验在SW1990细胞中转染XIST siRNA2,48 h后收集细胞应用Western blot检测细胞中与增殖相关基因Ki-67、PCNA的蛋白表达变化。结果显示:在48 h对照组与XIST沉默组Ki-67的表达水平分别为1.027±0.074、0.467±0.055,差异有统计学意义(P<0.001);在48 h对照组与XIST沉默组PCNA的表达水平分别为0.997±0.105、0.600±0.082,差异有统计学意义(P<0.001)(图6)。结果从分子层面证明:在胰腺癌细胞中,沉默XIST后细胞增殖促进因子Ki-67、PCNA表达被抑制,从而实现抑制癌细胞的增殖。

图6 XIST沉默对胰腺癌细胞Ki-67、PCNA蛋白表达的影响Figure 6 In fluence of XIST silencing on Ki-67 and PCNA expressions in pancreatic cancer cells
3 讨 论
据2014年最新统计数据显示,发达国家(美国)胰腺癌新发估计病例数,男性列第10位,女性列第9位,占恶性肿瘤病死率的第4位。据《2013年中国肿瘤登记年报》统计,胰腺癌位列我国男性恶性肿瘤发病率的第8位,人群恶性肿瘤病死率的第7位,全球范围内均呈快速上升趋势。胰腺的肿瘤大多是外分泌型肿瘤,80%是胰腺导管腺瘤,只有2%的胰腺外分泌肿瘤为良性[18-20]。胰腺癌以高侵袭性和早期转移为特点,临床症状出现晚,发现时已为晚期,很难施行治愈性的手术治疗,预后较差。近几年在我国发病率逐年上升,并且有年轻化的趋势。虽然放疗和化疗对延长患者生存期起到了一定的作用,但是患者中位生存期仍小于2年[21]。由于胰腺癌的这些特性,寻找参与胰腺癌发生发展,尤其是与胰腺癌早期诊断及预后相关的新的生物学指标,对于早期发现胰腺癌并改善胰腺癌患者的预后具有重要意义。
XIST是雌性哺乳动物X染色体的转录沉默所需的一个长非编码RNA,它在X染色体失活过程中发挥重要作用。近年来,越来越多的证据[22-25]显示XIST与肿瘤的发生、进展密切相关。在胶质母细胞瘤中,XIST敲除通过减少细胞增殖、迁移和侵袭以及诱导细胞凋亡而表现出抑制肿瘤发展的作用[22]。据Ma等[14-15]报道,在胃癌患者中,XIST高表达同更大的肿瘤体积、淋巴结转移、远处转移和TNM分期密切相关。
RT-PCR检测分析本科室2013—2015年收集的56对正常胰腺组织和胰腺癌组织、人胰腺导管上皮细胞及7个胰腺癌细胞系中XIST的表达情况。结果显示在胰腺癌组织和7个胰腺癌细胞系中,XIST均呈现高表达,在SW1990细胞系中表达升高尤其明显;结合临床资料分析显示XIST的高表达可能与更差的胰腺癌分期及淋巴结转移有关,与其他学者[14,26]研究结果一致。
利用RNA干扰技术在SW1990细胞中成功实现细胞内XIST沉默,胰腺癌细胞的细胞活力和增殖均被显著抑制,说明XIST在胰腺癌组织和胰腺癌细胞系中的高表达可能与胰腺癌生长及胰腺癌细胞增殖相关。XIST沉默后,胰腺癌细胞中Ki-67、PCNA的蛋白表达被显著抑制,说明XIST可能通过调控胰腺癌细胞中Ki-67、PCNA的蛋白表达来影响胰腺癌细胞增殖。Yue等[27]研究报道,胰腺癌组织及细胞系中,PCNA蛋白过表达可能有助于胰腺癌的发生或进展;本研究结果表明XIST沉默可抑制PCNA蛋白表达,并可能通过抑制PCNA蛋白表达而影响胰腺癌细胞活力和增殖。以上结果表明XIST可能是胰腺癌恶性程度高,增殖快的原因之一。
综上所述,深入了解XIST促进胰腺癌细胞的增殖及相关机制,可能为胰腺癌的诊断、病情监测提供实验依据,有可能将其作为胰腺癌治疗的新的作用靶点,对于指导治疗、提高术后生存率有重要的意义。
参考文献
[1]Vassaux G,Angelova A,Baril P,et al.The Promise of Gene Therapy for Pancreatic Cancer[J].Hum Gene Ther,2016,27(2):127–133.doi:10.1089/hum.2015.141.
[2]No authors listed.Pancreatic cancer[J].Nat Rev Dis Primers,2016,21(2):16023.doi:10.1038/nrdp.2016.23.
[3]Rivera JA,Graeme-Cook F,Werner J,et al.A rat model of pancreatic ductal adenocarcinoma:targeting chemical carcinogens[J].Surgery,1997,122(1):82–90.
[4]Song SY.Etiology and carcinogenesis of pancreatic ductal adenocarcinoma[J].Korean J Gastroenterol,2008,51(2):71–83.
[5]Park JY,Helm J,Coppola D,et al.MicroRNAs in pancreatic ductal adenocarcinoma[J].World J Gastroenterol,2011,17(7):817–827.doi:10.3748/wjg.v17.i7.817.
[6]Steele CW,Oien KA,McKay CJ,et al.Clinical potential of microRNAs in pancreatic ductal adenocarcinoma[J].Pancreas,2011,40(8):1165–1171.doi:10.1097/MPA.0b013e3182218ffb.
[7]Xue Y,Abou Tayoun AN,Abo KM,et al.MicroRNAs as diagnostic markers for pancreatic ductal adenocarcinoma and its precursor,pancreatic intraepithelial neoplasm[J].Cancer Genet,2013,206(6):217–221.doi:10.1016/j.cancergen.2013.05.020.
[8]Frampton AE,Krell J,Jamieson NB,et al.microRNAs with prognostic significance in pancreatic ductal adenocarcinoma:A meta-analysis[J].Eur J Cancer,2015,51(11):1389–1404.doi:10.1016/j.ejca.2015.04.006.
[9]No authors listed.Long non-coding RNA and disease[J].Hokkaido Igaku Zasshi,2014,89(2):165–166.
[10]Yoshimoto R,Mayeda A,Yoshida M,et al.MALAT1 long non-coding RNA in cancer[J].Biochim Biophys Acta,2016,1859(1):192–199.doi:10.1016/j.bbagrm.2015.09.012.
[11]Wu Y,Lu W,Xu J,et al.Prognostic value of long non-coding RNA MALAT1 in cancer patients[J].Tumour Biol,2016,37(1):897–903.doi:10.1007/s13277–015–3870–8.
[12]Berrondo C,Flax J,Kucherov V,et al.Expression of the Long Non-Coding RNA HOTAIR Correlates with Disease Progression in Bladder Cancer and Is Contained in Bladder Cancer Patient Urinary Exosomes[J].PLoS One,2016,11(1):e0147236.doi:10.1371/journal.pone.0147236.
[13]Luo Z,Li Y,Wang H,et al.Hepatocyte nuclear factor 1A (HNF1A)as a possible tumor suppressor in pancreatic cancer[J].PLoS One,2015,10(3):e0121082.doi:10.1371/journal.pone.0121082.
[14]Ma L,Zhou Y,Luo X,et al.Long non-coding RNA XIST promotes cell growth and invasion through regulating miR-497/MACC1 axis in gastric cancer[J].Oncotarget,2017,8(3):4125–4135.
[15]Chen DL,Ju HQ,Lu YX,et al.Long non-coding RNA XIST regulates gastric cancer progression by acting as a molecular sponge of miR-101 to modulate EZH2 expression[J].J Exp Clin Cancer Res,2016,35(1):142.doi:10.1186/s13046–016–0420–1.
[16]Schouten PC,Vollebergh MA,Opdam M,et al.High XIST and Low 53BP1 Expression Predict Poor Outcome after High-Dose Alkylating Chemotherapy in Patients with a BRCA1-like Breast Cancer[J].Mol Cancer Ther,2016,15(1):190–198.doi:10.1158/1535–7163.MCT–15–0470.
[17]Fang J,Sun CC,Gong C.Long noncoding RNA XIST acts as an oncogene in non-small cell lung cancer by epigenetically repressing KLF2 expression[J].Biochem Biophys Res Commun,2016,478(2):811–817.doi:10.1016/j.bbrc.2016.08.030.
[18]Gerritsen A,Molenaar IQ,Bollen TL,et al.Preoperative characteristics of patients with presumed pancreatic cancer but ultimately benign disease:a multicenter series of 344 pancreatoduodenectomies[J].Ann Surg Oncol,2014,21(12):3999–4006.doi:10.1245/s10434–014–3810–7.
[19]PDQ Adult Treatment Editorial Board.Pancreatic Neuroendocrine Tumors (Islet Cell Tumors) Treatment (PDQ®):Health Professional Version[J].PDQ Cancer Information Summaries [Internet].Bethesda (MD):National Cancer Institute (US),2002–2015.
[20]PDQ Adult Treatment Editorial Board.Pancreatic Neuroendocrine Tumors (Islet Cell Tumors) Treatment (PDQ®):Patient Version[J].PDQ Cancer Information Summaries [Internet].Bethesda (MD):National Cancer Institute (US),2002–2015.
[21]余春开,于双妮,卢朝辉,等.微小RNA在胰腺导管腺癌中的研究进展[J].中国医学科学院学报,2011,33(5):575–581.doi:10.3881/j.issn.1000–503X.2011.05.019.Yu CK,Yu SN,Lu ZH,et al.Research advances in microRNA in pancreatic ductal adenocarcinoma[J].Acta Academiae Medicinae Sinicae,2011,33(5):575–581.doi:10.3881/j.issn.1000–503X.2011.05.019.
[22]Yao Y,Ma J,Xue Y,et al.Knockdown of long non-coding RNA XIST exerts tumor-suppressive functions in human glioblastoma stem cells by up-regulating miR-152[J].Cancer Lett,2015,359(1):75–86.doi:10.1016/j.canlet.2014.12.051.
[23]Tantai J,Hu D,Yang Y,et al.Combined identification of long non-coding RNA XIST and HIF1A-AS1 in serum as an effective screening for non-small cell lung cancer[J].Int J Clin Exp Pathol,2015,8(7):7887–7895.
[24]Sirchia SM,Tabano S,Monti L,et al.Misbehaviour of XIST RNA in breast cancer cells[J].PLoS One,2009,4(5):e5559.doi:10.1371/journal.pone.0005559.
[25]Huang KC,Rao PH,Lau CC,et al.Relationship of XIST expression and responses of ovarian cancer to chemotherapy[J].Mol Cancer Ther,2002,1(10):769–776.
[26]No authors listed.Erratum:The lncRNA XIST exhibits oncogenic properties via regulation of miR-449a and Bcl-2 in human nonsmall cell lung cancer[J].Acta Pharmacol Sin,2017,38(3):443.doi:10.1038/aps.2017.3.
[27]Yue H,Na YL,Feng XL,et al.Expression of p57kip2,Rb protein and PCNA and their relationships with clinicopathology in human pancreatic cancer[J].World J Gastroenterol,2003,9(2):377–380.

