GDF10在神经病理性疼痛大鼠脊髓中的表达*
江 龙, 李 森, 王 莉, 洪有建, 刘 媛, 伍亚民, 黄显凯
(第三军医大学大坪医院创伤外科, 重庆 400042)
GDF10在神经病理性疼痛大鼠脊髓中的表达*
江 龙, 李 森, 王 莉, 洪有建, 刘 媛, 伍亚民, 黄显凯△
(第三军医大学大坪医院创伤外科, 重庆 400042)
目的: 观察生长和分化因子10(GDF10)在神经病理性疼痛大鼠脊髓中的表达变化。方法: 取雄性SD大鼠60只,通过结扎左侧L5脊神经制备神经病理性疼痛模型,于术前1 d,术后当天及术后1 d、3 d、10 d、21 d检测大鼠左后爪50%缩爪阈值,并采用免疫荧光染色及Western blot检测大鼠L5脊髓后角GDF10的表达变化。结果: 脊神经结扎大鼠在术后1 d缩爪阈值开始降低,自3 d起,与正常对照组相比差异有统计学意义(P<0.05),到10 d阈值下降最明显,至21 d呈现持平状态。免疫荧光检测观察到伤侧L5脊髓组织中GDF10主要表达于脊髓背角神经元细胞的胞浆内。GDF10在术后持续降低,到10 d降低最为显著,与正常组相比差异具有统计学意义(P<0.05),一直持续低水平表达至21 d。Western blot证实术后10 d脊髓中GDF10蛋白的表达较正常组大鼠明显降低(P<0.05)。 结论: 大鼠脊神经结扎使脊髓背角中GDF10表达减少,其减少可能与大鼠脊神经损伤后对机械刺激引起的疼痛过敏有关联。
神经病理性疼痛; 脊髓背角; 生长和分化因子10; 缩爪阈值
神经病理性疼痛是一种严重影响生活质量的慢性疼痛性疾病,主要表现为自发性疼痛和痛觉过敏。但是由于我们对其病理发生机制并不完全清楚,所以阻碍了开发新的用于神经病理性疼痛的治疗方法。因此,研究神经病理性疼痛的机制,对开发新的治疗神经病理性疼痛的药物具有重要意义[1]。
转化生长因子β(transforming growth factor,TGF-β)超家族是一类具有多功能并且具有环境依赖性的细胞因子,由超过30种蛋白质所组成。在哺乳动物,这类因子分为不同的亚家族:TGF-β、骨形成蛋白(bone morphogenetic protein,BMP)、活化素(activin)、生长和分化因子(growth and differentiation factor,GDF)等。TGF-β家族是由细胞内的大前体蛋白所产生,作为细胞外分泌的同二聚体或者异二聚体而引发生物学反应。TGF-β超家族成员是通过Ⅰ型丝氨酸/酪氨酸激酶受体(TGFβRⅠ)、Ⅱ型活化素受体样激酶(activin receptor-like kinases,ALKs)或BMP Ⅰ型受体(BMPR Ⅰ)、BMP Ⅱ型受体(BMPR Ⅱ)传递信号[2]。TGF-β1具有神经炎症抑制作用,不但可以预防神经损伤造成的神经病理性疼痛,还能逆转已稳定存在的神经病理性疼痛[3]。生长和分化因子10(growth and differentiation factor 10, GDF10)是BMPs亚家族成员之一,与其它亚家族成员相比,GDF10有着独特的基因结构,并且信号是通过TGFβRⅠ/Ⅱ传导而非BMPRⅠ/Ⅱ[4]。对GDF10在神经病理性疼痛中的作用及机制的研究对干预神经病理性疼痛的发生及维持具有中重要意义,而有关其在神经损伤引起的神经病理性疼痛中的变化及作用尚未见报道。
材 料 和 方 法
1 实验动物
成年雄性SD大鼠60只,体重230~250 g,由第三军医大学第三附属医院野战外科研究所动物中心提供。
2 主要试剂和仪器
抗GDF10兔多克隆抗体(北京博奥森);抗小鼠GAPDH单克隆抗体(Proteintech);抗神经元特异性核蛋白(neuron-specific nuclear protein, NeuN)单克隆抗体、抗胶质细胞原纤维酸性蛋白(glial fibrillary acidic protein, GFAP)单克隆抗体、PVDF膜和ECL化学发光底物(Miliipore);山羊抗兔Alexa Fluor 488荧光Ⅱ抗、山羊抗兔IgG/HRP Ⅱ抗和山羊抗小鼠IgG/HRP Ⅱ抗(北京中杉金桥);Triton X-100、DAPI和Tween 20(Sigma);RIPA裂解液、PMSF和Alexa Fluor 647荧光标记的山羊抗小鼠Ⅱ抗(碧云天);蛋白酶抑制剂(Roche)。低温离心机(Beckman);冰冻切片机和von Frey针刺痛觉测试套件(Stoelting);激光共聚焦扫描系统(Leica);蛋白质电泳和免疫印迹系统、凝胶成像系统(Bio-Rad)。
3 方法
3.1 动物模型的制作 随机将大鼠分为正常组(10只)、假手术组(10只)和手术组(40只)。采用大鼠左侧L5脊神经结扎(spinal nerve ligation,SNL)术制作大鼠神经病理性疼痛模型[5]。SD大鼠腹腔注射3%戊巴比妥钠(50 mg/kg)麻醉后,将大鼠俯卧位固定在鼠板上,背部皮肤备皮,确定两侧髂嵴,两侧髂嵴连线与脊柱相交处为L6棘突,以相交处为中点,作背部正中一长为3 cm的纵行切口,沿脊柱左侧椎旁肌作纵行切口,撑开器撑开后用止血钳钝性分离肌肉筋膜,暴露L6横突后用蚊氏钳咬除L6横突,注意不要损伤横突下的脊神经,咬除L6横突后可见L4和L5脊神经,分离L4和L5脊神经,用5-0手术丝线结扎L5脊神经远端,局部注射青霉素溶液后依次缝合肌肉、皮肤,置于鼠笼内25 ℃恒温待苏醒。对照组仅暴露分离L5脊神经而不予以结扎。凡有运动功能障碍、无触觉异常的大鼠不入组。正常组大鼠不予以任何处理,假手术组大鼠仅暴露分离左侧L5脊神经而不予以结扎。模型组大鼠取材时间点为1 d、10 d和21 d。
3.2 50%缩爪阈值的测定 根据Dixon报道的“up and down”方法[6],用von Frey针刺痛觉测试套件对大鼠进行50%缩爪阈值测定,从0.41 g的von Frey针刺痛觉测试套件开始,刺激大鼠左后爪足底,刺激维持2~3 s,观察大鼠6次的反应,以突然把脚抬离von Frey针刺痛觉测试套件为阳性反应,测量6次的结果,对照阈值表查出50%缩爪阈值。
3.3 免疫荧光观察 各组大鼠经腹腔注射戊巴比妥钠麻醉后,经心脏灌注0.01 mol/L PBS 200 mL至经心耳流出的液体无色透明为止,再灌注4%多聚甲醛150 mL固定后,取腰膨大脊髓,于固定液中后固定过夜后,依次经含20%、30%蔗糖的0.1 mol/L PBS中脱水沉底后行连续冰冻切片,切片厚30 μm,切片挑入切片保护液中-20 ℃保存备用。免疫荧光实验步骤:切片捞入0.01 mol/L PBS中漂洗3次,每次10 min;用含0.3% Triton的正常山羊血清(5%)中封闭1 h;单标为GDF10(1∶100);双标为GDF10(1∶100)与NeuN(1∶2 000),4 ℃孵育过夜;PBS漂洗10 min×3次;加入Alexa Fluor 488荧光标记的山羊抗兔Ⅱ抗(1∶200),Alexa Fluor 647荧光标记的山羊抗小鼠Ⅱ抗(1∶200),37 ℃孵育1 h;PBS漂洗3次,每次10 min;DAPI (10 mg/L) 3 min;PBS漂洗3次,每次5 min;50%甘油封片。于激光共聚焦显微镜下观察拍照。
3.4 Western blot实验 正常组、假手术组和模型10 d组大鼠经腹腔注射戊巴比妥钠麻醉后,冰上取L5节段左侧脊髓后放入液氮中备用。于10 mL RIPA裂解液中加入100 μL PMSF和一片蛋白酶抑制剂配制组织蛋白裂解液。将脊髓组织按照按1∶10的比例加入含蛋白酶抑制剂的RIPA裂解液,匀浆后置于冰上裂解30 min,随后用超声仪打碎细胞5 min,4 ℃、12 000 r/min离心25 min后吸取上清,用BCA法测定蛋白浓度,定量并分装后置于-80 ℃保存备用。大鼠脊髓蛋白样品经10% SDS-PAGE(80 V 20 min;120 V直到溴酚蓝指示剂到底部)分离后,湿转法电转至PVDF膜(恒流300 mA 70 min),按照分子量大小位置裁剪GDF10(50 kD)与GAPDH(35 kD)所在位置的PVDF膜,用含0.1% Tween 20 的TBST配制的5%脱脂奶粉中室温封闭1 h,分别在PVDF膜上加入兔GDF10多抗(1∶500)和小鼠GAPDH单抗(1∶10 000),4 ℃孵育过夜。TBST漂洗3次,每次10 min,分别加入TBST配制的山羊抗兔IgG/HRP Ⅱ抗(1∶5 000)和山羊抗小鼠IgG/HRP Ⅱ抗(1∶5 000)室温孵育1 h,TBST漂洗10 min×3次,ECL发光底物显色,于凝胶成像系统中扫描采集图像。
4 统计学处理
运用SPSS 19.0软件对数据进行处理。结果用均数±标准差(mean±SD)表示。组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
结 果
1 左侧L5脊神经结扎后大鼠痛觉行为的变化
实验组大鼠术侧后肢50%缩爪阈值从术后1 d开始即持续下降,到10 d阈值下降最明显,至21 d呈现持平状态,自3 d起,与正常对照组相比各时点的差异均有统计学意义(P<0.05),表明术后机械痛敏显著增加,见图1。

Figure 1.50% paw withdrawal threshold in each group. Mean±SD. n=5. *P<0.05 vs normal group; #P<0.05 vs sham group.
2 大鼠术侧脊髓背角GDF10表达变化
用免疫荧光染色检测了L5脊髓背角GDF10的表达变化,结果显示正常组和假手术组大鼠脊髓背角中有大量GDF10的表达。手术组大鼠术侧GDF10表达则在术后1 d、3 d、10 d和21 d逐渐减少,且以10 d减少最为明显,在21 d时呈持续低水平表达;手术组与正常对照组、假手术组GDF10免疫荧光强度的差异有统计学意义(P<0.05),见图2。
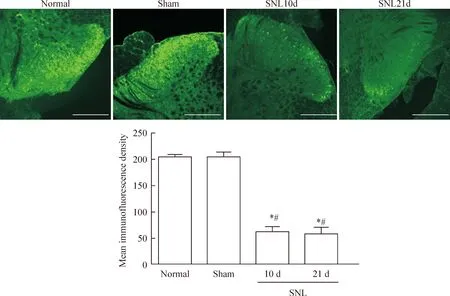
Figure 2.Immunofluorescence observation of GDF10 in the rat spinal dorsal horn of each group. The scale bar=160 μm. Mean±SD. n=5. *P<0.05 vs normal group; #P<0.05 vs sham group.
3 GDF10在脊髓背角神经元中的表达
为明确GDF10是否由在背角神经元中表达,通过NeuN和GDF10双标显示大鼠脊髓背角中能观察到大量NeuN和GDF10双标的神经元,提示GDF10在脊髓背角神经元中特异表达,见图3。
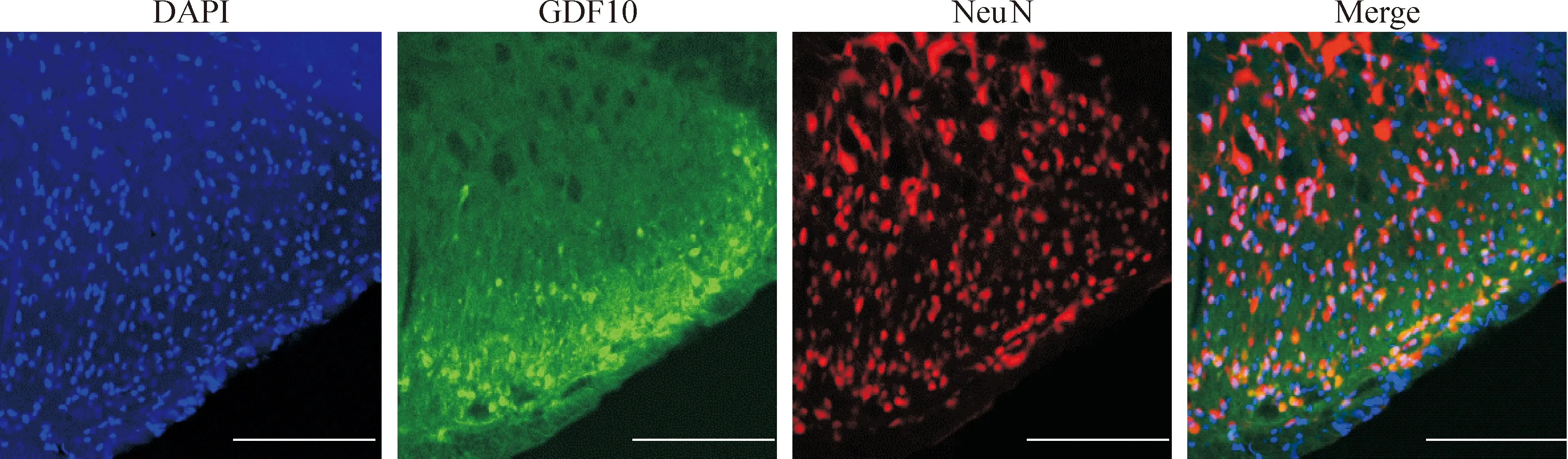
Figure 3.Double staining of NeuN and GDF10 in the spinal dorsal horn. The scale bar=160 μm.
4 神经病理性疼痛大鼠术侧脊髓中GDF10蛋白的表达
行为学分析结果显示在术后10 d缩爪阈值降低最为显著,以及免疫荧光显示GDF10在脊髓背角中的表达在术后10 d显著下降,由此我们重点观察了术后10 d组大鼠与正常对照组、假手术组大鼠术侧脊髓中GDF10的表达。Western blot结果显示手术组大鼠GDF10的表达较其余2组明显降低,统计分析提示该差异具有统计学意义(P<0.05),见图4。

Figure 4.The expression of GDF10 in the rat dorsal horn of each group. Mean±SD. n= 5. *P<0.05 vs normal group; #P<0.05 vs sham group.
讨 论
神经病理性疼痛是一种难治性的疼痛状态,主要见于中枢神经系统损伤(脊髓损伤)和外周神经损伤(坐骨神经压迫和糖尿病性神经病理性疼痛等)。然而患者在体研究神经病理性疼痛的相关机制很困难,因而建立合适的动物模型对揭示神经病理性疼痛的发生机制具有重要意义。目前常用结扎L5脊神经的方法来建立神经病理性疼痛模型,此模型的优点在于L5脊神经主要包含感觉纤维而运动纤维较少,因此结扎以后不会对大鼠运动功能产生影响,因而排除了运动功能损伤带来的疼痛行为学测试的误差;其次,此模型神经损伤稳定,疼痛重复性好,脊神经损伤导致的脊髓变化固定在同一节段,具有较好的实验重复性,大鼠不会发生自噬现象,并且此模型更有利于研究脊髓中星形胶质细胞和小胶质细胞变化的相关机制。所以在本研究中,我们采用了结扎大鼠左侧L5脊神经制备神经病理性疼痛模型。
有研究发现神经病理性疼痛后大鼠可表现出后肢稍外翻,足趾间距变窄,行走时发生抬腿动作的机械性疼痛反应及舔舐损伤侧后足的自发性疼痛反应[5]。von Frey针刺痛觉测试套件是一种经典的用于检测动物机械痛敏的行为学测试方法,对大鼠足底采取不同强度的刺激可以得到相对客观的大鼠缩爪阈值,反映大鼠对机械刺激阈值的变化,因此在本实验中对采用von Frey针刺痛觉测试套件检测了大鼠左后爪足底对机械刺激的缩爪阈值,我们发现脊神经结扎组大鼠缩爪阈值从术后1 d开始下降,到10 d阈值下降最明显,至21 d维持阈值低水平状态,通过统计学比较发现自术后3 d起与正常对照组相比,各时点差异显著。该结果提示该神经病理性疼痛模型中,大鼠后爪足底疼痛敏感随术后时间的延长而增加,两者具有时间-效应关系。
不同的BMP家族成员对神经病理性疼痛的发生过程具有不同作用,如脊髓内注射BMP2可以诱发神经炎症并使大鼠产生痛觉过敏[7],而脊髓内转染BMP7可以促进大鼠坐骨神经损伤后的功能恢复,却未对疼痛过敏的发生产生作用[8]。我们通过免疫荧光检测发现GDF10主要表达于正常大鼠脊髓背角内;在结扎大鼠左侧L5脊神经后,用免疫荧光及Western blot检测发现GDF10的表达在术后10 d时降低最明显,其表达降低的改变与术后大鼠缩爪阈值的变化一致。GDF10的这一性质对我们研究TGF-β超家族在神经病理性疼痛发生过程中发挥作用的机制研究具有提示意义。由于脊髓背角与神经病理性疼痛发生具有重要关系,上述结果提示GDF10与神经病理性疼痛的发生密切相关,可能参与了神经病理性疼痛的调控。
星形胶质细胞和小胶质细胞是神经病理性疼痛发生时脊髓内2种主要的神经炎性细胞[9]。研究发现在脊神经结扎致神经病理性疼痛模型中,小胶质细胞主要在疼痛早期活化,而星形胶质细胞主要在晚期活化,这提示了小胶质细胞主要参与了神经病理性疼痛的发生,而星形胶质细胞主要参与了疼痛的维持[10]。在神经损伤后,脊髓背角神经元的NMDA受体活化,使神经元表达并分泌某些分子如CXCL13等,作用于星形胶质细胞和小胶质细胞,使其活化并分泌炎性因子,促进了中枢敏化作用,从而导致了疼痛的发生[11]。由此可见神经元与胶质细胞的相互作用在神经病理性疼痛的发生中发挥了重要作用。我们在本实验中通过免疫荧光双标观察到GDF10与NeuN特异性共表达于脊髓背角神经元胞浆内,说明GDF10是主要由背角神经元分泌;当神经病理性疼痛发生时,背角神经元内GDF10的表达减少。据此我们推测GDF10参与了神经病理性疼痛模型中神经元与胶质细胞的相互作用,可抑制神经病理性疼痛模型中胶质细胞发生炎性反应。但GDF10参与2种细胞相互作用的分子机制,以及调控GDF10的表达是否能对神经病理性疼痛产生相应的保护作用尚需进一步研究。
[1] 韩济生.我国疼痛医学在传承与创新中发展[J]. 中华医学杂志, 2012, 92(37):2595-2596.
[2] Wharton K, Derynck R. TGF family signaling: novel insights in development and disease[J]. Development, 2009, 136(22):3691-3697.
[3] Echeverry S, Shi XQ, Haw A, et al. Transforming growth factor-β1 impairs neuropathic pain through pleiotropic effects[J]. Mol Pain, 2009, 5:16.
[4] Katoh Y, Katoh M. Comparative integromics on BMP/GDF family[J]. Int J Mol Med, 2006, 17(5):951-955.
[5] Kim SH, Chung JM. An experimental model for peripheral neuropathy produced by segmental spinal nerve ligation in the rat[J]. Pain, 1992, 50(3):355-363.
[6] Chaplan SR, Bach FW, Pogrel JW, et al. Quantitative assessment of tactile allodynia in the rat paw[J]. J Neurosci Methods, 1994, 53(1):55-63.
[7] Dmitriev AE, Lehman RA Jr, Symes AJ. Bone morphogenetic protein-2 and spinal arthrodesis: the basic science perspective on protein interaction with the nervous system[J]. Spine J, 2011, 11(6):500-505.
[8] Tsai M, Pan H, Liou D, et al. Adenoviral gene transfer of bone morphogenetic protein-7 enhances functional recovery after sciatic nerve injury in rats[J]. Gene Ther, 2010, 17(10):1214-1224.
[9] Ji RR, Berta T, Nedergaard M. Glia and pain: is chronic pain a gliopathy? [J]. Pain, 2013, 154(Suppl 1):S10-S28.
[10]Zhuang ZY, Gerner P, Woolf CJ, et al. ERK is sequentially activated in neurons, microglia, and astrocytes by spinal nerve ligation and contributes to mechanical allodynia in this neuropathic pain model[J]. Pain, 2005, 114(1-2): 149-159.
[11]Jiang B, Cao D, Zhang X, et al. CXCL13 drives spinal astrocyte activation and neuropathic pain via CXCR5[J]. J Clin Invest, 2016, 126(2):745-761.
(责任编辑: 陈妙玲, 罗 森)
Expression of GDF10 in spinal cord in a rat model of neuropathic pain
JIANG Long, LI Sen, WANG Li, HONG You-jian, LIU Yuan, WU Ya-min, HUANG Xian-kai
(DepartmentofTraumaticSurgery,DapingHospital,ThirdMilitaryMedicalUniversity,Chongqing400042,China.E-mail:hxkai123@sina.com)
AIM: To observe the expression change of growth and differentiation factor 10 (GDF10) in the spinal cord of the rats with neuropathic pain. METHODS: Male SD rats (n=60) were used. The neuropathic pain was induced by ligation of left L5 spinal nerves of the animals. The paw withdrawal threshold was detected 1 d before surgery, and 0 d, 1 d, 3 d, 10 d and 21 d after surgery. The changes of GDF10 in the dorsal horn of L5 spinal cord were detected by immunofluorescence staining and Western blot. RESULTS: The paw withdrawal threshold of the rats with spinal nerve ligation was decreased from 1 d after surgery until 3 d with obvious difference compared with the naïve rats (P<0.05), continuously decreased until 10 d, and then stabilized at 21 d. The GDF10 was located in the cytoplasm of the neurons in the dorsal horn of L5 spinal cord detected by immunofluorescence staining. The expression of GDF10 in L5 dorsal horn detected by immunofluorescence staining was reduced after surgery, significantly decreased from 10 d (P<0.05) until more than 21 d after surgery in spinal nerve ligation group compared with naïve group. GDF10 in L5 spinal cord detected at 10 d after surgery by Western blot was significantly down-regulated in spinal nerve ligation group compared with naïve group (P<0.05). CONCLUSION: Spinal nerve ligation induces the decrease in GDF10 expression in spinal dorsal horn. The down-regulation of GDF10 may contribute to the regulation of hyperpathia caused by mechanical stimulation after the injury of spinal nerve.
Neuropathic pain; Spinal dorsal horn; Growth and differentiation factor 10; Paw withdrawal threshold
1000- 4718(2017)03- 0444- 05
2016- 10- 27
2016- 12- 09
国家自然科学基金资助项目(No. 30772299);军队特需药品保密专项(No. 2009ZXJ09014-0096)
△通讯作者 Tel: 023-68757430; E-mail: hxkai123@sina.com
R363; R745.4
A
10.3969/j.issn.1000- 4718.2017.03.010

