成纤维细胞生长因子10抑制脂多糖刺激下BV2细胞的活化*
潘舒琳, 何笑笑, 胡莹莹, 方明楚, 姜 槐, 肖 健, 林振浪△
(1温州医科大学附属第二医院、育英儿童医院新生儿科,浙江 温州 325027; 2温州医科大学药学院,浙江 温州 325035)
成纤维细胞生长因子10抑制脂多糖刺激下BV2细胞的活化*
潘舒琳1, 何笑笑1, 胡莹莹1, 方明楚1, 姜 槐1, 肖 健2△, 林振浪1△
(1温州医科大学附属第二医院、育英儿童医院新生儿科,浙江 温州 325027;2温州医科大学药学院,浙江 温州 325035)
目的: 探索成纤维细胞生长因子10(fibroblast growth factor 10,FGF10)对脂多糖(lipopolysaccharide,LPS)刺激下小胶质细胞BV2活化的影响。方法: 小鼠BV2小胶质细胞用细胞培养基DMEM培养,置于37 ℃、5% CO2、饱和湿度的培养箱中培养,1~2 d换液,4~5 d传代。实验分为对照组、LPS组和FGF10组,FGF10组的BV2细胞预先给予FGF10 1 mg/L 30 min后,在LPS组和FGF10组中加入500 mg/L的LPS,在不同时点进行检测。用倒置显微镜观察小胶质细胞的形态学改变, RT-qPCR和ELISA分别检测肿瘤坏死因子α(TNF-α)转录和蛋白表达水平的改变来观测BV2 细胞的活化情况。结果: 静息状态下BV2细胞形态呈圆形或椭圆形,经过24 h LPS刺激后,BV2细胞形状向多极或纺锤样改变,活化细胞数量比值明显高于对照组;预先给予FGF10能抑制LPS刺激下的BV2细胞向活化形态改变,活化的BV2细胞明显减少。给予LPS刺激6 h后,LPS组TNF-α的mRNA水平相比于对照组显著升高,然而预先给予FGF10会显著抑制TNF-α的转录。 LPS作用24 h后,细胞培养上清液内TNF-α的表达水平与对照组相比显著上升,而预先给予FGF10在蛋白水平显著抑制TNF-α的表达。结论: FGF10能够成功抑制LPS刺激下BV2细胞的活化,有望成为治疗经胶质细胞介导的神经系统炎症性疾病的一种有效药物。
成纤维细胞生长因子10; BV2细胞; 脂多糖; 肿瘤坏死因子α
炎症反应是许多中枢神经系统性疾病中十分重要的病理过程。小胶质细胞是中枢神经系统炎症和免疫反应的主效应细胞,约占所有胶质细胞的10%~20%[1]。正常情况下,小胶质细胞促进神经元的发育,维持中枢神经系统的稳态。当中枢神经系统受到炎症,感染,缺氧等病理刺激时,小胶质细胞被激活,细胞功能向巨噬细胞转化。当小胶质细胞受到脂多糖(lipopolysaccharide, LPS)持续激活后将释放大量的炎症介质如前列腺素E2(prostaglandin E2, PGE2)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)、白细胞介素1β (interleukin-1β, IL-1β)、白细胞介素6 (interleukin-6, IL-6)等[2-3],这些炎症因子一旦过度表达将加剧神经元损伤,同时参与一些与炎症和神经变性相关的中枢神经系统疾病的病理过程,包括脑外伤、脑卒中、脑退行性疾病、感染等[4-5]。因此,抑制小胶质细胞过度活化可能是治疗神经系统炎症性疾病的一种有效方法。
成纤维细胞生长因子10(fibroblast growth factor 10,FGF10)是成纤维细胞生长因子家族的成员之一。FGF10与细胞的生长、增殖、分化和迁移有关,能促进四肢、肺、脂肪组织和前列腺的发育[6-8]。在对动物模型的研究发现,FGF10可以用于治疗急性肺损伤、肺炎、干眼等疾病[9-11]。FGF10的治疗作用可能与病理过程的炎症反应被抑制有关系[9-10],但FGF10是否能够通过抑制小胶质细胞活化从而减少炎症反应尚未完全清楚。本研究希望证实FGF10能够抑制LPS刺激下的BV2细胞活化,为FGF10治疗由胶质细胞介导的神经系统炎症性疾病提供理论依据。
材 料 和 方 法
1 主要试剂以及仪器
BV2细胞购于中国协和医科大学细胞中心;DMEM培养基 (Gibco);TNF-α ELISA试剂盒(eBioscience);LPS (Sigma);FGF10 (Grostre Biotech);iQTMSYBR® Green Supermix (Bio-Rad);TRIzol试剂(Roche);PrimeScriptTMRT试剂盒 (TaKaRa)。CFX96 TouchTM荧光定量PCR仪(Bio-Rad);倒置显微镜(NIKON)。
2 方法
2.1 细胞培养与分组 小鼠BV2小胶质细胞用DMEM培养基(含1×105U/L青霉素、10 mg/L链霉素、10 mmol/L谷氨酰胺以及10%小牛血清)培养,置于37 ℃、5% CO2、饱和湿度的培养箱中培养,1~2 d换液,4~5 d传代。实验分为对照(control)组、LPS组和FGF10组。提前一晚将细胞均匀铺在6孔板上,FGF10组的BV2细胞预先给予FGF10 1 mg/L 30 min后,在LPS组和FGF10组中加入500 μg/L的LPS,刺激6 h或24 h。
2.2 ELISA试剂盒检测TNF-α蛋白表达情况 LPS刺激24 h后,收集上清液1.5 mL于Eppendorf管中,按照ELISA检测试剂盒的说明书进行操作,测定上清液中TNF-α的表达情况。
2.3 RT-qPCR检测TNF-α的转录水平 收集经LPS刺激6 h后的BV2细胞,用TRIzol抽提总RNA,抽提步骤根据生产商提供的方法进行,然后将总RNA逆转录成cDNA。逆转录后得到的cDNA通过荧光定量PCR的方法,检测荧光信号强度,然后转化成为Ct值。β-actin作为管家基因用以消除因标本处理、PCR反应和逆转录不同而出现的差异。因此,用TNF-α与内参照β-actin mRNA含量比值作为TNF-α的mRNA表达水平指标。TNF-α的正义链是5’-TGATCCGCGACGTGGAA-3’, 反义链是5’-ACCGCCTGGAGTTCTGGAA-3’; β-actin的正义链是5’-CCGTGAAAAGATGACCCAGA-3’,反义链是5’-TACGACCAGAGGCATACAG-3’。
2.4 倒置显微镜观察细胞形态学变化 LPS刺激24 h后,将细胞放在倒置显微镜下观察,放大倍数200倍。每组样品取3个视野计数,重复3次。活化的BV2细胞的相对值=(多极型细胞+纺锤样双极细胞)/总细胞数量。
3 统计学处理
用GraphPad Prism 5软件中单因素方差分析的Tukey法来分析数据。计量数据用均数±标准差(mean±SD)表示,以P<0.05为差异有统计学意义。
结 果
1 FGF10对LPS刺激下BV2细胞形态学的影响
我们在200倍显微镜下观察了对照组、LPS组和FGF10组BV2细胞的形态学改变。处于静息状态下的BV2细胞形态呈圆形或椭圆形,体积较小。经过LPS刺激24 h后,LPS组的BV2细胞因受到激活体积相对于对照组增大,且形状从圆形或椭圆形向分枝样改变。活化的BV2细胞中一些向多极细胞转变,一些向两极延长、呈纺锤样改变。然而,FGF10组在预先给予FGF10 (1 mg/L)的情况下,活化的BV2细胞相对于LPS组明显减少。通过统计活化的小胶质细胞数占总细胞数量的比值我们可以得到相同的结果。LPS组活化的小胶质细胞占总细胞数量的比值明显高于对照组(P<0.01),而预先给予FGF10可以降低活化细胞比值(P<0.05),见图1。

Figure 1.The effect of FGF10 on the morphological changes of LPS-induced BV2 microglia. The scale bar=200 μm. Mean±SD. n=3. **P<0.001 vs control group; #P<0.05 vs LPS group.
2 FGF10抑制LPS刺激下BV2细胞TNF-α的转录水平
给予LPS刺激6 h后,用RT-qPCR检测促炎症因子TNF-α的转录水平。如图2所示,予以500 μg/L LPS刺激后,LPS组TNF-α的mRNA水平相比于对照组显著升高(P<0.01),然而FGF10组TNF-α的mRNA表达量相比LPS组显著下降(P<0.05)。

Figure 2.The effect of FGF10 on the mRNA expression of TNF-α in the BV2 microglial cells stimulated with LPS. Mean±SD. n=3. **P<0.01 vs control group; #P<0.05 vs LPS group.
3 FGF10抑制LPS刺激下BV2细胞TNF-α的蛋白表达
我们分别用100 μg/L、250 μg/L、500 μg/L、1.0 mg/L和1.5 mg/L LPS浓度刺激BV2小胶质细胞,然后通过检测24 h后TNF-α的蛋白表达量来选择合适的LPS剂量。结果如图3所示,随着LPS剂量增加TNF-α表达量与对照组相比明显增加(P<0.05),且当LPS浓度为500 μg/L时达到最大值,而1.0 mg/L组和1.5 mg/L组与500 μg/L组比较TNF-α表达量的差异无统计学显著性。因此,我们将LPS浓度500 μg/L作为最适刺激浓度。LPS作用24 h后,细胞培养上清液内TNF-α的水平与对照组相比显著上升(P<0.01),这种表现与转录水平的上升趋势是一致的。而预先给予FGF10在蛋白水平显著抑制TNF-α的表达(P<0.01),见图4。
讨 论
成纤维细胞生长因子家族具有多种生化和生物学功能。它们在胚胎发育,维持稳态,应对损伤反应,调节细胞的电生理兴奋性等方面中扮演着十分重要的角色[12]。FGF10是成纤维细胞生长因子家族中的成员,参与了多种生理和病理过程,包括了修复和再生等[13]。FGF10在治疗肺部疾病中的效果明显且应用广泛,包括了博来霉素引起的肺纤维化[14],高原肺水肿[15],缺血再灌注肺损伤[16]等。Tong等[9]在FGF10对LPS引起的急性肺损伤的影响的研究中发现,FGF10促进肺组织的修复,明显抑制支气管肺泡灌洗液和肺组织中的IL1β、TNFα等促炎症因子表达。Feng 等[10]用FGF10治疗铜绿假单胞菌肺炎不但可以增加7 d生存率而且肺部的IL-6和TNF-α水平明显降低。以上的研究结果提示,FGF10可能通过抑制炎症反应从而改善肺部疾病的修复情况。

Figure 3.The effect of LPS at different concentrations on protein expression of TNF-α in the activated BV2 microglia. Mean±SD. n=3. **P<0.01 vs 0 μ/L.
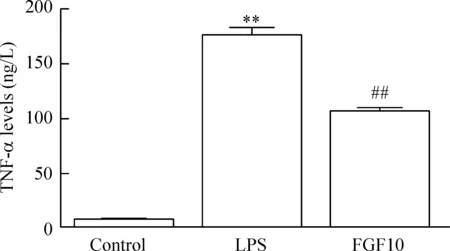
Figure 4.The effect of FGF10 on the protein of TNF-α in the BV2 microglial cells stimulated with LPS. Mean±SD. n=3. **P<0.01 vs control group; ##P<0.01 vs LPS group.
许多中枢神经系统疾病的病理过程中均有炎症反应的参与,如帕金森综合征,阿尔兹海默疾病,多发性硬化,脑外伤,感染,脑缺血再灌注损伤等。而中枢神经系统中的小胶质细胞在炎症反应过程中占据着重要的位置。正常情况下,小胶质细胞具有神经保护的作用,但是一旦受到病理因素的刺激后,它的形态会从静息态转变成活化态[17]。LPS是一种常见的细胞内毒素,它能够激活细胞中重要的病理机制,并且这些病理机制常常存在于炎症反应的病理过程中。LPS被广泛应用于模拟革兰氏阴性菌感染引起的小胶质细胞活化。因此,LPS激活小胶质细胞的模型可用于研究与炎症反应有关的中枢神经系统疾病中的小胶质细胞活化的机制以及小胶质细胞对神经元的损伤机制。
本研究采用LPS作为刺激BV2细胞活化的病理刺激原。在LPS激活BV2小胶质细胞的相关文献中,LPS的参考剂量一般在100 μg/L~1 mg/L范围内[1, 18]。我们用不同浓度 LPS刺激BV2小胶质细胞,然后通过检测24 h后TNF-α的蛋白表达量来选择合适的LPS剂量。结果显示浓度500 μg/L LPS作为最适刺激浓度。激活状态下的小胶质细胞会大量转录和翻译促炎症因子,如一氧化氮(nitric oxide,NO)、PGE2、TNF-α、IL-1β和IL-6 等。本研究发现,BV2细胞在500 μg/L LPS刺激时细胞形态发生明显的改变,细胞胞体增大且细胞向纺锤样的双极细胞或多极细胞转变。在给予LPS刺激后,BV2细胞的TNF-α转录和蛋白表达水平明显提高了。促炎症因子TNF-α在转录和蛋白表达水平显著升高以及小胶质细胞形态上向活化态改变的表现均提示了小胶质细胞在LPS刺激下发生了明显的活化转变。而大量促炎症因子的产生将大大加重中枢神经系统的炎症反应,加剧神经元的损伤。
有研究显示促炎症因子过表达与一些中枢神经系统退行性疾病有关,如阿尔兹海默、帕金森综合症、多发性硬化[19-20]等。因此,抑制炎症因子产生成为控制中枢神经系统炎症反应的重要机制。本研究发现,在给予LPS刺激后,BV2细胞的TNF-α转录和蛋白表达水平明显提高了,而预先给予FGF10则明显减少了在形态学上向活化态转变的小胶质细胞,同时抑制了促炎症因子TNF-α的转录和蛋白表达。说明FGF10具有抑制小胶质细胞活化的作用。这个结果提示,FGF10可能具有抑制中枢神经系统炎症反应的功能。一项支气管肺发育不良的研究发现,FGF10与Toll样受体的炎症信号通路有关[21]。既往的研究已经证实,中枢神经系统中的炎症反应与Toll样受体信号通路激活有关[22]。因此我们推测,FGF10有可能通过作用于BV2细胞上Toll样受体信号通路对炎症反应产生影响,这需要我们在后续实验中进一步证实。
综上所述,预先给予FGF10够能抑制LPS刺激下的BV2细胞形态向活化方向改变,同时减少小胶质细胞BV2细胞对促炎症因子TNF-α的转录和蛋白表达,表明FGF10有可能对胶质细胞介导的神经系统炎症性疾病具有保护作用。FGF10有望成为治疗经胶质细胞介导的神经系统炎症性疾病的一种有效药物。
[1] Dang Y, Mu Y, Wang K, et al. Papaverine inhibits lipopolysaccharide-induced microglial activation by suppressing NF-κB signaling pathway[J]. Drug Des Dev Ther, 2016, 10:851-859.
[2] Park J, Min JS, Kim B, et al. Mitochondrial ROS govern the LPS induced pro-inflammatory response in microglia cells by regulating MAPK and NF-κB pathways[J]. Neurosci Lett, 2015, 584:191-196.
[3] Velagapudi R, Aderogba M, Olajide OA. Tiliroside, a dietary glycosidic flavonoid,inhibits TRAF-6/NF-κB/p38-mediated neuroinflammation in activated BV2 microglia[J]. Biochim Biophys Acta, 2014, 1840(12):3311-3319.
[4] Walker DG, Whetzel AM, Lue LF. Expression of suppressor of cytokine signaling genes in human elderly and Alzheimer’s disease brains and human microglia[J]. Neuroscience, 2015, 302:121-137.
[5] Kim YS, Joh TH. Microglia, major player in the brain inflammation: their roles in the pathogenesis of Parkinson’s disease[J]. Exp Mol Med, 2006, 38(4):333-347.
[6] Sekine K, Ohuchi H, Fujiwara M, et al. Fgf10 is essential for limb and lung formation[J]. Nat Genet, 1999, 21(1):138-141.
[7] Sakaue H, Konishi M, Ogawa W, et al. Requirement of fibroblast growth factor 10 in development of white adipose tissue[J]. Genes Dev, 2002, 16(8):908-912.
[8] Thomson AA, Cunha GR. Prostatic growth and development are regulated by FGF10[J]. Development, 1999, 126(16):3693-3701.
[9] Tong L, Bi J, Zhu X, et al. Keratinocyte growth factor-2 is protective in lipopolysaccharide-induced acute lung injury in rats[J]. Respir Physiol Neurobiol, 2014, 201:7-14.
[10]Feng N, Wang Q, Zhou J, et al. Keratinocyte growth factor-2 inhibits bacterial infection withPseudomonasaeruginosapneumonia in a mouse model[J]. J Infect Chemo-ther, 2016, 22(1):44-52.
[11]Zheng W, Ma M, Du E, et al. Therapeutic efficacy of fibroblast growth factor 10 in a rabbit model of dry eye[J]. Mol Med Rep, 2015, 12(5):7344-7350.
[12]Itoh N, Ornitz DM. Fibroblast growth factors: from molecular evolution to roles in development, metabolism and disease[J]. J Biochem, 2011, 149(2):121-130.
[13]Jurjus A, Atiyeh BS, Abdallah IM, et al. Pharmacological modulation of wound healing in experimental burns[J]. Burns, 2007, 33(7):892-907.
[14]Gupte VV, Ramasamy SK, Reddy R, et al. Overexpression of fibroblast growth factor-10 during both inflammatory and fibrotic phases attenuates bleomycin-induced pulmonary fibrosis in mice[J]. Am J Respir Crit Care Med, 2009, 180(5):424-436.
[15]She J, Goolaerts A, Shen J, et al. KGF-2 targets alveolar epithelia and capillary endothelia to reduce high altitude pulmonary oedema in rats[J]. J Cell Mol Med, 2012, 16(12):3074-3084.
[16]Fang X, Wang L, Shi L, et al. Protective effects of keratinocyte growth factor-2 on ischemia-reperfusion-induced lung injury in rats[J]. Am J Respir Cell Mol Biol, 2014, 50(6):1156-1165.
[17]曾 琪, 戚仁斌, 胡巢凤, 等. PYNOD对LPS活化的BV2小胶质细胞炎症因子释放的影响[J]. 中国病理生理杂志, 2014, 30(11):1954-1959.
[18]Sun HN, Shen GN, Jin YZ, et al. 2-cyclohexylamino-5, 8-dimethoxy-1, 4-naphthoquinone inhibits LPS-induced BV2 microglial activation through MAPK/NF-κB signaling pathways[J]. Heliyon, 2016, 2(7):e00132.
[19]Tansey MG, McCoy MK, Frank-Cannon TC, et al. Neuroinflammatory mechanisms in Parkinson’s disease: potential environmental triggers, pathways, and targets for early therapeutic intervention[J]. Exp Neurol, 2007, 208(1):1-25.
[20]Wilms H, Zecca L, Rosenstiel P, et al. Inflammation in Parkinson’s diseases and other neurodegenerative diseases: cause and therapeutic implications[J]. Curr Pharm Des, 2007, 13(18):1925-1928.
[21]Benjamin JT, Smith RJ, Halloran BA, et al. FGF-10 is decreased in bronchopulmonary dysplasia and suppressed by Toll-like receptor activation[J]. Am J Physiol Lung Cell Mol Physiol, 2007, 292(2): L550-L558.
[22]Wang D, Shi J, Lv S, et al. Artesunate attenuates lipopolysaccharide-stimulated proinflammatory responses by suppressing TLR4, MyD88 expression, and NF-κB activation in microglial cells[J]. Inflammation, 2015, 38(5): 1925-1932.
(责任编辑: 林白霜, 罗 森)
Fibroblast growth factor 10 inhibits lipopolysaccharide-induced microglial activation
PAN Shu-lin1, HE Xiao-xiao1, HU Ying-ying1, FANG Ming-chu1, JIANG Huai1, XIAO Jian2, LIN Zhen-lang1
(1DepartmentofNeonatology,TheSecondAffiliatedHospital&YuyingChildren’sHospitalofWenzhouMedicalUniversity,Wenzhou325027,China;2SchoolofPharmacy,WenzhouMedicalUniversity,Wenzhou325035,China.E-mail:xfxj2000@126.com;linzhenlang@hotmail.com)
AIM: To investigate the effects of fibroblast growth factor 10 (FGF10) on lipopolysaccharide (LPS)-induced microglial activation. METHODS: Mouse BV2 microglial cells were maintained in DMEM in a humidified incubator with 95%/5% (V/V) mixture of air and CO2at 37 ℃. The medium was changed every 1 or 2 d. The cells were digested and passaged every 4 or 5 d. The BV2 microglial cells were first pretreated with FGF10 (1 mg/L) for 30 min and then stimulated with LPS (500 μg/L). The medium and the cells were collected at different time points. The morphological changes of microglia were visualized under microscope. To evaluate the microglial activation, the transcription and production of proinflammatory factor tumor necrosis factor-α (TNF-α) were examined by real-time quantitative polymerase chain reaction (RT-qPCR) and enzyme-linked immunosorbent assay (ELISA), respectively. RESULTS: The morphology of control BV2 microglia showed circular or oval shape. After exposure to LPS for 24 h, the microglia revealed spindle shaped or multipolar morphology, and the percentage of activated cells was significantly increased compared with control group. Pretreatment with FGF10 successfully inhibited the morphological change from normal to activated shape. LPS sti-mulation for 6 h significantly increased the transcription of TNF-α, while FGF10 pretreatment remarkably reversed the effect. In addition, the production of TNF-α increased in the presence of LPS stimulation for 24 h compared with control group. Pretreatment with FGF10 suppressed LPS-induced TNF-α expression.CONCLUSION: Pretreatment with FGF10 inhibits the morphological change from normal to activated shape, and remarkably suppressed the transcription and production of TNF-α. FGF10 successfully suppresses LPS-induced BV2 microglial activation, indicating that FGF10 is a therapeutic agent for the treatment of glia-mediated neuroinflammatory diseases.
Fibroblast growth factor 10; BV2 cells; Lipopolysaccharide; Tumor necrosis factor-α
1000- 4718(2017)03- 0534- 05
2016- 10- 09
2016- 12- 15
2014年度温州市科技局公益性科技计划(No. Y20140681)
△通讯作者 肖健 Tel: 0577-85773087; E-mail: xfxj2000@126.com; 林振浪 Tel: 0577-88002798; E-mail: linzhenlang@hotmail.com
R363.2
A
10.3969/j.issn.1000- 4718.2017.03.025

