紫苏β-酮脂酰ACP合成酶基因家族生物信息学分析
李 璐,梁 倩,安 茜,周雅莉,王计平
(山西农业大学农学院,山西太谷030801)
紫苏β-酮脂酰ACP合成酶基因家族生物信息学分析
李 璐,梁 倩,安 茜,周雅莉,王计平
(山西农业大学农学院,山西太谷030801)
紫苏作为一种新型油料作物,富含多种不饱和脂肪酸,其中,α-亚麻酸含量高达61.2%。β-酮脂酰ACP合成酶在植物脂肪酸合成中起着关键性作用。对紫苏β-酮脂酰ACP合成酶(KAS)基因家族及其编码蛋白进行了详细的生物信息学分析。结果表明,紫苏KAS家族蛋白中,KASⅡ基因编码的氨基酸数最多,KASⅢB最少,均为疏水性脂溶蛋白,无信号肽,推测该家族蛋白为非分泌型蛋白;家族蛋白都含有KAS保守结构域,属于cond-enzymes超蛋白家族,二级结构组成基本相同。系统进化树分析结果表明,紫苏KASⅠ与拟南芥KASⅠ、紫苏KASⅡ与油茶KASⅡ、紫苏KASⅢ与油茶KASⅢ亲缘关系最近,紫苏与油棕、油棕榈KAS酶家族亲缘关系较远。研究结果可为深入探究紫苏脂肪酸合成机制奠定理论基础。
紫苏;β-酮脂酰ACP合成酶(KAS);生物信息学分析
植物脂肪酸的合成是在一系列可溶性脂肪酸合成酶的作用下将C2结构反复添加到脂肪酸链中,经过8~9次循环,形成C16和C18脂肪酸[1]。在植物脂肪酸合成中,β-酮脂酰 ACP合成酶(KAS)作为脂酰基载体,作用于脂肪酸合成的缩合反应中[2]。β-酮脂酰ACP合成酶共分为4类:KASⅠ,KASⅡ,KASⅢ,KASⅣ,其中,KASⅠ和KASⅡ以酰基 -ACP为底物,KASⅠ主要在 C4-ACP~C16-ACP循环缩合反应中起作用;而KASⅡ对C16-ACP具有较高的选择特异性,催化棕榈酰基ACP与丙二酰ACP发生聚合反应生成硬脂酸,是C16-ACP~C18-ACP过程中的关键酶,决定着C16/C18脂肪酸的值,与植物抗低温胁迫和生长发育紧密相关[3]。KASⅢ是启动脂肪酸合成的关键酶,作用于第1次循环中的缩合反应,催化乙酰CoA和丙二酰CoA生成乙酰乙酰-ACP。目前,对KASⅣ的研究较少,对萼距花种子研究结果表明,KASⅣ主要作用于C6-ACP~C14-ACP过程中的缩合反应[4-5]。
紫苏(Perilla frutescens)系唇形科紫苏属1年生草本植物,种子含油量高达35%~64%,含有丰富的不饱和脂肪酸,占总脂肪酸含量的90%以上,具有广阔的开发前景[6]。植物KASⅢ主要以乙酰ACP为底物,但也可以作用于其他酰基ACP,因此,可以合成多种碳链结构的脂肪酸,说明KASⅢ对植物脂肪酸碳链结构的形成具有一定的作用[7-8]。对披针叶萼距花种子研究发现,KASⅢ影响脂肪酸的碳链长度[9];另外,有研究表明,植物中KASⅢ活性影响脂肪酸合成的速率,推测KASⅢ可能以限速酶作用于脂肪酸的合成途径[10]。不同物种的KAS基因可利用的酰基ACP也不同。
为了探索KAS基因家族在紫苏脂肪酸合成过程中发挥的作用,本研究对紫苏KAS家族进行了详细的生物信息学分析,对其编码蛋白进行初步预测,旨在为进一步深入研究KAS家族在紫苏等油料作物中的功能奠定理论基础。
1 材料和方法
1.1 材料
紫苏KAS家族蛋白序列来源于NCBI数据库(https://www.ncbi.nlm.nih.gov/),分别为:KASⅠ(序列号:AF026148.1),KASⅡ(序列号:AF026149.1),KASⅢA(序列号:AF026150.1),KASⅢB(序列号:AF026151.1)。
1.2 方法
借助在线分析软件 ProtParam(http://web.ex pasy.org/protparam/)对紫苏KAS基因家族编码蛋白进行理化性质分析;采用SignalP 4.1 Server(http:// www.cbs.dtu.dk/services/SignalP/)和TargetP 1.1Server(http://www.cbs.dtu.dk/services/TargetP/)进行信号肽预测和亚细胞定位分析;利用TMPred(http://www. ch.embnet.org/soft-ware/TMPRED_form.html)对跨膜区域进行分析;通过NCBI的CDD(Conserved Domain Database)数据库对其功能结构域进行分析鉴定;登陆在线软件SOPMA对紫苏KAS家族蛋白二级结构进行预测。采用在线分析软件Swiss-model(http://www.swissmodel.expasy.org/)进行三级结构分析并建模。运用MEGA 6.0多序列比对软件对紫苏等11个物种进行比对,构建系统进化树,分析物种间的同源性,获得相关的进化信息。
2 结果与分析
2.1 蛋白一级结构分析
利用ProtParam预测紫苏KAS家族蛋白理化性质,结果如表1所示。由表1可知,KASⅡ基因编码氨基酸数最多(530aa),KASⅢB最少(400aa),KASⅠ和KASⅡ,KASⅢA和KASⅢB的理论等电点较接近,脂溶系数都小于100,推测KAS家族蛋白为疏水性脂溶蛋白,除KASⅢB蛋白以外都为稳定蛋白。SignalP 4.1预测紫苏KAS家族蛋白都没有信号肽,因此,推测该家族蛋白为非分泌型蛋白。通过TargetP 1.1定位分析显示,KASⅠ,KASⅢA,KASⅢB蛋白亚细胞主要位于叶绿体上,KASⅡ蛋白则位于线粒体上。
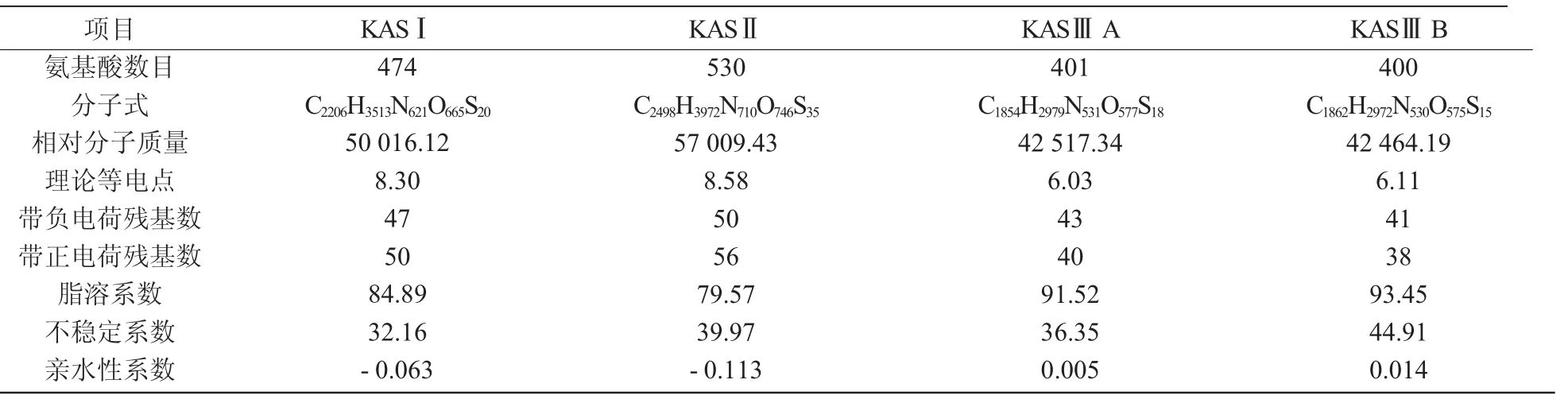
表1 KAS蛋白家族理化性质分析
2.2 蛋白二级结构分析
利用TMHMM 2.0预测跨膜区域显示,紫苏KAS家族蛋白无跨膜区。使用SOPMA软件预测KAS家族蛋白二级结构,结果如表2所示。由表2可知,KAS家族蛋白都由α-螺旋、β-转角、β-折叠和无规则卷曲组成,其中,KASⅠ,KASⅡ和KASⅢA各组分含量大小均为:无规则卷曲>α-螺旋>β-折叠>β-转角,而KASⅢB含量大小则为:α-螺旋>无规则卷曲>β-折叠>β-转角,结果表明,该家族蛋白二级结构组成基本相同,但KASⅢB略有不同,仍存在一定差异。

表2 KAS蛋白家族二级结构组成比例预测 %
2.3 蛋白结构域与三级结构分析
通过NCBI-CDD对紫苏KAS家族蛋白进行功能结构域预测,结果如图1所示。从图1可以看出,KAS家族蛋白都含有KAS保守结构域,属于condenzymes超蛋白家族。使用Swiss-model对紫苏KAS家族蛋白进行同源建模,结果表明,KASⅠ和KASⅡ三级结构预测基本相似,而KASⅢA和KASⅢB则差异较大(图2),推测可能与KAS家族蛋白在紫苏脂肪酸合成过程中发挥的不同作用有关。


2.4 系统进化树分析
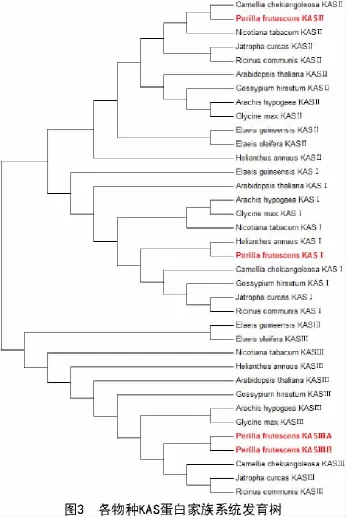
对紫苏(Perilla frutescens)、蓖麻(Ricinus communis)、大豆(Clycine max)、拟南芥(Arabidopsis thaliana)、花生(Arachis hypogaea)、陆地棉(Gossypium hirsutum)、麻风树(Jatropha curcas)、向日葵(Helianthus annuus)、烟草(Nicotiana tabacum)、山茶 花 (Camellia chekiangoleosa)、 油 棕(Elaeis guineensis)、油橄榄(Elaeis oleifera)共12个物种的KAS酶家族使用MEGA 6.0进行序列同源性分析,采用邻接法构建系统进化树。由图3可知,该系统进化树明显分为KASⅠ,KASⅡ,KASⅢ共三大类,其中,紫苏KASⅠ与拟南芥KASⅠ、紫苏KASⅡ与油茶KASⅡ、紫苏KASⅢ与油茶KASⅢ亲缘关系最近,紫苏与油棕、油棕榈KAS酶家族亲缘关系较远,该结果为后续进一步通过转基因技术鉴定紫苏KAS基因家族功能奠定了一定的理论基础。
3 讨论与结论
LIU等[11]对棉花的研究表明,通过RNAi沉默降低KASⅡ活性,使棕榈酸含量显著提高,达到总脂肪酸的65%。迄今为止,麻风树[12]、豌豆[13]、向日葵[14]等的KASⅢ基因都已被克隆。VERWOERT等[15]对油菜中超表达大肠杆菌KASⅢ基因研究发现,油菜中C18∶2和C18∶3脂肪酸含量增加,C18∶1脂肪酸含量则减少。紫苏籽油中含有多种不饱和脂肪酸,如棕榈酸(16∶0)、硬脂酸(18∶0)、油酸(18∶1)、亚油酸(18∶2)和α-亚麻酸(18∶3)[16-17],其中,α-亚麻酸为人体所必需的脂肪酸,具有降低胆固醇、提高智力、延缓衰老等重要作用。
本研究对紫苏KAS酶家族蛋白进行了详细的生物信息学分析,结果表明,紫苏KAS家族蛋白都属于疏水性脂溶蛋白,除KASⅢB蛋白外都为稳定蛋白,不含信号肽,因此,推测该家族蛋白为非分泌型蛋白。紫苏KAS家族蛋白二级结构组成相似,各组分含量稍有差异,功能结构域分析表明,KAS家族蛋白都含有KAS保守结构域,属于cond-enzymes超蛋白家族。对紫苏等11个物种的33条KAS蛋白序列进行系统进化树分析,结果表明,紫苏KASⅠ与拟南芥KASⅠ、紫苏KASⅡ与油茶KASⅡ、紫苏KASⅢ与油茶KASⅢ亲缘关系最近,紫苏与油棕、油棕榈KAS酶家族亲缘关系较远,进一步揭示了KAS家族酶在油料作物脂肪酸合成中功能的相似性,为更深入探究KAS家族酶在紫苏脂肪酸合成过程中的作用奠定了理论基础。
[1]张丽萍,杨建雄.生物化学简明教程[M].4版.北京:高等教育出版社,2009:274-276.
[2]孙颖,卢彰显,李建安.中国油桐栽培利用与应用基础研究进展[J].经济林研究,2007,25(2):84-87.
[3]ANDER S C,SAMUEL T L,ANTHONY J K,et al.A KAS2 cDNA complements the phenotypes of the Arabidopsis fab1 mutant that differs in a single residue bordering the substrate binding pocket[J]. The Plant Journal,2002,29(6):761-770.
[4]陈明娜,禹山林,杨庆利,等.花生β-酮脂酰-ACP合成酶Ⅱ基因的克隆与表达分析 [C]//科技部863计划现代农业技术领域办公室.全国植物分子育种研讨会摘要集.北京:科技部863计划现代农业技术领域办公室,2009.
[5]RIE Y,PENNYV WETTSTEIN-KNOWLES,HAJIME W.Identification and molecular characterization ofthe-Ketoacyl- [Acy 1 Carrier Protein]synthase component of the Arabidopsis mitochondrial fatty acid synthase [J].The Journal of Biological Chemistry,2004,279(9):8242-8251.
[6]彭小平,熊劲松.我国紫苏产业研究现状与展望[J].安徽农业科学,2010,38(16):8709-8711.
[7]CHOI K H,HEATH R J,ROCK C O.P-Ketoacyl-acyl carrier protein synthase III(FabH)is a determining factor in branched-chain fatty acid biosynthesis[J].J Bacteriol,2000,182(2):365-370.
[8]ABBADI A,BRUMMEL M,SCHXITT B S,et al.Reaction mechanism of recombinant 3-oxoacyl-(acy 1-carrier-protein)synthase III from cuphea wrightii embryo,a fatty acid synthase type II condensing enzyme[J].Biochem J,2000,345(1):153-160.
[9]BRIICK F M,BRUMMEL M,SCHUCH R,et al.In vitro evidence for feed-back regulation of β-ketoacyl-acyl carrier protein synthase III in medium-chain fatty acid biosynthesis [J].Planta,1996,198:271-278.
[10]DEHESH K,TAI H,EDWARDS P,et al.Overexpression of 3-ketoacyl-acyl-carrier protein synthase Ill in plants reduces the rate of lipid synthesis[J].Plant Physiol,2001,125(2):1103-1114.
[11]LIUQ,WUM,ZHANGBL,et al.Genetic enhancement ofpalmitic acid accumulation in cotton seed oil through RNAi down-regulation of ghKAS2 encoding β-ketoacyl-ACP synthaseⅡ(KASⅡ)[J]. Plant Biotechnology Journal,2016,24(4):1-12.
[12]LI J,LI M R,WU P Z,et al.Molecular cloning and expression analysis of a gene encoding a putative beta-ketoacyl-acyl carrier protein(ACP)synthase III(KAS III)from jatropha curcas[J]. Tree Physiol,2008,28(6):921-927.
[13]JONES A L,GANE A M,HERBERT D,et al.Beta-ketoacyl-acyl carrier protein synthase III from pea(Pisumsativum L.):properties,inhibition by a novel thiolactomycin analogue and isolation ofa cDNA clone encoding the enzyme[J].Planta,2003,216(5):921-927.
[14]GONZALEZ-MELLADO D,von WETTSTEIN-KNOWLES P,GARCES R,et al.The role of beta-ketoacyl-acyl carrier protein synthase III in the condensation steps of fatty acid biosynthesis in sunflower[J].Planta,2010,231(6):1277-1289.
[15]VERWOERTⅡ,VAN DER LINDEN K H,WALSH M C,et al. Modification of Brassica napus seed oil by expression of the Escherichia coli fabH gene,encoding 3-ketoacyl-acyl carrier protein synthaseⅢ[J].Plant Mol Biol,1995,27(5):875-886.
[16]张洪,黄建韶,赵东海.紫苏营养成分的研究[J].食品与机械,2006,22(2):41-43.
[17]NITTAM,KOBAYASHI H,OHNISHI-KAMEYAMA M.Essential oil variation of cultivated and wild perilla analyzed by GC/MS[J]. Biochemical Systematics and Ecology,2006,34(1):25-37.
声明
本刊已许可中国学术期刊(光盘版)电子杂志社在中国知网及其系列数据库产品中以数字化方式复制、汇编、发行、信息网络传播本刊全文。该社著作权使用费与本刊稿酬一并支付。作者向本刊提交文章发表的行为即视为同意我部上述声明。
《山西农业科学》编辑部
Bioinformatics Analysis of β-ketoacyl-acyl Carrier Protein Synthase Gene Family in Perilla frutescens
LI Lu,LIANGQian,ANXi,ZHOUYali,WANGJiping
(College ofAgronomy,Shanxi Agricultural University,Taigu 030801,China)
Perilla frutescens is a new oil crop containing all kinds ofunsaturated fatty acids in its seeds oil.The oil contains higher level of α-linolenic acid,up to 61.2%.β-ketoacyl-acyl carrier protein synthase gene family plays an important role in fatty acid synthesis in plant.In this study,the KAS family proteins were analyzed with bioinformatics tools.The results showed that KASⅡgene encoded the maximum number of amino acids,but KASⅢB was the least in perilla KAS family proteins.All of them were hydrophobic lipid soluble proteins without signal peptide.Thus,the protein family was predicted as non-secretory proteins.KAS protein family contained KAS conserved domain,belonging to the cond-enzymes super protein family,the secondary structure elements were similar. Phylogenetic tree analysis showed that PfKA SⅠhad close relationship with AtKASⅠ,PfKAS II and PfKAS III had the close genetic relationship comparing with CoKASⅡand CoKASⅢ,respectively.They had the farther genetic relationship with other species.These results provided a foundation for further illustration ofthe fatty acid synthesis mechanism in Perilla frutescens.
Perilla frutescens;β-ketoacyl-acyl carrier protein synthase;bioinformatics analysis
S565.9
A
1002-2481(2017)03-0321-04
10.3969/j.issn.1002-2481.2017.03.01
2016-12-12
国家自然科学基金项目(31201266)
李 璐(1992-),女,山西灵石人,在读硕士,研究方向:紫苏油脂代谢机理。王计平为通信作者。

