Rab11-FIP4对结肠癌细胞生物学特性的影响
杨守醒,俞耀军,王建嶂,郑波,薛战雄,徐昌隆
(温州医科大学附属第二医院育英儿童医院,浙江 温州 325027,1.消化内科;2.胃肠外科)
Rab11-FIP4对结肠癌细胞生物学特性的影响
杨守醒1,俞耀军2,王建嶂1,郑波1,薛战雄1,徐昌隆1
(温州医科大学附属第二医院育英儿童医院,浙江 温州 325027,1.消化内科;2.胃肠外科)
目的:探讨Rab11-FIP4的表达变化对结肠癌细胞生物学特性的影响。方法:采用结肠癌细胞株HCT116转染Rab11-FIP4特异性siRNA干扰Rab11-FIP4表达。用Western blot实验检测干扰效率。运用CCK-8实验和Transwell实验分别检测干扰Rab11-FIP4对结肠癌细胞株HCT116增殖和运动能力的影响。结果:siRNA转染使Rab11-FIP4表达量从100.2±21.5降低至23.5±5.8,差异有统计学意义(P<0.01)。干扰Rab11-FIP4后结肠癌细胞株HCT116的体外增殖明显下降,第2天的抑制率为29.40%,差异无统计学意义(P<0.05),第3天的抑制率为37.65%,差异有统计学意义(P<0.05),结肠癌细胞的迁移数从193.4±22.1降至113.9± 12.7,差异有统计学意义(P<0.05),细胞侵袭数从113.3±16.7降至66.5±6.7,差异有统计学意义(P<0.05)。结论:干扰Rab11-FIP4的表达能抑制结肠癌细胞的体外增殖、迁移和侵袭能力,Rab11-FIP4可能在结肠癌的进展中发挥重要作用。
Rab11-FIP4;结肠肿瘤;RNA,小分子干扰;细胞增殖;细胞运动;肿瘤侵润
Rab11-FIP4(Rab11-family interacting protein 4)是小G蛋白Rab11相互作用蛋白家族(Rab11 family interacting proteins,Rab11-FIPs)中的一员,其C末端含有一个同源的Rab11结合区(Rab11 binding domain,RBD),属于第二类Rab11-FIPs亚家族[1]。Rab11-FIP4主要定位于细胞内的再循环内体、高尔基体反面网状结构,其与Rab11结合后参与调控胞内囊泡运输和胞质的分裂过程。近期有研究显示,Rab11-FIP4可通过调控mTOR/PRAS40信号通路影响细胞性肝癌的进展[2]。但迄今关于Rab11-FIP4在结肠癌中的表达及其作用尚未见报道。
本研究检测结肠癌细胞株HCT116中Rab11-FIP4的表达,随后转染Rab11-FIP4特异性siRNA干扰其表达,检测干扰效率,并运用Cell counting kit-8(CCK-8)实验和Transwell实验分别检测干扰后对结肠癌细胞株HCT116增殖、迁移和侵袭能力的影响,以探讨Rab11-FIP4在结肠癌中的作用。
1 材料和方法
1.1 材料 结肠癌细胞株HCT116购自中国科学院细胞库,高糖DMEM(Dulbecco’s modified eagle’s medium)培养基购自美国Gibco公司,胎牛血清(FBS)购自美国Gibco公司,siRNAs购自上海拓然生物公司,CCK-8试剂盒购自日本Dojindo公司,Transwell小室购自美国BD Biosciences公司,Matrigel基质胶购自美国BD Biosciences公司。
1.2 方法
1.2.1 细胞培养:结肠癌细胞株HCT116用含10% FBS、100 ng/mL链霉素、100 U/mL青霉素的DMEM培养液于5% CO2和37 ℃条件下培养,细胞生长至80%~90%融合度时进行传代。
1.2.2 Western blot实验:生长状态良好的细胞加入细胞裂解液,置冰上裂解细胞,用细胞刮刀收集细胞裂解液,4 ℃ 12 000 r/min离心后收集上清备用。配制SDS-聚丙烯酰胺分离胶,各泳道加入等量蛋白样品,用Electrophoresis power supply(Bio-Rad)电泳仪进行电泳。蛋白转膜后,将转印有蛋白质的硝酸纤维素滤膜在适量的封闭液中室温封闭。一抗杂交液4 ℃孵育过夜。次日用含0.02% Tween-20的PBS室温漂洗滤膜,加入以封闭液配制的辣根过氧化物酶(HRP)标记的相应二抗的杂交液,室温下在平稳摇床上孵育。使用SuperSignal West Pico化学发光试剂盒进行检测。
1.2.3 siRNA转染实验:转染前1 d,接种适当数量的细胞至6孔板中,每孔中加入不含抗生素的培养基。siRNA转染干扰Rab11-FIP4为实验组,未进行siRNA转染为对照组。siRNA转染实验步骤如下:①用200 μL不含FBS培养基Opti-MEM稀释5 μL的siRNA储存液(20 mmol/L),轻轻混匀,室温孵育5 min;②用200 μL不含FBS培养基Opti-MEM稀释5 μL lipo2000,轻轻混匀并室温孵育5 min;③将两者轻轻混匀,室温孵育20 min;④将siRNA-lipo2000混合液加入细胞密度为30%~50%的6孔板内,同时加入400 μL无FBS培养基,轻轻混匀;⑤培养约6 h后,弃去孔内含siRNA-lipo2000混合液的培养基;⑥更换完全培养基,将6孔板置于37 ℃的CO2培养箱中培养;⑦转染完成后48~72 h进行siRNA沉默效果检测和细胞功能检测。
1.2.4 CCK-8实验:96孔板每孔种植4 000个细胞,培养0、24、48、72 h后每孔加入10 μL CCK-8试剂,37 ℃孵育2 h,检测450 nm波长吸收值。分别对实验组和对照组进行检测。
1.2.5 Transwell实验:①细胞迁移实验:Transwell内室接种200 μL细胞悬液(含50 000个细胞),每个Transwell外室中加800 μL含20%~30% FBS的DMEM培养基,37 ℃培养24~48 h。取出小室后,弃去内室的残余培养基,并用棉签擦净内室滤膜上的细胞,用含0.1%结晶紫和20%甲醇的PBS对小室染色30 min。用棉签擦净小室内表面和滤膜,倒置显微镜下观察小室滤膜上的细胞并计数(200×倍镜下随机选择5个视野并计数),同类实验至少重复3次。②细胞侵袭实验:提前将贮存于-20 ℃的Matrigel基质胶置于4 ℃解冻,当其由凝固状态变为液态时,用预冷的无血清DMEM将Matrigel基质胶按1:6比例混合置于冰上备用;取80 μL稀释好的Matrigel基质胶均匀铺在Transwell小室内膜上,37 ℃放置约4 h,确保去凝成胶体。其余实验过程同细胞迁移实验。以上实验分别对实验组和对照组进行检测。
1.3 统计学处理方法 应用SPSS12.0软件进行统计学分析。所有计量资料用±s表示,采用独立样本t检验进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 siRNA转染后Rab11-FIP4的表达情况 Western blot结果显示,实验组siRNA转染后Rab11-FIP4的产物条带灰度明显低于对照组,Rab11-FIP4表达从100.2±21.5降低至23.5±5.8,差异有统计学意义(P<0.01),见图1。
2.2 干扰Rab11-FIP4抑制结肠癌细胞的体外增殖能力 CCK-8实验显示,干扰Rab11-FIP4的表达后,结肠癌细胞株HCT116的体外增殖明显下降,第2天的抑制率为29.40%,差异无统计学意义(P>0.05),第3天的抑制率为37.65%,差异有统计学意义(P<0.05),见图2。
2.3 干扰Rab11-FIP4抑制结肠癌细胞的体外迁移和侵袭能力 细胞迁移实验结果显示,干扰Rab11-FIP4后,结肠癌细胞的迁移数从193.4±22.1降至113.9±12.7,差异具有统计学意义(P<0.05),见图3A。细胞侵袭实验结果显示,干扰Rab11-FIP4后细胞侵袭数从113.3±16.7降至66.5±6.7,差异有统计学意义(P<0.05),见图3B。
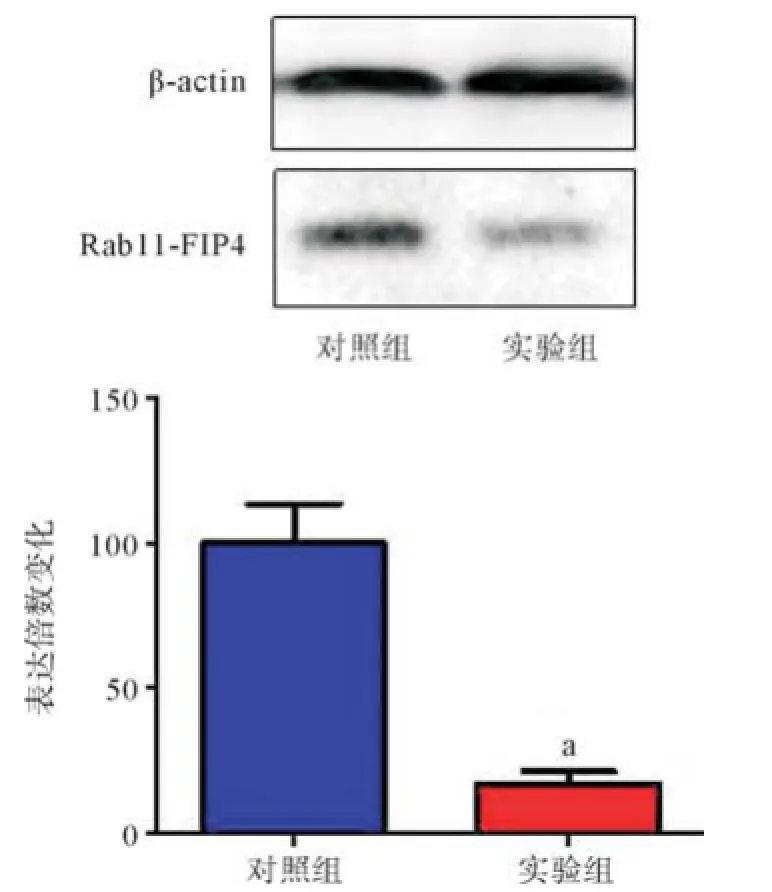
图1 Western blot检测siRNA转染后Rab11-FIP4的表达变化

图2 CCK-8实验分析细胞增殖变化
3 讨论

图3 Transwell实验检测干扰Rab11-FIP4后细胞迁移和侵袭能力的变化(×200)
癌基因的表达上调或抑癌基因的缺失是驱动肿瘤侵袭和远端转移的关键因素,而在绝大多数类型的肿瘤(包括结肠癌)中转移是导致肿瘤相关死亡的主要原因[3]。由于转移的存在,手术切除和药物治疗后结肠癌患者的存活率依然很低[4]。迄今,参与调控结肠癌转移过程的关键机制尚未阐明。有研究显示,过表达Rab11-FIP4可以促进肝癌细胞的体外运动侵袭能力以及体内的转移能力[2]。但关于Rab11-FIP4在其他类型实体瘤中是否有同样的功能尚不清楚。本实验通过转染特异靶向性siRNA干扰Rab11-FIP4的表达可显著抑制结肠癌细胞株HCT116的体外增殖、迁移和侵袭能力,提示Rab11-FIP4在结肠癌的进展中发挥重要作用。
Rab11是Rab小分子GTP酶家族的一个亚家族成员,活化状态的Rab11与GTP结合,通过识别其效应分子从而执行各种功能。执行完功能后Rab11在GTP酶激活蛋白(GTPase-activating protein,GAP)的参与下水解GTP进而转变为无活性的Rab11-GDP[1]。Rab11的生物学功能主要包括调节再循环内体的形成与运输,调控细胞膜受体和黏附分子的循环再利用过程,如AMPA受体、EGF受体、Toll样受体4、α5β1整合素、E-cadherin和N-cadherin等[5-7]。Rab11-FIPs蛋白家族成员的特点是它们的C末端含有一个同源的RBD,RBD能够高度特异地识别Rab11-GTP。有多项研究结果显示,Rab11-FIPs可以与Rab11相互作用,如FUKUDA等[8]报道Rab14和Rab11-FIP2相互作用,LALL等[9]研究发现所有的Rab11成员均可以与Rab14和I型FIPs(RCP、FIP2和Rip11)相互作用。此外,Rab11-FIP2、Rab11-FIP2以及Rab11可以形成复杂的复合体结构[10-12]。有研究显示,Rab11-FIP4不仅其C末端含有一个同源的Rab11结合区,其N末端还具有特征性的EF hand和脯氨酸富含区[13]。迄今Rab11-FIP4在结肠癌中的作用是否通过Rab11尚待深入研究。有研究报道,在肝癌中缺氧微环境可以通过HIF1α上调Rab11-FIP4的表达,然后Rab11-FIP4调控mTOR/PRAS40信号通路影响肝细胞肝癌的进展[2]。另有研究报道,Rab11-FIP4不仅能与Rab11直接结合,还可与小分子GTP酶家族的另一成员Arf6/Arf5结合,参与细胞的膜泡运输过程[14-15]。在结肠癌中,Rab11-FIP4是否也存在类似的调控机制,值得进一步的研究。
[1] WELZ T, WELLBOURNE-WOOD J, KERKHOFF E. Orchestration of cell surface proteins by Rab11[J]. Trends Cell Biol, 2014, 24(7): 407-415.
[2] HU F, DENG X, YANG X, et al. Hypoxia upregulates Rab11-family interacting protein 4 through HIF-1α to promote the metastasis of hepatocellular carcinoma[J]. Oncogene, 2015, 34(49): 6007-6017.
[3] CHRISTOFORI G. New signals from the invasive front[J]. Nature, 2006, 441(7092): 444-450.
[4] VATANDOUST S, PRICE T J, KARAPETIS C S. Colorectal cancer: Metastases to a single organ[J]. World J Gastroenterol, 2015, 21(41): 11767-11776.
[5] SCHAFER J C, MCRAE R E, MANNING E H, et al. Rab11-FIP1A regulates early trafficking into the recycling endosomes[J]. Exp Cell Res, 2016, 340(2): 259-273.
[6] RAMEL D, WANG X, LAFLAMME C, et al. Rab11 regulates cell-cell communication during collective cell movements[J]. Nat Cell Biol, 2013, 15(3): 317-324.
[7] JING J, PREKERIS R. Polarized endocytic transport: the roles of Rab11 and Rab11-FIPs in regulating cell polarity[J]. Histol Histopathol, 2009, 24(9): 1171-1180.
[8] FUKUDA M, KANNO E, ISHIBASHI K, et al. Large scale screening for novel rab effectors reveals unexpected broad Rab binding specif city[J]. Mol Cell Proteomics, 2008, 7(6): 1031-1042.
[9] LALL P, LINDSAY A J, HANSCOM S, et al. Structure-Function analyses of the interactions between Rab11 and Rab14 small GTPases with their shared effector rab coupling protein (RCP)[J]. J Biol Chem, 2015, 290(30): 18817-18832.
[10] EATHIRAJ S, MISHRA A, PREKERIS R, et al. Structural basis for Rab11-mediated recruitment of FIP3 to recycling endosomes[J]. J Mol Biol, 2006, 364(2): 121-135.
[11] JAGOE W N, LINDSAY A J, READ R J, et al. Crystal structure of rab11 in complex with rab11 family interacting protein 2[J]. Structure, 2006, 14(8): 1273-1283.
[12] SHIBA T, KOGA H, SHIN H W, et al. Structural basis for Rab11-dependent membrane recruitment of a family of Rab11-interacting protein 3 (FIP3)/Arfophilin-1[J]. Proc Natl Acad Sci U S A, 2006, 103(42): 15416-15421.
[13] HORGAN C P, MCCAFFREY M W. The dynamic Rab11-FIPs[J]. Biochem Soc Trans, 2009, 37(5): 1032-1036.
[14] FIELDING A B, SCHONTEICH E, MATHESON J, et al. Rab11-FIP3 and FIP4 interact with Arf6 and the exocyst to control membrane traff c in cytokinesis[J]. EMBO J, 2005, 24(19): 3389-3399.
[15] D’SOUZA-SCHOREY C, CHAVRIER P. ARF proteins: roles in membrane traff c and beyond[J]. Nat Rev Mol Cell Biol, 2006, 7(5): 347-358.
(本文编辑:贾建敏)
The influence of Rab11-FIP4 in cytological characteristics of colorectal cancer
YANG Shouxing1, YU Yaojun2, WANG Jianzhang1, ZHENG Bo1, XUE Zhanxiong1, XU Changlong1.
1.Department of Gastroenterology, the Second Aff liated Hospital & Yuying Children’s Hospital of Wenzhou Medical University, Wenzhou, 325027; 2.Department of Gastrointestinal Surgery, the Second Aff liated Hospital & Yuying Children’s Hospital of Wenzhou Medical University, Wenzhou, 325027
Objective:To investigate the effects of Rab11-FIP4 on cytological characteristics of colorectal cancer (CRC).Methods:Western blot was used to detect the expression of Rab11-FIP4 in CRC cell line HCT116, which was transfected with siRNAs that specifically targeting Rab11-FIP4. Proliferation and migration of HCT116 cells were analyzed by CCK-8 assay and Transwell assay.Results:Rab11-FIP4 by siRNA transfection expressing in 100.2±21.5 reduced to 23.5±5.8 (P<0.01). Interference Rab11-FIP4, CRC cell line HCT116 in vitro, proliferation decreased obviously, the second day of the inhibition rate was 29.40%, the inhibition rate of 37.65% on the third day (P<0.05), number of cells migrating from 193.4±22.1 to 113.9±12.7 (P<0.05) and cell invasion number from 113.3±16.7 to 66.5±6.7 (P<0.05).Conclusion:Knockdown of Rab11-FIP4 signif cantly inhibits proliferation, migration and invasion of CRC cells in vitro, indicating its important role in CRC progression.
Rab11-FIP4; colonic neoplasms; RNA, small interfering; cell proliferation; cell movement; neoplasm invasiveness
R735.3
A
10.3969/j.issn.2095-9400.2017.03.004
2016-11-07
浙江省自然科学基金资助项目(LY16H160055);温州市科技计划项目(Y20150156)。
杨守醒(1992-),男,浙江温州人,硕士生。
徐昌隆,副主任医师,副教授,硕士生导师,Email: xchlong@163.com。

