核桃青皮粗提物诱导KYSE150食管癌细胞周期阻滞及凋亡
李彩霞,张淑坤,李志刚,司传领
实验研究
核桃青皮粗提物诱导KYSE150食管癌细胞周期阻滞及凋亡
李彩霞1,张淑坤1,李志刚2,司传领3
目的:研究核桃青皮粗提物诱导KYSE150人食管癌细胞周期阻滞和凋亡的作用机制。方法:MTT方法检测核桃青皮粗提物对KYSE150细胞增殖的抑制效果,流式细胞仪检测核桃青皮粗提物对KYSE150细胞周期和细胞凋亡的影响,Western blot检测核桃青皮粗提物引起的细胞周期相关蛋白和凋亡相关蛋白的变化。结果:MTT结果显示,核桃青皮粗提物对KYSE150细胞的增殖抑制呈时间和浓度依赖性,当核桃青皮粗提物浓度为100 μg/mL时,在24 h,48 h和72 h对KYSE150细胞的增殖抑制率分别为(43.69±1.02)%,(88.73±1.32)%和(93.06±2.34)%;流式细胞术结果表明,核桃青皮粗提物诱导KYSE150细胞周期阻滞和凋亡;Western blot结果表明,核桃青皮粗提物通过上调p53,phospho-p53(p-p53)蛋白的表达,下调cyclinD1蛋白的表达,诱导KYSE150细胞周期阻滞在G0/G1期。另一方面,核桃青皮粗提物通过上调Bax蛋白,下调Bcl-2和Caspase-3蛋白的表达,从而诱导细胞凋亡。当核桃青皮粗提物浓度为40 μg/mL时,可上调p53,p-p53,Bax的表达量分别为对照组的(1.8±0.07),(23.6±0.12)和(1.5±0.02)倍,下调cyclinD1,Bcl-2和Caspase-3的表达量分别为对照组的(0.3±0.02),(0.03±0.005)和(0.1±0.01)倍。结论:核桃青皮粗提物可以引发KYSE150细胞周期阻滞在G0/G1期,并且可以通过线粒体途径诱导KYSE150细胞凋亡。
核桃青皮粗提物;KYSE150细胞;增殖;周期;凋亡
食管癌在各类肿瘤的发病率中排名第八,其死亡率在癌症总死亡率中占第四位[1]。近年来,由于化学药物毒副作用较大,限制了在临床上的广泛应用,所以从植物中寻找更安全的抗癌有效成分越来越受人们重视。核桃青皮又称青龙衣,为核桃外部厚厚的一层未成熟的果皮。白桃汤剂为民间抗癌药方,而核桃青皮就是此汤剂的主要成分之一[2]。核桃青皮很久以前就已经被用于治疗不同的疾病,如胃癌、肺癌[3-5]。研究已经证明,核桃青皮的提取物具有很强的抗菌和抗氧化活性[6-7]。我们先前的研究表明,核桃青皮提取物中的粗提取,乙酸乙酯提取物和没食子酸对食管癌KYSE150和EC9706细胞的增殖均有抑制作用,并初步探讨了其可能的作用机制[8]。本研究在之前的基础上,集中探讨核桃青皮粗提物对食管癌细胞KYSE150的增殖抑制作用,以及其对KYSE150细胞周期和凋亡的影响,并且进一步探讨其对细胞周期相关蛋白和凋亡相关蛋白的变化,从而为进一步开发治疗食管癌的中药提取物提供更多的理论根据。
1 材料与方法
1.1 细胞 食管癌细胞株KYSE150(天津医科大学总医院肺癌研究所提供)。用含10%胎牛血清的RPMI 1640培养液于37℃、5%CO2的孵箱中培养细胞,每1~2 d传代1次,取对数生长期的细胞。
1.2 药物 核桃青皮用95%的乙醇萃取4次,风干得到微细粉末即为核桃青皮粗提物。
1.3 主要试剂 胎牛血清(Hyclone)、RPMI-1640培养基(Hyclone)、胰蛋白酶、四甲基偶氮唑盐(MTT)、二甲基亚枫(DMSO)、DNase free RNase(Thermo Fisher)、Annexin V-FITC/PI Apoptosis Detection Kits(北京四正柏生物公司,凋亡试剂盒批号:FXP018,周期试剂盒批号:FXP021)、RIPA细胞裂解液和BCA蛋白定量试剂盒(索莱宝)、一抗兔抗人Caspase 3、小鼠抗人p53和兔抗人p-p53(Santa Cruz),一抗兔抗人Bax,兔抗人Bcl-2,小鼠抗人cyclinD1和兔抗人GAPDH(Cell Signaling)抗体,HRP标记的羊抗兔Ig G二抗,HRP标记的羊抗小鼠Ig G二抗。
1.4 MTT检测细胞增殖情况 将80 mg核桃青皮粗提物溶于1 mL的DMSO中,配成80 mg/mL储存浓度,用时稀释。取对数期生长的KYSE150,以每孔5000个细胞/100 μL密度接种于96孔板中,培养24 h,弃去培养液,分别加入含不同浓度的核桃青皮粗提物的培养液100 μL,浓度分别为5、10、20、30、 40、50、60、80、100 μg/mL,另设对照孔(加培养液100 μL和与溶解药物等量的DMSO),每组设6个复孔。细胞分别培养24、48和72 h后,每孔加入5 mg/mL MTT液10 μL,继续培养4 h,吸去上清,每孔加入DMSO 150 μL,轻轻振荡后用酶标仪检测,570 nm处测各孔吸光值(OD值),计算抑制率,细胞增殖抑制率=(1-实验组OD值/对照组OD值)×100%。重复3次。
1.5 流式细胞仪检测细胞周期的变化 将KYSE150细胞接种于六孔板,密度为3×105/孔,使用不同浓度的核桃青皮粗提物(0、10、20、40 μg/mL)处理,培养24 h后,收集各组全部细胞到15 mL离心管中,预冷的PBS洗2次,然后加入1 mL预冷的70%乙醇4℃固定细胞过夜,再用PBS洗涤2次后收集细胞于流式管,加入预先配置好的含有RNase A和PI的染色液0.4 mL,缓慢并充分重悬细胞沉淀,37℃避光温浴30 min后,用流式细胞仪在激发波长488 nm波长处检测红色荧光,同时检测光散射情况。重复3次。
1.6 Annexin V-FITC/PI双染色法检测细胞的凋亡率 KYSE150细胞分组及加药情况同1.5,24 h后离心收集细胞。以PBS洗涤2次后加入250 μL结合缓冲液重新悬浮细胞于流式管中,再加入5 μL Annexin V/FITC混匀后加入10 μL 120 μg/mL的PI溶液,设置空白对照组和单色对照组。混匀后室温避光孵育15 min,在反应管中加300 μL PBS,混匀后使用流式细胞仪检测细胞凋亡情况。重复3次。
1.7 Western blot检测细胞周期凋亡和细胞凋亡相关蛋白表达情况 分组及加药情况同1.5,孵育24 h,提取各组细胞总蛋白,BCA蛋白定量后,取35 μg蛋白与上样缓冲液混匀,使用SDS-PAGE法对变性后的蛋白进行电泳,转膜后室温封闭2 h,一抗分别为p53(1∶100)、p-p53(1∶100)、cyclin D1(1∶1000)、Caspeas-3(1∶100)、Bax(1∶500)和Bcl-2(1∶500),4℃孵育过夜。使用TBST洗膜5次,二抗羊抗小鼠或羊抗兔(1∶5000)37℃孵育2 h。再用TBST洗膜5次后使用ECL进行显色,随后使用BIO-RAD胶成像仪曝光,检测条带灰度值(蛋白相对表达量=目的条带灰度/内参条带灰度×100%)。
1.8 统计学处理 应用SPSS17.0软件分析统计数据,计量资料符合正态分布,以均数±标准差(±s)表示,采用单因素方差分析法进行组间比较,两两比较采用q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 核桃青皮粗提物对KYSE150细胞增殖的抑制作用 随着核桃青皮粗提物作用时间的延长,KYSE150细胞的增殖受到抑制,且抑制作用呈时间剂量依赖性(见图1A)。对照组KYSE150细胞生长活跃,经核桃青皮粗提物5~100 μg/mL处理48 h后,KYSE150细胞生长逐渐缓慢,增殖抑制率从(0.69± 2.27)%升高至(85.73±1.32)%。核桃青皮粗提物能有效的抑制KYSE150细胞的增殖,与对照组相比有统计学意义(见图1B)。

图1 核桃青皮粗提物对食管癌细胞KYSE150增殖的抑制作用
2.2 核桃青皮粗提物诱导KYSE150细胞周期阻滞在G0/G1期 核桃青皮粗提物对食管癌细胞株KYSE150作用24 h后,与对照组比较,不同浓度的核桃青皮粗提物均使细胞阻滞在G0/G1期的比例升高,同时S、G2/M期比例减少。并且核桃青皮粗提物的浓度越高,阻滞在G0/G1期的细胞比例就越高,(见表1)。
表1 核桃青皮粗提物对食管癌细胞株KYSE150细胞周期的影响(±s,%,n=3)
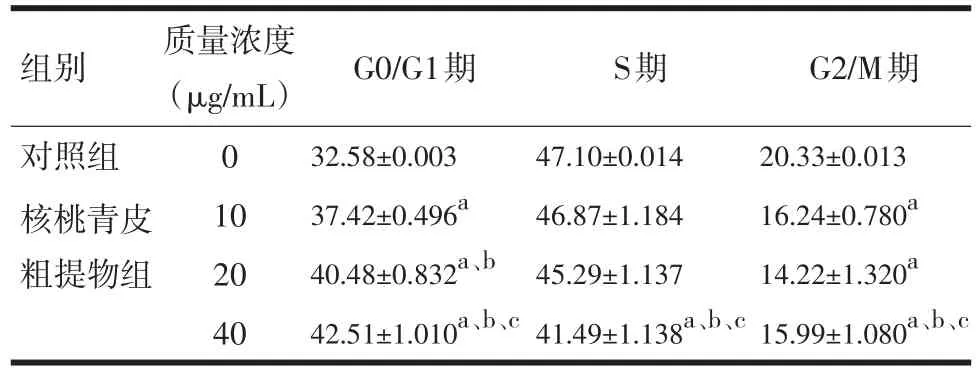
表1 核桃青皮粗提物对食管癌细胞株KYSE150细胞周期的影响(±s,%,n=3)
注:与对照组比较,aP<0.01;与10 μg/mL浓度组比较,bP<0.01;与20 μg/mL浓度组比较,cP<0.01
组别对照组核桃青皮粗提物组质量浓度(μg/mL)0 10 20 40 G0/G1期S期G2/M期32.58±0.003 37.42±0.496a 40.48±0.832a、b 42.51±1.010a、b、c 47.10±0.014 46.87±1.184 45.29±1.137 41.49±1.138a、b、c 20.33±0.013 16.24±0.780a 14.22±1.320a 15.99±1.080a、b、c
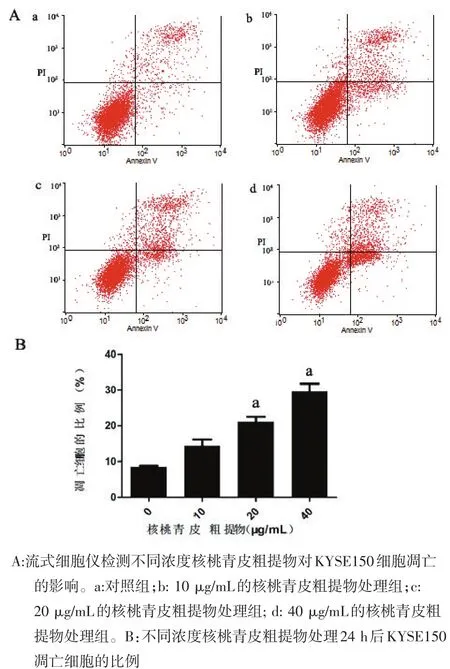
图2 不同浓度核桃青皮粗提物对KYSE150细胞凋亡的影响
2.3 核桃青皮粗提物诱导KYSE150细胞凋亡 不同浓度(10、20、40 μg/mL)的核桃青皮粗提物作用于KYSE150细胞24 h后,细胞早期凋亡率分别为(14.44±2.98)%、(21.07±2.64)%、(29.59±3.75)%,与对照组(8.56±0.44)%相比明显升高(P<0.05)。见图2。 2.4 核桃青皮粗提物对KYSE150中细胞周期相关蛋白p53、p-p53、cyclinD1以及与凋亡相关蛋白Bax、Bcl-2以及Caspase-3表达的影响 使用Western blot法检测p53、p-p53以及G0/G1期周期蛋白cyclin D1的表达情况,发现不同浓度的核桃青皮粗提物作用于KYSE150细胞24h后,p53、p-p53蛋白的表达量随着药物浓度的增加而逐渐增加(P<0.05,图3A,3C),而cyclinD1蛋白的表达量随着药物浓度的增加而逐渐减弱(P<0.05,图3A,3C)。同时,使用Western blot法检测细胞凋亡相关蛋白Bax,Bcl-2以及Caspase-3的表达情况,发现Bax蛋白的表达情况随着核桃青皮粗提物浓度的增加而逐渐增加(P<0.05,图3B,3D),而Bcl-2和Caspase-3蛋白的表达情况随着核桃青皮粗提物浓度的增加而逐渐减弱(P<0.05,图3B,3D)。
3 讨论
核桃植株全身都是宝,除其果仁可食用外,核桃青皮、核桃壳、核桃叶等均可入药,而且采集方便,具有消热、解毒、抗癌、镇痛等作用。核桃青果皮又称青龙衣为核桃楸和核桃的未成熟外果皮。自《山东中草药手册》称之为“青龙衣”后,现多延用此名称。辛、苦、涩、平,有清热解毒、祛风疗癣、止痛止痢的功效,具有广泛的药用价值,特别是其抗癌活性,越来越受到重视。文姝等[9]以Western Blot方法检测青龙衣提取液作用后的白血病K526细胞的p53、p21蛋白表达,结果p53、p21蛋白表达量均有增加,从而抑制周期蛋白依赖性激酶活性,使细胞停滞于G1期。徐巍等[10]研究表明青龙衣可显著抑制人肝癌SMMC-7721细胞生长、繁殖,且与作用时间、剂量呈明显相关性。但核桃青皮粗提物对食管癌的抗肿瘤作用未见报道。本实验研究发现,核桃青皮粗提物可有效的抑制食管癌细胞株KYSE150的细胞增殖,并且呈浓度和时间依赖性。本实验旨在研究核桃青皮粗提物抑制KYSE150细胞增殖并且诱导其细胞凋亡的机制,为探究核桃青皮开发为抗食管癌药物提供实验基础和依据。
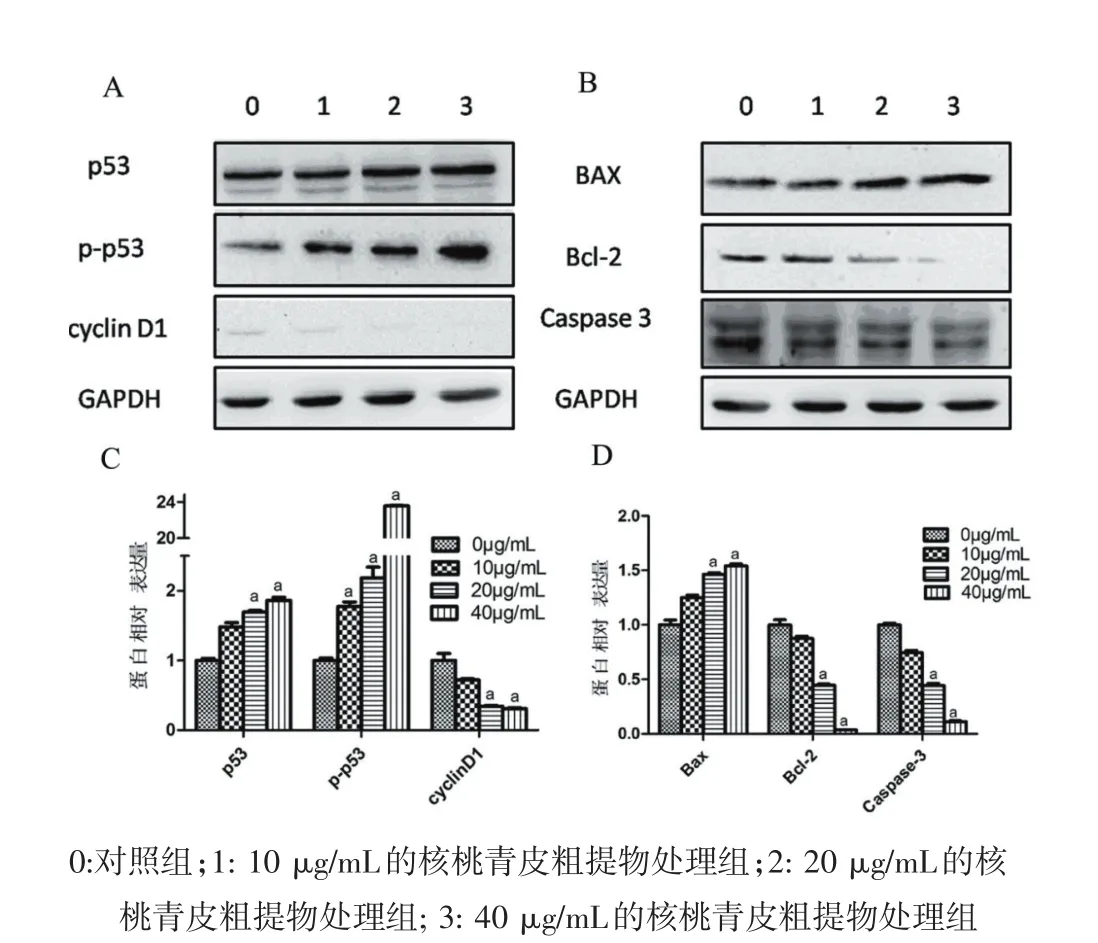
图3 核桃青皮粗提物对KYSE150细胞p53,p-p53,cyclinD1,Bax,Bcl-2以及Caspase-3蛋白表达的影响
我们研究发现,核桃青皮粗提物处理KYSE150细胞24 h,可以以浓度依赖性的方式使细胞周期阻滞在G0/G1期并伴随着S期的减少。表明细胞持续性的有丝分裂无法通过G1期到达S期,这种细胞周期阻滞是通过增加p53和p-p53蛋白的表达,并降低细胞周期蛋白cyclinD1的表达来实现的。p53则通过调节其下游效应基因CIP/WAF1、GADD45和MDM2的转录而使得细胞周期阻滞在G0/G1期,CIP/ WAF1表达的产物为p21蛋白,p21的表达是引起G0/G1期阻滞的直接原因[11-12]。p21与细胞周期蛋白家族、周期蛋白依赖性激酶(cyclin-dependent kinase,CDK)家族、增殖细胞细胞核抗原(proliferating cell nuclear antigen,PCNA)构成复合物。抑制复合物中的激酶活性,引起其底物成视网膜母细胞瘤蛋白(retinoblastoma protein,RB)的去磷酸化,阻止转录因子E2F释放,使参与与细胞增殖有关蛋白如cyclinD1、cyclinE、PCNA等不能表达,阻滞细胞从G1期进入S期,导致G0/G1期阻滞[13]。
目前细胞凋亡主要通过两条信号通路:通过调控Caspase-9起作用的线粒体凋亡通路和通过调控Caspase-8起作用的死亡受体通路。线粒体凋亡途径是通过线粒体释放细胞色素C(cyt-c)激活Caspase-9,继而激活Caspase-3形成cleaved-Caspase-3 (c-Caspase-3),从而发挥激活Ploy(ADP-ribose)polymerase(PARP)作用[14-15]。一旦PARP被激活,其将发挥“死亡基质”的作用,最终导致细胞凋亡。本实验结果表明,核桃青皮粗提物降低了Caspase-3酶原的表达。此外,Bcl-2家族在线粒体凋亡途径的调控中也起到重要作用。Bcl-2家族包括抑制和促进细胞凋亡两类功能相反的蛋白质,如Bcl-2抑制凋亡,Bax促进凋亡,并且,Bax上调,Bcl-2下调也会激活Caspase-9和Caspase-3[16]。本实验结果表明,核桃青皮粗提物作用于KYSE150细胞后,能够上调Bax的表达,同时下调Bcl-2的表达。因此,核桃青皮粗提物通过线粒体凋亡途径诱导KYSE150细胞凋亡。
本实验结果发现,核桃青皮粗提物可以引发KYSE150细胞G0/G1周期阻滞,并且可以通过线粒体途径诱导KYSE150细胞凋亡。由此表明,核桃青皮粗提物具有较好的抗食管癌作用,具有广阔的药物研发和临床应用前景。另一反面,现在核桃青皮是核桃生产中产生的大量副产物,其价值一直没有得到充分的开发和利用,而此次我们对其抗食管癌活性的研究,不但能使核桃青皮变废为宝,还能减少环境污染。然而,核桃青皮粗提物阻滞细胞周期和诱导细胞凋亡的信号转导通路,以及各个通路之间的联系有待进一步研究,并且亟需通过体内实验进一步验证核桃青皮粗提物抗食管癌的作用。
[1]Tang WR,Fang JY,Wu KS,et,al.Epidemiological characteristics and prediction of esophageal cancer mortality in china from 1991 to 2012[J].Asian Pac J Cancer Prev,2014,15(16):6929-6934.
[2]欧阳瑾,曹志友,王爽,等.核桃青皮提取物抑制小鼠Lewis肺癌生长的实验研究[J].时珍国医国药,2009,20(11):2749-2750.
[3]Liu Q,Zhao P,Li XC,et,al.New α-tetralone galloylglucosidesfrom the fresh pericarps of Juglans sigillata[J].Helv Chim Acta. 2010,93(2):265-271.
[4]Li XF.Progress of research on the chemical components and pharmaceutical action of walnut green husk[J].Food Sci Technol, 2007,32(4):241-242.
[5]王爽,杨淑艳,欧阳瑾,等,核桃青皮提取物对肺癌细胞生长的影响及意义[J].中国农村卫生事业管理,2015,35(8):1077-1078.
[6]CL Si,J Xu,JZ Jiang.Antibacterial capacity of Juglans sigillata green husks[J].Plant Med,2011,77(12):1418-1418.
[7]CL Si,PP Qin,HY Hu,et al.Low molecular weight extractives from green husks of Juglans sigillata and their antioxidant activities[J].J Biobased Mater Bio.2011,5(2):287-292.
[8]张仲卫,鄢文强,李彩霞,等,核桃青皮提取物对食管癌细胞增殖的抑制作用及其分子机制的探讨[J].中西医结合外科杂志,2014, 20(1):43-46.
[9]文姝,包永明,金礼吉,等.胡桃楸提取液诱导K562细胞凋亡机制的研究[J].中国微生态学杂志,2002,14(06):332-333.
[10]徐巍.青龙衣提取物对人肝癌细胞株抑制作用的实验研究[J].中医药学报,2014,42(5):30-33.
[11]Wang X,Simpson ER,Brown KA,et al.p53:Protection against Tumor Growth beyond Effects on Cell Cycle and Apoptosis[J]. Cancer Res,2015,75(23):5001-5007.
[12]Datta D,Anbarasu K,Rajabather S,et al.Nucleolar GTP-binding Protein-1(NGP-1)Promotes G1 to S Phase Transition by Activating Cyclin-dependent Kinase Inhibitor p21 Cip1/Waf1[J].J Biol Chem.2015,290(35):21536-21552.
[13]Meng F,Qian J,Yue H,et al.SUMOylation of Rb enhances its binding with CDK2 and phosphorylation at early G1 phase[J].Cell Cycle,2016,15(13):1724-1732.
[14]Jie S,Luan S,Zhenhai Z,et al.Reactive oxygen species-mediated mitochondrial pathway is involved in Baohuoside I-induced apoptosis in hunman non-smal cell lung cancer[J].Chem Biol Interact, 2012,199(1):9-17.
[15]Xu W,Guo G,Li J,et al.Activation of Bcl-2-Caspase-9 Apoptosis Pathway in the Testis of Asthmatic Mice[J].PLoS One,2016,11 (3):e0149353.
[16]Luo G,Wang M,Wu X,et al.Long non-coding RNA MEG3 inhibits cell proliferation and induces apoptosis in prostate cancer[J]. Cell Physiol Biochem.2015,37(6):2209-2220.
(收稿:2016-06-08 修回:2017-01-26)
(责任编辑 王 丰 屈振亮)
Extractives of J.sigillata Green Husks Induce Cell Cycle Arrest and Apoptosis in KYSE150 Cells
LICai-xia,ZHANG Shu-kun,LI Zhi-gang,et al.
Institute of Chinese and Western Medicines for Acute Abdominal Diseases,Tianjin Nankai Hospital,Tianjin(300100),China
Objective To explore the mechanisms of extractives of J.sigillata green husks in inducing cell-cycle arrest and apoptosis in esophageal cancer cells(KYSE150). Methods MTT assay was used to detect the rate of cell proliferation inhibition by the extractives of J.sigillata green husks.Flow cytometry assay was used to analyze the cell cycle arrest and apoptosis.Western blot assay was used to analyze expression levels of proteins in cell cycle and apoptosis signaling pathways. Results MTT assay indicated that the proliferation inhibition of extractives of J.sigillata green husks on KYSE150 cells was in time and dose dependent manners. When the concentration of extractives of J.sigillata green husks was 100 μ g/mL,the inhibition rates of KYSE150 cell proliferation were 43.69±1.02%,88.73±1.32%and 93.06±2.34%at 24 h,48 h and 72 h,respectively.Flow cytometry results show that the extractives of J.sigillata green husks caused cycle arrest in G0/ G1 phase via up-regulating p53,phospho-p53 and down-regulating cyclinD1.On the other hand,the extractives of J.sigillata green husks induced apoptosis via increasing the protein expression of Bax and decreasing the protein expression of Bcl-2 and Caspase-3.The expression of p53,p-p53 and Bax were increased 1.8±0.07,23.6 ±0.12 and 1.5±0.02 times compared with the control group respectively,while the expression of cyclinD1, Bcl-2 and Caspase were down-regulated 0.3±0.02,0.03±0.005 and 0.1±0.01 times compared with the control group respectively,when the concentration of extractives of J.sigillata green husks was 40 μ g/mL. Conclusion The extractives of J.sigillata green husks triggered G0/G1 phase arrest in KYSE150 cells.In addition,the extractives of J.sigillata green husks induced apoptosis through the mitochondrial apoptotic pathway.
Extractives of J.sigillata green husks;KYSE150 cell;proliferation;cellcycle;apoptosis.
R735.1
A
1007-6948(2017)02-0151-05
10.3969/j.issn.1007-6948.2017.02.013
天津市卫生局基金项目(2015KY27)
1.天津市中西医结合急腹症研究所细胞及分子生物学实验室(天津 300100)
2.天津市南开医院胸外科(天津 300100)
3.天津科技大学材料科学与化学工程学院(天津 300222)
李志刚,E-mail:zhigli38@hotmail.com

