氯通道在三氧化二砷诱导鼻咽癌细胞凋亡中的作用*
吕瑞玲, 高 宏, 邓志钦, 王海波, 梁协稠, 谭秋蝉, 朱林燕, 王立伟△, 陈丽新△
(暨南大学基础医学院 1生理学系, 2药理学系, 广东 广州 510632 )
氯通道在三氧化二砷诱导鼻咽癌细胞凋亡中的作用*
吕瑞玲1, 高 宏2, 邓志钦1, 王海波2, 梁协稠1, 谭秋蝉1, 朱林燕2, 王立伟1△, 陈丽新2△
(暨南大学基础医学院1生理学系,2药理学系, 广东 广州 510632 )
目的: 探讨氯通道在三氧化二砷(arsenic trioxide, As2O3)诱导人鼻咽癌CNE-2Z细胞凋亡中的作用。方法: 采用流式细胞术检测CNE-2Z细胞经As2O3作用24及48 h的凋亡率;应用膜片钳技术记录As2O3激活的细胞膜电流,并分析其电流特性;采用流式细胞术检测氯通道阻断剂DIDS 对As2O3诱导的CNE-2Z细胞凋亡的抑制作用。结果: (1) 5 μmol/L As2O3能够时间依赖性地诱导的CNE-2Z 细胞凋亡;(2) CNE-2Z细胞外灌流含5 μmol/L As2O3的等渗溶液能够激活一个具有外向整流特征的电流,激活的电流无明显的时间及电压依赖性失活,翻转电位接近氯平衡电位;(3) As2O3激活的电流能够被氯通道阻断剂DIDS 和NPPB 完全抑制,细胞外灌流47% 的高渗溶液能够完全抑制As2O3激活的电流;(4) 氯通道阻断剂DIDS 能够抑制As2O3诱导的CNE-2Z细胞凋亡。结论: As2O3可以激活CNE-2Z细胞的容积敏感性氯通道。氯通道在As2O3诱导的CNE-2Z凋亡中发挥重要作用。
氯通道; 三氧化二砷; 鼻咽癌; 细胞凋亡
三氧化二砷(As2O3)是中药砒霜的主要有效成分,国内外已先后将As2O3应用于其它血液系统肿瘤和实体瘤的治疗,并研究发现其能诱导多种肿瘤细胞凋亡[1-2]。鼻咽癌是中国南方、东南亚一带高发的恶性肿瘤,具有高转移性的特征。放疗是治疗鼻咽癌的基本方法,但放疗后易出现远处转移及局部复发,因此寻找有效的治疗鼻咽癌药物具有重大意义。研究发现经三氧化二砷治疗后,人鼻咽低分化鳞癌细胞CSNE-1小鼠移植瘤发生凋亡和分化现象[3]。将As2O3应用于高分化鼻咽癌细胞CNE- 1 中,研究发现其对CNE-1细胞有明显的放射增敏效应,其机制可能与As2O3使其细胞凋亡增加有关[4],表明As2O3对鼻咽癌具有治疗作用。
氯离子通道是一种重要的阴离子通道,广泛分布于机体的兴奋性和非兴奋性细胞膜,以及各种细胞器的膜性结构中。氯离子通道参与多种生理以及病理生理过程,如细胞增殖、凋亡、容积调节、物质转运、细胞迁移等。我们的研究发现氯离子通道在细胞凋亡中具有重要作用[5-9]。然而,氯离子通道在As2O3诱导的鼻咽癌细胞凋亡之中发挥何种作用,尚缺乏深入的研究。因此,本研究对三氧化二砷进行体外实验研究,观察其对人低分化鼻咽癌细胞凋亡的影响,研究其抗癌机制,探讨氯离子通道在三氧化二砷抗肿瘤中的作用。
材 料 和 方 法
1 细胞
本课题的研究对象为人鼻咽癌上皮细胞株CNE-2Z,由广东医学院病理教研室惠赠后于本室长期保存。复苏细胞后,取第3代生长至对数期时的细胞用于进一步实验。
2 主要试剂
三氧化二砷购于北京双鹜药业股份有限公司,用蒸馏水配制成10 mmol/L的储存溶液。氯通道阻断剂DIDS和NPPB购于Sigma,用二甲基亚砜(dimethyl sulfoxide,DMSO) 配制成100 mmol/L的储存液,使用前用等渗灌流液稀释至100 μmol/L。Annexin V-FITC/PI 双染细胞凋亡试剂盒购自南京凯基生物科技发展有限公司。
3 主要方法
3.1 细胞培养 CNE-2Z细胞用含10 %新生小牛血清、1×105IU/L青霉素和100 mg/L链霉素的RPMI-1640培养液常规培养在37 ℃、饱和湿度、5%、CO2培养箱内。CNE-2Z细胞每隔48 h传代1次。电流记录实验前用0.25%的胰酶消化CNE-2Z细胞制成单细胞悬液,将细胞悬液接种于22 mm的圆形玻片上,置于细胞培养箱内约60 min,待细胞贴壁后即可做膜片钳实验。
3.2 细胞凋亡检测 取对数生长期的细胞,制成细胞悬液,计数后接种于6孔板中,并调整细胞浓度为8.0×107/L,每孔总体积为2 mL,并将细胞置于37 ℃、饱和湿度、5% CO2培养箱中培养过夜。次日加药培养一定时间后,用胰酶消化,将细胞吹打均匀,并收集细胞,1 000 r/min离心 5 min;用冷 PBS 重悬、洗涤、离心 3 次; 用500 μL Binding Buffer 重悬细胞,分别加入 Annexin V-FITC,PI 各 5 μL,室温避光孵育 5~15 min;孵育后 1 h 内使用流式细胞仪(BD)进行检测,FL1通道检测FITC 荧光强度,FL3通道检测PI 荧光强度。
3.3 膜片钳实验
3.3.1 细胞灌流液 等渗灌流液(isotonic solution,渗透压为300 mOsm/L)成分为(mmol/L): 70 NaCl,0.5 MgCl2, 2 CaCl2, 10 HEPES,140 D-mannitol; 高渗灌流液(47% hypertonic solution,渗透压440 mOsm/L),溶液所含成分与等渗液相同,不同的是含D-mannitol 280 mmol/L,其它成分的量与等渗液相同。各成分溶解完全后用冰点渗透压计(Osmomat 030)测定渗透压,用Tris 碱调pH 至7.4。
3.3.2 电极内液 记录氯电流所用电极内液成分为(mmol/L):70 NMDG-Cl, 1.2 MgCl2,1 EGTA,10 HEPES, 140 D-mannitol, 2 ATP。用Tris 碱调pH 至7.25,渗透压调至300 mOsm/L。
3.3.3 全细胞膜片钳记录 用微电极拉制器拉制电极,拉制好的电极灌入电极内液后,微电极尖端的电阻为5~10 MΩ。为了使不同细胞的电流具有可比性,计算电流密度,电流密度的公式为:电流密度(pA/pF)=全细胞电流值(pA)/细胞电容(pF)。实验过程中调节G-SERIS和C-SLOW旋纽补偿电容性电流,其尽可能减少,即电流趋近于方波型时,其补偿值的大小即为该细胞膜电容。用EPC-7膜片钳放大器(HEKA)记录单细胞的全细胞氯电流。用转换器(CED1401)采集电流和电压信号,采样频率为3 KHz。全细胞电压钳制在0、±40以及±80 mV,反复循环,脉冲波宽设置为200 ms,脉冲间隔为4 s。用EPC软件记录并分析数据。
把准备好的细胞玻片用非熔性油脂贴附在灌流槽中,再安装在倒置相差显微镜的载物平台上,全细胞记录方式记录CNE-2Z细胞膜电流。记录等渗下稳定的背景电流约3 min,换5 μmol/L的As2O3胞外灌流,观察并记录激活电流的潜伏期、电流密度等。电流达到峰值并稳定后,加入100 μmol/L的氯通道阻断剂DIDS或NPPB,观察阻断剂对激活电流的影响。计算氯通道阻断剂对As2O3激活电流的抑制率。抑制率的计算公式为:[(Cmax-CIso)-(CBlockers-CIso)]/(Cmax-CIso) ×100%,其中CIso是等渗溶液中细胞的基础电流值,Cmax是As2O3激活的电流最大值,CBlockers是加入阻断剂后的最大效应时的电流值。
4 统计学处理
采用SPSS 13.0 软件进行统计分析,数据均采用均数±标准误(mean±SEM)表示,根据实验情况,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,每项实验至少重复3次,以P<0.05为差异有统计学意义。
结 果
1 As2O3诱导CNE-2Z细胞凋亡
CNE-2Z细胞在含5 μmol/L As2O3的培养基中培养24 h或48 h后,胰酶消化细胞后,用Annexin V-FITC/PI染料双染细胞,使用流式细胞仪检测细胞凋亡。结果显示,5 μmol/L As2O3作用CNE-2Z细胞24 h后,细胞凋亡率为(20.30±0.67)%。5 μmol/L As2O3作用CNE-2Z细胞48 h后,细胞凋亡率为(38.77±2.20)%,见图1。这表明As2O3可诱导CNE-2Z细胞凋亡;As2O3作用CNE-2Z细胞主要导致中、晚期凋亡,以及少量细胞的坏死;As2O3诱导CNE-2Z细胞凋亡具有时间依赖性。
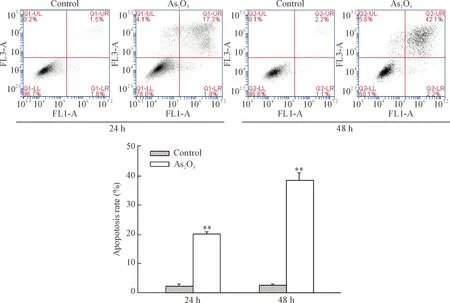
Figure 1.As2O3induced apoptosis of CNE-2Z cells. Mean±SEM.n=3.**P<0.01vscontrol.
图1 As2O3诱导CNE-2Z细胞凋亡
2 As2O3激活CNE-2Z细胞电流
当在细胞外灌流等渗溶液时,细胞的基础电流很小,在+80 mV电压钳制下,细胞的外向电流密度为(3.57±0.47) pA/pF, 在-80 mV电压钳制下,细胞的外向电流密度为(-3.64±0.48) pA/pF。当在细胞外灌流5 μmol/L的As2O3溶液时,可以明显激活一个电流,其潜伏期为(2.45±0.63) min。激活的电流具有明显的外向整流特征,但无明显的时间及电压依赖性失活。外向电流为(38.81±1.72) pA/pF,而内向电流为(-29.26±1.17) pA/pF。该激活电流的翻转电位为(-4.27±1.21) mV,接近本实验条件下氯离子平衡电位的理论值-0.9 mV,提示As2O3激活CNE-2Z细胞的电流为氯电流,见图2。
3 氯通道阻断剂DIDS对氯电流的抑制作用
DIDS是常用的氯通道阻断剂,100 μmol/L的DIDS能够完全抑制5 μmol/L的As2O3激活的电流。在+80 mV电压钳制下,DIDS使细胞的外向电流密度从(39.22±4.04) pA/pF降至(3.17±1.17) pA/pF (P<0.01),抑制率达(101.21±1.33)%;在-80 mV电压钳制下,DIDS使细胞的内向电流密度从(-27.10±1.39) pA/pF降至(-3.40±1.56) pA/pF (P<0.01),抑制率达(97.93±12.90)%,DIDS对内、外向电流的抑制作用无明显的差异,见图3。

Figure 2.As2O3activated currents in CNE-2Z cells. A: the time course of As2O3-activated currents in CNE-2Z cells; B: the current-voltage relationship of As2O3-activated currents in CNE-2Z cells; C: traces of background currents recorded in the isotonic solution (Iso); D: traces of As2O3-activated currents. Cells were clamped at 0, ±40 mV and ±80 mV repeatedly. Mean±SEM.n=15.**P<0.01vsIso.
图2 As2O3激活CNE-2Z细胞电流
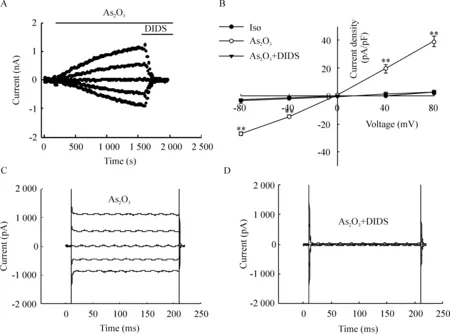
Figure 3.Inhibition of As2O3-induced currents by the chloride channel blocker DIDS. A: the time course of inhibition of As2O3-induced currents by DIDS; B: current-voltage relationship; C: traces of As2O3-induced currents; D: current traces showing inhibition of the currents by DIDS. Mean±SEM.n=5.**P<0.01vsAs2O3+DIDS.
图3 氯通道阻断剂DIDS对氯电流的抑制作用
4 氯通道阻断剂NPPB对氯电流的抑制作用
NPPB也是一种常用的氯通道阻断剂,100 μmol/L的NPPB能够完全抑制5 μmol/L As2O3激活的电流。在+80 mV电压钳制下,NPPB使细胞的外向电流密度从(38.49±3.75) pA/pF降至(2.50±2.14) pA/pF(P<0.01),其抑制率为(104.18±4.72)%;在-80 mV电压钳制下,NPPB使细胞的内向电流密度从(-31.18±3.00) pA/pF降至(-2.85±1.43) pA/pF(P<0.01),其抑制率为(104.26±4.02)%,NPPB对内、外向电流的抑制作用无明显的差异,见图4。

Figure 4.Inhibition of As2O3- induced currents by the chloride channel blocker NPPB. A: the time course of inhibition of As2O3-induced currents by NPPB; B: current-voltage relationship; C: traces of As2O3- induced currents; D: current traces showing inhibition of the currents by NPPB. Mean±SEM.n=5.**P<0.01vsAs2O3+NPPB.
图4 氯通道阻断剂NPPB对氯电流的抑制作用
5 As2O3激活的电流具有容积敏感性
5 μmol/L的As2O3能够激活一个外向优势的电流,当该电流平稳后,稳定灌流含5 μmol/L的As2O3的440 mOsm/L的高渗溶液(Hyper),激活的电流被快速且完全地抑制。在+80 mV电压钳制下,Hyper使细胞的外向电流密度从(37.73±2.11) pA/pF降至(5.50±1.24) pA/pF(P<0.01 ),其抑制率为(94.85±0.79)%;在-80 mV电压钳制下,Hyper使细胞的内向电流密度从(-29.50±1.18) pA/pF降至(-4.93±1.07) pA/pF(P<0.01 ),其抑制率为(96.06±4.17)%,高渗溶液对内、外向电流的抑制作用无明显的差异。在高渗环境下,细胞皱缩,细胞容积变小,导致As2O3激活的氯通道被关闭,提示As2O3激活的电流具有明显的容积敏感性,见图5。
6 氯通道阻断剂DIDS 对As2O3诱导凋亡的抑制作用
为明确氯通道是否参与 As2O3诱导的 CNE-2Z 细胞凋亡,预先用氯通道阻断剂DIDS(100 μmol/L)作用于细胞 25 min,然后换用DIDS(50 μmol/L)和As2O3(5 μmol/L)共同作用于 CNE-2Z 细胞 24 h。结果显示,DIDS 能够显著抑制 As2O3诱导的 CNE-2Z 细胞的凋亡作用,凋亡率从 (20.30±0.67)%下降至 (7.70±1.17)%,与 As2O3组相比,差异有统计学意义(P<0.01)。而单用 50 μmol/L DIDS 组的凋亡率为(2.70±0.31)%,与空白对照组的凋亡率(2.50±0.53)%相比,无显著差异。以上结果提示氯通道参与了 As2O3诱导的 CNE-2Z 细胞凋亡,见图6。
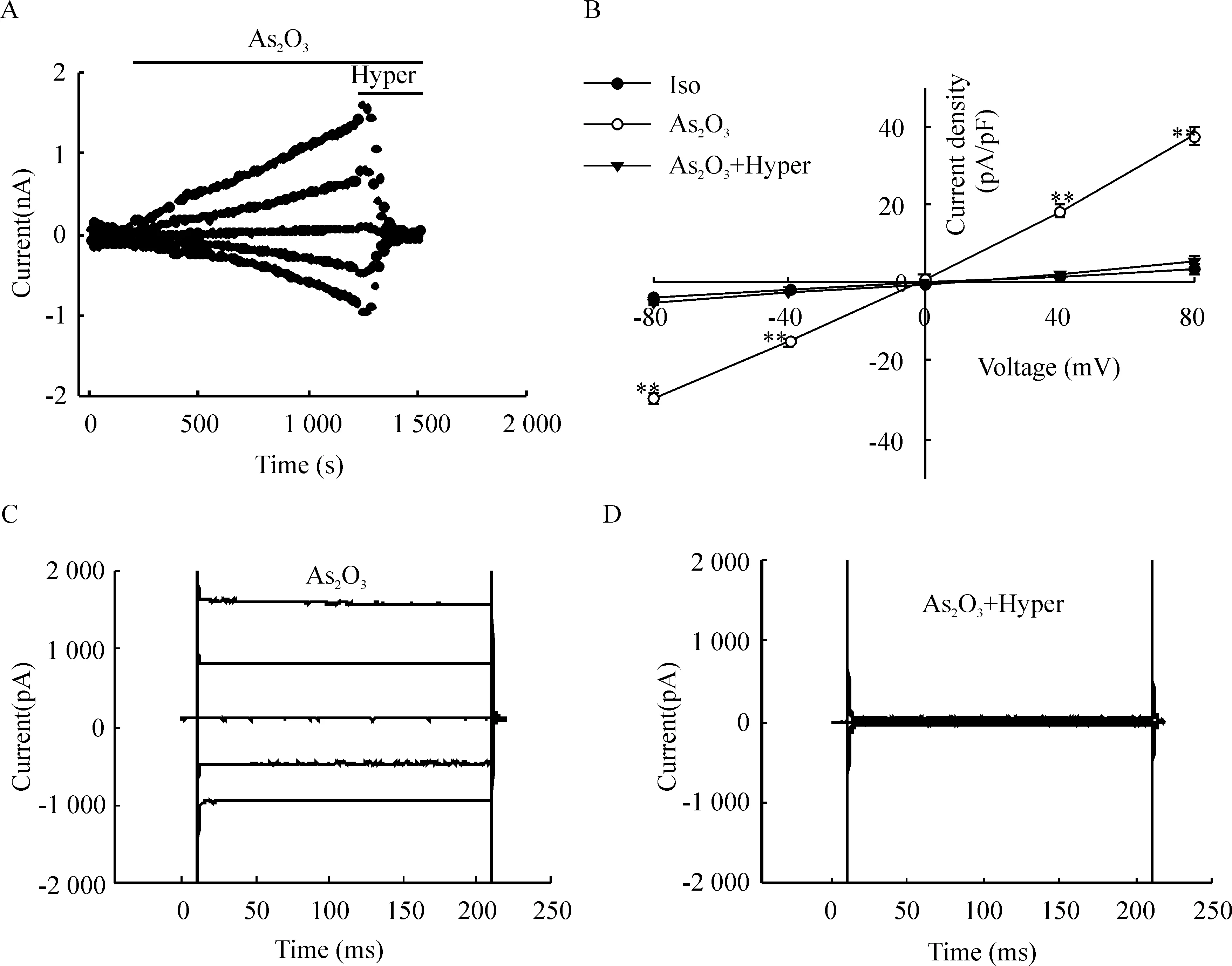
Figure 5.Inhibition of As2O3-induced currents by the 47% hypertonic solution (Hyper). A: the time course of inhibition of As2O3-induced currents by Hyper; B: current-voltage relationships; C: traces of As2O3-induced currents; D: current traces showing inhibition currents by Hyper. Mean±SEM.n=5.**P<0.01vsAS2O3+Hyper.
图5 高渗溶液对氯电流的抑制作用

Figure 6.Attenuation of As2O3-induced apoptosis of CNE-2Z by DIDS. Mean±SEM.n=3.**P<0.01vsAs2O3+DIDS.
图6 氯通道阻断剂DIDS 对As2O3诱导凋亡的抑制作用
讨 论
三氧化二砷作为砒霜的主要有效成分,已成功运用于治疗白血病和某些恶性肿瘤[1, 10-13],如鼻咽癌,前列腺癌,膀胱癌,乳腺癌等。三氧化二砷被广泛应用于肿瘤疾病的临床治疗中,是一种前景乐观的抗肿瘤药物。众多临床研究表明,诱导肿瘤细胞凋亡是三氧化二砷抗癌或抑癌作用的主要作用机制。细胞凋亡指为维持内环境稳定,由基因控制的、细胞自主的、有序的死亡。细胞在发生凋亡的过程中具有明显的形态学改变, 包括细胞膜发泡, 细胞皱缩, 线粒体膜电位下降, 染色体凝聚和DNA片段化等。在凋亡诱导剂诱导癌细胞凋亡的过程中,凋亡早期钾通道和氯通道会被激活,同时伴随水的外流,导致凋亡性容积减小(apoptotic volume decrease, AVD)。应用氯通道阻断剂可以抑制AVD的发生,从而抑制细胞凋亡[14]。我们的前期研究表明,在过氧化氢诱导肾上腺嗜铬细胞瘤 PC12 细胞的凋亡过程[15]以及顺铂[16]、紫杉醇[5]、华蟾酥毒基[6]诱导鼻咽癌 CNE-2Z 细胞凋亡的过程中,氯通道均发挥了重要的作用。但是三氧化二砷对鼻咽癌的抗癌作用是否与氯通道有关,目前尚不清楚。本研究旨在观察三氧化二砷对人低分化鼻咽癌细胞凋亡的影响,研究其抗癌机制,探讨氯离子通道在三氧化二砷抗肿瘤中的作用,加深对三氧化二砷抗癌机制的认识。
本实验结果表明As2O3在体外能够时间依赖性地诱导CNE-2Z细胞凋亡,应用全细胞膜片钳记录模式,直接观察As2O3对CNE-2Z细胞氯通道的影响,结果显示As2O3可以激活CNE-2Z细胞具有外向整流特征的电流,激活的电流无明显的时间及电压依赖性失活,翻转电位接近氯平衡电位,并且该激活电流能够被氯通道阻断剂DIDS 和NPPB 完全抑制,进一步表明As2O3激活的电流为氯电流。细胞外灌流47%的高渗溶液能够完全抑制As2O3激活的电流,表明激活的电流具有容积敏感性。
DIDS 和NPPB皆为常用的有效氯通道阻断剂,并且从膜片钳实验结果可知NPPB对As2O3激活的电流的抑制作用略高于DIDS的抑制作用。为了进一步证实在As2O3诱导CNE-2Z细胞凋亡过程中,氯通道具有重要作用,选取氯通道阻断剂DIDS 与As2O3共同作用于CNE-2Z细胞,通过流式检测细胞凋亡率。结果显示,单纯应用氯通道阻断剂DIDS无诱导细胞毒作用, DIDS 与As2O3共同作用组相比于As2O3处理组细胞凋亡率明显降低,表明氯通道阻断剂DIDS能够有效抑制As2O3诱导的CNE-2Z细胞凋亡,抑制氯通道后能够逆转As2O3对CNE-2Z细胞的凋亡作用,进一步证实在As2O3诱导CNE-2Z细胞凋亡过程中,氯通道具有重要作用。
研究发现As2O3处理CNE-2Z细胞后,调节细胞凋亡的关键基因bax的表达明显增多,而bcl-2的表达无明显变化,CNE-2Z细胞的线粒体膜电位降低[17]。细胞线粒体膜电位的降低表明线粒体膜通透性转运孔的开放,导致线粒体释放caspase活化物,从而引起细胞凋亡[18]。目前研究发现细胞内氯通道家族成员中,只有CLIC4在线粒体上表达,因此也将CLIC4 称之为线粒体细胞内氯通道 (mitochondrial chloride intracellular channel,mtCLIC),高表达CLIC4后可激活caspase,促进细胞的凋亡[19],表明氯通道CLIC4参与了线粒体膜电位的降低,导致caspase的活化和细胞的凋亡,提示As2O3也有可能通过线粒体途径诱导细胞凋亡。此外氯通道在维持细胞正常pH中发挥重要作用,当氯离子通道被过度激活后,细胞内的pH值改变将影响到细胞内的代谢动力学过程,如果与调节细胞增殖、分化和生存相关的信号调节蛋白发生改变或损害,将诱发许多病理生理过程的发生,从而有可能启动或促进细胞的凋亡过程。细胞凋亡过程中会伴有细胞骨架系统的改变,细胞骨架微丝主要由肌动蛋白组装的多聚体和肌动蛋白结合蛋白组成,其组装或解聚与细胞的许多功能活动相关[20],有文献报道,细胞经一定浓度的As2O3处理后,F-actin显著减少,表明As2O3通过改变细胞内的微丝结构从而改变细胞骨架,细胞骨架的改变可降低细胞迁移及黏附能力,使贴壁细胞易于脱落,从而降低肿瘤细胞转移、侵袭和增殖的能力,从而产生抗癌或抑癌的作用[21],我们前期结果表明CNE-2Z细胞经紫杉醇处理后,氯通道蛋白明显增多,细胞膜表面粗糙度增加,提示膜蛋白颗粒聚集,且细胞膜弹性也变差,细胞膜上氯通道表达以及分布改变可能是造成细胞膜物理特性变化的原因之一[5],提示As2O3可能通过影响细胞膜上的氯通道来改变细胞骨架,从而促进细胞凋亡。
综上所述,As2O3能够时间依赖性地诱导CNE-2Z细胞凋亡,能够激活CNE-2Z细胞的容积敏感性氯通道,氯通道阻断剂DIDS 能够抑制As2O3诱导的CNE-2Z细胞凋亡,表明氯通道在As2O3诱导CNE-2Z凋亡中具有重要作用。氯通道如何在As2O3诱导细胞凋亡过程中起作用的,这一问题有待进一步研究。
[1] Seol J, Park W, Kim E, et al. Effect of arsenic trioxide on cell cycle arrest in head and neck cancer cell line PCI-1 [J]. Biochem Biophys Res Commun, 1999, 265(2): 400-404.
[2] Shen Z, Shen J, Cai W, et al. The alteration of mitochondria is an early event of arsenic trioxide induced apoptosis in esophageal carcinoma cells [J]. Int J Mol Med , 2000, 5(2): 155-158.
[3] 王南瑶, 刘 琳. 三氧化二砷抗肿瘤机制及其临床应用新进展[J]. 临床肿瘤学杂志, 2004, 9(6): 660-662.
[4] 谢良喜, 李德锐, 林英城, 等. 三氧化二砷对鼻咽癌离体细胞的放射增敏作用 [J]. 中华放射医学与防护杂志, 2004, 24(3): 240-242.
[5] Zhang H, Li H, Yang L, et al. The ClC-3 chloride channel associated with microtubules is a target of paclitaxel in its induced-apoptosis [J]. Sci Rep, 2013, 3:2615.
[6] Liu J, Zhang D, Li Y, et al. Discovery of bufadienolides as a novel class of ClC-3 chloride channel activators with antitumor activities [J]. J Med Chem, 2013, 56(14): 5734-5743.
[7] Yang Y, Zhang K, Wang Y, et al. Disulfiram chelated with copper promotes apoptosis in human breast cancer cells by impairing the mitochondria functions [J]. Scanning, 2016, 38(6): 825-836.
[8] Ye D, Luo H, Lai Z , et al. ClC-3 chloride channel proteins regulate the cell cycle by up-regulating cyclinD1-CDK4/6 through suppressing p21/p27 expression in nasopharyngeal carcinoma cells [J]. Sci Rep, 2016, 6:30276.
[9] Wei Y, Lin N, Zuo W, et al. Ethanol promotes cell migration via activation of chloride channels in nasopharyn-geal carcinoma cells [J]. Alcohol Clin Exp Res, 2015, 39(8): 1341-1351.
[10]Chow S, Chan J, Fung K. Inhibition of cell proliferation and the action mechanisms of arsenic trioxide (As2O3) on human breast cancer cells [J]. J Cell Biochem, 2004, 93(1): 173-187.
[11]Fei M, Lu M, Wang Y, et al. Arsenic trioxide-induced growth arrest of human hepatocellular carcinoma cells involving FOXO3a expression and localization [J]. Med Oncol, 2009, 26(2): 178-185.
[12]Wang ZY, Chen Z. Acute promyelocytic leukemia: from highly fatal to highly curable [J]. Blood, 2008, 111(5): 2505-2515.
[13]阳东荣, 陈昭典, 单玉喜. 三氧化二砷对激素非依赖性前列腺癌PC-3细胞Caspase-3活性及Survivin基因表达的影响 [J].中华实验外科杂志, 2005, 22(1): 20-22.
[14]范爱辉, 王立伟, 毛建文, 等. 氯通道在顺铂诱导的鼻咽癌细胞凋亡性容积减小中的作用 [J]. 山东医药, 2007, 47(19): 40-42.
[15]Zuo W, Zhu L, Bai Z, et al. Chloride channels involve in hydrogen peroxide-induced apoptosis of PC12 cells [J]. Biochem Biophys Res Commun, 2009, 387(4): 666-670.
[16]阳小雅, 刘 梅, 伍嘉宝, 等. 顺铂激活的低分化鼻咽癌细胞氯电流为非钙激活氯电流 [J]. 中国病理生理杂志, 2009, 25(4): 666-669.
[17]陈扬超, 张月飞, 周克元. 三氧化二砷诱导鼻咽癌CNE-2Z细胞凋亡及其作用机制的初步研究 [J]. 癌症, 2001, 20(10): 1061-1064.
[18]Mignotte B, Vayssiere J. Mitochondria and apoptosis [J]. Eur J Biochem, 1998, 252(1): 1-15.
[19]Fernández S, Sagar M, Cheng C, et al. P53 and tumor necrosis factor α regulate the expression of a mitochondrial chloride channel protein [J]. J Biol Chem, 1999, 274(51): 36488-36497.
[20]Akisaka T, Yoshida H, Inoue S, et al. Organization of cytoskeletal F-actin, G-actin, and gelsolin in the adhesion structures in cultured osteoclast[J]. J Bone Miner Res, 2001, 16(7):1248-1255.
[21]沈志忠, 林志雄, 李曼红, 等.三氧化二砷对鼻咽癌细胞周期和细胞骨架微丝的影响 [J]. 中国耳鼻咽喉头颈外科, 2006, 13(1): 9-12.
(责任编辑: 林白霜, 罗 森)
Role of chloride channels on apoptosis of CNE-2Z cells induced by arsenic trioxide
LÜ Rui-ling1, GAO Hong2, DENG Zhi-qin1, WANG Hai-bo2, LIANG Xie-chou1, TAN Qiu-chan1, ZHU Lin-yan2, WANG Li-wei1, CHEN Li-xin2
(1DepartmentofPhysiology,2DepartmentofPharmacology,SchoolofBasicMedicine,JinanUniversity,Guangzhou510632,China.E-mail:twangliwei@jnu.edu.cn;tchenlixin@jnu.edu.cn)
AIM: To investigate the role of chloride channels in the apoptosis of human poorly differentiated nasopharyngeal carcinoma CNE-2Z cells induced by arsenic trioxide (As2O3). METHODS: The apoptotic rates of CNE-2Z cells induced by As2O3for 24 h or 48 h were monitored by flow cytometry. The technique of whole-cell patch clamp was used to record the currents activated by As2O3in the CNE-2Z cells. The inhibition of As2O3-induced apoptosis by chloride channel blocker DIDS in the CNE-2Z cells was analyzed by flow cytometry.RESULTS: As2O3at 5 μmol/L induced apoptosis of CNE-2Z cells in time-dependent manner. The currents with outward rectification were activated when the cells were exposed to 5 μmol/L As2O3. No obvious time- and voltage-dependent inactivation of the currents was observed. The reverse potential of the currents was close to the equilibrium potential for chloride. The activated currents were inhibited by the chloride channel blockers NPPB and DIDS. The 47% hypertonic solution inhibited the activated currents completely. Chloride channel blocker DIDS inhibited the apoptosis of CNE-2Z cells induced by As2O3.CONCLUSION: As2O3activates volume-sensitive chloride channels, and chloride channels may play an important role in the apoptosis of CNE-2Z cells induced by As2O3.
Chloride channels; Arsenic trioxide; Nasopharyngeal carcinoma; Apoptosis
1000- 4718(2017)04- 0647- 08
2016- 11- 22
2016- 12- 16
国家自然科学基金资助项目 (No. 81272223; No. 81273539);教育部基金项目(No. 20124401110009);广东省科技计划项目(No. 2013B051000059);广东省自然科学基金资助项目(No. 2016A030313495); 高水平大学建设医学团组项目(No. 88015306010; No. 88016013041)
R730.23; R329.25
A
10.3969/j.issn.1000- 4718.2017.04.012
△通讯作者 王立伟 Tel: 020-85226565; E-mail: twangliwei@jnu.edu.cn; 陈丽新 Tel: 020-85228865; E-mail: tchenlixin@jnu.edu.cn

