SLeX对肝癌HepG2细胞迁移和侵袭的影响*
武文娟, 崔 灿, 康品方, 石玉荣, 耿英华
(1蚌埠医学院生化与分子生物学教研室,安徽 蚌埠 233030; 2徐州市中心医院检验科,江苏 徐州 221009;蚌埠医学院第一附属医院 3心血管科, 4血液科,安徽 蚌埠 233004)
SLeX对肝癌HepG2细胞迁移和侵袭的影响*
武文娟1△, 崔 灿2, 康品方3, 石玉荣1, 耿英华4
(1蚌埠医学院生化与分子生物学教研室,安徽 蚌埠 233030;2徐州市中心医院检验科,江苏 徐州 221009;蚌埠医学院第一附属医院3心血管科,4血液科,安徽 蚌埠 233004)
目的: 探讨唾液酸化路易斯寡糖X(sialyl Lewis X, SLeX)在肝癌HepG2细胞中的表达及其对HepG2细胞迁移能力和侵袭能力的影响。方法: 实时荧光定量PCR和Western blot法检测α1,3-岩藻糖基转移酶VII (α1, 3-fucosyltransferase VII, FUT7)在HepG2细胞和L-02细胞中的表达,Western blot及免疫细胞化学染色检测SLeX在HepG2细胞和L-02细胞中表达,应用Transwell小室检测SLeX单克隆抗体封闭后HepG2细胞侵袭和迁移能力的改变。结果: FUT7和SLeX在HepG2细胞中表达,而在L-02细胞中无表达; 0.05、0.5和5 mg/L的SLeX单克隆抗体封闭后,HepG2细胞的迁移率逐渐下降,与对照组相比差异显著(P<0.05),侵袭穿膜细胞数明显少于对照组(P<0.05);SLeX单克隆抗体封闭组间两两比较迁移率与侵袭细胞数的差异均有统计学意义(P<0.05)。结论: SLeX在肝癌HepG2细胞中高表达,与HepG2细胞迁移能力和侵袭能力密切相关。
唾液酸化路易斯寡糖X; 肝细胞癌; HepG2细胞; 细胞迁移; 细胞侵袭
肿瘤细胞和内皮细胞之间的相互作用是一个重要的过程 ,它与肿瘤血管生成和血行转移密切相关,是恶性肿瘤治疗失败的常见原因之一。在此过程中肿瘤细胞与内皮细胞之间的黏附非常重要,有多种黏附分子参与,细胞黏附分子的表达异常或功能丧失在肿瘤的转移过程中有重要作用。唾液酸化路易斯X(sialy Lewis X,SLeX)属于细胞黏附分子家族,作为E-选择素、P-选择素和L-选择素的配体,可以介导肿瘤细胞与内皮细胞的黏附作用[1],使肿瘤细胞穿过血管内皮细胞的基底膜,促使癌细胞转移和扩散。SLeX在多种肿瘤细胞过表达[2],参与并介导肿瘤细胞的血行转移,可能作为肿瘤预后的一个标志物。为了探讨降低或封闭SLeX的表达是否能减少肿瘤细胞的侵袭和转移,本文检测了SLeX及参与SLeX合成的关键酶 α1,3-岩藻糖基转移酶VII(α1, 3-fucosyltransferase VII,FUT7)在肝癌细胞株HepG2及正常肝细胞株L-02中表达差异,并用SLeX单克隆抗体封闭SLeX,观察其对HepG2细胞迁移能力和侵袭能力的影响。
材 料 和 方 法
1 主要材料和试剂
肝癌细胞株HepG2及正常肝细胞株L-02 由本实验诊断中心冻存;DMEM高糖培养基为Gibco产品;胰酶为Life Technologies产品;新生牛血清购自杭州四季青生物制品公司; TRIzol和DEPC购自Invitrogen;PCR试剂盒购自天根公司;Transwell小室为Corning产品;MTT和二甲亚砜(DMSO)购自Sigma;Matrigel基质蛋白和鼠抗人SLeX单克隆抗体为BD产品;FUT7羊抗人多克隆抗体和HRP标记的羊抗鼠IgG购自Santa Cruz。
2 主要方法
2.1 细胞培养 复苏冻存的肝癌细胞株HepG2和正常肝细胞株L-02,37 ℃、饱和湿度、5% CO2条件下用含10%灭活小牛血清的DMEM高糖培养基培养,每隔2~3 d传代1次。取对数生长期细胞用于实验。
2.2 实时荧光定量PCR(RT-qPCR)检测FUT7的mRNA表达 对数生长期HepG2细胞和L-02细胞经胰酶消化,提取总RNA,逆转录合成cDNA,进行荧光定量PCR检测。FUT7的上游引物序列为5’-CCACGATCACCATCCTTG-3’,下游引物序列为5’-AGGCTTCGGTTGGCACTC-3’;GAPDH的上游引物序列为5’-CTCCTCCACCTTTGACGCTG-3’,下游引物序列为5’-TCCTCTTGTGCTCTTGCTGG-3’。扩增条件为:95 ℃ 3 min; 94 ℃ 20 s、58.9 ℃ 20 s、68 ℃ 20 s,共40 个循环。GAPDH作为内参照,采用2-ΔΔCt方法分析检测结果,实验重复3次。
2.3 Western blot法检测细胞蛋白水平 对数生长期HepG2细胞、L-02细胞用胰酶消化,加裂解液裂解细胞,提取总蛋白。10% SDS-PAGE电泳分离并转膜,5%脱脂牛奶封闭孵育2 h,加入FUT7/SLeX的 I 抗(1∶1 000),4 ℃孵育过夜后用TBST漂洗3次; II 抗(1∶5 000)37 ℃孵育2 h,TBST漂洗3次,ECL显色,Bio-Rad凝胶成像仪检测条带并进行灰度值分析。
2.4 免疫组织化学染色法检测SLeX表达 处理好的细胞爬片采用免疫组织化学二步法染色观察HepG2细胞及L-02细胞中SLeX的表达。二氨基联苯胺显色,苏木素复染,以细胞(和)细胞核出现淡黄色至棕褐色颗粒为染色阳性。显微镜下随机选取5个视野(×400),计数100个细胞中的阳性细胞数并计分:<5%为0分,5%~25%为1分,26%~50%为2分,51%~75%为3分,>75%为4分。显色强度:无着色为0分,淡黄色为1分,棕黄色为2分,棕色或棕褐色为3分。染色强度与阳性细胞百分比的乘积作为每种细胞的积分:0分为阴性(-),1~4分为弱阳性(+),5~8分为中度阳性(++),9~12分为强阳性(+++)。
2.5 MTT法检测细胞存活率 取对数期的HepG2细胞接种于96孔板,每孔1×104个细胞,分别加入终浓度为0.05、0.5、5 mg/L的SLeX抗体,同时设对照组和空白调零组,分别培养12 h、24 h后加入5 g/L MTT溶液20 μL,继续培养4 h,离心弃上清,加入100 μL DMSO,振荡混匀5 min ,在酶标仪上检测490 nm波长下各孔吸光度(A)值,按以下公式计算细胞存活率(%)=(A抗体-A空白)/(A对照-A空白)×100%。每组设3个复孔,实验重复3次。
2.6 Transwell细胞迁移实验 调整对数生长期的HepG2细胞浓度为2×108/L,按实验分组分别加入终浓度为0、0.05、0.5和5 mg/L的SLeX抗体,于24孔板中培养,加入的SLeX抗体可以封闭HepG2细胞的SLeX。SLeX抗体封闭HepG2细胞培养2 h后,用无血清DMEM培养基制成单细胞悬液,调整细胞浓度为5×107/L加入Transwell小室的上室, 每孔500 μL,下室加入含10% 胎牛血清的DMEM培养液1 000 μL,每孔3个复孔。置于37 ℃、饱和湿度、5% CO2孵箱中培养12 h后,棉签擦去小室上层未迁移的细胞,自然风干,再用瑞氏-吉姆萨复合染液染5~8 min,甲醇固定5 min,蒸馏水冲洗后自然风干;倒置显微镜下每个Transwell小室选取5个视野观察进行细胞计数并拍照。以对照组迁移细胞数为参照,计算各组细胞迁移率(%)=实验组迁移细胞数/对照组迁移细胞数×100%。
2.7 Matrigel侵袭实验 Transwell小室底部膜的内表面预先均匀铺制人工基底膜Matrigel,其余操作同“Transwell细胞迁移实验”。
3 统计学处理
所有实验数据均采用均数±标准差(mean±SD)表示,SPSS 19.0统计软件分析处理,多组间比较采用单因素方差分析,多重比较采用SNK-q检验,以P<0.05为差异有统计学意义。
结 果
1 FUT7 mRNA在L-02细胞及HepG2细胞中的表达
实时荧光定量PCR法检测结果表明FUT7的mRNA在肝癌细胞细胞株HepG2中的表达远远高于人正常肝细胞株L-02中的表达,差异有统计学显著性,见图1。
2 Western blot检测L-02细胞及HepG2细胞中FUT7和SLeX的表达水平
Western blot结果显示,HepG2细胞株中有特异性FUT7和SLeX的表达,而L-02细胞株中基本无特异性条带,统计分析结果表明FUT7和SLeX在肝癌细胞HepG2中的表达显著高于在正常肝细胞L-02中的表达(P<0.05),见图2。
Figure 1.The mRNA expression of FUT7 in L-02 cells and HepG2 cells detected by RT-qPCR. Mean±SD.n=3.*P<0.05vsL-02.
图1 L-02及HepG2细胞中FUT7的mRNA表达

Figure 2.The protein expression of FUT7 and SLeX in L-02 cells and HepG2 cells analyzed by Western blot. Mean±SD.n=3.*P<0.05vsL-02.
图2 Western blot 检测L-02细胞及HepG2细胞中FUT7和SLeX的蛋白表达
3 免疫组织化学染色结果
HepG2细胞的细胞膜、细胞质、细胞核中均呈深棕色,积分显示为强阳性,而L-02细胞无论细胞膜、细胞质、细胞核中均呈蓝色,无棕黄色颗粒,积分为0分,见图3。这表明SLeX在HepG2细胞中为强阳性表达而在L-02细胞中无表达。
4 MTT法检测SLeX抗体对HepG2细胞存活率的影响
用0.05、0.5和5 mg/L SLeX抗体处理HepG2细胞12 h和24 h后,MTT实验结果显示,与对照组相比,HepG2细胞的存活率与SLeX抗体的作用浓度和作用时间的差异均无统计学显著性,见图4。
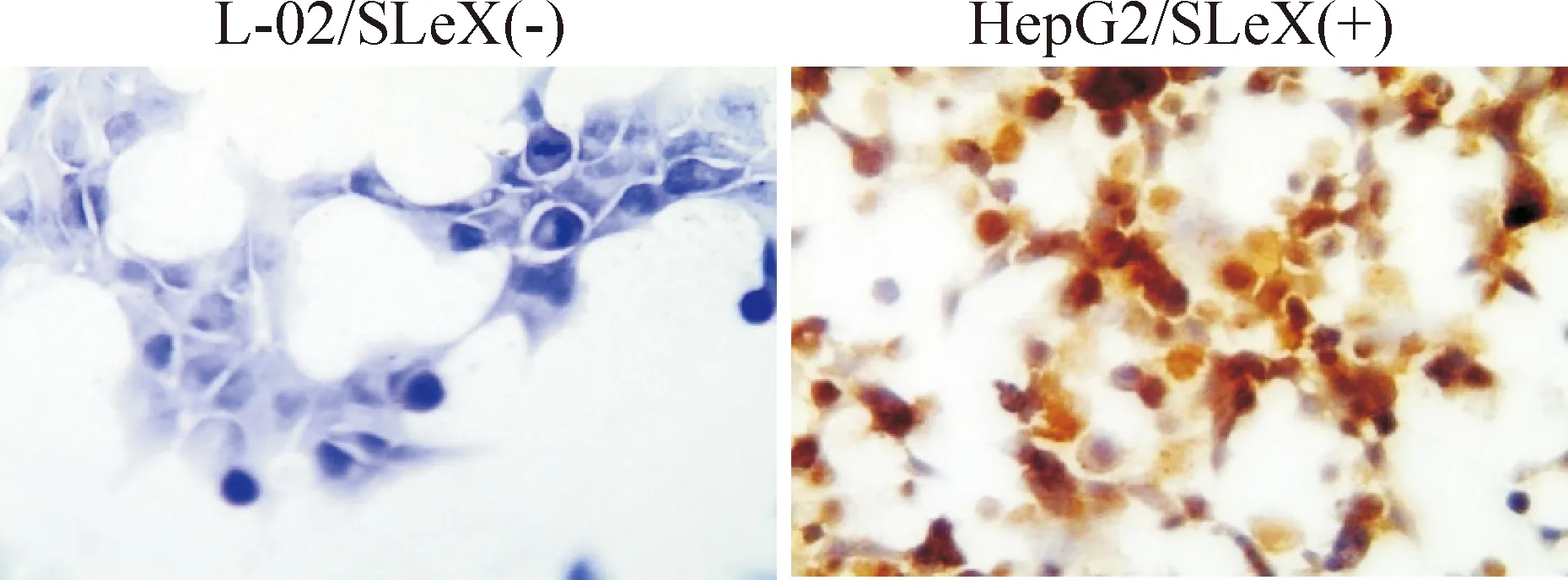
Figure 3.The protein expression of SLeX in L-02 cells and HepG2 cells detected by immunocytochemical staining (×400).
图3 免疫细胞化学染色检测L-02和HepG2细胞中SLeX蛋白的表达
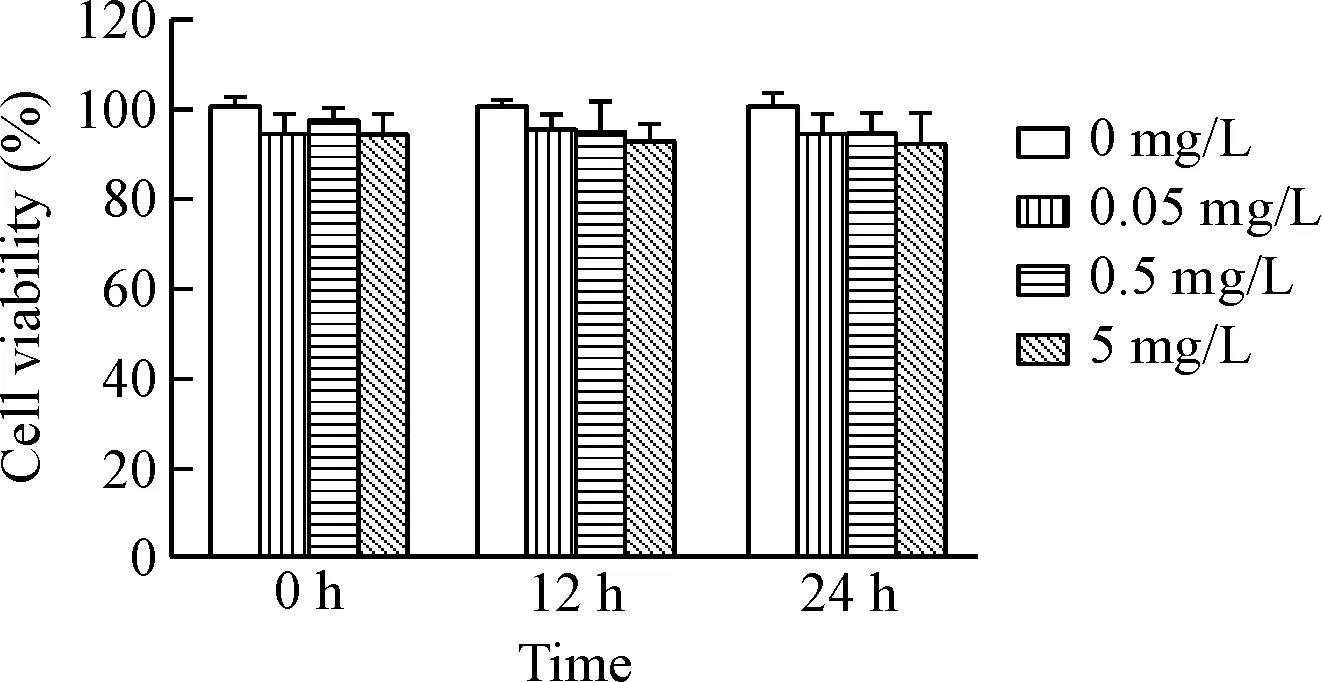
Figure 4.The viability of the HepG2 cells with different treatments. Mean±SD.n=3.
图4 HepG2细胞经不同因素作用后的存活率变化
5 SLeX对HepG2细胞迁移能力的影响
采用不同浓度SLeX抗体封闭HepG2细胞后,计数穿膜细胞数并计算细胞的迁移率,研究细胞迁移能力的改变。实验结果显示,在没有SLeX抗体封闭情况下设HepG2细胞迁移率为100%,当分别用0.05、0.5和5 mg/L的 SLeX抗体封闭后,HepG2细胞的迁移率随着SLeX抗体浓度的增加,穿膜细胞数量逐渐降低,迁移率逐渐下降,与对照组相比差异有统计学显著性(P<0.05),且迁移率与SLeX抗体浓度有显著负相关(r=-0.987,P<0.05),见图5。

Figure 5.The migration ability of the HepG2 cells treated with different doses of SLeX antibody. Mean±SD.n=3.*P<0.05vs0 mg/L.
图5 SLeX抗体作用于HepG2细胞后的迁移情况
6 SLeX对HepG2细胞侵袭能力的影响
不同浓度SLeX抗体封闭HepG2细胞后,3个抗体封闭组降解Matrigel胶侵袭穿膜的细胞数量随SLeX抗体浓度的增加而逐渐下降,抑制作用呈剂量依赖性。经统计学分析,0.05、0.5和5 mg/L的 SLeX抗体封闭组侵袭穿膜细胞数明显少于对照组(P<0.05),SLeX抗体封闭组之间两两比较差异均有统计学显著性(P<0.05),穿膜细胞数与SLeX抗体浓度呈显著负相关(r=-0.966,P<0.05),见图6。
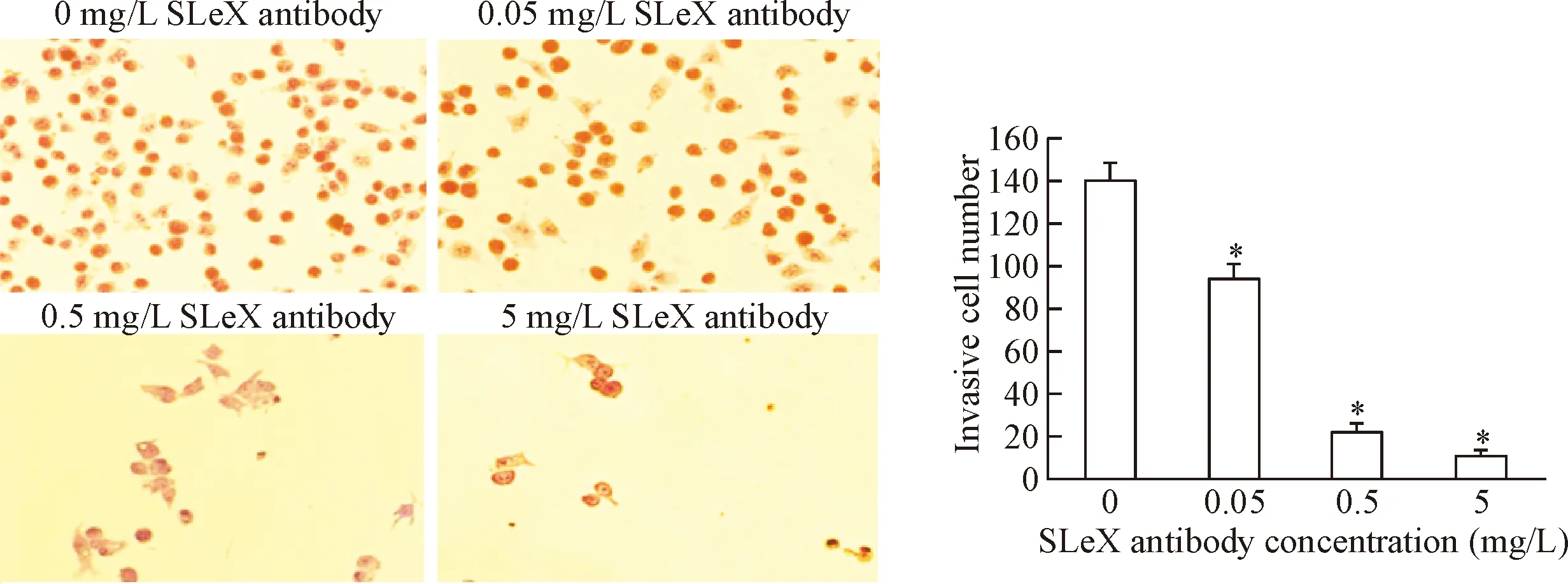
Figure 6.The effects of SLeX antibody on the invation of HepG2 cells. Mean±SD.n=3.*P<0.05vs0 mg/L.
图6 不同浓度SLeX抗体封闭对HepG2细胞侵袭能力的影响
讨 论
肿瘤细胞的血行转移涉及多个步骤,肿瘤细胞与血管内皮细胞的特异性黏附是其中的关键步骤之一,是肿瘤细胞向远处转移、定居的先决条件,黏附不仅是肿瘤细胞定向转移生长的基础,同时抑制宿主免疫应答,有利于肿瘤免疫逃逸。细胞膜上存在的黏附分子是介导细胞与细胞之间黏附的必要条件,SLeX 是黏附分子之一,其作为选择素的配体与选择素相互黏附和作用,在肿瘤细胞与血管内皮细胞黏附中起关键作用。
SLeX是Lewis X 抗原的唾液酸基衍生物,由半乳糖、葡萄糖、唾液酸、N-乙酰基和岩藻糖5个分子结合而成。正常情况下,SLeX 主要表达于人单核细胞和粒细胞表面。近年研究表明,它是糖化的肿瘤相关抗原,结肠癌、 前列腺癌、 肺癌等多种肿瘤细胞表面均有表达,可使肿瘤细胞与靶器官内皮细胞紧密黏附,诱导肿瘤细胞变形,促进肿瘤细胞趋化运动,从而导致转移[3]。Okuno 等[4]研究表明高表达SLeX的结直肠癌细胞可以减少肝窦中淋巴细胞介导的杀伤作用,促进肿瘤细胞更易转移到肝脏。结直肠癌组织中SLeX表达的增加与肿瘤的复发有一定的联系,生存分析亦显示高SLeX表达的患者存活率较差[5]。邓武坚等[6]用免疫组织化学方法检测肝癌组织中SLeX的阳性表达率为 64.1%,且与患者生存期、门脉癌栓、术前肝外转移、卫星灶、术后3月内复发密切相关。Gunawardena 等[7]研究证实头颈部鳞状细胞癌患者中SLeX 表达阳性的预后较差,阻断肿瘤细胞与内皮细胞黏附可减少肿瘤的淋巴结转移和远处转移。
FUT7 是SLeX合成过程中的关键酶,FUT7的活性可以直接影响SLeX的表达量。用 pEGFP-C1-FUT7转染人乳腺癌细胞MDA-MB-231,观察 FUT7及其产物 SLeX表达的改变,结果发现稳转组细胞FUT7及其产物 SLeX的表达量明显高于转染空质粒组及未转染组[8]。过表达FUT7可以上调SLeX的合成[9]。我们的研究中发现,FUT7在肝癌细胞细胞株HepG2中有表达,而在人正常肝细胞株L-02中表达量极低,Western blot及免疫细胞化学染色结果均显示SLeX在HepG2细胞中表达而在L-02细胞中未见表达。实验结果进一步证实FUT7是SLeX合成过程中的关键酶,正常肝细胞无SLeX表达,所以无迁移和侵袭能力,而肝癌细胞中有SLeX表达,可能与其迁移和侵袭能力有关。
肝癌细胞中的SLeX表达是否与其迁移和侵袭能力有关?崔红霞等[8]通过过表达FUT7促使SLeX合成增加,增强SLeX介导的人乳腺癌MDA-MB-231细胞的黏附能力和迁移能力。Brown 等[10]通过抑制SLeX 的生物合成,达到了抑制肺癌细胞的血行转移的目的。Kawamura等[11]通过引入Sda 碳水化合物结构到胃癌细胞株KATO III和结肠癌细胞株HT29中,降低SLeX 和SLea的表达,从而抑制了胃肠道肿瘤细胞的转移。McFerrin 等[12]实验证实人骨髓间充质基质细胞表达SLeX并可黏附于血管内皮细胞,用SLeX抗体封闭SLeX表达后降低了人骨髓间充质基质细胞在小动脉内的滚动和黏附。Borentain等[13]研究表明抑制E-选择素的表达可以抑制SLeX与E-选择素间的相互作用,从而抑制纯合子裸鼠内高表达SLeX的HepG2细胞肿瘤的生长,对低表达SLeX的HuH7细胞肿瘤则无作用。抑制肝癌细胞表达SLeX从而抑制肿瘤生长的机制可能是通过抑制新生血管生成实现的[13]。Naoya等[14]研究显示CD82通过下调ST3GAL4使SLeX表达减少,从而降低肿瘤细胞的血管黏附,抑制转移。我们用SLeX单克隆抗体封闭HepG2细胞证实:加入SLeX单克隆抗体后,细胞生长没有受到抑制,但细胞的迁移能力、侵袭能力均随着SLeX抗体浓度的增加而减弱且差异具有显著性,说明利用SLeX 的单克隆抗体与SLeX 结合,可以减弱HepG2细胞的迁移、侵袭能力,从而抑制肝癌的转移。由此可见肿瘤细胞的血行转移与SLeX表达量的高低密切相关,所以通过降低或封闭SLeX表达,阻断SLeX和选择素的相互作用,有望能有效抑制肿瘤细胞转移。针对SLeX和选择素的相互作用,抗肿瘤药物的作用方式主要分为以下几类:SLeX 的单克隆抗体与SLeX 结合、降低SLeX 合成中关键酶的活性、抑制选择素的表达、抑制SLeX和选择素的接触等。本实验研究结果表明用SLeX单克隆抗体与SLeX 结合,降低了HepG2细胞的迁移能力、侵袭能力,可能成为肝癌的治疗方向之一。
[1] Takigawa T, Tsurushima H, Suzuki K, et al. Cilostazol suppression of arterial intimal hyperplasia is associated with decreased expression of sialyl Lewis X homing receptors on mononuclear cells and E-selectin in endothelial cells[J]. J Vasc Surg, 2012, 55(2):506-516.
[2] Portela SV, Martín CV, Romay LM, et al. sLeaand sLexexpression in colorectal cancer: implications for tumourigenesis and disease prognosis[J]. Histol Histopathol, 2011, 26(10):1305-1316.
[3] St Hill CA, Baharo-Hassan D, Farooqui M. C2-O-sLeXglycoproterins are E-selection ligands that regulate invasion of human colon and hepatic carcinoma cells[J]. PLoS One, 2011, 6(1):e16281.
[4] Okuno K, Kawai I, Hirai N, et al. Role of sialyl Lewis X in liver metastasis in view of liver associated immunity[J]. Hepatogastroenterology, 2003, 50(51):756-760.
[5] Zwenger A, Rabassa M, Demichelis S, et al. High expression of sLex associated with poor survival in Argenti-nian colorectal cancer patients[J]. Int J Biol Markers, 2014, 29(1): e30-e39.
[6] 邓武坚, 陈 德, 钱世鹍, 等.肝癌组织中 E-selectin、sLeX、sLeA 和 CD44v6 的表达及其临床意义[J]. 广东医学, 2011, 32(7):891-894.
[7] Gunawardena I, Arendse M, Jameson MB, et al. Prognostic molecular markers in head and neck squamous cell carcinoma in a New Zealand population: matrix metalloproteinase-2 and sialyl Lewis x antigen[J]. ANZ J Surg, 2015, 85(11):843-848.
[8] 崔红霞, 赵学梅, 孙 超, 等.过表达外源FUT7对乳腺癌细胞黏附及迁移能力的影响[J]. 肿瘤防治研究, 2014, 41(3):252-255.
[9] Zhang Y, Liu S, Liu Y, et al. Overexpression of fucosyltransferase VII (FUT7) promotes embryo adhesion and implantation[J]. Fertil Steril, 2009, 91(3):908-914.
[10]Brown JR, Fuster MM, Li R, et al. A disaccharide-based inhibitor of glycosylation attenuates metastatic tumor cell dissemination[J]. Clin Cancer Res, 2006, 12(9): 2894-2901.
[11]Kawamura YI, Kawashima R, Fukunaga R, et al. Introduction of Sdacarbohydrate antigen in gastrointestinal cancer cells eliminates selectin ligands and inhibits metastasis[J]. Cancer Res, 2005, 65(14):6220-6227.
[12]McFerrin HE, Olson SD, Gutschow MV, et al. Rapidly self-renewing human multipotent marrow stromal cells (hMSC) express sialyl Lewis X and actively adhere to arterial endothelium in a chick embryo model system[J]. PLoS One, 2014, 9(8):e105411.
[13]Borentain P, Carmona S, Mathieu S, et al. Inhibition of E-selectin expression on the surface of endothelial cells inhibits hepatocellular carcinoma growth by preventing tumor angiogenesis[J]. Cancer Chemother Pharmaco, 2016, 77(4):847-856.
[14]Naoya Y, Koujiro Y, Satomi C, et al. Antigen-mediated adhesion of cancer cells: evidence for an anti-metastasis effect by down-regulation of sialyl Lewis antigens[J]. PLoS One, 2015, 10(4):e0124743.
(责任编辑: 林白霜, 罗 森)
Effects of SLeX on invasion and migration of HepG2 cells
WU Wen-juan1, CUI Can2, KANG Pin-fang3, SHI Yu-rong1, GENG Ying-hua4
(1DepartmentofBiochemistryandMolecularBiology,BengbuMedicalCollege,Bengbu233030,China;2DepartmentofClinicalLaboratory,XuzhouCentralHospital,Xuzhou221009,China;3DepartmentofCardiovascularMedicine,4DepartmentofHematology,TheFirstAffiliatedHospitalofBengbuMedicalCollege,Bengbu233004,China.E-mail:wuwj_2012@126.com)
AIM: To investigate the expression and effects of sialyl Lewis X (SLeX) on the invasion and migration of human hepatocellular carcinoma HepG2 cells. METHODS: The expression of α1,3-fucosyltransferase VII (FUT7) in HepG2 cells and L-02 cells was detected by RT-qPCR and Western blot. The SLeX expression in HepG2 cells and L-02 cells was determined by Western blot and immunocytochemical staining. The invasion and migration abilities of the treated cells were evaluated by Transwell assay. RESULTS: The expression of FUT7 and SLeX in the HepG2 cells, but not in the L-02 cells, was observed. The invasion rates of the HepG2 cells treated with SLeX monoclonal antibody at 0.05, 0.5 and 5 mg/L were significantly decreased as compared with control group (P<0.05). The migration ability of the HepG2 cells treated with SLeX monoclonal antibody at 0.05, 0.5 and 5 mg/L was also significantly reduced as compared with control group (P<0.05). The invasion rate and migratory cell number were significantly different between any 2 groups in the HepG2 cells treated with SLeX monoclonal antibody at 0.05, 0.5 and 5 mg/L (P<0.05). CONCLUSION: HepG2 cells express SLeX. SLeX is closely related to the migration and invasion abilities of the HepG2 cells.
Sialyl Lewis X; Hepatocellular carcinoma; HepG2 cells; Cell migration; Cell invasion
1000- 4718(2017)04- 0688- 06
2016- 07- 28
2016- 12- 13
安徽省教育厅省自然科学基金资助项目(No. KJ2011B098; No. KJ2014A162; No. KJ2017A234); 国家级大学生创新训练计划(No. 201310367041)
R735.7; R730.23
A
10.3969/j.issn.1000- 4718.2017.04.018
△通讯作者 Tel: 0552-3175909; E-mail: wuwj_2012@126.com

